B7.1基因的表达对肝癌细胞生物学特性的影响
作者:张宇梅 隋延仿 李增山
单位:张宇梅(第四军医大学病理学教研室,陕西西安710032);隋延仿(第四军医大学病理学教研室,陕西西安710032);李增山(第四军医大学病理学教研室,陕西西安710032)
关键词:肝癌细胞;B7.1基因;生长曲线;细胞周期;细胞毒
细胞与分子免疫学杂志000328
摘要:目的观察B7.1基因表达对肝癌细胞增殖特性的影响及诱发杀伤性T淋巴细胞(CTL)细胞毒活性的变化。方法用细胞计数法和流式细胞仪(FCM)测定细胞生长曲线、DNA含量及细胞周期的变化。同时测定CTL对转染B7.1基因前后肝癌细胞的细胞毒作用。结果转染B7.1基因后,肝癌细胞的增殖受到一定影响:生长延缓、增殖幅度降低和倍增时间延长。CTL对转染B7.1基因的肝癌细胞杀伤明显增强。结论转染B7.1基因的肝癌细胞出现了一定的增殖抑制现象,提示B7.1基因有一定的免疫调节作用。
, http://www.100md.com
中图号:R735.735 文献标识码: 文章编号:1007-8738(2000)03-0268-03
Effects of B7.1 gene expression on the biological characteristics of hepatocarcinoma cells
ZHANG Yu-mei SUI Yan-fang LI Zeng-shan
(Department of Pathology, Fourth Military Medical University, Xi’ an 710032, Shaanxi Province China)
Abstract: Aim To observe the effects of B7.1 gene expression on proliferation of hepatocarcinoma cells and on changes in cytotoxic activity of induced CTL. Methods Growth curve, DNA content and change in cell cycle were determinated by Cytometry and FCM. The cytotoxicity alteration of the CTL was also studied. Results After transfected wth B7.1 gene, the cell proliferation was lagged,and the cytotoxicity was reinforced. Conclusion The proliferation of HHCC after transfected with B7.1 gene can be inhibited which suggests a relationship between B7.1 gene and the immune system.
, http://www.100md.com
Keywords: HCC; B7.1 gene; growth curve; cell cycle; cytotoxicity ▲
肿瘤免疫主要由细胞免疫应答所介导。共刺激信号在抗原特异性T细胞活化中的重要意义已受到广泛承认,缺乏共刺激信号会导致T细胞克隆的无反应性或凋亡〔1,2〕。目前认为,B7作为一种重要的共刺激分子,在抗肿瘤免疫应答过程中起重要作用〔5,7〕。已有一些研究表明,转染B7.1的肿瘤细胞可对CD8+或CD4+T细胞产生直接的共刺激作用而导致对肿瘤细胞的杀伤或抑制〔5,7〕。我们观察了B7.1基因的表达对肝癌细胞生物学特性及诱导CTL细胞毒活性的影响。
1 材料和方法
1.1材料人肝癌细胞系HHCC及转染B7.1基因的肝癌细胞系HHCCB7.1为本室保存。效应细胞为与HHCC和IL2一起培养2wk的正常人外周血CD8+T细胞。以上细胞均置于DMEM培养液(含100mL/L小牛血清、青霉素及链霉素)中培养。DNAPrepstain为Coulter公司产品。MTT购于Sigma公司,用PBS液配成浓度为5g/L。溶解液DMF(N,N二甲基甲酰胺)按50%体积比加去离子水混合,以20%重量比加入十二烷基磺酸钠(SDS),置60℃使其溶解,然后用800mL/L冰醋酸—200mL/L1mol/LHCl调pH至4.7,4℃保存,用前60℃溶解。
, http://www.100md.com
1.2方法
1.2.1细胞增殖活性的测定①生长曲线测定:采用细胞计数法〔8〕。将HHCC及HHCCB7.1分别以0.5×105/孔和1×105/孔的浓度接种于12孔板,分为8组,每组做3个复孔。培养8d,每天检测一组,计数取均值,最后绘制细胞生长曲线,计算倍增时间。②细胞周期的测定:收集细胞,用PBS洗涤两次,经700mL/L乙醇固定后,加入DNAPrepstain染液500μL染色20min,上ELITEESP型FCM测定每个细胞的荧光强度,每份标本检测10000个细胞,用DNAMultiCycle软件进行统计学拟合分析。
1.2.2CTL杀伤活性的测定CTL杀伤活性的测定采用MTT比色法〔9〕。检测活细胞比率并计算杀伤率。将靶细胞接种于96孔板中,每孔104细胞,培养24h后,分别以不同的效靶比(100:1,25:1和1:1)加入效应细胞(100μL/孔),做3个复孔。空白对照组每孔仅加入200μL上述DMEM培养液,靶细胞对照组和效应细胞对照组分别加入相对应的细胞。上述各组均置于37℃50mL/LCO2培养4h后,每孔吸出100μL上清,加入MTT15μL(5g/L),继续培养4h,再加入100μL/孔的溶解液,于37℃培养48h,用自动酶标仪检测每孔光吸收(A)值,检测波长为570nm。杀伤率的计算公式如下:
, http://www.100md.com
CTL的杀伤活性(%)=〔靶细胞对照组A值-(实验组A值-效应细胞对照组A值)/靶细胞对照组A值〕×100%
统计学处理:所获结果应用SPSS及EPI6统计软件进行统计学分析。
2 结果
2.1细胞生长曲线及倍增时间以培养第1~8天的细胞数作图,绘制细胞的生长曲线。HHCCB7.1细胞生长曲线上升较缓,生长率明显低于HHCC;HHCC的倍增时间为24.72h,HHCCB7.1为41.63h;HHCCB7.1细胞的生长数明显减少、速度减慢。HHCC转染B7.1基因前后,细胞生长的受抑制有显著性差异(P∨0.01,图1)。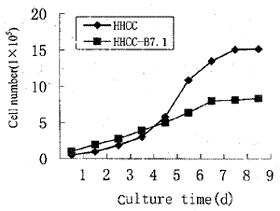
图1两种肝癌细胞的生长曲线
, 百拇医药 Fig 1 The growth curves of two hepatocarcinoma cells
2.2B7.1基因转染对肝癌细胞周期的影响FCM检测转染B7.1基因前后肝癌细胞DNA的含量,经计算机处理,所获各时相细胞的百分率见表1。可见转染B7.1基因的肝癌细胞S期的细胞比例减少,细胞增殖受到抑制,与未转染B7.1基因的肝癌细胞相比较差别显著(P∨0.05)。
表1两种肝癌细胞的FCM分析
Tab 1 FCM analysis of two hepatocarcinoma cells Percentage (% ) of the cells at distinct stage Cell line
Percentage(%)of the cells at distinct stage
, 百拇医药
G0/G1
S
G2/M
Total
HHCC
63.2
30.4
6.4
100.0
HHCCB7.1
57.2a
25.6a
17.2a
, 百拇医药
100.0 a
*P∨ 0.01 vs HHCC B7.1.
2.3CTL杀伤活性的观察CTL对转染B7.1基因前、后肝癌细胞的杀伤活性,结果见表2。效靶比为100∶1,25∶1和1∶1时,CTL对转染B7.1基因的肝癌细胞特异杀伤明显增强,且此杀伤效应随效靶比例的增加而增强。CTL对HHCC的杀伤活性与对HHCCB7.1的杀伤相比较,差别显著(P∨0.01)。
表2 CTL对两种肝癌细胞的杀伤活性
Tab 2 Cytotoxicity of two hepatocarcinoma cells by CTL Target cell
Cytotoxicity of CTL at different E/T ratio (% )
, http://www.100md.com
100∶1
25∶1
1∶1
HHCC
49.3
38.2
11.7
HHCC-B7.1
89.2a
84.4a
43.2a
aP∨0.01vsHHCCB7.1.
, 百拇医药
3 讨论
肝癌的免疫要解决的关键问题,在于激活有效的抗肿瘤淋巴细胞反应。在免疫应答过程中,对肿瘤抗原的识别分子是CTL的受体(TCR)。TCR只能识别经过降解并表达于抗原递呈细胞的抗原肽。肿瘤细胞只向CTL递呈在其细胞内加工后与MHCⅠ类分子结合,并转移至其瘤细胞表面的肿瘤抗原。T细胞的活化和增殖,不仅要求配体与TCR复合物的结合,还需要辅助刺激分子的辅助作用,才能使T细胞增殖及其诱导效应功能。在免疫反应激活过程中,共刺激信号的刺激作用具有重要的意义,缺乏此信号将不能有效地活化T细胞,甚至可能导致特异性无反应或免疫耐受。B7-1即CD80分子,能与T细胞表达的CD28/CTLA-4分子相互作用,通过蛋白酪氨酸激酶的胞内信息传导,启动IL-2基因转录,作为辅助信号活化T细胞,诱导免疫功能。同时,活化的T细胞增殖分化并分泌IFN-γ,又可上调APC表面B7的表达〔10,11〕。最近有人报道,APC提呈抗原的能力与其表面B7-1分子的表达量呈正相关〔12〕。以B7.1基因转染肝癌细胞,可直接表达B7.1分子,提供第二信号刺激,增强癌细胞与淋巴细胞之间的识别和激活作用,从而使淋巴细胞对肝癌细胞产生杀伤作用。结果亦证实,淋巴细胞对转染B7.1基因的肝癌细胞的特异杀伤明显增强,且此杀伤效应随效靶比例的增加而增强。此外还表明,B7.1基因有一定的免疫调节作用,其表达可增强抗原提呈效应,有效地激活与诱导显著的抗肿瘤免疫反应。
, http://www.100md.com
细胞的增殖能力是判定细胞活力的重要指标,常通过检测细胞的生长曲线、倍增时间及细胞周期等来显示。本研究通过以上方法发现,转染B7.1基因后的肝癌细胞HHCC增殖能力受到一定的影响,生长延缓,增殖幅度降低,倍增时间延长。人体是个有机的整体,其细胞数目是相对恒定的,细胞的增殖与死亡始终保持着一种平衡状态,如果这种平衡失调,人体即出现病理状态。肿瘤就是细胞异常增殖,且得不到有效抑制的结果。无限增殖是肿瘤细胞的重要特征之一,B7.1基因的转染可使肿瘤细胞的增殖受到抑制,因此,B7.1基因的转入有可能逆转肿瘤细胞的恶性表型。隋拥君〔13〕报道,将B7.1基因转入B16细胞后,可使之恢复分泌黑色素的能力。Ramarathinam等〔14,15〕报道,将B7基因导入肿瘤细胞,发现B7基因的表达可使瘤细胞致瘤性降低。我们将B7.1基因转入肝癌细胞HHCC后,瘤细胞的增殖特性发生变化,说明B7.1基因的表达对细胞产生了一定的影响。关于这一变化的机制,还有待进一步研究。■
基金项目:国家自然科学基金资助,№.39770827
, 百拇医药
作者简介:张宇梅,女,30岁,硕士生西安市长乐西路17号, Tel.(029)3374541 211 2000 by J Cell Mol Immunol Press www.immunology. net/jcmi; Email. immuedit@fmmu.edu.cn
参考文献:
〔1〕 Bretscher P. The two signal model of lymphocyte activation twenty one years later〔J〕 . Immunol Today, 1992;13(2):74 76.
〔2〕 Gimmi CD, Freeman GJ, Gribben JG, et al. Human T cell clonal anergy is induced by antigen presentation in the absence of B7 costimulation〔J〕 . Proc Natl Acad Sci USA, 1993; 90(14):6586 6590.
, 百拇医药
〔3〕 Linsley PS, Brady W, Grosmaire LS, et al. Binding of the B cell activation antigen B7 to CD28 costimulates T cell proliferation and interleukin 2 mRNA accumulation〔J〕 . J Exp Med, 1991; 173: 721 730.
〔4〕 张 跃 建 , 何 球 藻 , 方 舫 , 等 . B7 1基 因 转 染 小 鼠 EL 4淋 巴 瘤 诱 导 带 瘤 宿 主 抗 瘤 效 应 的 体 内 研 究 〔J〕 . 中 国 肿 瘤 生 物 治 疗 杂 志 , 1997; 4: 14 19.
〔5〕 Chen L, Ashe S, Brady WA, et al. Costimulation of antitumor immunity by the B7 counter receptor for the lymphocyte molecules CD28 and CTLA 4〔J〕 . Cell, 1992;71:1093 1102.
, http://www.100md.com
〔6〕 Baskar S , Ostrand Rosenberg S, Nabavi N, et al. Constitutive expression of B7 restores immunogenicity of tumor cells expressing truncated major histocompatibility complex class II molecules〔J〕 . Proc Natl Acad Sci USA, 1993;90:5687 5690.
〔7〕 Townsend SE, Allison JP. Tumor rejection after direct costimulation of CD8+ T cells by B7 transfected melanoma cells〔J〕 . Science, 1993;259:368 370.
〔8〕 鄂 征 , 主 编 . 组 织 培 养 和 分 子 细 胞 学 技 术 〔M〕 . 北 京 :北 京 出 版 社 , 1995:155.
, http://www.100md.com
〔9〕 巴 德 年 , 主 编 .当 代 免 疫 学 技 术 与 应 用 〔M〕 . 北 京 :北 京 医 科 大 学 中 国 协 和 医 科 大 学 联 合 出 版 社 , 1998:618.
〔10〕 Lanier LL, O'Fallon S, Somoza C, et al. CD80(B7) and CD86(B70) provide similar costimulatory signals for T cell proliferation, cytokine production and generation of CTL〔J〕 . J Immunol, 1995;154:97.
〔11〕 Wingren AG, Parra E, Varga M, et al. T cell activation pathways:B7, LFA 3 and ICAM l shape unique T cell profiles〔J〕 . Crit Rev Immunol, 1995;15:235.
, 百拇医药
〔12〕 Henry F, Bretaudeau L, Barbieux I, et al. Induction of antigen presentation by macrophages after phagocytosis of tumour apoptotic cell〔J〕 . Res Immunol, 1998;149:673.
〔13〕 隋 拥 君 , 丁 广 治 , 唐 佩 弦 , 等 .B7 1(CD80)基 因 的 克 隆 及 其 在 小 鼠 黑 色 素 瘤 细 胞 中 的 表 达 〔J〕 .免 疫 学 杂 志 , 1997;3:164 167.
〔14〕 Ramarathianam L, Castle M, Wu Y, et al.T cell costimulation by B7/BB1 induces CD8 T cell dependent tumor rejection : an important role of B7/BB1 in the induction , recruitment, and effector function of antitumor T cells〔J〕 . J Exp Med, 1994;179:205.
〔15〕 Cayeux S, Beck C, Aicher A, et al. Tumor cells cotransfected with interleukin 7 and B7.1 genes induce CD25 and CD28 on tumor infiltrating T lymphocytes and are strong vaccines〔J〕 . Eur J Immunol, 1995;25:2325~ 2329.
收稿日期:2000-01-13
修回日期:2000-01-23, 百拇医药
单位:张宇梅(第四军医大学病理学教研室,陕西西安710032);隋延仿(第四军医大学病理学教研室,陕西西安710032);李增山(第四军医大学病理学教研室,陕西西安710032)
关键词:肝癌细胞;B7.1基因;生长曲线;细胞周期;细胞毒
细胞与分子免疫学杂志000328
摘要:目的观察B7.1基因表达对肝癌细胞增殖特性的影响及诱发杀伤性T淋巴细胞(CTL)细胞毒活性的变化。方法用细胞计数法和流式细胞仪(FCM)测定细胞生长曲线、DNA含量及细胞周期的变化。同时测定CTL对转染B7.1基因前后肝癌细胞的细胞毒作用。结果转染B7.1基因后,肝癌细胞的增殖受到一定影响:生长延缓、增殖幅度降低和倍增时间延长。CTL对转染B7.1基因的肝癌细胞杀伤明显增强。结论转染B7.1基因的肝癌细胞出现了一定的增殖抑制现象,提示B7.1基因有一定的免疫调节作用。
, http://www.100md.com
中图号:R735.735 文献标识码: 文章编号:1007-8738(2000)03-0268-03
Effects of B7.1 gene expression on the biological characteristics of hepatocarcinoma cells
ZHANG Yu-mei SUI Yan-fang LI Zeng-shan
(Department of Pathology, Fourth Military Medical University, Xi’ an 710032, Shaanxi Province China)
Abstract: Aim To observe the effects of B7.1 gene expression on proliferation of hepatocarcinoma cells and on changes in cytotoxic activity of induced CTL. Methods Growth curve, DNA content and change in cell cycle were determinated by Cytometry and FCM. The cytotoxicity alteration of the CTL was also studied. Results After transfected wth B7.1 gene, the cell proliferation was lagged,and the cytotoxicity was reinforced. Conclusion The proliferation of HHCC after transfected with B7.1 gene can be inhibited which suggests a relationship between B7.1 gene and the immune system.
, http://www.100md.com
Keywords: HCC; B7.1 gene; growth curve; cell cycle; cytotoxicity ▲
肿瘤免疫主要由细胞免疫应答所介导。共刺激信号在抗原特异性T细胞活化中的重要意义已受到广泛承认,缺乏共刺激信号会导致T细胞克隆的无反应性或凋亡〔1,2〕。目前认为,B7作为一种重要的共刺激分子,在抗肿瘤免疫应答过程中起重要作用〔5,7〕。已有一些研究表明,转染B7.1的肿瘤细胞可对CD8+或CD4+T细胞产生直接的共刺激作用而导致对肿瘤细胞的杀伤或抑制〔5,7〕。我们观察了B7.1基因的表达对肝癌细胞生物学特性及诱导CTL细胞毒活性的影响。
1 材料和方法
1.1材料人肝癌细胞系HHCC及转染B7.1基因的肝癌细胞系HHCCB7.1为本室保存。效应细胞为与HHCC和IL2一起培养2wk的正常人外周血CD8+T细胞。以上细胞均置于DMEM培养液(含100mL/L小牛血清、青霉素及链霉素)中培养。DNAPrepstain为Coulter公司产品。MTT购于Sigma公司,用PBS液配成浓度为5g/L。溶解液DMF(N,N二甲基甲酰胺)按50%体积比加去离子水混合,以20%重量比加入十二烷基磺酸钠(SDS),置60℃使其溶解,然后用800mL/L冰醋酸—200mL/L1mol/LHCl调pH至4.7,4℃保存,用前60℃溶解。
, http://www.100md.com
1.2方法
1.2.1细胞增殖活性的测定①生长曲线测定:采用细胞计数法〔8〕。将HHCC及HHCCB7.1分别以0.5×105/孔和1×105/孔的浓度接种于12孔板,分为8组,每组做3个复孔。培养8d,每天检测一组,计数取均值,最后绘制细胞生长曲线,计算倍增时间。②细胞周期的测定:收集细胞,用PBS洗涤两次,经700mL/L乙醇固定后,加入DNAPrepstain染液500μL染色20min,上ELITEESP型FCM测定每个细胞的荧光强度,每份标本检测10000个细胞,用DNAMultiCycle软件进行统计学拟合分析。
1.2.2CTL杀伤活性的测定CTL杀伤活性的测定采用MTT比色法〔9〕。检测活细胞比率并计算杀伤率。将靶细胞接种于96孔板中,每孔104细胞,培养24h后,分别以不同的效靶比(100:1,25:1和1:1)加入效应细胞(100μL/孔),做3个复孔。空白对照组每孔仅加入200μL上述DMEM培养液,靶细胞对照组和效应细胞对照组分别加入相对应的细胞。上述各组均置于37℃50mL/LCO2培养4h后,每孔吸出100μL上清,加入MTT15μL(5g/L),继续培养4h,再加入100μL/孔的溶解液,于37℃培养48h,用自动酶标仪检测每孔光吸收(A)值,检测波长为570nm。杀伤率的计算公式如下:
, http://www.100md.com
CTL的杀伤活性(%)=〔靶细胞对照组A值-(实验组A值-效应细胞对照组A值)/靶细胞对照组A值〕×100%
统计学处理:所获结果应用SPSS及EPI6统计软件进行统计学分析。
2 结果
2.1细胞生长曲线及倍增时间以培养第1~8天的细胞数作图,绘制细胞的生长曲线。HHCCB7.1细胞生长曲线上升较缓,生长率明显低于HHCC;HHCC的倍增时间为24.72h,HHCCB7.1为41.63h;HHCCB7.1细胞的生长数明显减少、速度减慢。HHCC转染B7.1基因前后,细胞生长的受抑制有显著性差异(P∨0.01,图1)。

图1两种肝癌细胞的生长曲线
, 百拇医药 Fig 1 The growth curves of two hepatocarcinoma cells
2.2B7.1基因转染对肝癌细胞周期的影响FCM检测转染B7.1基因前后肝癌细胞DNA的含量,经计算机处理,所获各时相细胞的百分率见表1。可见转染B7.1基因的肝癌细胞S期的细胞比例减少,细胞增殖受到抑制,与未转染B7.1基因的肝癌细胞相比较差别显著(P∨0.05)。
表1两种肝癌细胞的FCM分析
Tab 1 FCM analysis of two hepatocarcinoma cells Percentage (% ) of the cells at distinct stage Cell line
Percentage(%)of the cells at distinct stage
, 百拇医药
G0/G1
S
G2/M
Total
HHCC
63.2
30.4
6.4
100.0
HHCCB7.1
57.2a
25.6a
17.2a
, 百拇医药
100.0 a
*P∨ 0.01 vs HHCC B7.1.
2.3CTL杀伤活性的观察CTL对转染B7.1基因前、后肝癌细胞的杀伤活性,结果见表2。效靶比为100∶1,25∶1和1∶1时,CTL对转染B7.1基因的肝癌细胞特异杀伤明显增强,且此杀伤效应随效靶比例的增加而增强。CTL对HHCC的杀伤活性与对HHCCB7.1的杀伤相比较,差别显著(P∨0.01)。
表2 CTL对两种肝癌细胞的杀伤活性
Tab 2 Cytotoxicity of two hepatocarcinoma cells by CTL Target cell
Cytotoxicity of CTL at different E/T ratio (% )
, http://www.100md.com
100∶1
25∶1
1∶1
HHCC
49.3
38.2
11.7
HHCC-B7.1
89.2a
84.4a
43.2a
aP∨0.01vsHHCCB7.1.
, 百拇医药
3 讨论
肝癌的免疫要解决的关键问题,在于激活有效的抗肿瘤淋巴细胞反应。在免疫应答过程中,对肿瘤抗原的识别分子是CTL的受体(TCR)。TCR只能识别经过降解并表达于抗原递呈细胞的抗原肽。肿瘤细胞只向CTL递呈在其细胞内加工后与MHCⅠ类分子结合,并转移至其瘤细胞表面的肿瘤抗原。T细胞的活化和增殖,不仅要求配体与TCR复合物的结合,还需要辅助刺激分子的辅助作用,才能使T细胞增殖及其诱导效应功能。在免疫反应激活过程中,共刺激信号的刺激作用具有重要的意义,缺乏此信号将不能有效地活化T细胞,甚至可能导致特异性无反应或免疫耐受。B7-1即CD80分子,能与T细胞表达的CD28/CTLA-4分子相互作用,通过蛋白酪氨酸激酶的胞内信息传导,启动IL-2基因转录,作为辅助信号活化T细胞,诱导免疫功能。同时,活化的T细胞增殖分化并分泌IFN-γ,又可上调APC表面B7的表达〔10,11〕。最近有人报道,APC提呈抗原的能力与其表面B7-1分子的表达量呈正相关〔12〕。以B7.1基因转染肝癌细胞,可直接表达B7.1分子,提供第二信号刺激,增强癌细胞与淋巴细胞之间的识别和激活作用,从而使淋巴细胞对肝癌细胞产生杀伤作用。结果亦证实,淋巴细胞对转染B7.1基因的肝癌细胞的特异杀伤明显增强,且此杀伤效应随效靶比例的增加而增强。此外还表明,B7.1基因有一定的免疫调节作用,其表达可增强抗原提呈效应,有效地激活与诱导显著的抗肿瘤免疫反应。
, http://www.100md.com
细胞的增殖能力是判定细胞活力的重要指标,常通过检测细胞的生长曲线、倍增时间及细胞周期等来显示。本研究通过以上方法发现,转染B7.1基因后的肝癌细胞HHCC增殖能力受到一定的影响,生长延缓,增殖幅度降低,倍增时间延长。人体是个有机的整体,其细胞数目是相对恒定的,细胞的增殖与死亡始终保持着一种平衡状态,如果这种平衡失调,人体即出现病理状态。肿瘤就是细胞异常增殖,且得不到有效抑制的结果。无限增殖是肿瘤细胞的重要特征之一,B7.1基因的转染可使肿瘤细胞的增殖受到抑制,因此,B7.1基因的转入有可能逆转肿瘤细胞的恶性表型。隋拥君〔13〕报道,将B7.1基因转入B16细胞后,可使之恢复分泌黑色素的能力。Ramarathinam等〔14,15〕报道,将B7基因导入肿瘤细胞,发现B7基因的表达可使瘤细胞致瘤性降低。我们将B7.1基因转入肝癌细胞HHCC后,瘤细胞的增殖特性发生变化,说明B7.1基因的表达对细胞产生了一定的影响。关于这一变化的机制,还有待进一步研究。■
基金项目:国家自然科学基金资助,№.39770827
, 百拇医药
作者简介:张宇梅,女,30岁,硕士生西安市长乐西路17号, Tel.(029)3374541 211 2000 by J Cell Mol Immunol Press www.immunology. net/jcmi; Email. immuedit@fmmu.edu.cn
参考文献:
〔1〕 Bretscher P. The two signal model of lymphocyte activation twenty one years later〔J〕 . Immunol Today, 1992;13(2):74 76.
〔2〕 Gimmi CD, Freeman GJ, Gribben JG, et al. Human T cell clonal anergy is induced by antigen presentation in the absence of B7 costimulation〔J〕 . Proc Natl Acad Sci USA, 1993; 90(14):6586 6590.
, 百拇医药
〔3〕 Linsley PS, Brady W, Grosmaire LS, et al. Binding of the B cell activation antigen B7 to CD28 costimulates T cell proliferation and interleukin 2 mRNA accumulation〔J〕 . J Exp Med, 1991; 173: 721 730.
〔4〕 张 跃 建 , 何 球 藻 , 方 舫 , 等 . B7 1基 因 转 染 小 鼠 EL 4淋 巴 瘤 诱 导 带 瘤 宿 主 抗 瘤 效 应 的 体 内 研 究 〔J〕 . 中 国 肿 瘤 生 物 治 疗 杂 志 , 1997; 4: 14 19.
〔5〕 Chen L, Ashe S, Brady WA, et al. Costimulation of antitumor immunity by the B7 counter receptor for the lymphocyte molecules CD28 and CTLA 4〔J〕 . Cell, 1992;71:1093 1102.
, http://www.100md.com
〔6〕 Baskar S , Ostrand Rosenberg S, Nabavi N, et al. Constitutive expression of B7 restores immunogenicity of tumor cells expressing truncated major histocompatibility complex class II molecules〔J〕 . Proc Natl Acad Sci USA, 1993;90:5687 5690.
〔7〕 Townsend SE, Allison JP. Tumor rejection after direct costimulation of CD8+ T cells by B7 transfected melanoma cells〔J〕 . Science, 1993;259:368 370.
〔8〕 鄂 征 , 主 编 . 组 织 培 养 和 分 子 细 胞 学 技 术 〔M〕 . 北 京 :北 京 出 版 社 , 1995:155.
, http://www.100md.com
〔9〕 巴 德 年 , 主 编 .当 代 免 疫 学 技 术 与 应 用 〔M〕 . 北 京 :北 京 医 科 大 学 中 国 协 和 医 科 大 学 联 合 出 版 社 , 1998:618.
〔10〕 Lanier LL, O'Fallon S, Somoza C, et al. CD80(B7) and CD86(B70) provide similar costimulatory signals for T cell proliferation, cytokine production and generation of CTL〔J〕 . J Immunol, 1995;154:97.
〔11〕 Wingren AG, Parra E, Varga M, et al. T cell activation pathways:B7, LFA 3 and ICAM l shape unique T cell profiles〔J〕 . Crit Rev Immunol, 1995;15:235.
, 百拇医药
〔12〕 Henry F, Bretaudeau L, Barbieux I, et al. Induction of antigen presentation by macrophages after phagocytosis of tumour apoptotic cell〔J〕 . Res Immunol, 1998;149:673.
〔13〕 隋 拥 君 , 丁 广 治 , 唐 佩 弦 , 等 .B7 1(CD80)基 因 的 克 隆 及 其 在 小 鼠 黑 色 素 瘤 细 胞 中 的 表 达 〔J〕 .免 疫 学 杂 志 , 1997;3:164 167.
〔14〕 Ramarathianam L, Castle M, Wu Y, et al.T cell costimulation by B7/BB1 induces CD8 T cell dependent tumor rejection : an important role of B7/BB1 in the induction , recruitment, and effector function of antitumor T cells〔J〕 . J Exp Med, 1994;179:205.
〔15〕 Cayeux S, Beck C, Aicher A, et al. Tumor cells cotransfected with interleukin 7 and B7.1 genes induce CD25 and CD28 on tumor infiltrating T lymphocytes and are strong vaccines〔J〕 . Eur J Immunol, 1995;25:2325~ 2329.
收稿日期:2000-01-13
修回日期:2000-01-23, 百拇医药