人FKBP12基因可溶性表达及活性研究
作者:裴武红 贺永怀 陈兴 李松 沈倍奋
单位:裴武红(北京基础医学研究所);贺永怀(北京基础医学研究所);陈兴(北京基础医学研究所);沈倍奋(北京基础医学研究所);李松(北京毒物药物研究所,北京 100850)
关键词: FKBP12;原核表达;肽基脯氨基顺反异构酶
细胞与分子免疫学杂志000307
摘要:目的获得具有生物学活性的hFKBP12, 以筛选新型的促神经再生药物。方法构建原核表达 载体pExSecI/hFKBP12, 并在 BL21(DE3)plysE菌株中进行可溶性高效表达。 表达上清经CM Sepharose fast flow一步层析。结果获得电泳纯的hFKBP12。 活性测定结果表明,纯化后的 hFKBP12显示具有较强的肽基脯氨基顺反异构酶活性。 结论原核表达的hFKBP12具有天然生物学活 性 。
, http://www.100md.com
中图号: R392.11 文献标识码:A 文章编号:1007-8738(2000)03-0204-03
Expression and bioactivity of human FKBP12 gene
PEI Wu-hong HE Yong-huai CHEN Xing SHEN Bei-fen
(Beijing Institute of Basic Medical Sciences)
LI Song
(Beijing Institute of pharmacology and Toxicology, Beijing 100850, China )
Abstract: Aim To obtain bioactive hFKBP12 protein for screening novel neurotrophic drugs. Methods hFKBP12 gene was inserted into prokaryotic expression vector pExSecI and then expressed in soluble form with high efficiency in E.coli BL21(DE3)plysE host. Recombinant hFKBP12 protein were purified by one step CM Sepharose fast flow chromatography. Results Recombinant hFKBP12 protein,with a purity of homogenity, showed peptidyl prolyl cis trans isomerase(PPIase)activity. Conclusion Recombinant hFKBP12 protein is bioactive just as it wild type's. Sepharose fast flow chromatography. Results Recombinant hFKBP12 protein,with a purity of homogenity, showed peptidyl prolyl cis trans isomerase(PPIase)activity. Conclusion Recombinant hFKBP12 protein is bioactive just as it wild type's.
, 百拇医药
Keyword: hFKBP12;prokaryotic expression;peptidyl prolylcis trans isomerase ▲
FKBP12是免疫抑制剂FK506结合蛋白(FK506bindingprotein,FKBP)家族的主要成员,因预计相对分子质量(Mr)为12000而得名,实际上其电泳行为Mr约14000。自1989年发现此蛋白以来,人们的研究主要集中于其介导的免疫抑制作用。1994年研究发现,FKBP12在神经系统中的含量比在免疫系统中要高出50倍以上,通过其介导FK506在体内外均可促进神经再生〔1〕。这一重大发现,使FKBP蛋白家族的研究成为热点,人们力求设计一类新型的FKBP结合药物,去除FK506的免疫抑制作用,而保留其促神经再生作用,以作为神经再生促进剂而应用于临床。1997年,美国一家药厂开发的基于FKBP12和FK506结构而设计的化合物已推进到猴的巴金森氏综合症模型上,使在这一领域的研究迈出了可喜的一步〔2〕。为了进一步研究FKBP12介导的促神经再生作用的机制,合理设计促神经再生剂,我们在大肠杆菌中表达了hFKBP12,并对表达产物进行了生物学活性研究。
, 百拇医药
1 材料和方法
1.1材料pExSecI质粒和BL21(DE3)plysE菌株为本室保存。工具酶NdeI,BamHI和T4DNA连接酶均为Promega公司产品。引物由上海生物工程公司合成。CMSepharose购自Pharmacia公司。测定活性的底物NsuccinylAlaAlaProPhepnitroanilide(AAPF)购自Sigma公司。
1.2方法
1.2.1DNA的体外操作参考《分子克隆》一书的有关部分〔3〕。
1.2.2原核表达与鉴定以pExSecI/hFKBP12转化宿主菌BL21(DE3)plysE,转化子过夜活化后,按3%接种于新鲜的LBkan培养基中,37℃培养至A600nm值约0.6。加入适当浓度的IPTG,在合适的条件下诱导,将发酵菌体经超声破碎、12000r/min离心后,用160g/LSDSPAGE分析重组蛋白hFKBP12的存在形式。
, 百拇医药
1.2.3表达产物的CMSepharose纯化取30mLCMSepharose,预先用5mmol/LpH6.5的磷酸缓冲液平衡,然后将表达产物的超声上清缓慢流过层析柱。先用10倍柱体积的5mmol/LpH6.5的人FKBP12基因的可溶性表达及活性研究磷酸缓冲液洗去不被CMSepharose吸附的杂蛋白,然后再用含有梯度NaCl的5mmol/LpH6.5的磷酸缓冲液进行洗脱,收集洗脱峰,用160g/LSDSPAGE分析。
1.2.4重组蛋白的活性测定按文献〔4,5〕的方法,测定肽基脯氨基顺反异构酶的活性:反应体积为1mL,于室温进行反应。在865μL反应缓冲液(50mmol/Lhepes,100mmol/LNaCl,pH8.0)中,加入10μL700nmol/L纯化的hFKBP12蛋白(对照组加不含hFKBP12蛋白的缓冲液)。混合后,移至分光光度计比色杯中,加入100μL4g/L的α胰凝乳蛋白酶,再立即加入25μL含3mmol/LAAPF底物的400mmol/L氯化锂/四氢呋喃溶液,迅速混合,测定390nm的吸光值(A390nm),每10s记录1次。
, http://www.100md.com
2 结果
2.1重组质粒pExSecI/hFKBP12的构建将PCR扩增的hFKBP12基因用NdeI和BamHI双酶切后,插入到用相同酶切的pExSecI表达载体中,构建重组质粒pExSecI/hFKBP12,经酶切鉴定正确(图1)。
图1重组质粒pExSecI/hFKBP12的酶切鉴定
Fig1Restrictionenzymedigestionpatternofrecombinant
plasmidpExSecI/hFKBP12
1:DL2000marker;2:λDNA/HindIIImarker;3:PlasmidpExSecI/hFKBP12digestedbyNdeIandBamHI.
, http://www.100md.com
2.2hFKBP12的可溶性表达将重组质粒pExSecI/hFKBP12转化BL21(DE3)plysE,在37℃以1mmol/LIPTG诱导时,hFKBP12的表达主要以包涵体的形式存在。由于包涵体成分复杂,因此具有复性过程烦琐、复性效率低和其中蛋白质降解严重等缺点。我们探索了hFKBP12可溶性表达的条件,发现在IPTG用量为0.1mmol/L、诱导温度为12℃~16℃、诱导时间为16h时,有相当量的hFKBP12以可溶性形式出现于菌体的超声上清中(图2)。我们对可溶性的hFKBP12进行了纯化及活性测定。
图2hFKBP12表达的SDSPAGE分析
Fig2SDSPAGEanalysisofhFKBP12expression
1,4:UninducedpExSecI/hFKBP12;2:InducedpExSecI/hFKBP12;
, 百拇医药
3:Marker(Mr);5:SupernatantofinducedpExSecI/hFKBP12;
6:PelletofinducedpExSecI/hFKBP12.
2.3hFKBP12的CMSepharose纯化表达产物的超声上清过CMSepharose层析柱后,所获结果表明,在用50mmol/L和500mmol/LNaCl的5mmol/LpH6.5的磷酸缓冲液洗脱时,可检测到蛋白峰(图3),其中50mmol/LNaCl洗脱出电泳纯的hFKBP12蛋白。蛋白紫外定量表明,hFKBP12的得率约为10mg/L发酵液。这种纯化方法操作简单,只用CMSepharose一步层析就可获得电泳纯的hFKBP12。
图3CMSepharose层析纯化hFKBP12蛋白的SDSPAGE分析
, http://www.100md.com
Fig3SDSPAGEanalysisofhFKBP12proteinpurifiedby
CMSepharosechromatography 1:50mmol/LNaClelutionofpurifiedhFKBP12;2:500mmol/LNaClelutionofundesiredprotein;3:Marker(Mr).
2.4PPIase的活性测定溶液中AAPF的ProAla肽键处于顺反式构象的动态平衡之中,hFKBP12是一种肽基脯氨基顺反异构酶,可协助AAPF顺反态之间的转变。当AAPF处于反式状态时,会被α胰凝乳蛋白酶裂解而释放,可在390nm波长检测的pnitroanilide基团。我们将纯化的hFKBP12,以7nmol/L浓度测定其PPIase活性。结果显示,复性后的hFKBP12具有较强的PPIase活性(图4),从而为以后的工作奠定了基础。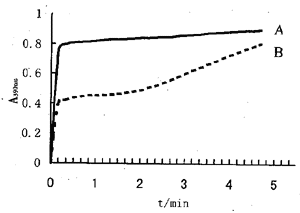
, http://www.100md.com
图4α胰凝乳蛋白酶联发光检测法测定hFKBP12的活性Fig4DetectionofPPIaseactivityofpurifiedhFKBP12by
αchymotrypsincoupledchromogenicassay
A:7nmol/LhFKBP12;B:NohFKBP12.
3 讨论
FK506是临床上广泛应用的免疫抑制剂,FKBP12是作为FK506的受体蛋白而发现的。对它们早期的研究主要集中于免疫系统的细胞,尤其是淋巴细胞。1994年以来,人们发现FKBP12在神经系统的含量远高于免疫系统,提示FKBP12具有多种神经营养功能,并确定其介导FK506的神经营养作用和免疫抑制作用是完全可以分开的〔6〕。国外有几个实验室利用以FKBP12的结构为基准而设计药物的方法,合成了一些具有神经营养作用的化合物,在体外、鼠体实验中取得了可喜的成绩〔7〕。同时,可介导FK506的免疫抑制作用和促神经再生作用。我们的目标是设计新型化合物。鉴于这类小分子化合物具有可口服、能穿透血脑屏障和不引起神经异常生长等优点,必然具有很广阔的应用前景。正因为如此,我们以FKBP12为模板,参考FK506的分子结构,而设计新型的促神经再生剂。本研究对hFKBP12基因的表达与活性分析,为这一目标的实施奠定了基础。■
, 百拇医药
基金项目:国家“973”创新药物基金资助,No.G1998051107
作者简介:裴武红:女,30岁,助理研究员,博士北京市太平路27号,Tel.(010)66931327 2000 by J Cell Mol Immunol Presswww.immunology. net/jcmi; Email. immuedit@fmmu.edu.cn
参考文献:
〔1〕 Gold BG. FK506 and the immunophilins in nerve regeneration〔J〕 . Mol Neurobiol, 1997; 15(3): 285- 306.
〔2〕 Steiner JP, Hamilton GS, Ross DT, et al. Neurotrophic immunophilin ligands stimulate structural and functional recovery in neurodegenerative animal models〔J〕 . Proc Natl Acad Sci USA, 1997; 94: 2019- 2024.
, 百拇医药
〔3〕 Sambrook J, Fritsch EF, Manitias T. Molecular Cloning: A Labortory Mannal〔M〕 . 2nd ed.New York: Cold Spring Harbor Laboratory Press, 1989; 9: 16- 69.
〔4〕 Kofron JL, Kuzmic P, Kishore V, et al. Determination of kinetic constants for peptidyl prolyl cis trans isomerase by an improved spectrophotometric assay〔J〕 . Biochem, 1991; 30: 6127- 6134.
〔5〕 Stndaert RF, Galat A, Verdine GL, et al. Molecular cloning and expression of the human FK506 binding protein FKBP〔J〕 . Nature, 1990; 346: 671- 674.
, 百拇医药
〔6〕 Hamilton GS, Steiner JP. Immunophilin: beyond immunosuppression〔J〕 . J Med Chem, 1998; 41(26): 5119- 5143.
〔7〕 Gold BG, Zeleny Pooley M, Wang MS, et al. A nonimmunosuppressive FKBP12 ligand increase nerve regenration〔J〕 . Exp Neurol, 1997; 147: 269- 278.
收稿日期:1999-08-30
修回日期:1999-10-25, http://www.100md.com
单位:裴武红(北京基础医学研究所);贺永怀(北京基础医学研究所);陈兴(北京基础医学研究所);沈倍奋(北京基础医学研究所);李松(北京毒物药物研究所,北京 100850)
关键词: FKBP12;原核表达;肽基脯氨基顺反异构酶
细胞与分子免疫学杂志000307
摘要:目的获得具有生物学活性的hFKBP12, 以筛选新型的促神经再生药物。方法构建原核表达 载体pExSecI/hFKBP12, 并在 BL21(DE3)plysE菌株中进行可溶性高效表达。 表达上清经CM Sepharose fast flow一步层析。结果获得电泳纯的hFKBP12。 活性测定结果表明,纯化后的 hFKBP12显示具有较强的肽基脯氨基顺反异构酶活性。 结论原核表达的hFKBP12具有天然生物学活 性 。
, http://www.100md.com
中图号: R392.11 文献标识码:A 文章编号:1007-8738(2000)03-0204-03
Expression and bioactivity of human FKBP12 gene
PEI Wu-hong HE Yong-huai CHEN Xing SHEN Bei-fen
(Beijing Institute of Basic Medical Sciences)
LI Song
(Beijing Institute of pharmacology and Toxicology, Beijing 100850, China )
Abstract: Aim To obtain bioactive hFKBP12 protein for screening novel neurotrophic drugs. Methods hFKBP12 gene was inserted into prokaryotic expression vector pExSecI and then expressed in soluble form with high efficiency in E.coli BL21(DE3)plysE host. Recombinant hFKBP12 protein were purified by one step CM Sepharose fast flow chromatography. Results Recombinant hFKBP12 protein,with a purity of homogenity, showed peptidyl prolyl cis trans isomerase(PPIase)activity. Conclusion Recombinant hFKBP12 protein is bioactive just as it wild type's. Sepharose fast flow chromatography. Results Recombinant hFKBP12 protein,with a purity of homogenity, showed peptidyl prolyl cis trans isomerase(PPIase)activity. Conclusion Recombinant hFKBP12 protein is bioactive just as it wild type's.
, 百拇医药
Keyword: hFKBP12;prokaryotic expression;peptidyl prolylcis trans isomerase ▲
FKBP12是免疫抑制剂FK506结合蛋白(FK506bindingprotein,FKBP)家族的主要成员,因预计相对分子质量(Mr)为12000而得名,实际上其电泳行为Mr约14000。自1989年发现此蛋白以来,人们的研究主要集中于其介导的免疫抑制作用。1994年研究发现,FKBP12在神经系统中的含量比在免疫系统中要高出50倍以上,通过其介导FK506在体内外均可促进神经再生〔1〕。这一重大发现,使FKBP蛋白家族的研究成为热点,人们力求设计一类新型的FKBP结合药物,去除FK506的免疫抑制作用,而保留其促神经再生作用,以作为神经再生促进剂而应用于临床。1997年,美国一家药厂开发的基于FKBP12和FK506结构而设计的化合物已推进到猴的巴金森氏综合症模型上,使在这一领域的研究迈出了可喜的一步〔2〕。为了进一步研究FKBP12介导的促神经再生作用的机制,合理设计促神经再生剂,我们在大肠杆菌中表达了hFKBP12,并对表达产物进行了生物学活性研究。
, 百拇医药
1 材料和方法
1.1材料pExSecI质粒和BL21(DE3)plysE菌株为本室保存。工具酶NdeI,BamHI和T4DNA连接酶均为Promega公司产品。引物由上海生物工程公司合成。CMSepharose购自Pharmacia公司。测定活性的底物NsuccinylAlaAlaProPhepnitroanilide(AAPF)购自Sigma公司。
1.2方法
1.2.1DNA的体外操作参考《分子克隆》一书的有关部分〔3〕。
1.2.2原核表达与鉴定以pExSecI/hFKBP12转化宿主菌BL21(DE3)plysE,转化子过夜活化后,按3%接种于新鲜的LBkan培养基中,37℃培养至A600nm值约0.6。加入适当浓度的IPTG,在合适的条件下诱导,将发酵菌体经超声破碎、12000r/min离心后,用160g/LSDSPAGE分析重组蛋白hFKBP12的存在形式。
, 百拇医药
1.2.3表达产物的CMSepharose纯化取30mLCMSepharose,预先用5mmol/LpH6.5的磷酸缓冲液平衡,然后将表达产物的超声上清缓慢流过层析柱。先用10倍柱体积的5mmol/LpH6.5的人FKBP12基因的可溶性表达及活性研究磷酸缓冲液洗去不被CMSepharose吸附的杂蛋白,然后再用含有梯度NaCl的5mmol/LpH6.5的磷酸缓冲液进行洗脱,收集洗脱峰,用160g/LSDSPAGE分析。
1.2.4重组蛋白的活性测定按文献〔4,5〕的方法,测定肽基脯氨基顺反异构酶的活性:反应体积为1mL,于室温进行反应。在865μL反应缓冲液(50mmol/Lhepes,100mmol/LNaCl,pH8.0)中,加入10μL700nmol/L纯化的hFKBP12蛋白(对照组加不含hFKBP12蛋白的缓冲液)。混合后,移至分光光度计比色杯中,加入100μL4g/L的α胰凝乳蛋白酶,再立即加入25μL含3mmol/LAAPF底物的400mmol/L氯化锂/四氢呋喃溶液,迅速混合,测定390nm的吸光值(A390nm),每10s记录1次。
, http://www.100md.com
2 结果
2.1重组质粒pExSecI/hFKBP12的构建将PCR扩增的hFKBP12基因用NdeI和BamHI双酶切后,插入到用相同酶切的pExSecI表达载体中,构建重组质粒pExSecI/hFKBP12,经酶切鉴定正确(图1)。

图1重组质粒pExSecI/hFKBP12的酶切鉴定
Fig1Restrictionenzymedigestionpatternofrecombinant
plasmidpExSecI/hFKBP12
1:DL2000marker;2:λDNA/HindIIImarker;3:PlasmidpExSecI/hFKBP12digestedbyNdeIandBamHI.
, http://www.100md.com
2.2hFKBP12的可溶性表达将重组质粒pExSecI/hFKBP12转化BL21(DE3)plysE,在37℃以1mmol/LIPTG诱导时,hFKBP12的表达主要以包涵体的形式存在。由于包涵体成分复杂,因此具有复性过程烦琐、复性效率低和其中蛋白质降解严重等缺点。我们探索了hFKBP12可溶性表达的条件,发现在IPTG用量为0.1mmol/L、诱导温度为12℃~16℃、诱导时间为16h时,有相当量的hFKBP12以可溶性形式出现于菌体的超声上清中(图2)。我们对可溶性的hFKBP12进行了纯化及活性测定。

图2hFKBP12表达的SDSPAGE分析
Fig2SDSPAGEanalysisofhFKBP12expression
1,4:UninducedpExSecI/hFKBP12;2:InducedpExSecI/hFKBP12;
, 百拇医药
3:Marker(Mr);5:SupernatantofinducedpExSecI/hFKBP12;
6:PelletofinducedpExSecI/hFKBP12.
2.3hFKBP12的CMSepharose纯化表达产物的超声上清过CMSepharose层析柱后,所获结果表明,在用50mmol/L和500mmol/LNaCl的5mmol/LpH6.5的磷酸缓冲液洗脱时,可检测到蛋白峰(图3),其中50mmol/LNaCl洗脱出电泳纯的hFKBP12蛋白。蛋白紫外定量表明,hFKBP12的得率约为10mg/L发酵液。这种纯化方法操作简单,只用CMSepharose一步层析就可获得电泳纯的hFKBP12。

图3CMSepharose层析纯化hFKBP12蛋白的SDSPAGE分析
, http://www.100md.com
Fig3SDSPAGEanalysisofhFKBP12proteinpurifiedby
CMSepharosechromatography 1:50mmol/LNaClelutionofpurifiedhFKBP12;2:500mmol/LNaClelutionofundesiredprotein;3:Marker(Mr).
2.4PPIase的活性测定溶液中AAPF的ProAla肽键处于顺反式构象的动态平衡之中,hFKBP12是一种肽基脯氨基顺反异构酶,可协助AAPF顺反态之间的转变。当AAPF处于反式状态时,会被α胰凝乳蛋白酶裂解而释放,可在390nm波长检测的pnitroanilide基团。我们将纯化的hFKBP12,以7nmol/L浓度测定其PPIase活性。结果显示,复性后的hFKBP12具有较强的PPIase活性(图4),从而为以后的工作奠定了基础。

, http://www.100md.com
图4α胰凝乳蛋白酶联发光检测法测定hFKBP12的活性Fig4DetectionofPPIaseactivityofpurifiedhFKBP12by
αchymotrypsincoupledchromogenicassay
A:7nmol/LhFKBP12;B:NohFKBP12.
3 讨论
FK506是临床上广泛应用的免疫抑制剂,FKBP12是作为FK506的受体蛋白而发现的。对它们早期的研究主要集中于免疫系统的细胞,尤其是淋巴细胞。1994年以来,人们发现FKBP12在神经系统的含量远高于免疫系统,提示FKBP12具有多种神经营养功能,并确定其介导FK506的神经营养作用和免疫抑制作用是完全可以分开的〔6〕。国外有几个实验室利用以FKBP12的结构为基准而设计药物的方法,合成了一些具有神经营养作用的化合物,在体外、鼠体实验中取得了可喜的成绩〔7〕。同时,可介导FK506的免疫抑制作用和促神经再生作用。我们的目标是设计新型化合物。鉴于这类小分子化合物具有可口服、能穿透血脑屏障和不引起神经异常生长等优点,必然具有很广阔的应用前景。正因为如此,我们以FKBP12为模板,参考FK506的分子结构,而设计新型的促神经再生剂。本研究对hFKBP12基因的表达与活性分析,为这一目标的实施奠定了基础。■
, 百拇医药
基金项目:国家“973”创新药物基金资助,No.G1998051107
作者简介:裴武红:女,30岁,助理研究员,博士北京市太平路27号,Tel.(010)66931327 2000 by J Cell Mol Immunol Presswww.immunology. net/jcmi; Email. immuedit@fmmu.edu.cn
参考文献:
〔1〕 Gold BG. FK506 and the immunophilins in nerve regeneration〔J〕 . Mol Neurobiol, 1997; 15(3): 285- 306.
〔2〕 Steiner JP, Hamilton GS, Ross DT, et al. Neurotrophic immunophilin ligands stimulate structural and functional recovery in neurodegenerative animal models〔J〕 . Proc Natl Acad Sci USA, 1997; 94: 2019- 2024.
, 百拇医药
〔3〕 Sambrook J, Fritsch EF, Manitias T. Molecular Cloning: A Labortory Mannal〔M〕 . 2nd ed.New York: Cold Spring Harbor Laboratory Press, 1989; 9: 16- 69.
〔4〕 Kofron JL, Kuzmic P, Kishore V, et al. Determination of kinetic constants for peptidyl prolyl cis trans isomerase by an improved spectrophotometric assay〔J〕 . Biochem, 1991; 30: 6127- 6134.
〔5〕 Stndaert RF, Galat A, Verdine GL, et al. Molecular cloning and expression of the human FK506 binding protein FKBP〔J〕 . Nature, 1990; 346: 671- 674.
, 百拇医药
〔6〕 Hamilton GS, Steiner JP. Immunophilin: beyond immunosuppression〔J〕 . J Med Chem, 1998; 41(26): 5119- 5143.
〔7〕 Gold BG, Zeleny Pooley M, Wang MS, et al. A nonimmunosuppressive FKBP12 ligand increase nerve regenration〔J〕 . Exp Neurol, 1997; 147: 269- 278.
收稿日期:1999-08-30
修回日期:1999-10-25, http://www.100md.com