人源抗丙型肝炎病毒噬菌体抗体库的构建及筛选
作者:张建琼 张雪萍 谢维 林陵 单祥年 王琰
单位:张建琼(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);张雪萍(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);谢维(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);林陵(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);单祥年(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);王琰(北京海军总医院)
关键词:噬菌体抗体库; HCV; 人源单克隆抗体
细胞与分子免疫学杂志000302
摘要:目的构建人丙型肝炎病毒(HCV)特异性噬菌体抗体库,制备人源抗HCV单克隆抗体(mAb)。方法用常规RTPCR法,直接从5例丙型肝炎患者外周血混合淋巴细胞中,扩增抗体重链Fd基因和κ轻链基因,与噬菌体载体pComb3连接,构建噬菌体抗体Fab库。对抗体库进行5轮吸附-洗脱-扩增的亲和选择后,以ELISA法鉴定抗HCV噬菌体抗体。结果RTPCR可有效地扩增出Fd和κ基因,并以此构建成容量为1.2×107的噬菌体抗体库。经5轮亲和选择可使特异性噬菌体抗体得到高度富集,抗HCV噬菌体抗体阳性克隆达96%。结论抗HCV噬菌体抗体库的构建和人源抗HCVmAb的制备,为HCV感染的诊断、治疗和发病机制的研究提供有效的分子工具。
, 百拇医药
中图号:Q782 文献标识码:A 文章编号:1007-8738(2000)03-0189-04
Construction and screening of human hepatitis C virus-specific phage antibody combinatorial library
ZHANG Jian-qiong ZHANG Xue-ping XIE Wei LIN Ling SHAN Xiang-nian
(Department of Microbiology & Immunology, Nanjing Railway Medical College, Nanjing 210009, Jiangsu Province, China)
WANG Yan
, 百拇医药
(Navy General Hospital Beijing, China)
Abstract: Aim Human monoclonal antibodies to hepatitis C virus NS4 mosaic antigen were generated from phage antibody combinatorial library. Methods Employing routine RT-PCR, the human Fd and κ light chains genes were amplified in human peripheral blood lymphocytes from patients infected with HCV by sets of oligonucleotide primers. Phage antibody library was constructed with the Fd and κ chain genes using pComb3 as vector. The affinity selection and ELISA were adopted for identification of specific phage antibodies to HCV. Results HCV-specific phage antibody library was constructed using Fd and κ genes and pComb3 vector. The library size was about 1.2× 107. The HCV-specific phage antibodies were highly enriched after five rounds of biopanning against HCV NS4 mosaic antigen and positive clones were detected upto 96% by ELISA. Conclusion HCV-specific antibody library and human monoclonal antibodies to HCV can be very useful as molecular tools for research diagnosis and therapy of HCV infection.
, http://www.100md.com
Keywords: phage antibody library; HCV; human monoclonal antibody ▲
丙型肝炎病毒(HCV)是输血后肝炎和散发性非甲非乙型肝炎的主要病因,至少有50%的HCV感染者发展为慢性肝炎、肝硬化甚至肝癌。HCV是单链正股RNA病毒,基因组约为9.5kb。HCV基因组有高度的变异性,目前HCV已分为11个基因型和70余个亚型〔1〕。由于HCV基因序列的高度异质性,使HCV的血清学检测和疫苗的研制面临重重困难,在被动免疫中应用中和抗体可能性也受到阻碍〔2〕。Farci等〔4〕的实验表明,在HCV慢性感染者体内有特异性中和抗体。病毒的包膜蛋白是宿主免疫系统的攻击目标,抗HCVE2包膜蛋白超变区(HVR1)的特异性抗体,能封闭HCV吸附培养的人成纤维细胞〔3〕,并能与两株不同基因型的HCV发生交叉反应。因此,制备人源性抗HCV抗体,对于HCV的诊断、治疗、制备疫苗及发病机制的研究等均有一定的价值。噬菌体抗体库技术为人源mAb的制备提供了有效的手段〔5〕。我们用常规RT-PCR技术,从丙型肝炎患者外周血淋巴细胞中扩增抗体基因,构建人源性噬菌体抗体库,并从中筛选到多株抗HCVNS4多基因型嵌合抗原的噬菌体抗体。
, http://www.100md.com
1 材料和方法
1.1材料噬菌粒pComb3购于美国Scripps研究所。辅助噬菌体VCSM13和HRP-羊抗M13抗体为Pharmacia公司产品。M-MLV,Trizolreagent为ISSN1007-8738细胞与分子免疫学杂志(JCellMolImmunol)2000;16(3)
Gibco公司产品。限制性内切酶和T4DNA连接酶均为Promega公司产品。其它有关化学试剂均为国产分析纯。HCVNS4多基因型嵌合蛋白,由美国CDC孟继鸿教授惠赠。SB,SOC和LB培养液按常规方法自配。
1.2方法
1.2.1人外周血淋巴细胞的分离从本院附属医院门诊随机取5例经第2代ELISA试剂检测血清抗HCVIG强阳性,PCR检测HCVRNA阳性的慢性丙型肝炎患者的外周血。每例采血10mL,用淋巴细胞分层液按常规方法制备人外周血淋巴细胞,并用冷PBS洗3次,混合后用倒置显微镜计数,分装(每管5×106细胞)。5例患者经HCV5′端非编码区型特异性引物PCR分型,4例为1b型,1例为3型。
, 百拇医药
1.2.2总RNA提取和cDNA第1链的合成以Trizolreagent提取细胞总RNA,按说明书操作。取RNA2μL测A260nm和A280nm值鉴定其浓度和纯度。另取5μLRNA,用6g/L琼脂糖凝胶电泳检查总RNA的完整性。取10μgRNA溶液,加入Olig。(dT)4μL(0.4μg),于70℃变性8min,冰浴5min。分别加入5×Buffer10μL,2.5mmol/LdNTP10μL,0.1mol/LDTT5μL,RNA酶抑制物40U和M-MLV400U,用DEPC处理水补足体积至50μL,37℃水浴1h,95℃5min,冰浴10min,于-20℃储存。
1.2.3引物设计及扩增Fd和κ基因PCR所用人抗体引物,根据Kang〔6〕的设计加适当改动和简并,由上海生工生物工程公司合成,PAGE纯化。IgG1CH3′端引物为:5′-GCATGTACTAGTTTTGTC-
ACAAGATTTGGG;VH5′端引物P1为:5′-SAGG-TGCAGCTCGAGSAGTCTGG(由VH1a与VH3a简并与);P2为:5′-SAGGTGCAGCTGCTCGAGTCTGG(由VHlf与VH3f简并);P3为:5′-CAGGTGCAGC-TRCTCGAGTCGGG(由VH与VH4f简并)。
, http://www.100md.com
Cκ3′端引物为:5′-GCGCCGTCTAGAACTAAC-ACTCTCCCCTGTTGAAGCTCTTTGTACGGGCAAG;
Vκ5′端引物为:5′-GAMATYGAGCTCACSCAGTC-TCCA(由Vκ1a与Vκ3a简并)。其中M=A或C,S=C或G,Y=C或T。重链引物中分别含有内切酶XhoI和SpeI的识别序列(下画线部分);轻链引物中分别含有内切酶SacI和XbaI的识别序列(下画线部分)。每管以5μLcDNA为PCR反应的模板,分别对Fd和κ基因进行扩增。
1.2.4大肠杆菌的电穿孔转化将2.5mL过夜培养的XL1-Blue菌液,接种在400mL含有四环素10mg/L的SB中,37℃培养至A600nm值为0.5。置冰浴中15min,于4℃离心弃上清,用100mL/L冷甘油水将细菌洗涤3次后,悬于4mL100mL/L甘油中即为感受态细胞。分装(每管0.2mL),于液氮中冻5min后,取出,置-70℃冻存。按Bio-Rad基因脉冲仪说明书中所述方法进行电穿孔转化。
, http://www.100md.com
1.2.5噬菌体抗体库的构建κPCR产物经琼脂糖凝胶电泳分离后,以QIAGEN凝胶提取Kit纯化,SacI+XbaI双酶切,再以PCR产物纯化Kit纯化。然后用T4DNA连接酶使之与相应酶切纯化的噬菌粒pComb3连接,电穿孔转化XL1-Blue细胞,扩增转化后的细菌。扩增后提取质粒得到含轻链片段的pComb3。对其进行XhoI+SpeI双酶切,并与用相应酶切的重链FdPCR产物连接,电穿孔转化XL1-Blue。转化后的细菌加2mL预热的SOC,置37℃振荡培养1h后,转移至SOC固体平板(含氨苄青霉素100mg/L,四环素10mg/L),于37℃培养24h。用SB洗下菌苔,取20μL菌液加入20mL含氨苄青霉素的SB中,37℃培养至A600nm约为0.5。加入约1011pfu的辅助噬菌体VCSM13,37℃培养1h,再加入终浓度为70mg/L的卡那霉素,振荡培养过夜。离心、收集上清,加入PEG6000到40g/L,NaCl到30g/L,置冰浴1h后,于4℃以12000r/min离心。弃上清,以3mLPBS溶解沉淀,再以12000r/min离心5min,弃去不溶物,收集上清即为噬菌体抗体库。
, http://www.100md.com
1.2.6噬菌体抗体库的筛选将HCVNS4嵌合蛋白以每孔100ng包被ELISA板条,用30g/LBSA封闭、PBS洗后,加入噬菌体抗体库100μL(约1012cfu),37℃温育2h。吸出噬菌体抗体液,以PBST洗1次(第2轮洗5次,第3,4,5轮各洗10次),PBS洗1次,加入100μL洗脱液(0.1mol/LHCl,以甘氨酸调至pH2.2,并含1g/LBSA)于室温静置10min。将洗脱液稍加吹打后吸出,立即用6μL2mol/LTris中和,并加入2mLXL1-Blue,于37℃静置20min后,再加入20mLSB(含氨苄青霉素和四环素),取10μL稀释铺盘测定cfu。其余细菌置37℃培养2h后,加入VCSM13和卡那霉素。噬菌体的沉淀和收集均按步骤1.2.5中的程序进行。反复进行“吸附→洗脱→扩增”5次淘洗,以使特异性噬菌体抗体高度富集。
1.2.7单克隆噬菌体抗体的制备及鉴定将经第5轮筛选、洗脱的噬菌体感染XL1-Blue后划平板,过夜培养。随机挑选细菌菌落,接种于4mL含氨苄青霉素和四环素的SB中,置37℃振荡培养过夜。取200μL加到4mL含同样量抗菌素的SB中,再37℃振荡培养2h,加入40μL的VCSM13培养2h后,加卡那霉素至70mg/L,置30℃振荡培养过夜。离心收集上清,即为单克隆噬菌体抗体,置4℃保存。将待检噬菌体抗体与等量10g/LBSA混合后,置室温孵育20min,加到已经HCVNS4嵌合蛋白包被和BSA封闭的ELISA板中,于37℃温育2h。用PBST洗4次、PBS洗2次后,加入HRP-羊抗M13抗体进行结合反应,以TMB显色。实验中采用VCSM13作为阴性对照。
, 百拇医药
2 结果
2.1细胞总RNA的提取采用Trizolreagent提取RNA法,每5×106个淋巴细胞可得到6~10μgRNA(A260nm/A280nm=1.5~1.8)。总RNA经琼脂糖凝胶电泳分析,可见28sRNA,18sRNA及5sRNA3条带,其中28sRNA与18sRNA带之间有类似Smear现象,为不同分子量的mRNA(图1)。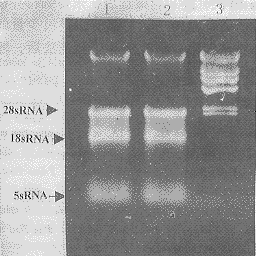
图1人外周血淋巴细胞总RNA的分离
Fig1IsolationoftotalRNAfromhumanperipheralblood
lymphocytes
1:TotalRNA;2:TotalRNA.
, http://www.100md.com
2.2Fd基因和κ轻链基因的扩增用Kang设计的3′端及简并后的P1,P2和P33条5′端重链引物,κ链3′端及简并的5′端引物配对后,对5例HC患者混合外周血淋巴细胞的cDNA进行扩增,均可见浓的特异性扩增带。与分子量标准相比较,其DNA片断的大小约为700bp,与推测的抗体重链Fd及κ轻链基因的大小相同〔6〕(图2)。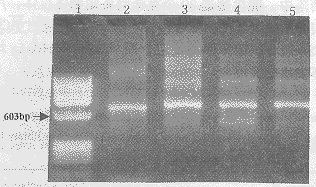
图2RT-PCR扩增人IgFd和κ轻链基因
Fig2AmplificationofhumanIgFdandκgenesbyRT-PCR
1:XФ174/HaeIIImarker;2:PCRproductofFdgene(5′terminalprimerP1);3:PCRproductofFdgene(5′terminalprimerP2);4:PCRproductofFdgene(5′terminalprimerP3);5:PCRproductofκgene.
, 百拇医药
2.3噬菌体抗体库的构建和筛选分别将不同引物扩增的Fd和κ链基因的PCR产物纯化,经酶切、连接、转化,构建成噬菌体抗体库,测定库的容量为1.2×107。随机挑取10个菌落扩增,提取质粒DNA,用XbaI+XhoI双酶切检测,5个克隆切出约2.4kb的带(图3中的第2,4,7,10和11道),即同时含有Fd段基因和κ链基因;4个克隆切出约1.7kb的片段(第1,3,5和9道),即仅含有Fd或κ链基因,1个克隆为变异株(第8道),说明Fab重组率为50%。以固相化的HCVNS4抗原对噬菌体抗体库进行5轮“吸附→洗脱→扩增”的淘筛,尽管淘洗强度逐轮加大,但洗脱下来的噬菌体滴度明显增加,说明携带有抗HCVNS4的特异性抗体的噬菌体得到了高度富集(表1)。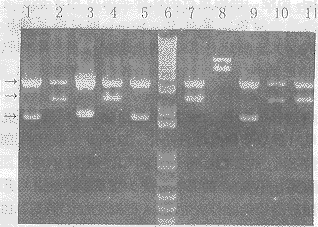
图3噬菌体抗体库的限制内切酶鉴定
Fig3Restrictionenzymeanalysisofphageantibodylibrary
, 百拇医药
1,3,5and9:ContainFdorκclones;6:DNAmolecularmarker(kb);2,4,7,10and11:ContainFabclones.
Threearrowsinthefigureseparatelyindicade3.0,2.4and1.7kbfromtoptobottom.
2.4噬菌体抗体的鉴定从第5轮筛选后得到的菌落中,随机挑选30个克隆制备噬菌体抗体,用ELISA测定其抗原结合活性,有29个克隆对HCVNS4嵌合抗原呈阳性反应,而与BSA和HBsAg均不发生交叉反应。
表1亲和选择对噬菌体抗体的富集效应
Tab1Selectiveenrichmentofphageantibodiesfromlibraryby
, http://www.100md.com
HCVNS4biopanning RoundsofClonescontaining
cfu added
cfueluted
panningFabgenes
1
1×1012
-
-
2
1×1012
1.0×106
, 百拇医药
-
3
1×1012
3.0×105
8/10
4
1×1012
6.7×105
10/10
5
1×1012
3.0×106
, 百拇医药
10/10
3 讨论
mAb已广泛应用于临床诊断和基础研究中,并取得了令人瞩目的成果。但鼠源性mAb易引起人体产生抗鼠抗体,制约了mAb在体内的应用。噬菌体抗体库技术,可在短期内制备人源mAb,使之体内应用展示了良好的前景。我们采用RT-PCR法,成功地扩增出丙型肝炎患者外周血淋巴细胞中的重链Fd基因和κ轻链基因。扩增产物的分子量与文献报道相一致。经自然免疫的人体(如患者或感染者)是目的抗体基因的良好来源。自然免疫的人体内目的抗体基因的mRNA丰度相对较高,有利于所建文库的筛选,并利于克隆出高亲和力的抗体。因此,我们选择抗HCVIgG阳性、国内流行的优势基因型HCV感染者作为采血对象,采血30~50mL即可满足建库所需。关于细胞总RNA的提取,多种方法均强调RNA的纯度,即A260nm/A280nm值应达1.8~2.0,使众多研究者花费了大量时间及经费,一味增加提取步骤,反复沉淀纯化。我们的研究表明,提取步骤应尽量简化,以减少污染RNA酶降解RNA的机会。对于RT-PCR,RNA的纯度固然重要,但RNA的完整性更为重要。因此,可用琼脂糖凝胶电泳检查总RNA的完整性。但是,由于DNA与RNA的电泳迁移速率互不相同(RNA比等长的DNA迁移得快),故不能用DNA分子量标准参照物对RNA的分子进行测定。检查总RNA的完整性,只需看到RNA的3条带,即可证实提取成功,不需要测定其分子量。我们曾用两种方法,多次提取外周血淋巴细胞总RNA,A260nm/A280nm值=1.1~1.8不等,用不同比值的RNA进行RT-PCR,均可获得满意结果。采用多例携带不同基因型HCV感染患者的外周血淋巴细胞,进行混合分装,并使每个分装(5×106细胞)代表一定的人群范围,以便于每次基因扩增能获得较好的效果。经过优化转化条件,可使抗体库容量达1.2×107,Fab基因的重组率达50%。为了筛选抗HCV特异性噬菌体抗体,经严格的5轮亲和淘筛,可使特异性噬菌体抗体高度富集。在第5轮筛选后,挑选30个克隆用ELISA进行特异性检测,证明有29个克隆可与HCVNS4抗原特异性结合,阳性克隆率为96%。国内外报道,筛选抗体库均为3~4轮,我们在筛选过程中发现,洗涤次数应达10次,才能使阴性对照孔中的VCSM13完全洗去。因此,第1,2轮筛选分别洗涤1次和5次,洗脱出的噬菌体中含有较多的非特异性噬菌体和辅助噬菌体,产出率也较高,但不能代表特异性噬菌体富集。我们也尝试在第1轮筛选时,即洗涤10次,经3轮筛选后,未得到特异性噬菌体抗体,可能是第1轮的强洗涤将极少量的特异性克隆洗去所致,而改用5轮筛洗法后,才获得理想的结果。■
, 百拇医药
基金项目:江苏省科技发展基金资助,No. BJ97070
作者简介:张建琼,女,38岁,博士。南京市丁家桥路87号,Tel. (025)3324421 2000 by J Cell Mol Immunol Press www.immunology. net/jcmi; Email. immuedit@fmmu.edu.cn
参 考 文 献 :
〔1〕 Simmonds P, Holmes EC, Cha TA, et al. Classification of hepatitis C virus into six major genotypes and a series of subtypes by phylogenetic analysis of the NS-5 region〔J〕 . J Gen Virol. 1993; 74:2391-2399.
, http://www.100md.com
〔2〕 Choo QL, Kuo G, Ralston R, et al. Vaccination of chimpanzees against infection by the hepatitis C virus〔J〕 . Proc Natl Acad Sci USA,1994; 91:1294-1298.
〔3〕 Farci P, Alter HJ, Wong DC, et al. Prevention of hepatitis C virus infection in chimpanzees after antibody-mediated in vitro neutralization〔J〕 . Proc Natl Acad Sci USA, 1994;91:7792-7796.
〔4〕 Zibert A, Schreier E, Roggendorf M. Antibodies in human sera specific to hypervariable region 1 of hepatitis C virus can block virol attachment〔J〕 . Virology, 1995; 208:653.
, 百拇医药
〔5〕 McCfferty J, Griffiths AD, Winter G, et al. Phage antibodies: filamentous phage displaying antibody variable domains〔J〕 . Nature, 1990; 348:552-554.
〔6〕 Kang AS, Burton DR, Lerner RA, et al. Combinatorial immunoglobulin libraries in phage〔M〕 . Methods: Companion Methods Enzymol, 1991: 2(2):111-118. ISSN 1007-8738 细 胞 与 分 子 免 疫 学 杂 志 (J Cell Mol Immunol)2000;16(3)
收稿日期:1999-08-05
修回日期:1999-10-08, 百拇医药
单位:张建琼(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);张雪萍(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);谢维(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);林陵(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);单祥年(南京铁道医学院微生物学与免疫学教研室,江苏南京 210009);王琰(北京海军总医院)
关键词:噬菌体抗体库; HCV; 人源单克隆抗体
细胞与分子免疫学杂志000302
摘要:目的构建人丙型肝炎病毒(HCV)特异性噬菌体抗体库,制备人源抗HCV单克隆抗体(mAb)。方法用常规RTPCR法,直接从5例丙型肝炎患者外周血混合淋巴细胞中,扩增抗体重链Fd基因和κ轻链基因,与噬菌体载体pComb3连接,构建噬菌体抗体Fab库。对抗体库进行5轮吸附-洗脱-扩增的亲和选择后,以ELISA法鉴定抗HCV噬菌体抗体。结果RTPCR可有效地扩增出Fd和κ基因,并以此构建成容量为1.2×107的噬菌体抗体库。经5轮亲和选择可使特异性噬菌体抗体得到高度富集,抗HCV噬菌体抗体阳性克隆达96%。结论抗HCV噬菌体抗体库的构建和人源抗HCVmAb的制备,为HCV感染的诊断、治疗和发病机制的研究提供有效的分子工具。
, 百拇医药
中图号:Q782 文献标识码:A 文章编号:1007-8738(2000)03-0189-04
Construction and screening of human hepatitis C virus-specific phage antibody combinatorial library
ZHANG Jian-qiong ZHANG Xue-ping XIE Wei LIN Ling SHAN Xiang-nian
(Department of Microbiology & Immunology, Nanjing Railway Medical College, Nanjing 210009, Jiangsu Province, China)
WANG Yan
, 百拇医药
(Navy General Hospital Beijing, China)
Abstract: Aim Human monoclonal antibodies to hepatitis C virus NS4 mosaic antigen were generated from phage antibody combinatorial library. Methods Employing routine RT-PCR, the human Fd and κ light chains genes were amplified in human peripheral blood lymphocytes from patients infected with HCV by sets of oligonucleotide primers. Phage antibody library was constructed with the Fd and κ chain genes using pComb3 as vector. The affinity selection and ELISA were adopted for identification of specific phage antibodies to HCV. Results HCV-specific phage antibody library was constructed using Fd and κ genes and pComb3 vector. The library size was about 1.2× 107. The HCV-specific phage antibodies were highly enriched after five rounds of biopanning against HCV NS4 mosaic antigen and positive clones were detected upto 96% by ELISA. Conclusion HCV-specific antibody library and human monoclonal antibodies to HCV can be very useful as molecular tools for research diagnosis and therapy of HCV infection.
, http://www.100md.com
Keywords: phage antibody library; HCV; human monoclonal antibody ▲
丙型肝炎病毒(HCV)是输血后肝炎和散发性非甲非乙型肝炎的主要病因,至少有50%的HCV感染者发展为慢性肝炎、肝硬化甚至肝癌。HCV是单链正股RNA病毒,基因组约为9.5kb。HCV基因组有高度的变异性,目前HCV已分为11个基因型和70余个亚型〔1〕。由于HCV基因序列的高度异质性,使HCV的血清学检测和疫苗的研制面临重重困难,在被动免疫中应用中和抗体可能性也受到阻碍〔2〕。Farci等〔4〕的实验表明,在HCV慢性感染者体内有特异性中和抗体。病毒的包膜蛋白是宿主免疫系统的攻击目标,抗HCVE2包膜蛋白超变区(HVR1)的特异性抗体,能封闭HCV吸附培养的人成纤维细胞〔3〕,并能与两株不同基因型的HCV发生交叉反应。因此,制备人源性抗HCV抗体,对于HCV的诊断、治疗、制备疫苗及发病机制的研究等均有一定的价值。噬菌体抗体库技术为人源mAb的制备提供了有效的手段〔5〕。我们用常规RT-PCR技术,从丙型肝炎患者外周血淋巴细胞中扩增抗体基因,构建人源性噬菌体抗体库,并从中筛选到多株抗HCVNS4多基因型嵌合抗原的噬菌体抗体。
, http://www.100md.com
1 材料和方法
1.1材料噬菌粒pComb3购于美国Scripps研究所。辅助噬菌体VCSM13和HRP-羊抗M13抗体为Pharmacia公司产品。M-MLV,Trizolreagent为ISSN1007-8738细胞与分子免疫学杂志(JCellMolImmunol)2000;16(3)
Gibco公司产品。限制性内切酶和T4DNA连接酶均为Promega公司产品。其它有关化学试剂均为国产分析纯。HCVNS4多基因型嵌合蛋白,由美国CDC孟继鸿教授惠赠。SB,SOC和LB培养液按常规方法自配。
1.2方法
1.2.1人外周血淋巴细胞的分离从本院附属医院门诊随机取5例经第2代ELISA试剂检测血清抗HCVIG强阳性,PCR检测HCVRNA阳性的慢性丙型肝炎患者的外周血。每例采血10mL,用淋巴细胞分层液按常规方法制备人外周血淋巴细胞,并用冷PBS洗3次,混合后用倒置显微镜计数,分装(每管5×106细胞)。5例患者经HCV5′端非编码区型特异性引物PCR分型,4例为1b型,1例为3型。
, 百拇医药
1.2.2总RNA提取和cDNA第1链的合成以Trizolreagent提取细胞总RNA,按说明书操作。取RNA2μL测A260nm和A280nm值鉴定其浓度和纯度。另取5μLRNA,用6g/L琼脂糖凝胶电泳检查总RNA的完整性。取10μgRNA溶液,加入Olig。(dT)4μL(0.4μg),于70℃变性8min,冰浴5min。分别加入5×Buffer10μL,2.5mmol/LdNTP10μL,0.1mol/LDTT5μL,RNA酶抑制物40U和M-MLV400U,用DEPC处理水补足体积至50μL,37℃水浴1h,95℃5min,冰浴10min,于-20℃储存。
1.2.3引物设计及扩增Fd和κ基因PCR所用人抗体引物,根据Kang〔6〕的设计加适当改动和简并,由上海生工生物工程公司合成,PAGE纯化。IgG1CH3′端引物为:5′-GCATGTACTAGTTTTGTC-
ACAAGATTTGGG;VH5′端引物P1为:5′-SAGG-TGCAGCTCGAGSAGTCTGG(由VH1a与VH3a简并与);P2为:5′-SAGGTGCAGCTGCTCGAGTCTGG(由VHlf与VH3f简并);P3为:5′-CAGGTGCAGC-TRCTCGAGTCGGG(由VH与VH4f简并)。
, http://www.100md.com
Cκ3′端引物为:5′-GCGCCGTCTAGAACTAAC-ACTCTCCCCTGTTGAAGCTCTTTGTACGGGCAAG;
Vκ5′端引物为:5′-GAMATYGAGCTCACSCAGTC-TCCA(由Vκ1a与Vκ3a简并)。其中M=A或C,S=C或G,Y=C或T。重链引物中分别含有内切酶XhoI和SpeI的识别序列(下画线部分);轻链引物中分别含有内切酶SacI和XbaI的识别序列(下画线部分)。每管以5μLcDNA为PCR反应的模板,分别对Fd和κ基因进行扩增。
1.2.4大肠杆菌的电穿孔转化将2.5mL过夜培养的XL1-Blue菌液,接种在400mL含有四环素10mg/L的SB中,37℃培养至A600nm值为0.5。置冰浴中15min,于4℃离心弃上清,用100mL/L冷甘油水将细菌洗涤3次后,悬于4mL100mL/L甘油中即为感受态细胞。分装(每管0.2mL),于液氮中冻5min后,取出,置-70℃冻存。按Bio-Rad基因脉冲仪说明书中所述方法进行电穿孔转化。
, http://www.100md.com
1.2.5噬菌体抗体库的构建κPCR产物经琼脂糖凝胶电泳分离后,以QIAGEN凝胶提取Kit纯化,SacI+XbaI双酶切,再以PCR产物纯化Kit纯化。然后用T4DNA连接酶使之与相应酶切纯化的噬菌粒pComb3连接,电穿孔转化XL1-Blue细胞,扩增转化后的细菌。扩增后提取质粒得到含轻链片段的pComb3。对其进行XhoI+SpeI双酶切,并与用相应酶切的重链FdPCR产物连接,电穿孔转化XL1-Blue。转化后的细菌加2mL预热的SOC,置37℃振荡培养1h后,转移至SOC固体平板(含氨苄青霉素100mg/L,四环素10mg/L),于37℃培养24h。用SB洗下菌苔,取20μL菌液加入20mL含氨苄青霉素的SB中,37℃培养至A600nm约为0.5。加入约1011pfu的辅助噬菌体VCSM13,37℃培养1h,再加入终浓度为70mg/L的卡那霉素,振荡培养过夜。离心、收集上清,加入PEG6000到40g/L,NaCl到30g/L,置冰浴1h后,于4℃以12000r/min离心。弃上清,以3mLPBS溶解沉淀,再以12000r/min离心5min,弃去不溶物,收集上清即为噬菌体抗体库。
, http://www.100md.com
1.2.6噬菌体抗体库的筛选将HCVNS4嵌合蛋白以每孔100ng包被ELISA板条,用30g/LBSA封闭、PBS洗后,加入噬菌体抗体库100μL(约1012cfu),37℃温育2h。吸出噬菌体抗体液,以PBST洗1次(第2轮洗5次,第3,4,5轮各洗10次),PBS洗1次,加入100μL洗脱液(0.1mol/LHCl,以甘氨酸调至pH2.2,并含1g/LBSA)于室温静置10min。将洗脱液稍加吹打后吸出,立即用6μL2mol/LTris中和,并加入2mLXL1-Blue,于37℃静置20min后,再加入20mLSB(含氨苄青霉素和四环素),取10μL稀释铺盘测定cfu。其余细菌置37℃培养2h后,加入VCSM13和卡那霉素。噬菌体的沉淀和收集均按步骤1.2.5中的程序进行。反复进行“吸附→洗脱→扩增”5次淘洗,以使特异性噬菌体抗体高度富集。
1.2.7单克隆噬菌体抗体的制备及鉴定将经第5轮筛选、洗脱的噬菌体感染XL1-Blue后划平板,过夜培养。随机挑选细菌菌落,接种于4mL含氨苄青霉素和四环素的SB中,置37℃振荡培养过夜。取200μL加到4mL含同样量抗菌素的SB中,再37℃振荡培养2h,加入40μL的VCSM13培养2h后,加卡那霉素至70mg/L,置30℃振荡培养过夜。离心收集上清,即为单克隆噬菌体抗体,置4℃保存。将待检噬菌体抗体与等量10g/LBSA混合后,置室温孵育20min,加到已经HCVNS4嵌合蛋白包被和BSA封闭的ELISA板中,于37℃温育2h。用PBST洗4次、PBS洗2次后,加入HRP-羊抗M13抗体进行结合反应,以TMB显色。实验中采用VCSM13作为阴性对照。
, 百拇医药
2 结果
2.1细胞总RNA的提取采用Trizolreagent提取RNA法,每5×106个淋巴细胞可得到6~10μgRNA(A260nm/A280nm=1.5~1.8)。总RNA经琼脂糖凝胶电泳分析,可见28sRNA,18sRNA及5sRNA3条带,其中28sRNA与18sRNA带之间有类似Smear现象,为不同分子量的mRNA(图1)。

图1人外周血淋巴细胞总RNA的分离
Fig1IsolationoftotalRNAfromhumanperipheralblood
lymphocytes
1:TotalRNA;2:TotalRNA.
, http://www.100md.com
2.2Fd基因和κ轻链基因的扩增用Kang设计的3′端及简并后的P1,P2和P33条5′端重链引物,κ链3′端及简并的5′端引物配对后,对5例HC患者混合外周血淋巴细胞的cDNA进行扩增,均可见浓的特异性扩增带。与分子量标准相比较,其DNA片断的大小约为700bp,与推测的抗体重链Fd及κ轻链基因的大小相同〔6〕(图2)。

图2RT-PCR扩增人IgFd和κ轻链基因
Fig2AmplificationofhumanIgFdandκgenesbyRT-PCR
1:XФ174/HaeIIImarker;2:PCRproductofFdgene(5′terminalprimerP1);3:PCRproductofFdgene(5′terminalprimerP2);4:PCRproductofFdgene(5′terminalprimerP3);5:PCRproductofκgene.
, 百拇医药
2.3噬菌体抗体库的构建和筛选分别将不同引物扩增的Fd和κ链基因的PCR产物纯化,经酶切、连接、转化,构建成噬菌体抗体库,测定库的容量为1.2×107。随机挑取10个菌落扩增,提取质粒DNA,用XbaI+XhoI双酶切检测,5个克隆切出约2.4kb的带(图3中的第2,4,7,10和11道),即同时含有Fd段基因和κ链基因;4个克隆切出约1.7kb的片段(第1,3,5和9道),即仅含有Fd或κ链基因,1个克隆为变异株(第8道),说明Fab重组率为50%。以固相化的HCVNS4抗原对噬菌体抗体库进行5轮“吸附→洗脱→扩增”的淘筛,尽管淘洗强度逐轮加大,但洗脱下来的噬菌体滴度明显增加,说明携带有抗HCVNS4的特异性抗体的噬菌体得到了高度富集(表1)。

图3噬菌体抗体库的限制内切酶鉴定
Fig3Restrictionenzymeanalysisofphageantibodylibrary
, 百拇医药
1,3,5and9:ContainFdorκclones;6:DNAmolecularmarker(kb);2,4,7,10and11:ContainFabclones.
Threearrowsinthefigureseparatelyindicade3.0,2.4and1.7kbfromtoptobottom.
2.4噬菌体抗体的鉴定从第5轮筛选后得到的菌落中,随机挑选30个克隆制备噬菌体抗体,用ELISA测定其抗原结合活性,有29个克隆对HCVNS4嵌合抗原呈阳性反应,而与BSA和HBsAg均不发生交叉反应。
表1亲和选择对噬菌体抗体的富集效应
Tab1Selectiveenrichmentofphageantibodiesfromlibraryby
, http://www.100md.com
HCVNS4biopanning RoundsofClonescontaining
cfu added
cfueluted
panningFabgenes
1
1×1012
-
-
2
1×1012
1.0×106
, 百拇医药
-
3
1×1012
3.0×105
8/10
4
1×1012
6.7×105
10/10
5
1×1012
3.0×106
, 百拇医药
10/10
3 讨论
mAb已广泛应用于临床诊断和基础研究中,并取得了令人瞩目的成果。但鼠源性mAb易引起人体产生抗鼠抗体,制约了mAb在体内的应用。噬菌体抗体库技术,可在短期内制备人源mAb,使之体内应用展示了良好的前景。我们采用RT-PCR法,成功地扩增出丙型肝炎患者外周血淋巴细胞中的重链Fd基因和κ轻链基因。扩增产物的分子量与文献报道相一致。经自然免疫的人体(如患者或感染者)是目的抗体基因的良好来源。自然免疫的人体内目的抗体基因的mRNA丰度相对较高,有利于所建文库的筛选,并利于克隆出高亲和力的抗体。因此,我们选择抗HCVIgG阳性、国内流行的优势基因型HCV感染者作为采血对象,采血30~50mL即可满足建库所需。关于细胞总RNA的提取,多种方法均强调RNA的纯度,即A260nm/A280nm值应达1.8~2.0,使众多研究者花费了大量时间及经费,一味增加提取步骤,反复沉淀纯化。我们的研究表明,提取步骤应尽量简化,以减少污染RNA酶降解RNA的机会。对于RT-PCR,RNA的纯度固然重要,但RNA的完整性更为重要。因此,可用琼脂糖凝胶电泳检查总RNA的完整性。但是,由于DNA与RNA的电泳迁移速率互不相同(RNA比等长的DNA迁移得快),故不能用DNA分子量标准参照物对RNA的分子进行测定。检查总RNA的完整性,只需看到RNA的3条带,即可证实提取成功,不需要测定其分子量。我们曾用两种方法,多次提取外周血淋巴细胞总RNA,A260nm/A280nm值=1.1~1.8不等,用不同比值的RNA进行RT-PCR,均可获得满意结果。采用多例携带不同基因型HCV感染患者的外周血淋巴细胞,进行混合分装,并使每个分装(5×106细胞)代表一定的人群范围,以便于每次基因扩增能获得较好的效果。经过优化转化条件,可使抗体库容量达1.2×107,Fab基因的重组率达50%。为了筛选抗HCV特异性噬菌体抗体,经严格的5轮亲和淘筛,可使特异性噬菌体抗体高度富集。在第5轮筛选后,挑选30个克隆用ELISA进行特异性检测,证明有29个克隆可与HCVNS4抗原特异性结合,阳性克隆率为96%。国内外报道,筛选抗体库均为3~4轮,我们在筛选过程中发现,洗涤次数应达10次,才能使阴性对照孔中的VCSM13完全洗去。因此,第1,2轮筛选分别洗涤1次和5次,洗脱出的噬菌体中含有较多的非特异性噬菌体和辅助噬菌体,产出率也较高,但不能代表特异性噬菌体富集。我们也尝试在第1轮筛选时,即洗涤10次,经3轮筛选后,未得到特异性噬菌体抗体,可能是第1轮的强洗涤将极少量的特异性克隆洗去所致,而改用5轮筛洗法后,才获得理想的结果。■
, 百拇医药
基金项目:江苏省科技发展基金资助,No. BJ97070
作者简介:张建琼,女,38岁,博士。南京市丁家桥路87号,Tel. (025)3324421 2000 by J Cell Mol Immunol Press www.immunology. net/jcmi; Email. immuedit@fmmu.edu.cn
参 考 文 献 :
〔1〕 Simmonds P, Holmes EC, Cha TA, et al. Classification of hepatitis C virus into six major genotypes and a series of subtypes by phylogenetic analysis of the NS-5 region〔J〕 . J Gen Virol. 1993; 74:2391-2399.
, http://www.100md.com
〔2〕 Choo QL, Kuo G, Ralston R, et al. Vaccination of chimpanzees against infection by the hepatitis C virus〔J〕 . Proc Natl Acad Sci USA,1994; 91:1294-1298.
〔3〕 Farci P, Alter HJ, Wong DC, et al. Prevention of hepatitis C virus infection in chimpanzees after antibody-mediated in vitro neutralization〔J〕 . Proc Natl Acad Sci USA, 1994;91:7792-7796.
〔4〕 Zibert A, Schreier E, Roggendorf M. Antibodies in human sera specific to hypervariable region 1 of hepatitis C virus can block virol attachment〔J〕 . Virology, 1995; 208:653.
, 百拇医药
〔5〕 McCfferty J, Griffiths AD, Winter G, et al. Phage antibodies: filamentous phage displaying antibody variable domains〔J〕 . Nature, 1990; 348:552-554.
〔6〕 Kang AS, Burton DR, Lerner RA, et al. Combinatorial immunoglobulin libraries in phage〔M〕 . Methods: Companion Methods Enzymol, 1991: 2(2):111-118. ISSN 1007-8738 细 胞 与 分 子 免 疫 学 杂 志 (J Cell Mol Immunol)2000;16(3)
收稿日期:1999-08-05
修回日期:1999-10-08, 百拇医药