银屑病患者外周血整合素表达的研究
作者:刘翠杰 刘华昌 尹格平 孙晓明
单位:250031 济南,济南军区总医院皮肤科(刘翠杰 刘华昌),流式细胞室(尹格平 孙晓明)
关键词:
中华皮肤科杂志980222.htm
整合素(intergrin)是粘附分子之一,我们采用流式细胞仪对银屑病患者β1整合素(CD29)和β2整合素(CD18)的表达进行了定量观察,报道如下。
一、资料和方法
(一)临床资料:32例寻常型银屑病均为我科门诊及住院患者,其中男20例,女12例;年龄7~54岁,平均34岁;病程1周至20年,均为进行期。泛发性20例,局限性12例。30例对照组为健康体检者,男17例,女13例;年龄16~52岁,平均36岁。两组均排除高血压、糖尿病以及心血管疾病。
, http://www.100md.com
(二)实验方法:
1.仪器与试剂:FACScan型流式细胞仪由美国BD公司生产。标有荧光抗体的鼠抗人CD18、CD29及阴性对照羊抗鼠IgG1-FITC,由法国国际免疫公司生产。淋巴细胞分离液由中国医学科学院血液制品研究所生产。
2.血液样品处理:取肘静脉血2ml,加入2% EDTA(1∶9)抗凝管,重层于淋巴细胞分离液上,离心1500r/min,15分钟,提取其中淋巴细胞层,再用PBS 2ml漂洗,同速离心,弃上清液后备用。
3.免疫反应:①CD18:分2管,每管先加100μl提取淋巴细胞,然后一管加CD18-FITC 20ml,另一管加IgG1-FITC 20ml,避光室温30分钟,上机。②CD29:方法同前,只是CD18-FITC改为加CD29-FITC。
二、结果
, 百拇医药
如附表所示,32例银屑病患者CD18、CD29表达明显高于正常人对照组,经统计学处理有非常显著性差异(t值分别为10.19、6.30,P值均<0.01);泛发性高于局限性,且有显著性差异(t值分别为5.78、3.28,P<0.01);局限性CD18、CD29表达仍高于对照组(t值分别为
附表 银屑病患者外周血CD18、CD29的
表达(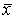 ±s,%) 组 别
±s,%) 组 别
例数
CD18
CD29
对照组
30
, 百拇医药
17.03±8.96
19.04±9.28
银屑病组
32
51.62±16.43
48.76±24.23
泛发性
20
61.57±9.34
58.25±21.74
局限性
12
, 百拇医药
35.12±11.64
32.95±20.04
5.42、3.10,P<0.01)。
三、讨论
整合素家族是由一条α链与一条β链通过非共价键方式相连的异二聚体。正常人表皮中只有基底层角朊细胞表达CD29,并主要分布在基底细胞的侧面与顶面,它是基底膜重要成份之一,参与维持基底膜的完整性。体外实验证实,它还与皮肤中炎性细胞浸润及免疫反应有关,在表皮细胞游走和增殖中发挥重要作用。研究发现银屑病患者除了受累及未受累皮肤基底细胞表达CD29外,皮损处血管CD29表达增强,并不受环孢素A的影响,但环孢素A能影响表皮树枝状细胞对CD18的表达,CD18、CD29在角朊细胞的残余或持续存在是本病临床复发的有效标志[1,2]。
我们发现银屑病患者外周血CD18、CD29表达显著增强,泛发性高于局限性,局限性仍高于正常人,提示CD18、CD29表达水平与疾病严重程度有关,可作为判断病情的指标。整合素参与细胞间以及细胞与细胞外基质蛋白的粘附,推测外周血CD18、CD29的增加,可能引起淋巴细胞与内皮细胞及其它细胞间的粘附增加,一方面加大了血流阻力,导致微循环和血液流变学变化,而微循环变化是银屑病表皮增殖、发病的机理之一;另一方面又促使大量淋巴细胞游走并聚集于真皮,引起局部的炎症反应和组织损伤,本研究中发现皮损广泛、局部炎症明显的患者,CD18、CD29的表达明显增高,进一步支持这一观点。外周血CD18、CD29增加,通过血液循环、高内皮静脉以及增生迂曲的血管,又可能引起皮损局部CD18、CD29表达增强,CD18、CD29可能使角朊细胞缩短细胞周期[3]。因此研究能够阻滞CD18、CD29在银屑病患者中表达的抗体,将为银屑病提供新的治疗途径。
, 百拇医药
参 考 文 献
1 Horrocks C, Duncan JI, Oliver AM, et al. Adhesion molecule expression in psoriatic skin lesions and the influence of cyclosporin A. Clin Exp Immunol, 1991,84∶157-162.
2 Edwards BD, Andrew SM, O′Driscoll JB, et al. Changes in numbers of epidermal cell adhesion molecules caused by oral cyclosporin in psoriasis. J Clin Pathol, 1993,46∶713-717.
3 De Luca M, Pellegrini G, Zambruno G, et al. Role of intergrins in cell adhesion and polarity in normal keratinocyte and human skin pathologies. J Dermatol, 1994,21∶821-828.
(收稿:1997-09-23 修回:1997-12-22), 百拇医药
单位:250031 济南,济南军区总医院皮肤科(刘翠杰 刘华昌),流式细胞室(尹格平 孙晓明)
关键词:
中华皮肤科杂志980222.htm
整合素(intergrin)是粘附分子之一,我们采用流式细胞仪对银屑病患者β1整合素(CD29)和β2整合素(CD18)的表达进行了定量观察,报道如下。
一、资料和方法
(一)临床资料:32例寻常型银屑病均为我科门诊及住院患者,其中男20例,女12例;年龄7~54岁,平均34岁;病程1周至20年,均为进行期。泛发性20例,局限性12例。30例对照组为健康体检者,男17例,女13例;年龄16~52岁,平均36岁。两组均排除高血压、糖尿病以及心血管疾病。
, http://www.100md.com
(二)实验方法:
1.仪器与试剂:FACScan型流式细胞仪由美国BD公司生产。标有荧光抗体的鼠抗人CD18、CD29及阴性对照羊抗鼠IgG1-FITC,由法国国际免疫公司生产。淋巴细胞分离液由中国医学科学院血液制品研究所生产。
2.血液样品处理:取肘静脉血2ml,加入2% EDTA(1∶9)抗凝管,重层于淋巴细胞分离液上,离心1500r/min,15分钟,提取其中淋巴细胞层,再用PBS 2ml漂洗,同速离心,弃上清液后备用。
3.免疫反应:①CD18:分2管,每管先加100μl提取淋巴细胞,然后一管加CD18-FITC 20ml,另一管加IgG1-FITC 20ml,避光室温30分钟,上机。②CD29:方法同前,只是CD18-FITC改为加CD29-FITC。
二、结果
, 百拇医药
如附表所示,32例银屑病患者CD18、CD29表达明显高于正常人对照组,经统计学处理有非常显著性差异(t值分别为10.19、6.30,P值均<0.01);泛发性高于局限性,且有显著性差异(t值分别为5.78、3.28,P<0.01);局限性CD18、CD29表达仍高于对照组(t值分别为
附表 银屑病患者外周血CD18、CD29的
表达(
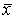 ±s,%) 组 别
±s,%) 组 别例数
CD18
CD29
对照组
30
, 百拇医药
17.03±8.96
19.04±9.28
银屑病组
32
51.62±16.43
48.76±24.23
泛发性
20
61.57±9.34
58.25±21.74
局限性
12
, 百拇医药
35.12±11.64
32.95±20.04
5.42、3.10,P<0.01)。
三、讨论
整合素家族是由一条α链与一条β链通过非共价键方式相连的异二聚体。正常人表皮中只有基底层角朊细胞表达CD29,并主要分布在基底细胞的侧面与顶面,它是基底膜重要成份之一,参与维持基底膜的完整性。体外实验证实,它还与皮肤中炎性细胞浸润及免疫反应有关,在表皮细胞游走和增殖中发挥重要作用。研究发现银屑病患者除了受累及未受累皮肤基底细胞表达CD29外,皮损处血管CD29表达增强,并不受环孢素A的影响,但环孢素A能影响表皮树枝状细胞对CD18的表达,CD18、CD29在角朊细胞的残余或持续存在是本病临床复发的有效标志[1,2]。
我们发现银屑病患者外周血CD18、CD29表达显著增强,泛发性高于局限性,局限性仍高于正常人,提示CD18、CD29表达水平与疾病严重程度有关,可作为判断病情的指标。整合素参与细胞间以及细胞与细胞外基质蛋白的粘附,推测外周血CD18、CD29的增加,可能引起淋巴细胞与内皮细胞及其它细胞间的粘附增加,一方面加大了血流阻力,导致微循环和血液流变学变化,而微循环变化是银屑病表皮增殖、发病的机理之一;另一方面又促使大量淋巴细胞游走并聚集于真皮,引起局部的炎症反应和组织损伤,本研究中发现皮损广泛、局部炎症明显的患者,CD18、CD29的表达明显增高,进一步支持这一观点。外周血CD18、CD29增加,通过血液循环、高内皮静脉以及增生迂曲的血管,又可能引起皮损局部CD18、CD29表达增强,CD18、CD29可能使角朊细胞缩短细胞周期[3]。因此研究能够阻滞CD18、CD29在银屑病患者中表达的抗体,将为银屑病提供新的治疗途径。
, 百拇医药
参 考 文 献
1 Horrocks C, Duncan JI, Oliver AM, et al. Adhesion molecule expression in psoriatic skin lesions and the influence of cyclosporin A. Clin Exp Immunol, 1991,84∶157-162.
2 Edwards BD, Andrew SM, O′Driscoll JB, et al. Changes in numbers of epidermal cell adhesion molecules caused by oral cyclosporin in psoriasis. J Clin Pathol, 1993,46∶713-717.
3 De Luca M, Pellegrini G, Zambruno G, et al. Role of intergrins in cell adhesion and polarity in normal keratinocyte and human skin pathologies. J Dermatol, 1994,21∶821-828.
(收稿:1997-09-23 修回:1997-12-22), 百拇医药