含人类乳头瘤病毒16E7-L1的嵌合型病毒样颗粒的构建、表达和纯化鉴定
作者:程浩 郑树
单位:310016杭州,浙江医科大学邵逸夫医院皮肤科(程浩),肿瘤研究所[郑树(指导者)];澳大利亚昆士兰大学免疫和癌症研究中心[周健(指导者)]
关键词:乳头状瘤病毒;人病毒样颗粒
中华皮肤科杂志990402
【摘要】目的 研究人类乳头瘤病毒(HPV)16型的早期基因E7,构建、表达并纯化鉴定了HPV16E7与BPVL1重组的嵌合型病毒样颗粒VLPs。方法 HPV16E7基因分3段经PCR扩增后分别克隆入连有BPVL1的质粒PUC形成BPVL1-HPV16E7;以质粒PVL1393为载体将BPVL1-HPV16E7基因转染杆状病毒并在昆虫细胞中进行表达;用超声粉碎和蔗糖超离、氯化铯梯度离心等方法纯化以及免疫印迹、ECL、透射电镜等方法鉴定表达产物。结果和结论 成功地获得表达BPVL1-HPV16E7重组体,形态和结构与野生型HPV几乎一致的嵌合型病毒样颗粒VLPs。将为进一步的HPV16E7的疫苗研究等奠定基础。
, 百拇医药
Construction, Expression, Purification and Identification of
Chimeric HPV16 E7-L1 Virus-Like Particles
CHENG Hao, ZHENG Shu, ZHOU Jian.
Department of Dermatology, Sir Run Run Shaw Hospital of Zhejiang Medical University, Hangzhou 310016
【Abstract】Objective To study the human papillomavirus (HPV) type 16 E7, the chimeric HPV16 E7-L1 virus-like particles (VLPs) were constructed, produced, purified and identified. Methods The HPV16E7 gene was cut to three parts, amplified by PCR, and connected individually with BPVL1 on plasmid PUC. With PVL1393 as a transfect vector, the BPVL1/HPV16E7 recombinants were transfected to baculovirus which subsequently expressed the chimeric BPVL1/HPV16E7 protein in the SF-9 cells. The recombinant proteins were then purified by centrifuge, sonication, sucrose and CsCl ultracentrifuge, and were identified by SDS-PAGE, Western blot, ECL and TEM. Results and Conclusion The chimeric BPVL1/HPV16E7 recombinants were constructed, expressed and purified successfully, and they were also identified as VLPs which were similar to the wild type HPV particles in terms of their biological and structural characteristics. Our results had laid the foundation of further study of the vaccine of HPV16E7.
, http://www.100md.com
【Key Words】 Papillomavirus, human Virus-like particles
人类乳头瘤病毒(HPV)16型的感染已被证实与上皮性肿瘤尤其是鳞状细胞癌(鳞癌)的发生有密切关系,HPV16的早期基因及其蛋白产物E7是引起细胞恶性转化的关键性物质[1,2]。人类是HPV的唯一宿主,至今仍未能体外培养HPV。因此研究HPV16E7体外制备方法无论对HPV16E7的致癌机理、检测乃至疫苗的研究都有重大意义。我们将乳头瘤病毒的主要壳蛋白即主要晚期结构基因L1与HPV16E7基因连接后在杆状病毒—昆虫细胞系统表达。通过对表达产物的纯化、鉴定,可得到与野生型HPV在生物学特性上一致的含L1-HPV16E7的嵌合型或重组病毒样颗粒(virus-likeparticles,VLPs)。
材料和方法
一、材料
, http://www.100md.com
1.菌株和质粒:大肠杆菌DHα5、质粒PUC-BPVL1和质粒PVL1393均由澳大利亚昆士兰大学免疫和癌症研究中心(CICR)提供。
2.病毒和细胞:杆状病毒购于Pharmingen公司。秋粘虫细胞(Spodoptera Frugiperda,SF-9)(ATCC.CRL1171)由CICR提供。SF-9细胞的培养基为含10%胎牛血清的SF-900Ⅱ培养基(Gibco,BRL,美国)。抗L1的单抗(MC15)和抗HPV16E7(a)和(b)单抗由CICR提供。
3.酶和其它试剂:EcoRⅤ、BamHⅠ、XbaⅠ、NgoMⅠ、T4DNA连接酶、酶切用缓冲液等购于美国Promega公司。BaculoGoldTM转染药盒购自Pharmingen公司。强化学发光法(enhanced chemiluminescence,ECL)药盒购于澳大利亚Amersham公司。
, http://www.100md.com 二、方法
1.聚合酶链反应(PCR):HPV16病毒E7基因被分成3段进行PCR扩增。3对PCR引物分别为:①E7a,5′-TATG GATATCATGCATGGAGATACACCTACATTGC-3′和5′-CATGGATATCCGGCCGTTATGAGCT GTCATTTAATTGC-3′;②E7b,5′-TATGGATATCGAGGAGGAGGATGATGAAATAGATGGTC C3′和5′-CATGGATATCCGGCCGTTACCTAGAGTCACACTTGCAACAAAAGG-3′;③E7c,5'-ATGGATATCCTTCGGTTGTGCGTACAAAGC-3′和5′-GATATCCGGCCGTTATGGTTTCTGA GACCAGA-3′。其5′端和3′端分别含有EcoRⅤ限制性酶切位点。PCR扩增体系为:10×PCR缓冲液10μL,2mmol/LNTPs10μL,TaqDNA聚合酶1μL,模板2μL和引物1μL。PCR扩增参数为:94℃变性1min、56℃复性1min、72℃延伸2min、共21个循环。取PCR产物在含TBE的0.8%琼脂糖凝胶中电泳及紫外灯下观察结果。
, http://www.100md.com
2.表达重组杆状病毒转染载体的构建和转染:参照文献[3]。①用冻融法从琼脂糖凝胶上回收PCR产物中的3段HPV16E7基因片段,经EcoRⅤ酶切后克隆入连有BPVL1的载体PUC:BPVL1序列的C末端已切下1段序列并加上一中止密码和EcoRⅤ酶切位点以插入3段中任意一E7片段。具体步骤有HPV16E7基因片段和克隆载体PUC的EcoRⅤ酶切、去磷酸化、T4DNA连接酶连接、电转化仪(BioRad)转化大肠杆菌DHα5、氨苄青霉素抗性培养、XbaⅠ和NgoMⅠ酶切筛选正确阳性克隆(含BPVL1-HPV16E7基因片段)、扩大培养正确克隆以及质粒DNA大提(qiagen plasmid/cosmid purification protocol)和酶切回收目的片段。②将BPVL1-HPV16E7基因片段插入杆状病毒转化质粒PVL1393:具体步骤有3段BPVL1-HPV16E7基因片段DNA和质粒PVL1393的BamHⅠ酶切、质粒去磷酸化、T4DNA连接酶连接、电转化仪转化大肠杆菌DHα5、氨苄青霉素抗性培养、XbaⅠ酶切筛选正确连接克隆(含BPVL1-HPV16E7基因片段)和扩大培养正确连接克隆。3株重组克隆分别被命名为PVL1393/BPVL1-HPV16E7A,PVL1393/BPVL1-HPV16E7B,PVL1393/BPVL1-HPV16E7C。③转染杆状病毒:采用BaculoGoldTM转染药盒将3段PVL1393/BPVL1-HPV16E7基因转染杆状病毒线状DNA并感染SF-9昆虫细胞。具体步骤有:将3株重组克隆DNA与杆状病毒DNA混合作用5min后加转染缓冲液B;在培养于6孔板的总数为2×106的SF-9细胞上加转染缓冲液A;将上述重组DNA与杆状病毒DNA的混合液加至SF-9细胞中,27℃培养4h后加SF-9培养液。每天观察细胞的形态变化,如细胞核出现多面体,细胞肿胀及感染后期的溶胞现象。将培养上清液感染更多SF-9细胞以便获得更多的表达产物。
, http://www.100md.com
3.重组杆状病毒的表达及其产物的纯化:参照文献[4]。含PVL/BPVL1-HPV16E7的杆状病毒感染SF-9昆虫细胞后随SF-9细胞在27℃振摇培养72h以上即可获得一定量表达产物。离心昆虫细胞培养液,沉淀重悬于2mmol/LPMSF/PBS后用Dounce匀浆器碾磨;4℃离心3000r/min10min后倾上清液,细胞核沉淀物重悬于含PSMF的PBS中并行超声粉碎;用20%蔗糖超速离心(4℃,2h26000r/min);沉淀物再次重悬、超声粉碎;与50%氯化铯混匀后行梯度离心(20℃,20h,40000r/min);收集离心管中浮密度为1.30g/mL的白色云雾状条带,其中即含PVL1393/BPVL1-HPV16E7重组蛋白的VLPs。
4.重组蛋白的鉴定:①蛋白分子量和特异性的鉴定:含PVL/BPVL1-HPV16E7重组蛋白的样品用10%的SDS-PAGE凝胶进行电泳(180V,40min)后凝胶直接进行考马斯亮蓝染色和进行免疫印迹分析。后者经纤维膜转膜(100V,1h)后,膜依次进行5%牛奶封闭、抗L1的单抗MC15(1∶2000)和抗E7单抗(1∶1000)杂交、HRP标记的2抗(1∶1000)作用、滴加ECL药盒溶液A和B后行X光片曝光以显示杂交条带。②电镜分析:将样本PBS透析后放在碳网上,用2%pH6.2钼酸胺(Sigma,美国)染色后用日立H-800电镜进行透射电镜观察。
, 百拇医药
结果
重组蛋白的分子量和特异性鉴定:3段BPVL1-HPV16E7重组蛋白的分子量均与野生型BPVL1的接近,相对分子质量约为55000。图1为3段重组蛋白BPVL1-HPV16E7(a)、(b)和(c)与野生型BPVL1一同进行10%SDS-PAGE凝胶电泳后的考马斯亮蓝染色结果,均可见一分子量几近一致的浓染条带。上述样本用抗L1单抗杂交的结果也显示3段重组蛋白与野生型BPVL1有同一位置的特异杂交条带(图2)。上述4个样本用抗HPV16E7(a)和(b)单抗(未能获得c段的单抗)杂交的结果显示,BPVL1-HPV16E7(a)和(b)两重组蛋白有特异的阳性条带,而野生型BPVL1和BPVL1-HPV16E7(c)则均未显示阳性条带(图3)。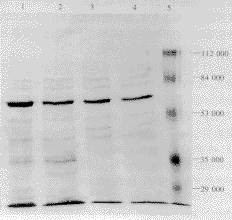
1:BPVL1HPVE7c,2:BPVL1HPVE7b,3:BPVL1HPVE7a,4:BPVL1,5:Marker
, 百拇医药
图1 嵌合型VLP的考马斯亮染色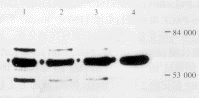
1:BPVL1HPVE7c,2:BPVL1HPVE7b,3:BPVL1HPVE7a,4:BPVL1
图2 嵌合型VLP用抗L1杂交的ECL显色
1:BPVL1HPVE7c,2:BPVL1HPVE7b,3:BPVL1HPVE7a,4:BPVL1
图3 嵌合型VLP用抗E7抗体杂交的ECL显色
重组蛋白的透射电镜观察:结果显示,含BPVL1-HPV16E7(a)、(b)和(c)的3个重组蛋白均能自动环化成一个50nm的环形颗粒结构(图4),且形态和结构与野生型BPVL1完全相同,即为病毒样颗粒。
, 百拇医药
图4 嵌合型VLP的透射电镜照片
讨论
HPV是一种约有8000bp的小DNA病毒,为环状双链DNA形成的20面体。HPV病毒颗粒直径约55nm,在氯化铯中浮密度为1.34g/mL。HPV16型的基因序列以及E7基因的序列和表达的氨基酸序列已研究清楚(图5,6)。近年研究发现,HPV的主要壳蛋白即主要晚期结构蛋白L1[单独和(或)次要壳蛋白L2]在原核和真核表达系统中表达时能自我装配成空的病毒颗粒即病毒样颗粒VLPs[5],其在氯化铯中的浮密度为1.29g/mL。L1的C末端不是形成病毒样颗粒所必需,而是可切除部分片段并融合其它基因片段,且表达的重组蛋白也并不因此而降低其形成VLPs的能力[6]。研究E7基因的功能或应用,都需要能使之既表达又保持功能活性的载体。以往常用于HPV研究的载体有腺病毒、痘苗病毒或某些细菌等,但模拟HPV天然感染尚有困难。L1的这些特性使其有可能成为研究HPV乃至其它基因或蛋白的理想载体。本实验首次成功地将HPV16E7基因分3段克隆和连接于L1,并在杆状病毒-昆虫表达系统进行表达,最后通过超声粉碎、蔗糖和氯化铯超速离心等纯化手段以及SDS-PAGE电泳、免疫印迹、ECL和电镜等鉴定方法获得与野生型HPV在形态和结构上均极为相似的重组病毒样颗粒VLPs。我们还认为,这种重组的病毒样颗粒可用于研究HPV16E7的致癌机理甚或治疗HPV相关肿瘤的疫苗研究。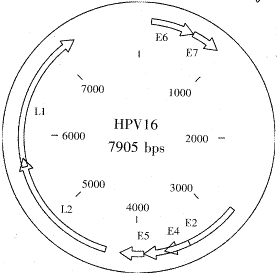
, 百拇医药
图5 HPV16的基因图
划线处为分段的位置
图6HPV16E7的基因序列和表达产物氨基酸序列
参考文献
1 zur Hausen H. Human papillomaviruses in the pathogenesis of anogenital cancer. Virology, 1991,184:9- 13.
2 Lambert PF, Pan H, Pitot HC, et al. Epidermal cancer associated with expression of human papilomavirus type 16 E7 and E6 oncogenes in the skin of transgenic mice. Proc Natl Acad USA, 1993,90:5583- 5587.
, 百拇医药
3 Peng SW, Frazer IH, Germain J, et al.Papillomavirus virus-like particles can deliver defined CTL epitopes to the MHC class I pathway. Virology, 1998,240:147- 157.
4 Qi YM, Peng SW, Hengst K, et al. Epithelial cells display separate receptors for papillomavirus VLPs and for soluble L1 capsid protein. Viro-logy, 1996,216:35- 45.
5 Zhou J, Sun XY, Stenzel DJ, et al. Expression of vaccinia recombinant HPV16 L1 and L2 ORF proteins in epithelial cells is sufficient for assembly of HPV virion-like particles. Virology, 1991,185:251- 257.
6 Muller M, Zhou J, Reed TD, et al. Chimeric papillomavirus like particles. Virology, 1997,234:93- 111.
收稿:1998-08-03修回:1998-12-18, 百拇医药
单位:310016杭州,浙江医科大学邵逸夫医院皮肤科(程浩),肿瘤研究所[郑树(指导者)];澳大利亚昆士兰大学免疫和癌症研究中心[周健(指导者)]
关键词:乳头状瘤病毒;人病毒样颗粒
中华皮肤科杂志990402

【摘要】目的 研究人类乳头瘤病毒(HPV)16型的早期基因E7,构建、表达并纯化鉴定了HPV16E7与BPVL1重组的嵌合型病毒样颗粒VLPs。方法 HPV16E7基因分3段经PCR扩增后分别克隆入连有BPVL1的质粒PUC形成BPVL1-HPV16E7;以质粒PVL1393为载体将BPVL1-HPV16E7基因转染杆状病毒并在昆虫细胞中进行表达;用超声粉碎和蔗糖超离、氯化铯梯度离心等方法纯化以及免疫印迹、ECL、透射电镜等方法鉴定表达产物。结果和结论 成功地获得表达BPVL1-HPV16E7重组体,形态和结构与野生型HPV几乎一致的嵌合型病毒样颗粒VLPs。将为进一步的HPV16E7的疫苗研究等奠定基础。
, 百拇医药
Construction, Expression, Purification and Identification of
Chimeric HPV16 E7-L1 Virus-Like Particles
CHENG Hao, ZHENG Shu, ZHOU Jian.
Department of Dermatology, Sir Run Run Shaw Hospital of Zhejiang Medical University, Hangzhou 310016
【Abstract】Objective To study the human papillomavirus (HPV) type 16 E7, the chimeric HPV16 E7-L1 virus-like particles (VLPs) were constructed, produced, purified and identified. Methods The HPV16E7 gene was cut to three parts, amplified by PCR, and connected individually with BPVL1 on plasmid PUC. With PVL1393 as a transfect vector, the BPVL1/HPV16E7 recombinants were transfected to baculovirus which subsequently expressed the chimeric BPVL1/HPV16E7 protein in the SF-9 cells. The recombinant proteins were then purified by centrifuge, sonication, sucrose and CsCl ultracentrifuge, and were identified by SDS-PAGE, Western blot, ECL and TEM. Results and Conclusion The chimeric BPVL1/HPV16E7 recombinants were constructed, expressed and purified successfully, and they were also identified as VLPs which were similar to the wild type HPV particles in terms of their biological and structural characteristics. Our results had laid the foundation of further study of the vaccine of HPV16E7.
, http://www.100md.com
【Key Words】 Papillomavirus, human Virus-like particles
人类乳头瘤病毒(HPV)16型的感染已被证实与上皮性肿瘤尤其是鳞状细胞癌(鳞癌)的发生有密切关系,HPV16的早期基因及其蛋白产物E7是引起细胞恶性转化的关键性物质[1,2]。人类是HPV的唯一宿主,至今仍未能体外培养HPV。因此研究HPV16E7体外制备方法无论对HPV16E7的致癌机理、检测乃至疫苗的研究都有重大意义。我们将乳头瘤病毒的主要壳蛋白即主要晚期结构基因L1与HPV16E7基因连接后在杆状病毒—昆虫细胞系统表达。通过对表达产物的纯化、鉴定,可得到与野生型HPV在生物学特性上一致的含L1-HPV16E7的嵌合型或重组病毒样颗粒(virus-likeparticles,VLPs)。
材料和方法
一、材料
, http://www.100md.com
1.菌株和质粒:大肠杆菌DHα5、质粒PUC-BPVL1和质粒PVL1393均由澳大利亚昆士兰大学免疫和癌症研究中心(CICR)提供。
2.病毒和细胞:杆状病毒购于Pharmingen公司。秋粘虫细胞(Spodoptera Frugiperda,SF-9)(ATCC.CRL1171)由CICR提供。SF-9细胞的培养基为含10%胎牛血清的SF-900Ⅱ培养基(Gibco,BRL,美国)。抗L1的单抗(MC15)和抗HPV16E7(a)和(b)单抗由CICR提供。
3.酶和其它试剂:EcoRⅤ、BamHⅠ、XbaⅠ、NgoMⅠ、T4DNA连接酶、酶切用缓冲液等购于美国Promega公司。BaculoGoldTM转染药盒购自Pharmingen公司。强化学发光法(enhanced chemiluminescence,ECL)药盒购于澳大利亚Amersham公司。
, http://www.100md.com 二、方法
1.聚合酶链反应(PCR):HPV16病毒E7基因被分成3段进行PCR扩增。3对PCR引物分别为:①E7a,5′-TATG GATATCATGCATGGAGATACACCTACATTGC-3′和5′-CATGGATATCCGGCCGTTATGAGCT GTCATTTAATTGC-3′;②E7b,5′-TATGGATATCGAGGAGGAGGATGATGAAATAGATGGTC C3′和5′-CATGGATATCCGGCCGTTACCTAGAGTCACACTTGCAACAAAAGG-3′;③E7c,5'-ATGGATATCCTTCGGTTGTGCGTACAAAGC-3′和5′-GATATCCGGCCGTTATGGTTTCTGA GACCAGA-3′。其5′端和3′端分别含有EcoRⅤ限制性酶切位点。PCR扩增体系为:10×PCR缓冲液10μL,2mmol/LNTPs10μL,TaqDNA聚合酶1μL,模板2μL和引物1μL。PCR扩增参数为:94℃变性1min、56℃复性1min、72℃延伸2min、共21个循环。取PCR产物在含TBE的0.8%琼脂糖凝胶中电泳及紫外灯下观察结果。
, http://www.100md.com
2.表达重组杆状病毒转染载体的构建和转染:参照文献[3]。①用冻融法从琼脂糖凝胶上回收PCR产物中的3段HPV16E7基因片段,经EcoRⅤ酶切后克隆入连有BPVL1的载体PUC:BPVL1序列的C末端已切下1段序列并加上一中止密码和EcoRⅤ酶切位点以插入3段中任意一E7片段。具体步骤有HPV16E7基因片段和克隆载体PUC的EcoRⅤ酶切、去磷酸化、T4DNA连接酶连接、电转化仪(BioRad)转化大肠杆菌DHα5、氨苄青霉素抗性培养、XbaⅠ和NgoMⅠ酶切筛选正确阳性克隆(含BPVL1-HPV16E7基因片段)、扩大培养正确克隆以及质粒DNA大提(qiagen plasmid/cosmid purification protocol)和酶切回收目的片段。②将BPVL1-HPV16E7基因片段插入杆状病毒转化质粒PVL1393:具体步骤有3段BPVL1-HPV16E7基因片段DNA和质粒PVL1393的BamHⅠ酶切、质粒去磷酸化、T4DNA连接酶连接、电转化仪转化大肠杆菌DHα5、氨苄青霉素抗性培养、XbaⅠ酶切筛选正确连接克隆(含BPVL1-HPV16E7基因片段)和扩大培养正确连接克隆。3株重组克隆分别被命名为PVL1393/BPVL1-HPV16E7A,PVL1393/BPVL1-HPV16E7B,PVL1393/BPVL1-HPV16E7C。③转染杆状病毒:采用BaculoGoldTM转染药盒将3段PVL1393/BPVL1-HPV16E7基因转染杆状病毒线状DNA并感染SF-9昆虫细胞。具体步骤有:将3株重组克隆DNA与杆状病毒DNA混合作用5min后加转染缓冲液B;在培养于6孔板的总数为2×106的SF-9细胞上加转染缓冲液A;将上述重组DNA与杆状病毒DNA的混合液加至SF-9细胞中,27℃培养4h后加SF-9培养液。每天观察细胞的形态变化,如细胞核出现多面体,细胞肿胀及感染后期的溶胞现象。将培养上清液感染更多SF-9细胞以便获得更多的表达产物。
, http://www.100md.com
3.重组杆状病毒的表达及其产物的纯化:参照文献[4]。含PVL/BPVL1-HPV16E7的杆状病毒感染SF-9昆虫细胞后随SF-9细胞在27℃振摇培养72h以上即可获得一定量表达产物。离心昆虫细胞培养液,沉淀重悬于2mmol/LPMSF/PBS后用Dounce匀浆器碾磨;4℃离心3000r/min10min后倾上清液,细胞核沉淀物重悬于含PSMF的PBS中并行超声粉碎;用20%蔗糖超速离心(4℃,2h26000r/min);沉淀物再次重悬、超声粉碎;与50%氯化铯混匀后行梯度离心(20℃,20h,40000r/min);收集离心管中浮密度为1.30g/mL的白色云雾状条带,其中即含PVL1393/BPVL1-HPV16E7重组蛋白的VLPs。
4.重组蛋白的鉴定:①蛋白分子量和特异性的鉴定:含PVL/BPVL1-HPV16E7重组蛋白的样品用10%的SDS-PAGE凝胶进行电泳(180V,40min)后凝胶直接进行考马斯亮蓝染色和进行免疫印迹分析。后者经纤维膜转膜(100V,1h)后,膜依次进行5%牛奶封闭、抗L1的单抗MC15(1∶2000)和抗E7单抗(1∶1000)杂交、HRP标记的2抗(1∶1000)作用、滴加ECL药盒溶液A和B后行X光片曝光以显示杂交条带。②电镜分析:将样本PBS透析后放在碳网上,用2%pH6.2钼酸胺(Sigma,美国)染色后用日立H-800电镜进行透射电镜观察。
, 百拇医药
结果
重组蛋白的分子量和特异性鉴定:3段BPVL1-HPV16E7重组蛋白的分子量均与野生型BPVL1的接近,相对分子质量约为55000。图1为3段重组蛋白BPVL1-HPV16E7(a)、(b)和(c)与野生型BPVL1一同进行10%SDS-PAGE凝胶电泳后的考马斯亮蓝染色结果,均可见一分子量几近一致的浓染条带。上述样本用抗L1单抗杂交的结果也显示3段重组蛋白与野生型BPVL1有同一位置的特异杂交条带(图2)。上述4个样本用抗HPV16E7(a)和(b)单抗(未能获得c段的单抗)杂交的结果显示,BPVL1-HPV16E7(a)和(b)两重组蛋白有特异的阳性条带,而野生型BPVL1和BPVL1-HPV16E7(c)则均未显示阳性条带(图3)。

1:BPVL1HPVE7c,2:BPVL1HPVE7b,3:BPVL1HPVE7a,4:BPVL1,5:Marker
, 百拇医药
图1 嵌合型VLP的考马斯亮染色

1:BPVL1HPVE7c,2:BPVL1HPVE7b,3:BPVL1HPVE7a,4:BPVL1
图2 嵌合型VLP用抗L1杂交的ECL显色

1:BPVL1HPVE7c,2:BPVL1HPVE7b,3:BPVL1HPVE7a,4:BPVL1
图3 嵌合型VLP用抗E7抗体杂交的ECL显色
重组蛋白的透射电镜观察:结果显示,含BPVL1-HPV16E7(a)、(b)和(c)的3个重组蛋白均能自动环化成一个50nm的环形颗粒结构(图4),且形态和结构与野生型BPVL1完全相同,即为病毒样颗粒。

, 百拇医药
图4 嵌合型VLP的透射电镜照片
讨论
HPV是一种约有8000bp的小DNA病毒,为环状双链DNA形成的20面体。HPV病毒颗粒直径约55nm,在氯化铯中浮密度为1.34g/mL。HPV16型的基因序列以及E7基因的序列和表达的氨基酸序列已研究清楚(图5,6)。近年研究发现,HPV的主要壳蛋白即主要晚期结构蛋白L1[单独和(或)次要壳蛋白L2]在原核和真核表达系统中表达时能自我装配成空的病毒颗粒即病毒样颗粒VLPs[5],其在氯化铯中的浮密度为1.29g/mL。L1的C末端不是形成病毒样颗粒所必需,而是可切除部分片段并融合其它基因片段,且表达的重组蛋白也并不因此而降低其形成VLPs的能力[6]。研究E7基因的功能或应用,都需要能使之既表达又保持功能活性的载体。以往常用于HPV研究的载体有腺病毒、痘苗病毒或某些细菌等,但模拟HPV天然感染尚有困难。L1的这些特性使其有可能成为研究HPV乃至其它基因或蛋白的理想载体。本实验首次成功地将HPV16E7基因分3段克隆和连接于L1,并在杆状病毒-昆虫表达系统进行表达,最后通过超声粉碎、蔗糖和氯化铯超速离心等纯化手段以及SDS-PAGE电泳、免疫印迹、ECL和电镜等鉴定方法获得与野生型HPV在形态和结构上均极为相似的重组病毒样颗粒VLPs。我们还认为,这种重组的病毒样颗粒可用于研究HPV16E7的致癌机理甚或治疗HPV相关肿瘤的疫苗研究。

, 百拇医药
图5 HPV16的基因图

划线处为分段的位置
图6HPV16E7的基因序列和表达产物氨基酸序列
参考文献
1 zur Hausen H. Human papillomaviruses in the pathogenesis of anogenital cancer. Virology, 1991,184:9- 13.
2 Lambert PF, Pan H, Pitot HC, et al. Epidermal cancer associated with expression of human papilomavirus type 16 E7 and E6 oncogenes in the skin of transgenic mice. Proc Natl Acad USA, 1993,90:5583- 5587.
, 百拇医药
3 Peng SW, Frazer IH, Germain J, et al.Papillomavirus virus-like particles can deliver defined CTL epitopes to the MHC class I pathway. Virology, 1998,240:147- 157.
4 Qi YM, Peng SW, Hengst K, et al. Epithelial cells display separate receptors for papillomavirus VLPs and for soluble L1 capsid protein. Viro-logy, 1996,216:35- 45.
5 Zhou J, Sun XY, Stenzel DJ, et al. Expression of vaccinia recombinant HPV16 L1 and L2 ORF proteins in epithelial cells is sufficient for assembly of HPV virion-like particles. Virology, 1991,185:251- 257.
6 Muller M, Zhou J, Reed TD, et al. Chimeric papillomavirus like particles. Virology, 1997,234:93- 111.
收稿:1998-08-03修回:1998-12-18, 百拇医药