高压氧直接暴露下细胞内Ca2+的变化及其检测
作者:刘 磊 刘景昌 蔺世龙 李 斌
单位:海军医学研究所,上海200433
关键词:高压氧;微血管;细胞氧舱;平滑肌细胞;内皮细胞;荧光显微镜
航天医学与医学工程990605摘要:目的 探讨直接暴露高压氧下细胞内Ca2+的变化规律及其相应的检测方法。方法 采用自行研制的微型细胞氧舱,结合显微荧光方法,测定共培养的内皮细胞(EC)和平滑肌细胞(SMC)内钙浓度变化。结果 (1)细胞氧舱密闭性好,体积小,能耐受0.6MPa的压力,可在高压氧暴露下直接观测细胞钙变化。透光度强,图像不失真。(2)0.2和0.3MPa高压氧暴露下初始阶段5min以内EC[Ca2+]i和SMC[Ca2+]i均增加,随着暴露时间延长(>5min)则呈现下降,尤其以SMC[Ca2+]i为明显。0.4MPaO2暴露时,可见EC破裂。结论 高压氧暴露下EC[Ca2+]i和SMC[Ca2+]i变化呈双向反应,先增加,后降低。所采用的微型细胞氧舱及其检测技术方法可靠,适合于高压氧直接暴露下研究细胞[Ca2+]i的变化及其规律。
, 百拇医药
中图分类号:Q246 文献标识码:A 文章编号:1002-0837(1999)06-0410-04
Changes and Its Measurement of Intracellular Ca2+
during Exposure to Hyper b aric Oxygen
LIU Lei, LIU Jing-chang, LIN Shi-long, LI Bin
Address reprint requests to:LIU Lei.Naval Medical Research
Institute, Shanghai 200433,China
Abstract: Objective To investigate the rule of change of intracellular Ca 2+ and i ts measurement method during exposure to hyperbaric oxygen (HBO). Metho d Microfluo rescence method was used to measu the changes of intracellular Ca2+ con centration in co-cultured endothelial cells (EC) and smooth muscle cell s (SMC) in a specially designed miniature oxygen chamber. Result (1) [Ca2+]i changes during HBO exposure can be clearly obse rved directly in the chamber. (2) Within 5 min during 0.2 MPa and 0.3[ KG*7]MPa HBO expos ure, EC[Ca2+]i and SMC [Ca2+]i showed a tendency, to increas e at firs t and then decrease with time throughout the exposures, especially the SMC[Ca 2+]i. The EC ruptured under exposure to 0.4MPa HBO. Conclusion During HB O exposure, EC[Ca2+]i and SMC[Ca2+]i showed biphasic changes , which incr eased at first and then decreased.The technique and method used were reliable an d suitable for in vestigating of intracellular [Ca2+]i changes under HBO.
, http://www.100md.com
Key words: hyperbaric oxygen; microvessel; cell oxygen chamber; smooth m uscle cell; endothelial cells;fluorescence microscope.
低氧和缺氧条件下,血管平滑肌细胞(smooth muscle cell, SMC)[Ca2+]i和内皮细胞(endothelialcell,EC)[Ca2+]i的变化,已有文献报道[1]。但富氧和高压氧(hyperbricoxygen,HBO)暴露下,两种细胞[Ca2+]i的变化规律尚不清楚。由于钙在神经细胞的生理和病理过程中起重要作用[2],已知,Ca2+是可兴奋包括神经细胞在内的一个特殊第二信使,担负着“兴奋信号传感器”的作用,而[Ca2+]i的超载,则是诸多缺血缺氧性疾病病程的一个重要环节。了解HBO对Ca2+平衡的作用,也是阐明HBO治疗效用机理的一个重要理论问题。为此,我们采用自行研制的细胞氧舱,直接测量了0.1~0.4MPa(1~4ATA)HBO暴露下培养的血管平滑肌细胞和内皮细胞[Ca2+]i的变化,并研究了不同氧压下其变化规律。
, 百拇医药
方 法
细胞氧舱的制备 用有机玻璃制成12cm×1.2cm×0.8cm的长方体,中间车空1.0cm×0.4cm×0.4
cm,上下两面嵌入直径1.0cm的石英玻璃,左端嵌入两根直径1mm的无缝钢管作为进出气口。氧气气源用容积1.3L,15MPa的小钢瓶,通过减压器供气,并控制流量,以氧压表测压,右端留有进样口及活塞。经0.6MPa耐压检验合格后备用(图1)。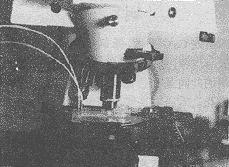 图1 高压氧直接暴露下细胞[Ca2+]i的测量装置
图1 高压氧直接暴露下细胞[Ca2+]i的测量装置
Fig.1 Device for of measurement cell [Ca2+]i during HBO exposure
, 百拇医药 样品分组 加入传代(2~3代)后的SMC和EC细胞悬液(1~2×105cells/ml)于盖玻片上共培养。并按表1进行实验。
表1 不同氧压和N2-O2下对SMC及EC进行观察的程序
Table 1 Observation procedure of SMC and EC under different
oxyen pre ssure and N2-O2
N2-O2
HBO
MPa
, 百拇医药
0.1
0.2
0.3
0.4
0.1
0.2
0.3
0.4
O2%
21
10.5
7.0
5.2
, 百拇医药
99.2
99.2
99.2
99.2
SMC+EC数
27+9
30+12
29+8
31+11
32+13
33+9
32+10
29+7
, 百拇医药
待细胞贴壁后取出,置于10μmol/L的荧光指示剂Fluo-3/AM(Sigma公司)中,37℃黑暗条件下孵育60min,MEM(Gibco公司)培养基反复冲洗后,置细胞氧舱内。
测量方法 纯氧洗舱,1min加压至规定的压力并稳压停留,利用显微荧光动态监测高压氧暴露前和暴露期间两种细胞的荧光强度,激发波长为450~510nm。
结 果
经荧光显微镜测定[Ca2+]i浓度变化显示,0.1MPaO2暴露下3min后,共培养的EC[Ca2+]i和SMC[Ca2+]i均缓慢下降。0.2MPaO2暴露下3min内可见共培养的EC[Ca2+]i和SMC[Ca2+]i均明显增加;此后,SMC[Ca2+]i即减少,尤以贴附于EC生长的SMC[Ca2+]i下降更为显著;5min后EC[Ca2+]i也稍减少;HBO暴露下10min后两者均明显减少(图2)。当氧压增至0.4MPa时,EC[Ca2+]i瞬间(1~3min内)也呈现增加,但很快即下降,部分EC破裂,荧光指示剂外泄。共培养EC[Ca2+]i在0.2~0.4 MPa下增加,维持时间相对较长,除0.4MPa外,在5min后开始下降。SMC[Ca2+]i只在2~3min内增加,而后即下降(图3,4)。0.1~0.4MpaN2-O2对照组的结果显示,共培养的SMC[Ca2+]i和EC[Ca2+]i均同步缓慢下降。


, 百拇医药
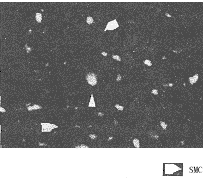
图2 0.2MPO2暴露下共培养的SMC和EC[Ca2+]i的变化
以荧光强度显示[Ca2+]i含量变化,a.暴露前的SMC和EC[Ca2+]i;
b.暴露3minSMC和EC[Ca2+]i均增加;c.暴露5minSMC[Ca2+]i明显下降;
d.暴露10minSMC[Ca2+]i进一步下降,同时,EC[Ca2+]i也减少
Fig.2 Changesof[Ca2+]i in co-cultural SMC and EC during HB O exposure to
, 百拇医药
0.2MPa[Ca2+]i were showed by fluorescence intensity,a. SMC[Ca2+] i and EC [Ca2+]i before HBO exposure;
b.[Ca2+]i in SMC and E C increased after exposure to 0.2 MPa HBO for 3 min;
c. SMC [Ca2+]i ob viously decreased after exposure to 0.2 MPa HBO for 5 min;
d. SMC[Ca2+] i further decreased during exposure to 0.2 MPa
, http://www.100md.com
for 10 min, meanwhile EC[Ca2 +]i also reduced
图3 高压氧暴露下共培养的EC[Ca2+]i的变化
Fig.3 Changes of co-cultural EC[Ca2+]i during HBO exposure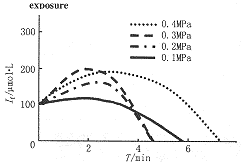
图4 高压氧暴露下共培养的SMC[Ca2+]i的变化
Fig.4 Changes of co-cultural SMC[Ca2+]i during HBO exposure
, 百拇医药
讨 论
研究Ca2+平衡,尤其细胞内Ca2+变化的特征与规律,是探讨各种Ca2+依赖性生物过程机制的共同基础。在高气压条件下,钙平衡发生变化。有研究证实高压氧在治疗缺血、缺氧性疾病与损伤的效用机理之一,就是它可以降低神经组织细胞[Ca2+]i浓度,并通过减少L型钙通道开放数来实现[3]。那么,在不同氧压作用下[Ca2+]i变化规律如何,就有必要测定直接于高压下暴露时[Ca2+]i含量。目前测定[Ca2+]i通用流式细胞仪和显微荧光测Ca2+法。前者能定量检测,但不能连续动态观察,且不直观;后者不仅能连续动态检测,而且,可提供图像,较为直观。但是,二者均不能直接检测高气压下暴露期间细胞内Ca2+的变化。为此,我们自行研制了微型细胞氧舱,能耐受0.6MPa的压力,体积小,适合荧光显微镜下的工作距离,且上下两面嵌有平行的石英玻璃,透光性能良好,图像不失真。由于微型细胞氧舱有0.8cm的高度,致使细胞的聚焦平面距离物镜镜头的工作距离稍远,仅能以10倍的物镜观察,故光通量小,图像较暗,但仍不失为高气压条件下连续观察细胞内Ca2+变化的一种良好方法。
, 百拇医药
有研究表明,低氧8h、24h后,均可见培养的脑微血管EC[Ca2+]i增加[4],但HBO直接暴露下,EC[Ca2+]i的变化却与此不同,0.2和0.3 MPaO2暴露,EC[Ca2+]i和SMC[Ca2+]i均呈现出短暂的一过性增加,持续约3~5min,而后即很快下降,尤以贴附于EC生长的SMC[Ca2+]i下降最为显著,我们认为这可能与HBO致内皮细胞内NO的增加有关[5]。本研究结果提示进行高压氧治疗时,氧压值以0.2MPa左右为适宜。0.4MPaO2暴露下,EC呈现相继破裂,荧光指示剂外泄,表明此压力下氧已对细胞产生毒性作用,致使细胞功能与结构损伤。本工作报道了高压氧(0.1~0.4MPa)直接暴露时细胞内Ca2+变化的规律,并提供了研究高气压暴露下细胞内Ca2+变化的新方法。
, 百拇医药
参考文献
[1]Grynkiewiez G,Poenie M,Tsien RY.A new generation of Ca2+ indicators wi th greatly improved fluorescence properties[J].J Biol Chem,1985,260:3440~ 3444
[2]Mc Burney RN,Neering IR.Neuronal calcium homeostasis[J].TINS, 1987,10:164~169
[3]方以群,刘景昌.高压氧对脑缺血及再灌注时海马游离Ca2+及钙通道的作用[J].中国应用生理学杂志,1995,11(2):129~132
[4]吕 敏,顾正中.一氧化氮在低氧脑血管舒张反应中的作用[J].中国应用生理学杂志,1997,13(3):6~7
[5]刘 磊,刘景昌,蔺世龙等.NO在高压氧调控脑微血管舒缩功能中的效用[J].微循环学杂志,1999,9(2):5~7
收稿日期:1999-10-09, 百拇医药
单位:海军医学研究所,上海200433
关键词:高压氧;微血管;细胞氧舱;平滑肌细胞;内皮细胞;荧光显微镜
航天医学与医学工程990605摘要:目的 探讨直接暴露高压氧下细胞内Ca2+的变化规律及其相应的检测方法。方法 采用自行研制的微型细胞氧舱,结合显微荧光方法,测定共培养的内皮细胞(EC)和平滑肌细胞(SMC)内钙浓度变化。结果 (1)细胞氧舱密闭性好,体积小,能耐受0.6MPa的压力,可在高压氧暴露下直接观测细胞钙变化。透光度强,图像不失真。(2)0.2和0.3MPa高压氧暴露下初始阶段5min以内EC[Ca2+]i和SMC[Ca2+]i均增加,随着暴露时间延长(>5min)则呈现下降,尤其以SMC[Ca2+]i为明显。0.4MPaO2暴露时,可见EC破裂。结论 高压氧暴露下EC[Ca2+]i和SMC[Ca2+]i变化呈双向反应,先增加,后降低。所采用的微型细胞氧舱及其检测技术方法可靠,适合于高压氧直接暴露下研究细胞[Ca2+]i的变化及其规律。
, 百拇医药
中图分类号:Q246 文献标识码:A 文章编号:1002-0837(1999)06-0410-04
Changes and Its Measurement of Intracellular Ca2+
during Exposure to Hyper b aric Oxygen
LIU Lei, LIU Jing-chang, LIN Shi-long, LI Bin
Address reprint requests to:LIU Lei.Naval Medical Research
Institute, Shanghai 200433,China
Abstract: Objective To investigate the rule of change of intracellular Ca 2+ and i ts measurement method during exposure to hyperbaric oxygen (HBO). Metho d Microfluo rescence method was used to measu the changes of intracellular Ca2+ con centration in co-cultured endothelial cells (EC) and smooth muscle cell s (SMC) in a specially designed miniature oxygen chamber. Result (1) [Ca2+]i changes during HBO exposure can be clearly obse rved directly in the chamber. (2) Within 5 min during 0.2 MPa and 0.3[ KG*7]MPa HBO expos ure, EC[Ca2+]i and SMC [Ca2+]i showed a tendency, to increas e at firs t and then decrease with time throughout the exposures, especially the SMC[Ca 2+]i. The EC ruptured under exposure to 0.4MPa HBO. Conclusion During HB O exposure, EC[Ca2+]i and SMC[Ca2+]i showed biphasic changes , which incr eased at first and then decreased.The technique and method used were reliable an d suitable for in vestigating of intracellular [Ca2+]i changes under HBO.
, http://www.100md.com
Key words: hyperbaric oxygen; microvessel; cell oxygen chamber; smooth m uscle cell; endothelial cells;fluorescence microscope.
低氧和缺氧条件下,血管平滑肌细胞(smooth muscle cell, SMC)[Ca2+]i和内皮细胞(endothelialcell,EC)[Ca2+]i的变化,已有文献报道[1]。但富氧和高压氧(hyperbricoxygen,HBO)暴露下,两种细胞[Ca2+]i的变化规律尚不清楚。由于钙在神经细胞的生理和病理过程中起重要作用[2],已知,Ca2+是可兴奋包括神经细胞在内的一个特殊第二信使,担负着“兴奋信号传感器”的作用,而[Ca2+]i的超载,则是诸多缺血缺氧性疾病病程的一个重要环节。了解HBO对Ca2+平衡的作用,也是阐明HBO治疗效用机理的一个重要理论问题。为此,我们采用自行研制的细胞氧舱,直接测量了0.1~0.4MPa(1~4ATA)HBO暴露下培养的血管平滑肌细胞和内皮细胞[Ca2+]i的变化,并研究了不同氧压下其变化规律。
, 百拇医药
方 法
细胞氧舱的制备 用有机玻璃制成12cm×1.2cm×0.8cm的长方体,中间车空1.0cm×0.4cm×0.4
cm,上下两面嵌入直径1.0cm的石英玻璃,左端嵌入两根直径1mm的无缝钢管作为进出气口。氧气气源用容积1.3L,15MPa的小钢瓶,通过减压器供气,并控制流量,以氧压表测压,右端留有进样口及活塞。经0.6MPa耐压检验合格后备用(图1)。
 图1 高压氧直接暴露下细胞[Ca2+]i的测量装置
图1 高压氧直接暴露下细胞[Ca2+]i的测量装置Fig.1 Device for of measurement cell [Ca2+]i during HBO exposure
, 百拇医药 样品分组 加入传代(2~3代)后的SMC和EC细胞悬液(1~2×105cells/ml)于盖玻片上共培养。并按表1进行实验。
表1 不同氧压和N2-O2下对SMC及EC进行观察的程序
Table 1 Observation procedure of SMC and EC under different
oxyen pre ssure and N2-O2
N2-O2
HBO
MPa
, 百拇医药
0.1
0.2
0.3
0.4
0.1
0.2
0.3
0.4
O2%
21
10.5
7.0
5.2
, 百拇医药
99.2
99.2
99.2
99.2
SMC+EC数
27+9
30+12
29+8
31+11
32+13
33+9
32+10
29+7
, 百拇医药
待细胞贴壁后取出,置于10μmol/L的荧光指示剂Fluo-3/AM(Sigma公司)中,37℃黑暗条件下孵育60min,MEM(Gibco公司)培养基反复冲洗后,置细胞氧舱内。
测量方法 纯氧洗舱,1min加压至规定的压力并稳压停留,利用显微荧光动态监测高压氧暴露前和暴露期间两种细胞的荧光强度,激发波长为450~510nm。
结 果
经荧光显微镜测定[Ca2+]i浓度变化显示,0.1MPaO2暴露下3min后,共培养的EC[Ca2+]i和SMC[Ca2+]i均缓慢下降。0.2MPaO2暴露下3min内可见共培养的EC[Ca2+]i和SMC[Ca2+]i均明显增加;此后,SMC[Ca2+]i即减少,尤以贴附于EC生长的SMC[Ca2+]i下降更为显著;5min后EC[Ca2+]i也稍减少;HBO暴露下10min后两者均明显减少(图2)。当氧压增至0.4MPa时,EC[Ca2+]i瞬间(1~3min内)也呈现增加,但很快即下降,部分EC破裂,荧光指示剂外泄。共培养EC[Ca2+]i在0.2~0.4 MPa下增加,维持时间相对较长,除0.4MPa外,在5min后开始下降。SMC[Ca2+]i只在2~3min内增加,而后即下降(图3,4)。0.1~0.4MpaN2-O2对照组的结果显示,共培养的SMC[Ca2+]i和EC[Ca2+]i均同步缓慢下降。




, 百拇医药
图2 0.2MPO2暴露下共培养的SMC和EC[Ca2+]i的变化
以荧光强度显示[Ca2+]i含量变化,a.暴露前的SMC和EC[Ca2+]i;
b.暴露3minSMC和EC[Ca2+]i均增加;c.暴露5minSMC[Ca2+]i明显下降;
d.暴露10minSMC[Ca2+]i进一步下降,同时,EC[Ca2+]i也减少
Fig.2 Changesof[Ca2+]i in co-cultural SMC and EC during HB O exposure to
, 百拇医药
0.2MPa[Ca2+]i were showed by fluorescence intensity,a. SMC[Ca2+] i and EC [Ca2+]i before HBO exposure;
b.[Ca2+]i in SMC and E C increased after exposure to 0.2 MPa HBO for 3 min;
c. SMC [Ca2+]i ob viously decreased after exposure to 0.2 MPa HBO for 5 min;
d. SMC[Ca2+] i further decreased during exposure to 0.2 MPa
, http://www.100md.com
for 10 min, meanwhile EC[Ca2 +]i also reduced

图3 高压氧暴露下共培养的EC[Ca2+]i的变化
Fig.3 Changes of co-cultural EC[Ca2+]i during HBO exposure

图4 高压氧暴露下共培养的SMC[Ca2+]i的变化
Fig.4 Changes of co-cultural SMC[Ca2+]i during HBO exposure
, 百拇医药
讨 论
研究Ca2+平衡,尤其细胞内Ca2+变化的特征与规律,是探讨各种Ca2+依赖性生物过程机制的共同基础。在高气压条件下,钙平衡发生变化。有研究证实高压氧在治疗缺血、缺氧性疾病与损伤的效用机理之一,就是它可以降低神经组织细胞[Ca2+]i浓度,并通过减少L型钙通道开放数来实现[3]。那么,在不同氧压作用下[Ca2+]i变化规律如何,就有必要测定直接于高压下暴露时[Ca2+]i含量。目前测定[Ca2+]i通用流式细胞仪和显微荧光测Ca2+法。前者能定量检测,但不能连续动态观察,且不直观;后者不仅能连续动态检测,而且,可提供图像,较为直观。但是,二者均不能直接检测高气压下暴露期间细胞内Ca2+的变化。为此,我们自行研制了微型细胞氧舱,能耐受0.6MPa的压力,体积小,适合荧光显微镜下的工作距离,且上下两面嵌有平行的石英玻璃,透光性能良好,图像不失真。由于微型细胞氧舱有0.8cm的高度,致使细胞的聚焦平面距离物镜镜头的工作距离稍远,仅能以10倍的物镜观察,故光通量小,图像较暗,但仍不失为高气压条件下连续观察细胞内Ca2+变化的一种良好方法。
, 百拇医药
有研究表明,低氧8h、24h后,均可见培养的脑微血管EC[Ca2+]i增加[4],但HBO直接暴露下,EC[Ca2+]i的变化却与此不同,0.2和0.3 MPaO2暴露,EC[Ca2+]i和SMC[Ca2+]i均呈现出短暂的一过性增加,持续约3~5min,而后即很快下降,尤以贴附于EC生长的SMC[Ca2+]i下降最为显著,我们认为这可能与HBO致内皮细胞内NO的增加有关[5]。本研究结果提示进行高压氧治疗时,氧压值以0.2MPa左右为适宜。0.4MPaO2暴露下,EC呈现相继破裂,荧光指示剂外泄,表明此压力下氧已对细胞产生毒性作用,致使细胞功能与结构损伤。本工作报道了高压氧(0.1~0.4MPa)直接暴露时细胞内Ca2+变化的规律,并提供了研究高气压暴露下细胞内Ca2+变化的新方法。
, 百拇医药
参考文献
[1]Grynkiewiez G,Poenie M,Tsien RY.A new generation of Ca2+ indicators wi th greatly improved fluorescence properties[J].J Biol Chem,1985,260:3440~ 3444
[2]Mc Burney RN,Neering IR.Neuronal calcium homeostasis[J].TINS, 1987,10:164~169
[3]方以群,刘景昌.高压氧对脑缺血及再灌注时海马游离Ca2+及钙通道的作用[J].中国应用生理学杂志,1995,11(2):129~132
[4]吕 敏,顾正中.一氧化氮在低氧脑血管舒张反应中的作用[J].中国应用生理学杂志,1997,13(3):6~7
[5]刘 磊,刘景昌,蔺世龙等.NO在高压氧调控脑微血管舒缩功能中的效用[J].微循环学杂志,1999,9(2):5~7
收稿日期:1999-10-09, 百拇医药