肾综合征出血热患者白细胞介素-8的动态变化
作者:樊万虎 岳金声 张帆 张成文
单位:710061 西安医科大学第一临床医学院
关键词:
中华传染病杂志980328表2 IL-8含量与临床病型(晚期定型)间关系(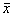 ±s) 病期
±s) 病期
病 型
轻(n=8)
中(n=15)
重(n=8)
危重(n=5)
发热期
, 百拇医药
284.1±96.4
565.2±116.3
1527.2±281.4
1908.5±306.1
低血压期
*
895.3±198.4
2113.1±298.7
2259.4±328.5
少尿期
*
746.4±194.7
, 百拇医药
1681.3±326.5
2210.6±296.1
多尿期
68.1±28.2
182.1±81.1
186.6±94.5
237.7±91.9
恢复期
58.6±19.6
69.8±20.4
62.8±22.9
96.2±38.4
, 百拇医药
总计
144.2±91.8
488.1±198.6
1082.1±346.4
1348.5±351.9
*无此期标本
白细胞介素-8(IL-8)是一种小分子量活性多肽,有较强的趋化和激活嗜中性粒细胞作用[1]。我们应用双抗体夹心ELISA法检测了36例肾综合征出血热(HFRS)患者102份血清IL-8含量,探讨IL-8在HFRS发病中的作用。
材料与方法
一、检测对象
, 百拇医药
36例分别为1993~1995年我院传染科、西安市传染病院住院患者,男28例,女8例,平均年龄32.9(18~61)岁。用间接免疫荧光法检测HFRS特异性IgM和IgG抗体均阳性,按1986年南京全国肾综合征出血热临床专题会议制定的诊断和分型标准分为,轻型8例,中型15例,重型8例,危重型5例(1例死亡)。从入院之日起,隔日采血1次,共102份。对照组20例均为健康献血员。
二、试剂与方法
96孔聚苯乙烯微量反应板(丹麦Maxisorp公司);抗IL-8单克隆抗体、标准品、阴性对照均由第四军医大学免疫学教研室金伯泉教授提供;DG-3022酶标仪(南京华东电子管厂)。
血清IL-8测定方法 包被酶标抗体100 μL/孔、4°C放置48小时→洗板3次→加待测样品、阴性对照,倍比稀释的标准品100 μl/孔,37°C 2小时、洗板3次、酶标抗体100 μl/孔,37°C 1小时,洗板3次、ABTS显色液100 μl/孔、37°C 30分钟、酶标仪测410 nm处A值,绘制标准曲线,测各标本的含量。
, 百拇医药
结 果
一、肾综合征出血热患者病程中IL-8含量的动态变化
102份HFRS患者血清IL-8平均含量805.2±283.1 ng/L,与对照组相比,差异有显著性(P<0.001);于病程第3天已增高,3~5病日升高达峰值,6病日开始下降,7~10病日明显下降,15病日降至接近正常水平;各病期变化见表1。
二、IL-8含量与临床病型间的关系
见表2。IL-8含量随HFRS患者病情加重而增高,轻、中、重和危重型
表1 HFRS患者各病期
IL-8含量变化 (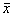 ±s) 病期
±s) 病期
, 百拇医药
例数
IL-8(ng/L)
正常对照
20
78.2±24.6
发热期
18
1004.6±228.7
低血压期
12
1528.4±231.9
少尿期
36
, 百拇医药
1010.3±202.5
多尿期
24
150.8±81.0
恢复期
12
81.7±19.5
之间差异有显著性(P<0.005)。中型较轻型发热期IL-8含量明显增高(P<0.01),重型及危重型患者发热、低血压、少尿期较中型患者IL-8含量明显增高(P<0.001),各型患者恢复期IL-8含量接近正常(P>0.5)。
三、IL-8含量与尿蛋白含量的关系
IL-8含量随尿蛋白增加而升高,呈明显正相关(r=0.6045 P<0.005);且尿蛋白(g/L)<0.5、0.5~3.0、>3.0之间IL-8含量差异有显著性(P<0.01)。讨 论
, 百拇医药
免疫器官和免疫细胞,尤其是单核-巨噬细胞、血管内皮细胞是HFRS病毒攻击的主要靶器官和细胞[2],引起其功能和结构紊乱,出现HFRS患者体内细胞因子的产生异常,如肿瘤坏死因子在病程早期及极期明显升高,加重对机体的损伤[3]。IL-8是单核细胞、巨噬细胞、内皮细胞、表皮细胞在IL-1、肿瘤坏死因子等诱导下合成和分泌的,由72~77个氨基酸组成的小分子多肽,其受体主要分布于中性粒细胞、单核细胞和T细胞[4],主要发挥趋化、激活作用。
HFRS患者血清IL-8在病程第3天已增高,5病日达高峰,6病日开始下降;发热期明显升高,低血压期达高峰,少尿期开始下降,恢复期降至正常;与病毒在单核细胞,血管内皮细胞增殖时间相一致。高滴度的IL-8可趋化中性粒细胞,并刺激其产生白三烯[5],而使血管通透性增加,血浆外渗,与临床出现低血压相关。IL-8的含量变化与病程进展密切相关,是引起HFRS病理损伤的重要因素之一。
, 百拇医药
轻、中、重和危重型患者IL-8含量渐增高,差异有显著性(P<0.005)。中型较轻型发热期明显增高(P<0.01),重型及危重型较中型发热、低血压、少尿期明显增高(P<0.001)。IL-8含量与病情轻重明显相关,IL-8含量越高,临床出现低血压的可能性越大且越严重,发生较严重的肾功能衰竭。早期动态检测IL-8含量,对判定HFRS患者的预后和转归有重要的参考价值。
HFRS患者血清中IL-8含量与尿蛋白含量呈明显正相关(r=0.4296 P<0.01),IL-8与患者肾损伤有一定关系。
参考文献
1 Baggiolinh M, Walz A, Steven I. Neutrophil-activating peptide-1/interleuking a novel cytokine that activates neutrophils. J Chin Invest, 1989,84:1045-1049.
, http://www.100md.com
2 朱平,杨为松,刘健,等.肾综合征出血热病毒感染人血管内皮细胞的观察.中华医学杂志,1989;69(10):588-590.
3 刘清珍,樊万虎,张成文,等.流行性出血热患者肿瘤坏死因子的动态检测及临床意义.中华传染病杂志,1993,11:166-167.
4 Tyornton. AJ, Strietor. RM, Lindley Z,et al. Cytokine-induced gene espres-
sion of a neutrophil chemotactic factor/IL-8 in human hepatocytes. J Immunol, 1990, 144:2609-2613.
5 Dahinden. CA, Kurzmoto. Y, Weck. AD, et al. The neutrophil-activating peptide NAF/NAP-1 induces histanine and leakotriene yelease by interleukin-3 primed basophils. J Exp Med, 1989, 170: 1787-1790., 百拇医药
单位:710061 西安医科大学第一临床医学院
关键词:
中华传染病杂志980328表2 IL-8含量与临床病型(晚期定型)间关系(
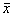 ±s) 病期
±s) 病期病 型
轻(n=8)
中(n=15)
重(n=8)
危重(n=5)
发热期
, 百拇医药
284.1±96.4
565.2±116.3
1527.2±281.4
1908.5±306.1
低血压期
*
895.3±198.4
2113.1±298.7
2259.4±328.5
少尿期
*
746.4±194.7
, 百拇医药
1681.3±326.5
2210.6±296.1
多尿期
68.1±28.2
182.1±81.1
186.6±94.5
237.7±91.9
恢复期
58.6±19.6
69.8±20.4
62.8±22.9
96.2±38.4
, 百拇医药
总计
144.2±91.8
488.1±198.6
1082.1±346.4
1348.5±351.9
*无此期标本
白细胞介素-8(IL-8)是一种小分子量活性多肽,有较强的趋化和激活嗜中性粒细胞作用[1]。我们应用双抗体夹心ELISA法检测了36例肾综合征出血热(HFRS)患者102份血清IL-8含量,探讨IL-8在HFRS发病中的作用。
材料与方法
一、检测对象
, 百拇医药
36例分别为1993~1995年我院传染科、西安市传染病院住院患者,男28例,女8例,平均年龄32.9(18~61)岁。用间接免疫荧光法检测HFRS特异性IgM和IgG抗体均阳性,按1986年南京全国肾综合征出血热临床专题会议制定的诊断和分型标准分为,轻型8例,中型15例,重型8例,危重型5例(1例死亡)。从入院之日起,隔日采血1次,共102份。对照组20例均为健康献血员。
二、试剂与方法
96孔聚苯乙烯微量反应板(丹麦Maxisorp公司);抗IL-8单克隆抗体、标准品、阴性对照均由第四军医大学免疫学教研室金伯泉教授提供;DG-3022酶标仪(南京华东电子管厂)。
血清IL-8测定方法 包被酶标抗体100 μL/孔、4°C放置48小时→洗板3次→加待测样品、阴性对照,倍比稀释的标准品100 μl/孔,37°C 2小时、洗板3次、酶标抗体100 μl/孔,37°C 1小时,洗板3次、ABTS显色液100 μl/孔、37°C 30分钟、酶标仪测410 nm处A值,绘制标准曲线,测各标本的含量。
, 百拇医药
结 果
一、肾综合征出血热患者病程中IL-8含量的动态变化
102份HFRS患者血清IL-8平均含量805.2±283.1 ng/L,与对照组相比,差异有显著性(P<0.001);于病程第3天已增高,3~5病日升高达峰值,6病日开始下降,7~10病日明显下降,15病日降至接近正常水平;各病期变化见表1。
二、IL-8含量与临床病型间的关系
见表2。IL-8含量随HFRS患者病情加重而增高,轻、中、重和危重型
表1 HFRS患者各病期
IL-8含量变化 (
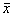 ±s) 病期
±s) 病期, 百拇医药
例数
IL-8(ng/L)
正常对照
20
78.2±24.6
发热期
18
1004.6±228.7
低血压期
12
1528.4±231.9
少尿期
36
, 百拇医药
1010.3±202.5
多尿期
24
150.8±81.0
恢复期
12
81.7±19.5
之间差异有显著性(P<0.005)。中型较轻型发热期IL-8含量明显增高(P<0.01),重型及危重型患者发热、低血压、少尿期较中型患者IL-8含量明显增高(P<0.001),各型患者恢复期IL-8含量接近正常(P>0.5)。
三、IL-8含量与尿蛋白含量的关系
IL-8含量随尿蛋白增加而升高,呈明显正相关(r=0.6045 P<0.005);且尿蛋白(g/L)<0.5、0.5~3.0、>3.0之间IL-8含量差异有显著性(P<0.01)。讨 论
, 百拇医药
免疫器官和免疫细胞,尤其是单核-巨噬细胞、血管内皮细胞是HFRS病毒攻击的主要靶器官和细胞[2],引起其功能和结构紊乱,出现HFRS患者体内细胞因子的产生异常,如肿瘤坏死因子在病程早期及极期明显升高,加重对机体的损伤[3]。IL-8是单核细胞、巨噬细胞、内皮细胞、表皮细胞在IL-1、肿瘤坏死因子等诱导下合成和分泌的,由72~77个氨基酸组成的小分子多肽,其受体主要分布于中性粒细胞、单核细胞和T细胞[4],主要发挥趋化、激活作用。
HFRS患者血清IL-8在病程第3天已增高,5病日达高峰,6病日开始下降;发热期明显升高,低血压期达高峰,少尿期开始下降,恢复期降至正常;与病毒在单核细胞,血管内皮细胞增殖时间相一致。高滴度的IL-8可趋化中性粒细胞,并刺激其产生白三烯[5],而使血管通透性增加,血浆外渗,与临床出现低血压相关。IL-8的含量变化与病程进展密切相关,是引起HFRS病理损伤的重要因素之一。
, 百拇医药
轻、中、重和危重型患者IL-8含量渐增高,差异有显著性(P<0.005)。中型较轻型发热期明显增高(P<0.01),重型及危重型较中型发热、低血压、少尿期明显增高(P<0.001)。IL-8含量与病情轻重明显相关,IL-8含量越高,临床出现低血压的可能性越大且越严重,发生较严重的肾功能衰竭。早期动态检测IL-8含量,对判定HFRS患者的预后和转归有重要的参考价值。
HFRS患者血清中IL-8含量与尿蛋白含量呈明显正相关(r=0.4296 P<0.01),IL-8与患者肾损伤有一定关系。
参考文献
1 Baggiolinh M, Walz A, Steven I. Neutrophil-activating peptide-1/interleuking a novel cytokine that activates neutrophils. J Chin Invest, 1989,84:1045-1049.
, http://www.100md.com
2 朱平,杨为松,刘健,等.肾综合征出血热病毒感染人血管内皮细胞的观察.中华医学杂志,1989;69(10):588-590.
3 刘清珍,樊万虎,张成文,等.流行性出血热患者肿瘤坏死因子的动态检测及临床意义.中华传染病杂志,1993,11:166-167.
4 Tyornton. AJ, Strietor. RM, Lindley Z,et al. Cytokine-induced gene espres-
sion of a neutrophil chemotactic factor/IL-8 in human hepatocytes. J Immunol, 1990, 144:2609-2613.
5 Dahinden. CA, Kurzmoto. Y, Weck. AD, et al. The neutrophil-activating peptide NAF/NAP-1 induces histanine and leakotriene yelease by interleukin-3 primed basophils. J Exp Med, 1989, 170: 1787-1790., 百拇医药