龈沟液中存在白细胞介素8降解酶及其自身抗体
作者:曹采方 谢昊 马大龙 孟焕新
单位:100081 北京医科大学口腔医学院(曹采方、孟焕新);湖北医科大学口腔医学院(谢昊);北京医科大学免疫学系(马大龙)
关键词:白细胞介素8;抑制因子;丝氨酸蛋白酶;自身抗体;龈沟液
中华口腔医学杂志980304 【摘要】 目的 探究龈沟液中是否存在白细胞介素8(interleukin-8, IL-8)的抑制因子。方法 (1)将13例成人牙周炎的14份及8例牙周健康者的9份龈沟液样本各自一分为二,1/2加入丝氨酸蛋白酶抑制剂──苯*****,另1/2加入等量的磷酸盐缓冲液作为对照。ELISA法检测各样本中的IL-8含量。(2)对15例成人牙周炎的41份龈沟液样本,用间接ELISA法测定龈沟液中的IL-8自身抗体(IgG)。 结果 (1)加入酶抑制剂的龈沟液中IL-8的检出量(3.01mg/L±5.79 mg/L)显著高于对照组(0.05mg/L±0.15 mg/L),P<0.001。(2)龈沟液中IL-8自身抗体水平高于阴性对照标准差3倍。龈沟液中加入大肠杆菌超声粉碎液对此检测结果无明显影响。结论 龈沟液中存在能降解IL-8的丝氨酸蛋白酶;成人牙周炎的龈沟液中存在IL-8自身抗体。
, http://www.100md.com
Existence of IL-8 degrading protease and anti-IL-8 IgG in gingival crevicular fluid Cao Caifang*, Xie Hao, Ma Dalong, et al.*School of Stomatology, Beijing Medical University, Beijing 100081
【Abstract】 Objective To identify the nature of the IL-8 inhibitor(s) in gingival crevicul fluid (GCF). Methods (1)14 GCF samples were collected from 13 adult periodontitis (AP) patients, and 9 samples were taken from 8 healthy subjects. Each GCF sample was divided into two aliquots. A serine protease-specific inhibitor-PMSF was added to one aliquot and PBS added to the other aliquot as control. ELISA was used to measure IL-8 level in the samples. (2) 41 GCF samples were collected from 15 AP patients and indirect ELISA was performed to detect the anti-IL-8 IgG antibody. Results (1) IL-8 level in the PMSF-added samples were significantly greater than that in the control group(3.01 mg/L±5.79 mg/L vs 0.05 mg/L±0.15 mg/L, P<0.001). (2)The mean value of anti-IL-8 IgG in GCF was greater than that of negative control +3×s. Conclusion A serine protease which can “cleave” IL-8 exists in GCF and GCF from AP sites contain auto-antibody against IL-8.
, 百拇医药
【Key words】 Interleukin-8 Inhibitor Serine protease Auto-antibody Gingival crevicular fluid
白细胞介素8(interleukin-8, IL-8)是一种主要由单核细胞分泌、具有多种生物学功能的细胞因子,其主要作用是趋化和激活多形核白细胞。 曾有报道,47.7%和31%的牙周炎患者龈沟液中未能检出IL-8[1, 2]。我们在一部分牙周炎患者龈组织匀浆中也未能检出IL-8,并发现牙周炎龈沟液中存在IL-8的抑制因子[3]。为探明IL-8抑制因子的性质,我们做了如下研究。
材料和方法
1.病例选择及龈沟液取样:从北京医科大学口腔医学院牙周科选择全身健康、3个月内无抗生素应用史及牙周治疗史的成人牙周炎患者13例(AP组),其中男性9例,女性4例。共选择牙周袋深度4~6mm、探诊出血指数2~4的患牙14颗。另选牙周健康者8例,其中男性5例,女性3例,共9颗牙。用经0.1%牛血清白蛋白(BSA)预处理过的3个Whatman 3# 滤纸条,分别放入所选牙的近中、远中和中央牙周袋(沟)内,30秒时取出[4]。将每颗牙的3个滤纸条放入同一Eppendorf管,作为1个样本,-20℃保存备用。
, http://www.100md.com
2.龈沟液混合样本的制备:41份龈沟液样本分别取自15例成人牙周炎患者,牙周袋深4~10mm,出血指数≥2。离心洗提后,将所有洗提液混合在一起待检。
3.大肠杆菌超声粉碎液的制备:将5×1011细胞/升的大肠杆菌悬液于60℃,30min热致死后,超声粉碎5min,使95%以上的细胞裂解。用0.1%BSA-PBS将其倍比稀释成9个浓度梯度备用。
4.酶抑制实验:将没有混合的每份龈沟液(gingival crevicular fluid, GCF) 样本加0.1%BSA-PBS-T液(含0.05%Tween-20)120 μl,离心洗提出龈沟液。每份龈沟液中加入重组人IL-8(rhIL-8) (北京医科大学分子免疫室提供)[5],在其终浓度达0.01mg/L后,把每份GCF样本一分为二,一份加入3mmol/L的苯*****(PMSF),另一份加入等量磷酸盐缓冲液(PBS)作对照,共计23对样本。37℃下、 30 min后,夹心ELISA法检测其中IL-8的含量(IL-8 检测试剂盒由第四军医大学免疫学教研室金伯泉教授惠赠)[6] 。
, 百拇医药
5.间接ELISA法检测IL-8自身抗体(IgG):用2mg/L rhIL-8包被96孔酶标板,3% BSA封闭后,每孔加40 μl龈沟液混合样本和10 μl大肠杆菌超声粉碎梯度液,每份样本做复孔。同时设阴性对照(不加龈沟液或HRP-羊抗人IgG),HRP-羊抗人IgG工作浓度为1∶100。
结果
1.酶抑制实验结果:23份GCF样本(加PMSF)中检出的IL-8值为3.01mg/L±5.79 mg/L(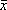 ±s),高于加PBS的对照样本,后者的检出均值为0.05 mg/L±0.15 mg/L。经Sign检验 , 两组间差异有高度显著性,P<0.001。值得注意的是,两组IL-8的检出均值都低于试验前加入的0.01mg/L。
±s),高于加PBS的对照样本,后者的检出均值为0.05 mg/L±0.15 mg/L。经Sign检验 , 两组间差异有高度显著性,P<0.001。值得注意的是,两组IL-8的检出均值都低于试验前加入的0.01mg/L。
2.间接ELISA法检测结果:在各GCF混合样本中加入不同浓度的大肠杆菌粉碎液后,检出的IL-8自身抗体OD值的标准差均非常小(0.003),IL-8自身抗体的平均检出OD值(0.042)高于阴性对照值标准差的3倍(0.034),证实GCF中有IL-8自身抗体。附图显示细菌超声粉碎液各浓度梯度与其相应IL-8抗体检出OD值的拟合曲线为一斜率近似零的直线(Y=0.000 4X + 4.227 2),说明大肠杆菌超声粉碎抗原对IL-8抗体的检出无明显影响。
, http://www.100md.com
讨论
众所周知,丝氨酸蛋白酶为一组酶,其成员有胰凝乳蛋白酶、胰蛋白酶、弹性蛋白酶及凝血酶等。有资料显示,IL-8 是一种耐酶多肽,弹性蛋白酶对其活性无影响,凝血酶可以将内皮细胞产生的IL-8(77个氨基酸)降解为单核细胞产生形式的IL-8(72个氨基酸)而使其生物活性增强,胰蛋白酶仅在高浓度(200nmol/L)时才可将IL-8裂解成小的片段,并使其活性消失[7~9]。Ayesh等[10~12]报道:在鼠浆膜液中有一种分子量为40 000的IL-8裂解酶,该酶不仅可裂解IL-8和C5a,还可使其活性消失,此酶可能是一种炎症的调节因子。PMSF是一种特异的丝氨酸蛋白酶抑制剂,其半衰期在25℃时仅35 min[13],1.5 mmol/L的PMSF即可完全抑制IL-8裂解酶[10]。本组结果提示龈沟液中存在一种可裂解IL-8的裂解酶,属丝氨酸蛋白酶。关于该酶的性质、来源均需进一步探索。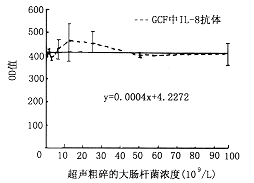
, http://www.100md.com
附图 大肠杆菌对检出IL-8抗体的影响
在酶抑制实验中,IL-8的检出值均低于加入值0.01mg/L。这提示龈沟液中可能还有其他IL-8抑制因子。Sylvester等[14]报道,9/16(35%)的健康人血清中存在IL-8的自身抗体。本组研究证实了牙周炎患者的龈沟液中也存在IL-8自身抗体。rhIL-8来源于大肠杆菌,将龈沟液与不同浓度大肠杆菌超声粉碎液反应后,龈沟液中IL-8抗体的检出值并无明显改变,IL-8抗体OD值仍高于阴性对照标准差的3倍。结果表明,rhIL-8可以直接用于对IL-8自身抗体的检测,大肠杆菌各抗原成分对龈沟液中IL-8自身抗体的检出无明显影响。
参考文献
1Payne JB, Reinhardt RA, Masada MP, et al. Gingival crevicular fluid IL-8: correlation with local IL-1beta level and patient estrogen status. J Periodont Res, 1993, 28(6 Pt 1):451- 453.
, http://www.100md.com
2Crawford JM, Homon C,Lee M. Interleukin-8 levels in human saliva and gingival crevicular fluid. J Dent Res,1993,72 (special issue), IADR Abstract ,1120.
3谢昊,曹采方,马大龙,等. 龈沟液中存在IL-8抑制因子及其生物活性. 中华口腔医学杂志, 1997, 32: 375-377.
4谢昊,曹采方,孟焕新,等. 预处理滤纸条对回收IgG及IL-8的影响. 北京医科大学学报,1995,27:186-187.
5周宝宏,马大龙,狄春辉,等.人单核细胞衍生IL-8 cDNA的体外扩增及其在大肠杆菌中高效表达.中华微生物学与免疫学杂志, 1992,12:174-177.
, 百拇医药 6刘金,金伯泉,董邦权,等. 6株抗rhIL8单克隆抗体识别表位的鉴定及双单克隆抗体夹心ELISA检测IL-8方法的建立. 中国免疫学杂志, 1994,10:131-133.
7Peveri P, Walz A, Dewald B,et al. A novel neutrophil-activating factor produced by human mononuclear phagocytes. J Exp Med,1988, 167:1547-1559.
8Ruef C, Jefferson DM, Schlegl Haueter SE, et al. Regulation of cytokine secretion by cysticfibrosis airway epithelial cells. Eur Respir J, 1993, 6:1429-1436.
9Hebert CA, Luscinskas FW, Kiely JM, et al. Endothelial and leukocyte forms of IL-8. Conversion by thrombin and interactions with neutrophils. J Immunol, 1990, 145:3033-3040.
, http://www.100md.com
10Ayesh SK, Azar Y, Babior BM, et al. Inactivation of interleukin-8 by the C5a-inactivating protease from serosal fluid. Blood, 1993,81:1424-1427.
11Gimbrone MA Jr,Obin MS, Brock AF, et al. Endothelial interleukin-8: a novel inhibitor of leukocyte-endothelial interactions. Science , 1989, 246:1601-1603.
12 Ayesh SK, Ferne M, Flechner I, et al. Partial characterization of a C5a-inhibitor in peritoneal fluid. J Immunol, 1990,144:3066-3070.
, 百拇医药
13Sambrook J, Fritsch EF, Maniatis T, 著. 分子克隆实验指南.金冬雁,黎孟枫,译.第2版.北京:科学出版社, 1992. 871-872.
14Sylvester I, Yoshimura T, Sticherling M, et al. Neutrophil attractant protein-1-immunoglobulin G immune complexes and free anti-NAP-1 antibody in normal human serum. J Clin Invest, 1992, 90: 471-481.
(收稿:1996-08-23 修回:1998-01-26), 百拇医药
单位:100081 北京医科大学口腔医学院(曹采方、孟焕新);湖北医科大学口腔医学院(谢昊);北京医科大学免疫学系(马大龙)
关键词:白细胞介素8;抑制因子;丝氨酸蛋白酶;自身抗体;龈沟液
中华口腔医学杂志980304 【摘要】 目的 探究龈沟液中是否存在白细胞介素8(interleukin-8, IL-8)的抑制因子。方法 (1)将13例成人牙周炎的14份及8例牙周健康者的9份龈沟液样本各自一分为二,1/2加入丝氨酸蛋白酶抑制剂──苯*****,另1/2加入等量的磷酸盐缓冲液作为对照。ELISA法检测各样本中的IL-8含量。(2)对15例成人牙周炎的41份龈沟液样本,用间接ELISA法测定龈沟液中的IL-8自身抗体(IgG)。 结果 (1)加入酶抑制剂的龈沟液中IL-8的检出量(3.01mg/L±5.79 mg/L)显著高于对照组(0.05mg/L±0.15 mg/L),P<0.001。(2)龈沟液中IL-8自身抗体水平高于阴性对照标准差3倍。龈沟液中加入大肠杆菌超声粉碎液对此检测结果无明显影响。结论 龈沟液中存在能降解IL-8的丝氨酸蛋白酶;成人牙周炎的龈沟液中存在IL-8自身抗体。
, http://www.100md.com
Existence of IL-8 degrading protease and anti-IL-8 IgG in gingival crevicular fluid Cao Caifang*, Xie Hao, Ma Dalong, et al.*School of Stomatology, Beijing Medical University, Beijing 100081
【Abstract】 Objective To identify the nature of the IL-8 inhibitor(s) in gingival crevicul fluid (GCF). Methods (1)14 GCF samples were collected from 13 adult periodontitis (AP) patients, and 9 samples were taken from 8 healthy subjects. Each GCF sample was divided into two aliquots. A serine protease-specific inhibitor-PMSF was added to one aliquot and PBS added to the other aliquot as control. ELISA was used to measure IL-8 level in the samples. (2) 41 GCF samples were collected from 15 AP patients and indirect ELISA was performed to detect the anti-IL-8 IgG antibody. Results (1) IL-8 level in the PMSF-added samples were significantly greater than that in the control group(3.01 mg/L±5.79 mg/L vs 0.05 mg/L±0.15 mg/L, P<0.001). (2)The mean value of anti-IL-8 IgG in GCF was greater than that of negative control +3×s. Conclusion A serine protease which can “cleave” IL-8 exists in GCF and GCF from AP sites contain auto-antibody against IL-8.
, 百拇医药
【Key words】 Interleukin-8 Inhibitor Serine protease Auto-antibody Gingival crevicular fluid
白细胞介素8(interleukin-8, IL-8)是一种主要由单核细胞分泌、具有多种生物学功能的细胞因子,其主要作用是趋化和激活多形核白细胞。 曾有报道,47.7%和31%的牙周炎患者龈沟液中未能检出IL-8[1, 2]。我们在一部分牙周炎患者龈组织匀浆中也未能检出IL-8,并发现牙周炎龈沟液中存在IL-8的抑制因子[3]。为探明IL-8抑制因子的性质,我们做了如下研究。
材料和方法
1.病例选择及龈沟液取样:从北京医科大学口腔医学院牙周科选择全身健康、3个月内无抗生素应用史及牙周治疗史的成人牙周炎患者13例(AP组),其中男性9例,女性4例。共选择牙周袋深度4~6mm、探诊出血指数2~4的患牙14颗。另选牙周健康者8例,其中男性5例,女性3例,共9颗牙。用经0.1%牛血清白蛋白(BSA)预处理过的3个Whatman 3# 滤纸条,分别放入所选牙的近中、远中和中央牙周袋(沟)内,30秒时取出[4]。将每颗牙的3个滤纸条放入同一Eppendorf管,作为1个样本,-20℃保存备用。
, http://www.100md.com
2.龈沟液混合样本的制备:41份龈沟液样本分别取自15例成人牙周炎患者,牙周袋深4~10mm,出血指数≥2。离心洗提后,将所有洗提液混合在一起待检。
3.大肠杆菌超声粉碎液的制备:将5×1011细胞/升的大肠杆菌悬液于60℃,30min热致死后,超声粉碎5min,使95%以上的细胞裂解。用0.1%BSA-PBS将其倍比稀释成9个浓度梯度备用。
4.酶抑制实验:将没有混合的每份龈沟液(gingival crevicular fluid, GCF) 样本加0.1%BSA-PBS-T液(含0.05%Tween-20)120 μl,离心洗提出龈沟液。每份龈沟液中加入重组人IL-8(rhIL-8) (北京医科大学分子免疫室提供)[5],在其终浓度达0.01mg/L后,把每份GCF样本一分为二,一份加入3mmol/L的苯*****(PMSF),另一份加入等量磷酸盐缓冲液(PBS)作对照,共计23对样本。37℃下、 30 min后,夹心ELISA法检测其中IL-8的含量(IL-8 检测试剂盒由第四军医大学免疫学教研室金伯泉教授惠赠)[6] 。
, 百拇医药
5.间接ELISA法检测IL-8自身抗体(IgG):用2mg/L rhIL-8包被96孔酶标板,3% BSA封闭后,每孔加40 μl龈沟液混合样本和10 μl大肠杆菌超声粉碎梯度液,每份样本做复孔。同时设阴性对照(不加龈沟液或HRP-羊抗人IgG),HRP-羊抗人IgG工作浓度为1∶100。
结果
1.酶抑制实验结果:23份GCF样本(加PMSF)中检出的IL-8值为3.01mg/L±5.79 mg/L(
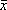 ±s),高于加PBS的对照样本,后者的检出均值为0.05 mg/L±0.15 mg/L。经Sign检验 , 两组间差异有高度显著性,P<0.001。值得注意的是,两组IL-8的检出均值都低于试验前加入的0.01mg/L。
±s),高于加PBS的对照样本,后者的检出均值为0.05 mg/L±0.15 mg/L。经Sign检验 , 两组间差异有高度显著性,P<0.001。值得注意的是,两组IL-8的检出均值都低于试验前加入的0.01mg/L。2.间接ELISA法检测结果:在各GCF混合样本中加入不同浓度的大肠杆菌粉碎液后,检出的IL-8自身抗体OD值的标准差均非常小(0.003),IL-8自身抗体的平均检出OD值(0.042)高于阴性对照值标准差的3倍(0.034),证实GCF中有IL-8自身抗体。附图显示细菌超声粉碎液各浓度梯度与其相应IL-8抗体检出OD值的拟合曲线为一斜率近似零的直线(Y=0.000 4X + 4.227 2),说明大肠杆菌超声粉碎抗原对IL-8抗体的检出无明显影响。
, http://www.100md.com
讨论
众所周知,丝氨酸蛋白酶为一组酶,其成员有胰凝乳蛋白酶、胰蛋白酶、弹性蛋白酶及凝血酶等。有资料显示,IL-8 是一种耐酶多肽,弹性蛋白酶对其活性无影响,凝血酶可以将内皮细胞产生的IL-8(77个氨基酸)降解为单核细胞产生形式的IL-8(72个氨基酸)而使其生物活性增强,胰蛋白酶仅在高浓度(200nmol/L)时才可将IL-8裂解成小的片段,并使其活性消失[7~9]。Ayesh等[10~12]报道:在鼠浆膜液中有一种分子量为40 000的IL-8裂解酶,该酶不仅可裂解IL-8和C5a,还可使其活性消失,此酶可能是一种炎症的调节因子。PMSF是一种特异的丝氨酸蛋白酶抑制剂,其半衰期在25℃时仅35 min[13],1.5 mmol/L的PMSF即可完全抑制IL-8裂解酶[10]。本组结果提示龈沟液中存在一种可裂解IL-8的裂解酶,属丝氨酸蛋白酶。关于该酶的性质、来源均需进一步探索。

, http://www.100md.com
附图 大肠杆菌对检出IL-8抗体的影响
在酶抑制实验中,IL-8的检出值均低于加入值0.01mg/L。这提示龈沟液中可能还有其他IL-8抑制因子。Sylvester等[14]报道,9/16(35%)的健康人血清中存在IL-8的自身抗体。本组研究证实了牙周炎患者的龈沟液中也存在IL-8自身抗体。rhIL-8来源于大肠杆菌,将龈沟液与不同浓度大肠杆菌超声粉碎液反应后,龈沟液中IL-8抗体的检出值并无明显改变,IL-8抗体OD值仍高于阴性对照标准差的3倍。结果表明,rhIL-8可以直接用于对IL-8自身抗体的检测,大肠杆菌各抗原成分对龈沟液中IL-8自身抗体的检出无明显影响。
参考文献
1Payne JB, Reinhardt RA, Masada MP, et al. Gingival crevicular fluid IL-8: correlation with local IL-1beta level and patient estrogen status. J Periodont Res, 1993, 28(6 Pt 1):451- 453.
, http://www.100md.com
2Crawford JM, Homon C,Lee M. Interleukin-8 levels in human saliva and gingival crevicular fluid. J Dent Res,1993,72 (special issue), IADR Abstract ,1120.
3谢昊,曹采方,马大龙,等. 龈沟液中存在IL-8抑制因子及其生物活性. 中华口腔医学杂志, 1997, 32: 375-377.
4谢昊,曹采方,孟焕新,等. 预处理滤纸条对回收IgG及IL-8的影响. 北京医科大学学报,1995,27:186-187.
5周宝宏,马大龙,狄春辉,等.人单核细胞衍生IL-8 cDNA的体外扩增及其在大肠杆菌中高效表达.中华微生物学与免疫学杂志, 1992,12:174-177.
, 百拇医药 6刘金,金伯泉,董邦权,等. 6株抗rhIL8单克隆抗体识别表位的鉴定及双单克隆抗体夹心ELISA检测IL-8方法的建立. 中国免疫学杂志, 1994,10:131-133.
7Peveri P, Walz A, Dewald B,et al. A novel neutrophil-activating factor produced by human mononuclear phagocytes. J Exp Med,1988, 167:1547-1559.
8Ruef C, Jefferson DM, Schlegl Haueter SE, et al. Regulation of cytokine secretion by cysticfibrosis airway epithelial cells. Eur Respir J, 1993, 6:1429-1436.
9Hebert CA, Luscinskas FW, Kiely JM, et al. Endothelial and leukocyte forms of IL-8. Conversion by thrombin and interactions with neutrophils. J Immunol, 1990, 145:3033-3040.
, http://www.100md.com
10Ayesh SK, Azar Y, Babior BM, et al. Inactivation of interleukin-8 by the C5a-inactivating protease from serosal fluid. Blood, 1993,81:1424-1427.
11Gimbrone MA Jr,Obin MS, Brock AF, et al. Endothelial interleukin-8: a novel inhibitor of leukocyte-endothelial interactions. Science , 1989, 246:1601-1603.
12 Ayesh SK, Ferne M, Flechner I, et al. Partial characterization of a C5a-inhibitor in peritoneal fluid. J Immunol, 1990,144:3066-3070.
, 百拇医药
13Sambrook J, Fritsch EF, Maniatis T, 著. 分子克隆实验指南.金冬雁,黎孟枫,译.第2版.北京:科学出版社, 1992. 871-872.
14Sylvester I, Yoshimura T, Sticherling M, et al. Neutrophil attractant protein-1-immunoglobulin G immune complexes and free anti-NAP-1 antibody in normal human serum. J Clin Invest, 1992, 90: 471-481.
(收稿:1996-08-23 修回:1998-01-26), 百拇医药