E-Cadherin与肿瘤转移
作者:张 韬
单位:中国医学科学院中国协和医科大学北京协和医院口腔科(100730)
关键词:
E 赖钦声, 毛 驰 审校
中图分类号:R739.8
文献标识码:A
文章编号:1005-4979(1999)03-225-03
E-CADHERIN AND TUMOR METASTASIS
细胞粘附可分为细胞—细胞粘附和细胞—基质粘附两大类。前者又可根据参与细胞的类型分为同质粘附(homotypic adhesion)和异质粘附(heterotypic adhesion)。同一种类型细胞间的粘附称同质粘附,两种以上细胞间的粘附称异质粘附[1]。经过多年的研究已分离鉴定出四类与肿瘤转移有关的细胞粘附分子(cell adhesion molecules, CAM),它们是整合蛋白、免疫球蛋白超家族分子、钙粘附蛋白和选择素[2]。
, http://www.100md.com
钙粘附蛋白(cadherin)是一类主要介导细胞间同质粘附的钙依赖性跨膜糖蛋白。主要分为分布于上皮组织中的E-cadherin (epithelia cadherin,也称L-CAM)。分布于神经和肌肉组织中的N-cadherin和分布于胎盘组织中的P-cadherin三类。此外还发现了一些新的cadherin分子,如在内皮细胞表达的V-cadherin,在视网膜细胞表达的R-cadherin,在脑组织表达的B-cadherin。E-chaherin是研究较多的同质粘附分子。近年来已成为肿瘤细胞侵袭和转移研究的热点之一[1]。
1 E-cadherin的结构
人类的E-cadherin编码基因定位于16号染色体q22.1附近,由723~748个氨基酸组成,分子量为80~124kD,分子中存在一个疏水基因,位于跨膜区,氨基末端位于细胞膜外,是钙离子的结合位点,对Ca2+有高度敏感性,羟基末端位于细胞浆内,与肌动蛋白相连,由α、β、γ三个亚单位(catenins)及其它一些连接蛋白组成,对维持细胞形态和调节细胞粘附具有重要作用[3]。如附图示。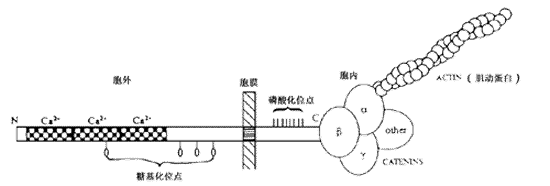
, 百拇医药
附图 E-cadherin结构示意图
2 E-cadherin的功能
E-cadherin对维持细胞形态、细胞运动及粘附功能具有重要作用。Nagafuchi等[4]于1987年用足够长的E-cadherin cDNA转染内源性E-cadherin表达很低的L细胞后,使L细胞获得高表达的E-cadherin,结果转染后的L细胞获得Ca2+依赖的高聚集能力,聚集程度与E-cadherin的蛋白表达呈正相关。同时,表达E-cadherin的细胞形态也发生了变化,L细胞不再形成单层细胞,彼此紧密聚集形成细胞簇,从而提供了E-cadherin具有细胞粘附作用和维持细胞形态功能的直接证据。Hiraho等[5]的免疫组化染色研究发现E-cadherin位于细胞边缘,染色程度与细胞内肌动蛋白束含量一致。有研究显示细胞外环境中低Ca2+水平可引起细胞的离解[8]。1995年Shapiro等[6]曾形象地形容E-cadherin就象是一条由Ca2+介导的拉链将细胞与细胞之间连接起来。
, http://www.100md.com
3 E-cadherin在人类正常组织及肿瘤组织的表达
近年来国外学者研究了E-cadherin在人类正常上皮组织和肿瘤组织中的表达,发现在正常上皮中E-cadherin总是均匀稳定地在细胞边缘区呈强阳性表达,而在大多数肿瘤组织中相对于正常组织显示低表达;不均匀性表达,甚至显示表达缺如,并且表达强度往往随着肿瘤分化程度下降而下降。相似的结果在结肠癌、肝癌、肺癌、乳腺癌、前列腺癌、膀胱癌、胃癌、胰腺癌、卵巢癌、宫颈癌及头颈肿癌等中得以证明。最近还发现在胃癌、卵巢癌、宫颈癌有E-cadherin基因的突变和等位基因的杂合性缺失[3,9,11,12,21~25]。
4 E-cadherin与肿瘤转移
肿瘤转移是一个极为复杂的多步骤过程,大致包括:(1) 肿瘤细胞从原发灶脱落,(2) 侵犯周围组织, (3) 进入循环系统,(4) 逃避免疫监视,(5) 附着于远处的管腔床,(6) 外渗入靶器官组织,(7) 形成继发肿瘤几个过程[7]。从肿瘤转移过程可以看出细胞粘附在癌细胞的侵袭转移过程中有重要作用,首先,癌细胞与原发癌的分离同癌细胞同质粘附的降低有关,癌细胞与肿瘤间质细胞和基质粘附的改变也是有利于肿瘤转移的重要因素。其次,在管腔内同质或异质瘤栓形成,也是粘附的结果。另外,瘤细胞游出管腔过程中,与管腔内皮及其下基底膜的粘附是转移过程的重要步骤[1]。因此E-cadherin与肿瘤侵袭和转移的关系必然成为近年来肿瘤侵袭和转移研究的热点。
, 百拇医药
1991年Chen等[8]用实验证实了E-cadherin可以限制L细胞的侵袭行为。Hashimoto等通过研究转移能力不同的鼠卵巢癌OV2944细胞中E-cadherin的表达,发现在高转移的细胞株中仅有少量E-cadherin的表达,而高表达的E-cadherin则出现在低转移的细胞株中。用小鼠E-cadherin cDNA质粒导入缺失E-cadherin的高侵袭细胞系,高水平稳定表达该cDNA的转染细胞其侵袭性消失[10]。
E-cadherin与肿瘤转移的关系不仅在细胞系中得到证明,近年来在人类肿瘤中亦得到证明。
4.1 结肠癌
1993年Dorudis等[11]用免疫组化和原位杂交的方法检测了112例结肠癌石蜡标本中E-cadherin的表达,发现44例高中分化结肠癌中有36例表达良好,而28例低分化癌中有24例阴性,36例E-cadherin表达阴性和弱阳性或不稳定表达的原发灶有29例伴有淋巴结转移,而36例原发灶阳性者仅3例发生转移,进一步研究32例转移淋巴结有20例E-cadherin阴性,8例肝转移灶中有7例阴性,表明,E-cadherin的表达下降与肿瘤分化程度,发展和转移密切相关。在VanAken等[12]的研究中也得出相似的结果。
, http://www.100md.com
4.2 乳腺癌
Oka等[13]1993年用E-cadherin的单抗采用免疫组化的方法检测了120例乳腺癌,发现在癌旁上皮细胞中。E-cadherin在细胞边缘区呈强阳性表达,120例肿瘤组织中,56例(47%)高表达,64例(53%)表达降低或阴性,表达降低的发生率在侵袭性导管癌(58%,56/97)和低分化癌(18%,21/25)中显著高于无侵袭性和分化较好的乳腺癌。进一步研究发现,在T3、T4期肿瘤中,表达下降率为71%(22/31),而伴有淋巴结转移者为74%(29/39),伴有远处转移者,其发生率为86%(19/22),因此认为E-cadherin的表达下降与乳腺癌转移高度相关,并对预后判断有一定价值。Glukora等[14]的研究也有类似的结论。
4.3 妇科肿瘤
Sakuragi等[15]1994年利用E-cadherin的单抗用免疫组化的方法研究了30例子宫内膜癌,发现E-cadherin表达与肿瘤分化程度正相关,与子宫肌层的侵袭度负相关,7例有盆腔淋巴结转移的肿瘤中6例E-cadherin表达阴性或呈不均匀性表达,而4例同时伴有腹主动脉旁和盆腔淋巴结转移的肿瘤均阴性或不均匀表达,提示E-cadherin的表达与淋巴结转移有关,在卵巢癌中也得到了相似的结果。
, http://www.100md.com
4.4 头颈部肿瘤
Schipper等[17]1997年用免疫荧光和原位杂交方法分析了32例头颈部鳞癌,发现其中12例高分化鳞癌E-cadherin与正常复层上皮相似呈强表达,而15例中分化鳞癌中E-cadherin中度表达或呈不均匀性表达,而5例低分化鳞癌全为阴性表达,进一步研究发现8例有鳞癌浸润的淋巴结中7例E-cadherin阴性,说明E-cadherin的表达与肿瘤分化程度和转移负相关。Mattijssen等[18]1993年用免疫组化方法回顾性研究了50例原发性头颈部鳞癌病人冰冻标本中E-cadherin的表达,追踪30个月,发现29例生存期超过30个月的患者癌细胞的膜着色水平明显高于16个复发及转移者,提示膜的E-cadherin表达在头颈鳞癌患者的预后判断上有重要意义。Schipper等[19]于1994年又用免疫组化法检测了73例上消化道鳞癌与淋巴结转移的关系,认为E-cadherin表达降低与淋巴结转移率升高有关,E-cadherin的丧失足以使分化的无侵袭能力的细胞向低分化侵袭状态转变,提示E-cadherin可做为咽喉鳞癌分化和侵袭的标志物。Brabant等[20]通过Northen杂交和免疫组化法分别检测良性甲状腺病变及癌组织中E-cadherin mRNA和膜表达水平,显示良性病变的mRNA含量高,胞膜区染色强阳性;癌组织中mRNA含量差异大,大多数示弱阳性,转移及复发癌中mRNA含量低,胞浆中存在弱阳性染色,认为癌组织中E-cadherin的弱表达,可能是发生了单基因突变或错译的结果,不稳定的E-cadherin表达可能是高侵袭性的标志。
, 百拇医药
5 结语
总之,绝大多数研究表明,E-cadherin的表达与恶性肿瘤的分化程度、侵袭力、转移负相关与预后正相关,E-cadherin的低表达和不稳定表达可促进转移的发生。E-cadherin与肿瘤转移和预后的关系尚需在多种人类肿瘤中证实,E-cadherin的表达调控机制如何及其表达下降与基因缺失突变的关系等问题尚待继续深入研究。随着对其研究的深入,将有助于我们加深对肿瘤转移的了解,为肿瘤转移及预后的预测和临床治疗提供帮助。
作者简介:张 韬(1969-),男,住院医师,硕士
参考文献:
[1] 高进主编.癌的侵袭与转移.北京:北京医科大学中国协和医科大学联合出版社,1996:3.
[2] Ponta H, Hofmann M & Herrlich P. Recent advances in the genetics of metastasis. Eur J Cancer, 1994,30A(13):1995.
, http://www.100md.com
[3] Mareel M, Bracke M & VanRoy F. Cancer metastasis: negative regulation by an invasion-suppressor complex. Cancer Detect Prev, 1995,19(5):451.
[4] Nagufuchi A, Shirayoshi Y, Okazaki K, et al. Transformation of cell adhesion properties by exogenously introduced E-cadherindherin cDNA. Nature, 1987, 329(6137):341.
[5] Hirano S, Akinao N, Kohei H, et al. Calcium-dependent cell-cell adhesion molecules (cadherins): subclass specificities and possible involvement of actin bundles. J Cell Biol, 1987,105(6):2501.
, 百拇医药
[6] Shapiro L, Fannon AM, Kwong PD, et al. Structural basis of cell-cell adhesion by cadherins. Nature, 1995,374(6520):327.
[7] Nakayama H, Yasui W, Yokozaki H, et al. Reduce expression of nm23 is associated with metastasis. Jpn J Cancer Res, 1993,84(2):184.
[8] Chen WC & Obrink C. Cell-cell contacts mediated by E-cadherin (uvomourulin) restrict invasive behavior of L-cells. J Cell Biol, 1991,114(2);319.
, http://www.100md.com
[9] Shiozaki H, Tahara H, Oka H, et al. Expression of immunoreactive E-cadherin adhesion molecules in human cancer. Am J pathol, 1991,139(1):17.
[10] Vleminckx K, VaKaet LJr, Mareel M, et al. Genetic manipulation of E-cadherin expression by epithelial tumor cell an invasion suppressor role. Cell, 1991,145(1);66:107.
[11] Dorudi S, Sheffield JP, PoulsomR, et al. E-cadherin expression in colurectal cancer. An immunocytochemical and in situ hybridization study. Am J Pathol, 1993,142(4);981.
, 百拇医药
[12] Van Aken J, Cavelier CA, De Werer N, et al. Immunohistochemicalanalysis of E-cadherin expression in human colorectal tumor. Pathol Res Pract, 1993, 189(9):957.
[13] Oka H, Shiozaki H, Kobayashi K, et al. Expression of E-cadherin cell adhesion molecules in human breast cancer tissues and its relationship to metastasis. Cancer Res, 1993,53(7):1696.
[14] Glukhova M, Koteliansky V, Sastre X, et al. Adhesion systems in normal breast and in invasive breast carcinoma. Am J Pathol, 1995,146(3):706.
, 百拇医药
[15] Sakuragi N, Nishiya M, Ikeda K, et al. Decreased E-cadherin expression in endometrialcarcinoma is associated with tumor differentiation and deep myometrial invasion. Gynecol Oncol, 1994,53(2):183.
[16] Veatch AL, Carson LF & Ramakrishnan S. Diffferential expression of cell-cell adhesion molecule E-cadherin in ascites and solid human ovarian tumor cells. Int J Cancer,1994,58(3):393.
[17] Schipper JH, Frixen UH, Behrens J, et al. E-cadherin expression in squamous cell carcinomas of head and neck: inverse correlation with tumor differentiation and lymph node metastasis. Cancer Res, 1991,51(23):6328.
, 百拇医药
[18] Mattijissen V, Peters HM, Schalkwijk L, et al. E-cadherin expression in head and neck squamous cell carcinoma is associated with clinical outcome. Int J Cancer, 1993,55(4):5804i.
[19] Schiper JH, Unger A & Jahnke K. E-cadherin as a functional marker of the differentiation and invasiveness of squamous cell carcinoma of the head and neck. Clin Otolaryngol, 1994,19(5):381.
[20] Brabant G, Hoang-Vu C, Cetin Y, et al. E-cadherin: a differentiation marker in thyroid malignancies. Cancer Res, 1993,53(20):4987.
, 百拇医药
[21] Dogan A. Wang ZD & spencer J. E-cadherin expression in intestinal epithelium. J Clin Pathol, 1995,48(2):143.
[22] Slagle BL, Zhou YZ, Birchmerier W, et al. Deletion of the E-cadherin gene in hepatitis B virus-positive Chinese hepatocellular carinomas. Hepatology, 1993,18(4):757.
[23] Bongiorno PF, al-kasspooles M, Lee SW, et al. E-cadherin expression in primary and metastatic thoracic neoplasms and in Barrett's oesophagus. Br J Cancer, 1995,71(1):166.
, 百拇医药
[24] Moll R, Mites M, friction UGH, et al. Differential loss of E-cadherin expression in infiltrating ductal and lobular breast carcinomas. Am J pathol, 1993,143(6):1731.
[25] Jiang WG. E-cadherin and its associated protein, catenins, cancer invasion and metastasis. Br J Surg, 1996,83(4):437.
收稿日期:1998-10-29, 百拇医药
单位:中国医学科学院中国协和医科大学北京协和医院口腔科(100730)
关键词:
E 赖钦声, 毛 驰 审校
中图分类号:R739.8
文献标识码:A
文章编号:1005-4979(1999)03-225-03
E-CADHERIN AND TUMOR METASTASIS
细胞粘附可分为细胞—细胞粘附和细胞—基质粘附两大类。前者又可根据参与细胞的类型分为同质粘附(homotypic adhesion)和异质粘附(heterotypic adhesion)。同一种类型细胞间的粘附称同质粘附,两种以上细胞间的粘附称异质粘附[1]。经过多年的研究已分离鉴定出四类与肿瘤转移有关的细胞粘附分子(cell adhesion molecules, CAM),它们是整合蛋白、免疫球蛋白超家族分子、钙粘附蛋白和选择素[2]。
, http://www.100md.com
钙粘附蛋白(cadherin)是一类主要介导细胞间同质粘附的钙依赖性跨膜糖蛋白。主要分为分布于上皮组织中的E-cadherin (epithelia cadherin,也称L-CAM)。分布于神经和肌肉组织中的N-cadherin和分布于胎盘组织中的P-cadherin三类。此外还发现了一些新的cadherin分子,如在内皮细胞表达的V-cadherin,在视网膜细胞表达的R-cadherin,在脑组织表达的B-cadherin。E-chaherin是研究较多的同质粘附分子。近年来已成为肿瘤细胞侵袭和转移研究的热点之一[1]。
1 E-cadherin的结构
人类的E-cadherin编码基因定位于16号染色体q22.1附近,由723~748个氨基酸组成,分子量为80~124kD,分子中存在一个疏水基因,位于跨膜区,氨基末端位于细胞膜外,是钙离子的结合位点,对Ca2+有高度敏感性,羟基末端位于细胞浆内,与肌动蛋白相连,由α、β、γ三个亚单位(catenins)及其它一些连接蛋白组成,对维持细胞形态和调节细胞粘附具有重要作用[3]。如附图示。

, 百拇医药
附图 E-cadherin结构示意图
2 E-cadherin的功能
E-cadherin对维持细胞形态、细胞运动及粘附功能具有重要作用。Nagafuchi等[4]于1987年用足够长的E-cadherin cDNA转染内源性E-cadherin表达很低的L细胞后,使L细胞获得高表达的E-cadherin,结果转染后的L细胞获得Ca2+依赖的高聚集能力,聚集程度与E-cadherin的蛋白表达呈正相关。同时,表达E-cadherin的细胞形态也发生了变化,L细胞不再形成单层细胞,彼此紧密聚集形成细胞簇,从而提供了E-cadherin具有细胞粘附作用和维持细胞形态功能的直接证据。Hiraho等[5]的免疫组化染色研究发现E-cadherin位于细胞边缘,染色程度与细胞内肌动蛋白束含量一致。有研究显示细胞外环境中低Ca2+水平可引起细胞的离解[8]。1995年Shapiro等[6]曾形象地形容E-cadherin就象是一条由Ca2+介导的拉链将细胞与细胞之间连接起来。
, http://www.100md.com
3 E-cadherin在人类正常组织及肿瘤组织的表达
近年来国外学者研究了E-cadherin在人类正常上皮组织和肿瘤组织中的表达,发现在正常上皮中E-cadherin总是均匀稳定地在细胞边缘区呈强阳性表达,而在大多数肿瘤组织中相对于正常组织显示低表达;不均匀性表达,甚至显示表达缺如,并且表达强度往往随着肿瘤分化程度下降而下降。相似的结果在结肠癌、肝癌、肺癌、乳腺癌、前列腺癌、膀胱癌、胃癌、胰腺癌、卵巢癌、宫颈癌及头颈肿癌等中得以证明。最近还发现在胃癌、卵巢癌、宫颈癌有E-cadherin基因的突变和等位基因的杂合性缺失[3,9,11,12,21~25]。
4 E-cadherin与肿瘤转移
肿瘤转移是一个极为复杂的多步骤过程,大致包括:(1) 肿瘤细胞从原发灶脱落,(2) 侵犯周围组织, (3) 进入循环系统,(4) 逃避免疫监视,(5) 附着于远处的管腔床,(6) 外渗入靶器官组织,(7) 形成继发肿瘤几个过程[7]。从肿瘤转移过程可以看出细胞粘附在癌细胞的侵袭转移过程中有重要作用,首先,癌细胞与原发癌的分离同癌细胞同质粘附的降低有关,癌细胞与肿瘤间质细胞和基质粘附的改变也是有利于肿瘤转移的重要因素。其次,在管腔内同质或异质瘤栓形成,也是粘附的结果。另外,瘤细胞游出管腔过程中,与管腔内皮及其下基底膜的粘附是转移过程的重要步骤[1]。因此E-cadherin与肿瘤侵袭和转移的关系必然成为近年来肿瘤侵袭和转移研究的热点。
, 百拇医药
1991年Chen等[8]用实验证实了E-cadherin可以限制L细胞的侵袭行为。Hashimoto等通过研究转移能力不同的鼠卵巢癌OV2944细胞中E-cadherin的表达,发现在高转移的细胞株中仅有少量E-cadherin的表达,而高表达的E-cadherin则出现在低转移的细胞株中。用小鼠E-cadherin cDNA质粒导入缺失E-cadherin的高侵袭细胞系,高水平稳定表达该cDNA的转染细胞其侵袭性消失[10]。
E-cadherin与肿瘤转移的关系不仅在细胞系中得到证明,近年来在人类肿瘤中亦得到证明。
4.1 结肠癌
1993年Dorudis等[11]用免疫组化和原位杂交的方法检测了112例结肠癌石蜡标本中E-cadherin的表达,发现44例高中分化结肠癌中有36例表达良好,而28例低分化癌中有24例阴性,36例E-cadherin表达阴性和弱阳性或不稳定表达的原发灶有29例伴有淋巴结转移,而36例原发灶阳性者仅3例发生转移,进一步研究32例转移淋巴结有20例E-cadherin阴性,8例肝转移灶中有7例阴性,表明,E-cadherin的表达下降与肿瘤分化程度,发展和转移密切相关。在VanAken等[12]的研究中也得出相似的结果。
, http://www.100md.com
4.2 乳腺癌
Oka等[13]1993年用E-cadherin的单抗采用免疫组化的方法检测了120例乳腺癌,发现在癌旁上皮细胞中。E-cadherin在细胞边缘区呈强阳性表达,120例肿瘤组织中,56例(47%)高表达,64例(53%)表达降低或阴性,表达降低的发生率在侵袭性导管癌(58%,56/97)和低分化癌(18%,21/25)中显著高于无侵袭性和分化较好的乳腺癌。进一步研究发现,在T3、T4期肿瘤中,表达下降率为71%(22/31),而伴有淋巴结转移者为74%(29/39),伴有远处转移者,其发生率为86%(19/22),因此认为E-cadherin的表达下降与乳腺癌转移高度相关,并对预后判断有一定价值。Glukora等[14]的研究也有类似的结论。
4.3 妇科肿瘤
Sakuragi等[15]1994年利用E-cadherin的单抗用免疫组化的方法研究了30例子宫内膜癌,发现E-cadherin表达与肿瘤分化程度正相关,与子宫肌层的侵袭度负相关,7例有盆腔淋巴结转移的肿瘤中6例E-cadherin表达阴性或呈不均匀性表达,而4例同时伴有腹主动脉旁和盆腔淋巴结转移的肿瘤均阴性或不均匀表达,提示E-cadherin的表达与淋巴结转移有关,在卵巢癌中也得到了相似的结果。
, http://www.100md.com
4.4 头颈部肿瘤
Schipper等[17]1997年用免疫荧光和原位杂交方法分析了32例头颈部鳞癌,发现其中12例高分化鳞癌E-cadherin与正常复层上皮相似呈强表达,而15例中分化鳞癌中E-cadherin中度表达或呈不均匀性表达,而5例低分化鳞癌全为阴性表达,进一步研究发现8例有鳞癌浸润的淋巴结中7例E-cadherin阴性,说明E-cadherin的表达与肿瘤分化程度和转移负相关。Mattijssen等[18]1993年用免疫组化方法回顾性研究了50例原发性头颈部鳞癌病人冰冻标本中E-cadherin的表达,追踪30个月,发现29例生存期超过30个月的患者癌细胞的膜着色水平明显高于16个复发及转移者,提示膜的E-cadherin表达在头颈鳞癌患者的预后判断上有重要意义。Schipper等[19]于1994年又用免疫组化法检测了73例上消化道鳞癌与淋巴结转移的关系,认为E-cadherin表达降低与淋巴结转移率升高有关,E-cadherin的丧失足以使分化的无侵袭能力的细胞向低分化侵袭状态转变,提示E-cadherin可做为咽喉鳞癌分化和侵袭的标志物。Brabant等[20]通过Northen杂交和免疫组化法分别检测良性甲状腺病变及癌组织中E-cadherin mRNA和膜表达水平,显示良性病变的mRNA含量高,胞膜区染色强阳性;癌组织中mRNA含量差异大,大多数示弱阳性,转移及复发癌中mRNA含量低,胞浆中存在弱阳性染色,认为癌组织中E-cadherin的弱表达,可能是发生了单基因突变或错译的结果,不稳定的E-cadherin表达可能是高侵袭性的标志。
, 百拇医药
5 结语
总之,绝大多数研究表明,E-cadherin的表达与恶性肿瘤的分化程度、侵袭力、转移负相关与预后正相关,E-cadherin的低表达和不稳定表达可促进转移的发生。E-cadherin与肿瘤转移和预后的关系尚需在多种人类肿瘤中证实,E-cadherin的表达调控机制如何及其表达下降与基因缺失突变的关系等问题尚待继续深入研究。随着对其研究的深入,将有助于我们加深对肿瘤转移的了解,为肿瘤转移及预后的预测和临床治疗提供帮助。
作者简介:张 韬(1969-),男,住院医师,硕士
参考文献:
[1] 高进主编.癌的侵袭与转移.北京:北京医科大学中国协和医科大学联合出版社,1996:3.
[2] Ponta H, Hofmann M & Herrlich P. Recent advances in the genetics of metastasis. Eur J Cancer, 1994,30A(13):1995.
, http://www.100md.com
[3] Mareel M, Bracke M & VanRoy F. Cancer metastasis: negative regulation by an invasion-suppressor complex. Cancer Detect Prev, 1995,19(5):451.
[4] Nagufuchi A, Shirayoshi Y, Okazaki K, et al. Transformation of cell adhesion properties by exogenously introduced E-cadherindherin cDNA. Nature, 1987, 329(6137):341.
[5] Hirano S, Akinao N, Kohei H, et al. Calcium-dependent cell-cell adhesion molecules (cadherins): subclass specificities and possible involvement of actin bundles. J Cell Biol, 1987,105(6):2501.
, 百拇医药
[6] Shapiro L, Fannon AM, Kwong PD, et al. Structural basis of cell-cell adhesion by cadherins. Nature, 1995,374(6520):327.
[7] Nakayama H, Yasui W, Yokozaki H, et al. Reduce expression of nm23 is associated with metastasis. Jpn J Cancer Res, 1993,84(2):184.
[8] Chen WC & Obrink C. Cell-cell contacts mediated by E-cadherin (uvomourulin) restrict invasive behavior of L-cells. J Cell Biol, 1991,114(2);319.
, http://www.100md.com
[9] Shiozaki H, Tahara H, Oka H, et al. Expression of immunoreactive E-cadherin adhesion molecules in human cancer. Am J pathol, 1991,139(1):17.
[10] Vleminckx K, VaKaet LJr, Mareel M, et al. Genetic manipulation of E-cadherin expression by epithelial tumor cell an invasion suppressor role. Cell, 1991,145(1);66:107.
[11] Dorudi S, Sheffield JP, PoulsomR, et al. E-cadherin expression in colurectal cancer. An immunocytochemical and in situ hybridization study. Am J Pathol, 1993,142(4);981.
, 百拇医药
[12] Van Aken J, Cavelier CA, De Werer N, et al. Immunohistochemicalanalysis of E-cadherin expression in human colorectal tumor. Pathol Res Pract, 1993, 189(9):957.
[13] Oka H, Shiozaki H, Kobayashi K, et al. Expression of E-cadherin cell adhesion molecules in human breast cancer tissues and its relationship to metastasis. Cancer Res, 1993,53(7):1696.
[14] Glukhova M, Koteliansky V, Sastre X, et al. Adhesion systems in normal breast and in invasive breast carcinoma. Am J Pathol, 1995,146(3):706.
, 百拇医药
[15] Sakuragi N, Nishiya M, Ikeda K, et al. Decreased E-cadherin expression in endometrialcarcinoma is associated with tumor differentiation and deep myometrial invasion. Gynecol Oncol, 1994,53(2):183.
[16] Veatch AL, Carson LF & Ramakrishnan S. Diffferential expression of cell-cell adhesion molecule E-cadherin in ascites and solid human ovarian tumor cells. Int J Cancer,1994,58(3):393.
[17] Schipper JH, Frixen UH, Behrens J, et al. E-cadherin expression in squamous cell carcinomas of head and neck: inverse correlation with tumor differentiation and lymph node metastasis. Cancer Res, 1991,51(23):6328.
, 百拇医药
[18] Mattijissen V, Peters HM, Schalkwijk L, et al. E-cadherin expression in head and neck squamous cell carcinoma is associated with clinical outcome. Int J Cancer, 1993,55(4):5804i.
[19] Schiper JH, Unger A & Jahnke K. E-cadherin as a functional marker of the differentiation and invasiveness of squamous cell carcinoma of the head and neck. Clin Otolaryngol, 1994,19(5):381.
[20] Brabant G, Hoang-Vu C, Cetin Y, et al. E-cadherin: a differentiation marker in thyroid malignancies. Cancer Res, 1993,53(20):4987.
, 百拇医药
[21] Dogan A. Wang ZD & spencer J. E-cadherin expression in intestinal epithelium. J Clin Pathol, 1995,48(2):143.
[22] Slagle BL, Zhou YZ, Birchmerier W, et al. Deletion of the E-cadherin gene in hepatitis B virus-positive Chinese hepatocellular carinomas. Hepatology, 1993,18(4):757.
[23] Bongiorno PF, al-kasspooles M, Lee SW, et al. E-cadherin expression in primary and metastatic thoracic neoplasms and in Barrett's oesophagus. Br J Cancer, 1995,71(1):166.
, 百拇医药
[24] Moll R, Mites M, friction UGH, et al. Differential loss of E-cadherin expression in infiltrating ductal and lobular breast carcinomas. Am J pathol, 1993,143(6):1731.
[25] Jiang WG. E-cadherin and its associated protein, catenins, cancer invasion and metastasis. Br J Surg, 1996,83(4):437.
收稿日期:1998-10-29, 百拇医药