牙齿发育中神经生长因子及其受体表达的免疫组化研究
作者:王捍国 肖明振 刘 军
单位:第四军医大学口腔医学院,陕西 西安 710032
关键词:神经生长因子;受体;牙齿发育;免疫组织化学
牙体牙髓牙周病学杂志990203 摘要 目的:探讨神经生长因子在牙齿发育中的作用。方法:制备人牙齿发育各阶段标本,进行神经生长因子及其受体的免疫组化研究。结果:两者在牙齿发育中有各自的时空表达。结论:神经生长因子不仅参与牙齿神经支配的建立,而且调控细胞的增殖分化和牙胚的发育。
中图号:R780.2 文献标识码:A 文章编号:1005-2593(1999)02-0099-03
[牙体牙髓牙周病学杂志,1999,9(2):99]
Immunohistochemical localization of nerve growth factor
, 百拇医药
and its receptor in human developing teeth
Wang Hanguo, Xiao Mingzhen, Liu Jun
School of Stomatology, The Fourth Military Medical University, Xi'an 710032
Abstract Aim: To study the functions of nerve growth factor in human developing teeth. Methods: After preparing specimens of every stage of human developing teeth, immunohistochemical staining of nerve growth factor and its receptor was carried on. Results: Each had its own temporol-spatial distribution during tooth development. Conclusions: Nerve growth factor not only participates the establishment of the dental innervation, but also modulates the proliferation and differentiation of developing epithelial and mesenchymal cells, and the development of the dental germ.
, 百拇医药
Key words nerve growth factor; receptor; tooth development; immunohistochemistry
[Chinese Journal of Conservative Dentistry, 1999,9(2):99]
牙齿发育是多因素参与的上皮与间充质间有序的相互作用的复杂过程。越来越多的证据表明:神经生长因子(nerve growth factor, NGF)作为一种多功能生长因子,是牙齿发育多因素网络调节的重要组成部分。目前,此类研究取材多限于大、小鼠牙胚,本实验采用免疫组化的方法研究NGF及其低亲和力受体(low-affinity p75 nerve growth factor receptor,NGFR)在人牙齿各发育阶段中的表达,以进一步明确NGF在牙齿发育中的作用。
1 材料和方法
, http://www.100md.com
1.1 标本制备
8例合法引产正常胎儿,头臀长(crown-rump length,CRL)为15~40cm,相应胎龄4~8个月。截取上下颌骨,40g/L多聚甲醛固定24h,EDTA脱钙液脱钙4周,脱水透明。以上过程均在4℃下进行。石蜡包埋,作4μm连续切片。同时收集因正畸或阻生而拔除的年轻恒牙(根尖孔敞开呈喇叭状)和成熟恒牙(根尖孔形成),按以上方法处理。
1.2 免疫组化染色
使用美国ZYMED公司SP试剂盒,按其步骤进行免疫组化染色。石蜡切片脱蜡至水,30ml/L 过氧化氢液室温孵育10min以消除内源性过氧化物酶活性,浸入柠檬酸盐缓冲液内进行微波抗原修复,100ml/L正常山羊血清室温孵育10min,倾去血清,滴加1 :50稀释的NGF、NGFR抗体(Santa Cruz Biotechnology,Inc. 进口,武汉伯士德公司提供),4℃过夜。37℃复温1h,滴加1:100稀释的生物素标记二抗,37℃孵育30min,最后滴加1 :100稀释的辣根酶标记链霉卵白素,37℃孵育30min。以上每一步骤后PBS缓冲液振洗3次,每次5min。滴加新鲜配制的DAB-H2O2液显色,苏木素复染,脱水透明封片。
, 百拇医药
1.3 结果判断
NGF为胞浆内抗原,其阳性表达细胞胞浆内可见明显棕黄色颗粒。
NGFR表达于细胞膜上,其阳性表达细胞胞膜呈棕黄色。
2 结果
蕾状期:NGF、NGFR在牙板和成釉器为弱阳性表达,在邻近间充质细胞为阴性表达(图 1、2)。
图1 NGF在蕾状期和硬组织形成期牙胚的表达 ×40
图2 NGFR在蕾状期和硬组织形成期牙胚的表达 ×40
, 百拇医药
帽状期:NGF在成釉器上皮(即内、外釉上皮和星网层细胞)和牙囊呈阳性表达,牙乳头阴性;NGFR仅有内釉上皮和牙囊呈阳性表达,余均为阴性(图3)。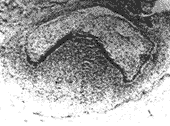
图3 NGFR在帽状期牙胚的表达 ×100
钟状早期:内釉上皮、中间层细胞呈NGF阳性,牙乳头细胞和牙囊呈弱阳性,外釉上皮、星网层为阴性; NGFR表达模式同帽状期(图4、5)。
图4 NGF在钟状早期牙胚的表达 ×40
图5 NGFR在钟状早期牙胚的表达 ×100
, http://www.100md.com
钟状晚期(硬组织形成期):成釉细胞呈NGF阳性,NGFR阴性,成牙本质细胞两者均为阳性,其它细胞呈阴性(图1、2)。
无论年轻恒牙还是成熟恒牙,成牙本质细胞和牙髓成纤维细胞均不表达NGF和NGFR(图6)。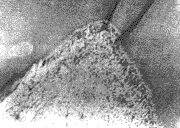
图6 NGF、NGFR在恒牙的表达 ×100
3 讨论
牙齿的发育包括发育的起始、细胞分化和形态形成三个阶段,此过程主要受上皮和外胚间充质细胞间有序的相互作用的调控。目前,有关此调控的分子机制尚未十分明确,但可以肯定的是许多生物分子参与具体调控过程,如生长因子、转录因子、细胞膜表面成分和细胞外基质等。
NGF作为神经营养因子(neurotrophin factors,NTFs)家族最先发现的成员,对神经系统的生物学效应是促进外周感觉和交感神经元及中枢胆碱能神经元的存活并诱导神经元的分化和成熟及维持其生理功能[1] 。NTFs家族受体分高亲和力和低亲和力两类,前者由酪氨酸激酶原癌基因家族编码的产物组成,其中TrkA与NGF特异性结合,而低亲和力受体gp75NTFR( 通常称作NGFR)可与所受NTFs结合[2]。近来有学者发现NGF及其受体NGFR、TrkA在胚胎性组织和器官中表达,揭示其在非神经细胞的分化和器官的形态发生过程中具有一定作用。原位杂交实验表明大鼠牙胚发育过程中未见TrkA表达[3],故本实验仅研究人牙胚发育过程中NGF和NGFR的时空表达。
, http://www.100md.com
本研究发现NGF和NGFR在蕾状期均为阴性表达,NGF首先出现在帽状期成釉器各层上皮及牙板,钟状期牙囊亦表达,硬组织形成期则仅有成釉细胞和年轻成牙本质细胞呈阳性。而NGFR的表达并不完全与之相应,它首先出现于帽状期内釉上皮,钟状期极化的前成釉细胞表达明显减弱,分泌基质后分化为成釉细胞则为阴性。NGFR在牙囊内帽状期及钟状期均为阳性,在间充质则一直为阴性。在年轻及成熟恒牙中两者均不表达。
作为经典的神经营养因子,NGF参与了牙齿发育中神经支配的建立过程。本实验和以前的研究都发现NGF及NGFR在牙乳头和牙囊内的时空分布与牙齿发育的神经支配的建立过程一致,牙胚内产生的NGF作为趋化因子,可以诱导三叉神经干轴突生长至牙齿,并在神经细胞凋亡过程中维持相应神经元的存活[3]。
同时,NGF是一种多功能生长因子,可通过其相应的受体以自分泌或(和)旁分泌的方式在牙胚发育中起到重要作用。本实验发现的NGFR在内釉上皮的表达过程同以前研究中增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)一致,而PCNA是分裂活性细胞的标志物,处于G1、S和G2-M期的细胞表达PCNA[4]。这就说明NGF通过NGFR可诱导内釉上皮细胞增殖。细胞培养发现,NGF可促进人牙乳头细胞DNA合成,增加细胞内碱性磷酸酶(ALP)活性及其分泌,并可诱导牙乳头细胞内成牙本质细胞特异性标志物牙本质涎蛋白mRNA的表达,所有这些都证实NGF可以促进牙乳头间充质细胞的增殖和分化[5]。
, http://www.100md.com
值得注意的是:牙胚发育中并未见TrkA表达,故NGF在牙胚中所有的生物学效应是通过NGFR实现的。曾有学者认为NGFR需与TrkA同时表达且结合后才能够介导NGF的生物学效应。 但近来研究表明在无TrkA的情况下,NGFR仍具有生物学活性。Rabizadeh S等[6]发现仅表达NGFR的神经细胞在培养基无血清的情况下可发生凋亡,当有抗体或配体与NGFR结合时则凋亡被抑制。因此,表达NGFR的细胞为NGF依赖性。牙乳头间充质细胞来源于神经嵴,NGF和NGFR很可能参于其细胞凋亡过程。关于NGF与NGFR结合后的细胞内信号转导机制主要有以下两种解释:两者结合后,活化鞘磷酯酶,而此酶水解鞘磷酯产生脂质第二信使酰基神经鞘氨醇,诱导产生的转录因子NF-kB与胞核DNA特异序列结合后,可以调节细胞外基质、胞膜表面分子等基因的表达,产生生物学效应[7]。 而Represa J等[8]发现在耳蜗前庭神经节内,NGF与NGFR结合可激活细胞内糖基磷酯酰氨醇/肌醇-磷酸烯糖(phosphoglycan)(glycosyl-ptd Ins/IPG)信号转导系统,促使细胞分化。
, 百拇医药
总之,NGF在牙齿发育中不仅参与神经支配的建立过程,而且调控细胞的增殖分化和牙胚发育。
参考文献
1 Levi-Montalcini R. The never growth factor 35 years later. Science,1987,237(4819):1154
2 Klein R, Jing SQ, Nanduri V et al. The trk proro-oncogene encodes a receptor for nerve growth factor. Cell, 1991,65(1):189
3 Luukko K. Neuronal cells and neurotrophins in odontogenesis. Eur J Oral Sci, 1998,106(supple 1):80
, 百拇医药
4 Casasco A. Application of immunocytochemistry for detection of proliferating cell populations during tooth development. Anat Rec,1996,245(2):162
5 刘军. 神经生长因子和神经肽对牙乳头间充质细胞和牙胚生长、分化影响的体外实验研究:〔学位论文〕. 西安:第四军医大学口腔医学院,1998
6 Rabizadeh S, Oh J, Zh 6ong LT et al. Induction of apoptosis by the low-affinity NGF receptor. Science,1993,261(5119):345
7 Carter BD, Kaltschmidt C, Kaltschmidt B et al. Selective activation of NF-kB by nerve growth factor through the neurotrophin receptor p75. Science,1996,272(5261):542
8 Represa J, Avila MA, Minor C et al. Glycosyl-phosphatidylinositol /inositol phosphoglycan: a signaling system for the low-affinity nerve growth factor receptor. Proc Natl Acad Sci USA, 1991,88(18):8016
收稿日期:1998-10-12, 百拇医药
单位:第四军医大学口腔医学院,陕西 西安 710032
关键词:神经生长因子;受体;牙齿发育;免疫组织化学
牙体牙髓牙周病学杂志990203 摘要 目的:探讨神经生长因子在牙齿发育中的作用。方法:制备人牙齿发育各阶段标本,进行神经生长因子及其受体的免疫组化研究。结果:两者在牙齿发育中有各自的时空表达。结论:神经生长因子不仅参与牙齿神经支配的建立,而且调控细胞的增殖分化和牙胚的发育。
中图号:R780.2 文献标识码:A 文章编号:1005-2593(1999)02-0099-03
[牙体牙髓牙周病学杂志,1999,9(2):99]
Immunohistochemical localization of nerve growth factor
, 百拇医药
and its receptor in human developing teeth
Wang Hanguo, Xiao Mingzhen, Liu Jun
School of Stomatology, The Fourth Military Medical University, Xi'an 710032
Abstract Aim: To study the functions of nerve growth factor in human developing teeth. Methods: After preparing specimens of every stage of human developing teeth, immunohistochemical staining of nerve growth factor and its receptor was carried on. Results: Each had its own temporol-spatial distribution during tooth development. Conclusions: Nerve growth factor not only participates the establishment of the dental innervation, but also modulates the proliferation and differentiation of developing epithelial and mesenchymal cells, and the development of the dental germ.
, 百拇医药
Key words nerve growth factor; receptor; tooth development; immunohistochemistry
[Chinese Journal of Conservative Dentistry, 1999,9(2):99]
牙齿发育是多因素参与的上皮与间充质间有序的相互作用的复杂过程。越来越多的证据表明:神经生长因子(nerve growth factor, NGF)作为一种多功能生长因子,是牙齿发育多因素网络调节的重要组成部分。目前,此类研究取材多限于大、小鼠牙胚,本实验采用免疫组化的方法研究NGF及其低亲和力受体(low-affinity p75 nerve growth factor receptor,NGFR)在人牙齿各发育阶段中的表达,以进一步明确NGF在牙齿发育中的作用。
1 材料和方法
, http://www.100md.com
1.1 标本制备
8例合法引产正常胎儿,头臀长(crown-rump length,CRL)为15~40cm,相应胎龄4~8个月。截取上下颌骨,40g/L多聚甲醛固定24h,EDTA脱钙液脱钙4周,脱水透明。以上过程均在4℃下进行。石蜡包埋,作4μm连续切片。同时收集因正畸或阻生而拔除的年轻恒牙(根尖孔敞开呈喇叭状)和成熟恒牙(根尖孔形成),按以上方法处理。
1.2 免疫组化染色
使用美国ZYMED公司SP试剂盒,按其步骤进行免疫组化染色。石蜡切片脱蜡至水,30ml/L 过氧化氢液室温孵育10min以消除内源性过氧化物酶活性,浸入柠檬酸盐缓冲液内进行微波抗原修复,100ml/L正常山羊血清室温孵育10min,倾去血清,滴加1 :50稀释的NGF、NGFR抗体(Santa Cruz Biotechnology,Inc. 进口,武汉伯士德公司提供),4℃过夜。37℃复温1h,滴加1:100稀释的生物素标记二抗,37℃孵育30min,最后滴加1 :100稀释的辣根酶标记链霉卵白素,37℃孵育30min。以上每一步骤后PBS缓冲液振洗3次,每次5min。滴加新鲜配制的DAB-H2O2液显色,苏木素复染,脱水透明封片。
, 百拇医药
1.3 结果判断
NGF为胞浆内抗原,其阳性表达细胞胞浆内可见明显棕黄色颗粒。
NGFR表达于细胞膜上,其阳性表达细胞胞膜呈棕黄色。
2 结果
蕾状期:NGF、NGFR在牙板和成釉器为弱阳性表达,在邻近间充质细胞为阴性表达(图 1、2)。

图1 NGF在蕾状期和硬组织形成期牙胚的表达 ×40

图2 NGFR在蕾状期和硬组织形成期牙胚的表达 ×40
, 百拇医药
帽状期:NGF在成釉器上皮(即内、外釉上皮和星网层细胞)和牙囊呈阳性表达,牙乳头阴性;NGFR仅有内釉上皮和牙囊呈阳性表达,余均为阴性(图3)。

图3 NGFR在帽状期牙胚的表达 ×100
钟状早期:内釉上皮、中间层细胞呈NGF阳性,牙乳头细胞和牙囊呈弱阳性,外釉上皮、星网层为阴性; NGFR表达模式同帽状期(图4、5)。

图4 NGF在钟状早期牙胚的表达 ×40

图5 NGFR在钟状早期牙胚的表达 ×100
, http://www.100md.com
钟状晚期(硬组织形成期):成釉细胞呈NGF阳性,NGFR阴性,成牙本质细胞两者均为阳性,其它细胞呈阴性(图1、2)。
无论年轻恒牙还是成熟恒牙,成牙本质细胞和牙髓成纤维细胞均不表达NGF和NGFR(图6)。

图6 NGF、NGFR在恒牙的表达 ×100
3 讨论
牙齿的发育包括发育的起始、细胞分化和形态形成三个阶段,此过程主要受上皮和外胚间充质细胞间有序的相互作用的调控。目前,有关此调控的分子机制尚未十分明确,但可以肯定的是许多生物分子参与具体调控过程,如生长因子、转录因子、细胞膜表面成分和细胞外基质等。
NGF作为神经营养因子(neurotrophin factors,NTFs)家族最先发现的成员,对神经系统的生物学效应是促进外周感觉和交感神经元及中枢胆碱能神经元的存活并诱导神经元的分化和成熟及维持其生理功能[1] 。NTFs家族受体分高亲和力和低亲和力两类,前者由酪氨酸激酶原癌基因家族编码的产物组成,其中TrkA与NGF特异性结合,而低亲和力受体gp75NTFR( 通常称作NGFR)可与所受NTFs结合[2]。近来有学者发现NGF及其受体NGFR、TrkA在胚胎性组织和器官中表达,揭示其在非神经细胞的分化和器官的形态发生过程中具有一定作用。原位杂交实验表明大鼠牙胚发育过程中未见TrkA表达[3],故本实验仅研究人牙胚发育过程中NGF和NGFR的时空表达。
, http://www.100md.com
本研究发现NGF和NGFR在蕾状期均为阴性表达,NGF首先出现在帽状期成釉器各层上皮及牙板,钟状期牙囊亦表达,硬组织形成期则仅有成釉细胞和年轻成牙本质细胞呈阳性。而NGFR的表达并不完全与之相应,它首先出现于帽状期内釉上皮,钟状期极化的前成釉细胞表达明显减弱,分泌基质后分化为成釉细胞则为阴性。NGFR在牙囊内帽状期及钟状期均为阳性,在间充质则一直为阴性。在年轻及成熟恒牙中两者均不表达。
作为经典的神经营养因子,NGF参与了牙齿发育中神经支配的建立过程。本实验和以前的研究都发现NGF及NGFR在牙乳头和牙囊内的时空分布与牙齿发育的神经支配的建立过程一致,牙胚内产生的NGF作为趋化因子,可以诱导三叉神经干轴突生长至牙齿,并在神经细胞凋亡过程中维持相应神经元的存活[3]。
同时,NGF是一种多功能生长因子,可通过其相应的受体以自分泌或(和)旁分泌的方式在牙胚发育中起到重要作用。本实验发现的NGFR在内釉上皮的表达过程同以前研究中增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)一致,而PCNA是分裂活性细胞的标志物,处于G1、S和G2-M期的细胞表达PCNA[4]。这就说明NGF通过NGFR可诱导内釉上皮细胞增殖。细胞培养发现,NGF可促进人牙乳头细胞DNA合成,增加细胞内碱性磷酸酶(ALP)活性及其分泌,并可诱导牙乳头细胞内成牙本质细胞特异性标志物牙本质涎蛋白mRNA的表达,所有这些都证实NGF可以促进牙乳头间充质细胞的增殖和分化[5]。
, http://www.100md.com
值得注意的是:牙胚发育中并未见TrkA表达,故NGF在牙胚中所有的生物学效应是通过NGFR实现的。曾有学者认为NGFR需与TrkA同时表达且结合后才能够介导NGF的生物学效应。 但近来研究表明在无TrkA的情况下,NGFR仍具有生物学活性。Rabizadeh S等[6]发现仅表达NGFR的神经细胞在培养基无血清的情况下可发生凋亡,当有抗体或配体与NGFR结合时则凋亡被抑制。因此,表达NGFR的细胞为NGF依赖性。牙乳头间充质细胞来源于神经嵴,NGF和NGFR很可能参于其细胞凋亡过程。关于NGF与NGFR结合后的细胞内信号转导机制主要有以下两种解释:两者结合后,活化鞘磷酯酶,而此酶水解鞘磷酯产生脂质第二信使酰基神经鞘氨醇,诱导产生的转录因子NF-kB与胞核DNA特异序列结合后,可以调节细胞外基质、胞膜表面分子等基因的表达,产生生物学效应[7]。 而Represa J等[8]发现在耳蜗前庭神经节内,NGF与NGFR结合可激活细胞内糖基磷酯酰氨醇/肌醇-磷酸烯糖(phosphoglycan)(glycosyl-ptd Ins/IPG)信号转导系统,促使细胞分化。
, 百拇医药
总之,NGF在牙齿发育中不仅参与神经支配的建立过程,而且调控细胞的增殖分化和牙胚发育。
参考文献
1 Levi-Montalcini R. The never growth factor 35 years later. Science,1987,237(4819):1154
2 Klein R, Jing SQ, Nanduri V et al. The trk proro-oncogene encodes a receptor for nerve growth factor. Cell, 1991,65(1):189
3 Luukko K. Neuronal cells and neurotrophins in odontogenesis. Eur J Oral Sci, 1998,106(supple 1):80
, 百拇医药
4 Casasco A. Application of immunocytochemistry for detection of proliferating cell populations during tooth development. Anat Rec,1996,245(2):162
5 刘军. 神经生长因子和神经肽对牙乳头间充质细胞和牙胚生长、分化影响的体外实验研究:〔学位论文〕. 西安:第四军医大学口腔医学院,1998
6 Rabizadeh S, Oh J, Zh 6ong LT et al. Induction of apoptosis by the low-affinity NGF receptor. Science,1993,261(5119):345
7 Carter BD, Kaltschmidt C, Kaltschmidt B et al. Selective activation of NF-kB by nerve growth factor through the neurotrophin receptor p75. Science,1996,272(5261):542
8 Represa J, Avila MA, Minor C et al. Glycosyl-phosphatidylinositol /inositol phosphoglycan: a signaling system for the low-affinity nerve growth factor receptor. Proc Natl Acad Sci USA, 1991,88(18):8016
收稿日期:1998-10-12, 百拇医药