大鼠视网膜神经节细胞的培养
作者:钟一声 蒋幼芹 熊小玲
单位:410011 长沙,湖南医科大学附属第二医院眼科
关键词:视网膜神经节细胞;细胞;培养的;抗原;THY-1
中华眼科杂志990218 【摘要】 目的 建立视网膜神经节细胞(retinal ganglion cells,RGCs)的体外培养方法, 为RGCs的体外实验研究奠定基础。方法 采用胰酶消化法将16只生后2~3天的Sprague-Dawley 大鼠视网膜制成细胞悬液后,接种于涂以鼠尾胶原的24孔培养板,预先置入1 cm×1 cm的载玻片。细胞数约4×105个/孔,在37℃、体积分数为5%的CO2培养箱中培养。于第1、3及5天行抗大鼠THY-1单克隆抗体免疫细胞化学检查以鉴定RGCs,镜下计算每1 0个高倍镜下(high power,HP)RGCs 的细胞数和其轴突生长率。结果 在鼠尾胶原上培养的RGCs生长良好,部分细胞伸出突起,且有些突起相互连接成网。培养第1天,RGCs数和轴突生长百分率分别为(401±9)个/10 HP和(25.34±0.72)%,第3天为(351±6)个/10 HP和(35.16±2.22)%,第5天为(109±8)个/10 HP和(69.84±0.97)%。结论 RGCs的体外培养能获成功, 鼠尾胶原是RGCs体外生长的良好支持物。
, 百拇医药
Rat retinal ganglion cells in culture ZHONG Yisheng, JIANG Youqin, XIONG Xiaoling. Department of Ophthalmology, Second Affiliated Hospital, Hunan Medical University, Changsha 410011
【Abstract】 Objective To establish a culture system for retinal ganglion cells (RGCs) in order to lay a foundation for the experimental research in vitro. Methods The retinae of 16 postnatal 2~3 day Sprague-Dawley rats were dissected into cell suspension with trypsin digestion. The cell suspension was implanted in 24 well culture plates with a cover slide 1 cm2 in size and covered with murine tail collagen preplaced in each well (4×105 cells/well) and cultured under 37℃ in an incubator with 5% CO2. The cells were identified by immunocytochemical method with anti-rat Thy -1.1 monoclonal antibody after culture for 1, 3, 5 days, respectively, and the number of RGCs and its axon-growth percentage were counted in each 10-field high power (HP, 200 x) view under light microscope. Results The RGCs cultured in murine tail collagen tissue grew very well. Some cells possessed axons and some axons connected in networks. The RGC number and its axon-growth percentage were (401±9) cells/10 HP and (25.34±0.72)% in 1-day-culture, (351±6) cells/10 HP and (35.16±2.22)% in 3-day-culture, (109±8)cells/10 HP and (69.84±0.97)% in 5-day-culture, respectively. Conclusion RGCs can be cultured successfully and the murine tail collagen tissue is a good substratum for RGC survival in vitro.
, 百拇医药
【Key words】 Retinal ganglion cells Cell,cultured Antigen,Thy-1
视网膜神经节细胞(retinal ganglion cells, RGCs)是青光眼病理性损害的主要细胞。一般认为,RGCs的死亡可导致视功能不可逆性损伤,研究RGCs损害的细胞学和分子生物学机制,有利于青光眼发病机制研究。有研究证实,神经节细胞损伤后在一定条件下其轴突可以再生[1,2], RGCs培养成功可为青光眼研究提供最直接的实验手段,从而为体外研究青光眼的损害机制、探讨青光眼的预防和治疗方法提供新思路。鉴于此, 我们于1995年起在自制鼠尾胶原培养板上,成功培养了大鼠RGCs,现将结果报告如下。
材料和方法
一、鼠尾胶原的制备
参照王子淑[3]方法制备鼠尾胶原, 在无菌条件下将Sprague-Dawley大鼠鼠尾切成小段,剥去毛皮,抽出尾腱置平皿中,剪碎尾腱,浸入0.1%醋酸溶液150 ml中,置4℃冰箱,不时振摇。48 h后,移入灭菌离心管内(4 000 r/min)离心30 min,取上清液分装入小瓶,低温冰箱保存。
, 百拇医药
二、培养板的处理
为了对培养细胞行免疫细胞化学鉴定,培养板内预先置入1 cm×1 cm的载玻片。涂胶方法: 用吸管将胶原液均匀涂于24孔培养板(美国Coster公司产品)后,向孔内充入氨气片刻,待胶原与氨气作用30 min后胶原凝固,然后用D-Hank液反复冲洗, 晾干后即可使用。
三、RGCs悬液的制备
1.分离神经层视网膜组织:取16只生后 2~3天的Sprague-Dawley大鼠(湖南医科大学实验动物中心提供),分4次实验,每次4只, 将其颈椎脱位致死,消毒后轻轻摘出眼球,置入含100 U/ml青霉素和100 μg/ml链霉素的D-Hank液内漂洗3次。在显微镜下,沿角巩缘剪除角膜, 用镊子去除晶体及玻璃体,然后钝性分离出神经层视网膜组织。
2.消化视网膜组织:用D-Hank液(含100 U/ml青霉素和100 μg/ml链霉素)对视网膜漂洗3次,置入0.08%胰蛋白酶(美国Sigma公司产品),于37℃下消化30 min,加入10%小牛血清的DMEM培养液终止消化。
, 百拇医药
3.制备细胞悬液:将上液以300 r/min离心,共3~5 min,弃去上清液,加入培养液(80%DMEM、20%胎牛血清、6 mg/ml葡萄糖、100 U/ml青霉素、100 μg/ml链霉素、2 μg/ml二性霉素、25 mmol/L氯化钾及10 mmol/L Hepes液)约8 ml, 用钝头吸管吹打使之成为细胞悬液,行细胞计数, 调整培养液量使每ml含(6~7)×105个细胞。
四、接种培养
将每次实验的细胞悬液接种于预先经鼠尾胶原处理的3块24孔培养板内,每组1块随机培养1、3及5天。每孔约0.6 ml RGCs悬液(细胞数为4×105个/孔),置于体积分数为5%的CO2培养箱内,于37℃下培养。12~24 h后,加入5-溴-2′-脱氧尿苷(20 μg/ml,美国Sigma公司产品)以抑制非神经细胞生长,48 h后更换培养液,每天于倒置显微镜下观察细胞生长过程及形态变化。
, http://www.100md.com
五、RGCs鉴定方法
1.形态学观察:每天于Olympus 倒置显微镜下观察活细胞形态。
2.细胞免疫化学检查:取培养1、3及5天的细胞行抗大鼠THY-1单克隆抗体(美国Sigma公司产品) 免疫细胞学检查,同时设立阴性对照组。方法: 每次实验用的3块24孔培养板中,每板随机取6块覆有细胞的载玻片,其中4块为实验组,2块为阴性对照组,实验组用0.01 mol/L磷酸盐缓冲液(PBS)(pH=7.4)清洗1或2次,4%多聚甲醛液固定2 h后,用含5%羊血清的PBS清洗3次,加入抗大鼠THY-1单克隆抗体(1∶20, PBS稀释);阴性对照组加入含1%牛血清白蛋白的PBS,置于4℃冰箱过夜,PBS清洗3次后,加入HRP标记的羊抗鼠IgG(1∶100, PBS稀释),置室温下1 h,PBS清洗3次,加入不含过氧化氢的邻苯二胺,置于暗处反应30 min后,加入含0.005%过氧化氢的邻苯二胺液显色5 min,PBS清洗终止反应,光镜下观察,随机计数每10个高倍镜下(high power,HP)(200倍)胞膜完整的阳性染色细胞数及阳性染色细胞中有轴突生长细胞的百分率(即RGCs轴突生长率)。
, 百拇医药
结果
一、形态学观察
Olympus倒置显微镜下观察, 可见经胰蛋白酶消化所获得的视网膜神经节细胞静置在覆有鼠尾胶原的培养板内。4~6 h开始贴壁;24 h后细胞基本完全贴壁,呈单层排列, 部分细胞聚集成团,细胞呈圆形或椭圆形,核圆且相对透明,少数细胞膜上伸出短而小的突起(图1);48 h后细胞体积较前稍增大,伸出突起细胞增多;72 h后,少数细胞形成典型的细胞突起,且突起相互连接(图2);5天后有明显突起的细胞增多,细胞开始死亡, 细胞数目减少;培养7天时,细胞体积明显变小,仅少数细胞残存,多数细胞死亡。
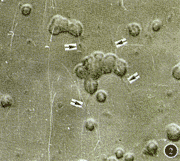
图1 培养1天的RGCs,可见少数细胞伸出轴突(箭头) ×40
, 百拇医药
图2 培养3天的RGCs,可见细胞伸出典型的轴突(箭头) ×40
二、免疫细胞化学检查
应用抗大鼠THY-1单克隆抗体对培养细胞行免疫细胞化学染色,显示RGCs胞浆和轴突染成棕黄色;培养第1天,每10个HP下可见抗鼠THY-1 单克隆抗体阳性染色细胞数平均为(401±9)个,染色阳性细胞中,有轴突生长的细胞数占25.34%;第3天,每10个HP下阳性染色细胞数平均为(351±6)个,有轴突生长的细胞数占35.16%(图3);第5天, 阳性染色细胞数平均为(109±8)个,有轴突生长的细胞数占69.84%(图4)。

图3 培养3天Thy-1免疫细胞化学染色,胞浆和轴突染成棕黄色(箭头) ×40
, 百拇医药
图4 培养5天Thy-1免疫细胞化学染色,见部分细胞轴突相互连接(箭头) ×40
讨论
一、RGCs培养的现状
自Raff等[4]采用完全消化法于体外成功地培养了生后2~3天大鼠RGCs以来,许多学者曾先后对其进行过研究[5,6]。目前常使用猫眼和鼠眼作为培养RGCs的材料来源,一般选用生后1~8周的猫或生后2~7天的鼠眼视网膜,此阶段的RGCs与中枢连接已经形成,且细胞已经特异化[6,7]。 本研究选取生后2~3天的Sprague-Dawley 大鼠视网膜细胞,在实验操作过程中尽量保持组织新鲜,以利于细胞存活。
RGCs的原代培养国内尚未见报道, 其主要的原因是神经细胞培养需要神经生长因子,且价格昂贵,加之神经细胞较难成活, 技术条件要求较高,故行原代培养较困难。我们通过调整DMEM 培养液中葡萄糖和氯化钾的浓度,适时增加谷氨酰胺和胎牛血清, 成功地使乳鼠RGCs在体外存活5天,较周明华等[8]采用RPMI1640和6%胎牛血清培养乳鼠RGCs 存活期延长3天,更利于体外实验研究。
, http://www.100md.com
二、培养板、皿的处理
RGCs的培养需要对培养物品进行处理,以利于其贴壁生长。Takahashi等[9] 采用先培养胶质细胞单层后,再接种RGCs的方法,以有利于其长期存活,但其缺点是培养时镜下难以辨认和分离RGCs。有学者将载玻片覆以聚-L-赖氨酸、聚-D-赖氨酸、Cell-Tak(一种生物聚合体)、板素和多聚鸟氨酸等进行处理,其中以聚-L-赖氨酸和板素最常见[6,8]。赵丽萍等[10]比较鸡胚前脑细胞在各种支持物上生长的情况显示各种支持物促前脑细胞生长的顺序依次为:人羊膜上皮面>鼠尾胶原>多聚鸟氨酸>板素>纤维连接蛋白>人羊膜基底面>I型胶原,但羊膜作为支持物时在显微镜下难以分辨细胞轮廓,而鼠尾胶原透明, 易于获得,本实验亦证明采用自制鼠尾胶原作为RGCs生长支持物可成功地培养鼠RGCs。
三、THY-1抗原与RGCs的鉴定
, 百拇医药
THY-1抗原是存在于啮齿类动物许多细胞表面的一种糖蛋白,鼠大脑和胸腺存在高浓度的THY-1抗原,大鼠视网膜THY-1 抗原表达开始于胚胎19天,且仅仅表达在RGCs 和其突起上,RGCs THY-1抗原表达直至生后14天才开始增加,其增加与内丛状层的厚度增加相平行,认为RGCs THY-1抗原表达与其轴突伸长、树突生长及与靶组织上丘开始建立突触联系有关[5]。Barnstable等[11]发现THY-1抗原是啮齿类动物RGCs特异性的标记物。Takahashi等[9]亦用抗鼠THY-1单克隆抗体鉴定鼠RGCs。本实验采用抗鼠THY-1单克隆抗体免疫细胞化学方法鉴定鼠RGCs,表明染色阳性细胞为RGCs。
本课题受国家自然科学基金资助(基金编号39570752)
参考文献
1 Aguayo AJ, Bray GM, Rasminsky M, et al. Synaptic connections made by axons regenerating in the central nervous system of adult mammals. J Exp Biol,1990,153 :199-224.
, 百拇医药
2 Shatz CJ, O′Leary DDM. Repair and replacement to restore sight. Arch Ophthalmol,1993,111:472-477.
3 王子淑,主编.动物细胞遗传实验技术.成都 :四川大学出版社,1987 .381-382.
4 Raff MC,Fields KL,Hakomori SI, et al. Cell-type-specific markers for distinguishing and studying neurons and the major classes of glial cells in culture. Brain Res,1979,174:283-308.
5 Leifer D,Lipton SA,Barnstable CJ,et al . Monoclonal antibody to Thy-1 enhances regeneration of processes by rat retinal ganglion cells in culture. Science,1984,224:303-306.
, 百拇医药
6 Montague PR,Friedlander MJ. Expression of an intrinsic growth strategy by mammalian retinal neurons. Proc Natl Acad Sci USA ,1989,86:7223-7227.
7 Lipton SA,Tauck DL. Voltage dependent conductances of solitary ganglion cells dissociated from the rat retina. J Physiol,1987, 385:361-391.
8 周明华,赵丽萍. 中脑顶盖提取液对培养在不 同支持物的初生大鼠视网膜神经细胞生长的影响.解剖学报,1991,22:195-198.
9 Takahashi N,Cummins D,Caprioli J. Rat retinal ganglion cells in cultures. Exp Eye Res,1991,53:565-572.
10 赵丽萍,周明华.鸡胚前脑细胞在各种支持物特别是人羊膜基底膜上生长的定量研究.解剖学报,1989,20:56-59.
11 Barnstable CJ,Drager UC. Thy-1 antigen: a ganglion cell specific marker in rodent retina. Neuroscience,1984, 11: 847-855.
(收稿: 1998-03-24 修回:1998-10-30), 百拇医药
单位:410011 长沙,湖南医科大学附属第二医院眼科
关键词:视网膜神经节细胞;细胞;培养的;抗原;THY-1
中华眼科杂志990218 【摘要】 目的 建立视网膜神经节细胞(retinal ganglion cells,RGCs)的体外培养方法, 为RGCs的体外实验研究奠定基础。方法 采用胰酶消化法将16只生后2~3天的Sprague-Dawley 大鼠视网膜制成细胞悬液后,接种于涂以鼠尾胶原的24孔培养板,预先置入1 cm×1 cm的载玻片。细胞数约4×105个/孔,在37℃、体积分数为5%的CO2培养箱中培养。于第1、3及5天行抗大鼠THY-1单克隆抗体免疫细胞化学检查以鉴定RGCs,镜下计算每1 0个高倍镜下(high power,HP)RGCs 的细胞数和其轴突生长率。结果 在鼠尾胶原上培养的RGCs生长良好,部分细胞伸出突起,且有些突起相互连接成网。培养第1天,RGCs数和轴突生长百分率分别为(401±9)个/10 HP和(25.34±0.72)%,第3天为(351±6)个/10 HP和(35.16±2.22)%,第5天为(109±8)个/10 HP和(69.84±0.97)%。结论 RGCs的体外培养能获成功, 鼠尾胶原是RGCs体外生长的良好支持物。
, 百拇医药
Rat retinal ganglion cells in culture ZHONG Yisheng, JIANG Youqin, XIONG Xiaoling. Department of Ophthalmology, Second Affiliated Hospital, Hunan Medical University, Changsha 410011
【Abstract】 Objective To establish a culture system for retinal ganglion cells (RGCs) in order to lay a foundation for the experimental research in vitro. Methods The retinae of 16 postnatal 2~3 day Sprague-Dawley rats were dissected into cell suspension with trypsin digestion. The cell suspension was implanted in 24 well culture plates with a cover slide 1 cm2 in size and covered with murine tail collagen preplaced in each well (4×105 cells/well) and cultured under 37℃ in an incubator with 5% CO2. The cells were identified by immunocytochemical method with anti-rat Thy -1.1 monoclonal antibody after culture for 1, 3, 5 days, respectively, and the number of RGCs and its axon-growth percentage were counted in each 10-field high power (HP, 200 x) view under light microscope. Results The RGCs cultured in murine tail collagen tissue grew very well. Some cells possessed axons and some axons connected in networks. The RGC number and its axon-growth percentage were (401±9) cells/10 HP and (25.34±0.72)% in 1-day-culture, (351±6) cells/10 HP and (35.16±2.22)% in 3-day-culture, (109±8)cells/10 HP and (69.84±0.97)% in 5-day-culture, respectively. Conclusion RGCs can be cultured successfully and the murine tail collagen tissue is a good substratum for RGC survival in vitro.
, 百拇医药
【Key words】 Retinal ganglion cells Cell,cultured Antigen,Thy-1
视网膜神经节细胞(retinal ganglion cells, RGCs)是青光眼病理性损害的主要细胞。一般认为,RGCs的死亡可导致视功能不可逆性损伤,研究RGCs损害的细胞学和分子生物学机制,有利于青光眼发病机制研究。有研究证实,神经节细胞损伤后在一定条件下其轴突可以再生[1,2], RGCs培养成功可为青光眼研究提供最直接的实验手段,从而为体外研究青光眼的损害机制、探讨青光眼的预防和治疗方法提供新思路。鉴于此, 我们于1995年起在自制鼠尾胶原培养板上,成功培养了大鼠RGCs,现将结果报告如下。
材料和方法
一、鼠尾胶原的制备
参照王子淑[3]方法制备鼠尾胶原, 在无菌条件下将Sprague-Dawley大鼠鼠尾切成小段,剥去毛皮,抽出尾腱置平皿中,剪碎尾腱,浸入0.1%醋酸溶液150 ml中,置4℃冰箱,不时振摇。48 h后,移入灭菌离心管内(4 000 r/min)离心30 min,取上清液分装入小瓶,低温冰箱保存。
, 百拇医药
二、培养板的处理
为了对培养细胞行免疫细胞化学鉴定,培养板内预先置入1 cm×1 cm的载玻片。涂胶方法: 用吸管将胶原液均匀涂于24孔培养板(美国Coster公司产品)后,向孔内充入氨气片刻,待胶原与氨气作用30 min后胶原凝固,然后用D-Hank液反复冲洗, 晾干后即可使用。
三、RGCs悬液的制备
1.分离神经层视网膜组织:取16只生后 2~3天的Sprague-Dawley大鼠(湖南医科大学实验动物中心提供),分4次实验,每次4只, 将其颈椎脱位致死,消毒后轻轻摘出眼球,置入含100 U/ml青霉素和100 μg/ml链霉素的D-Hank液内漂洗3次。在显微镜下,沿角巩缘剪除角膜, 用镊子去除晶体及玻璃体,然后钝性分离出神经层视网膜组织。
2.消化视网膜组织:用D-Hank液(含100 U/ml青霉素和100 μg/ml链霉素)对视网膜漂洗3次,置入0.08%胰蛋白酶(美国Sigma公司产品),于37℃下消化30 min,加入10%小牛血清的DMEM培养液终止消化。
, 百拇医药
3.制备细胞悬液:将上液以300 r/min离心,共3~5 min,弃去上清液,加入培养液(80%DMEM、20%胎牛血清、6 mg/ml葡萄糖、100 U/ml青霉素、100 μg/ml链霉素、2 μg/ml二性霉素、25 mmol/L氯化钾及10 mmol/L Hepes液)约8 ml, 用钝头吸管吹打使之成为细胞悬液,行细胞计数, 调整培养液量使每ml含(6~7)×105个细胞。
四、接种培养
将每次实验的细胞悬液接种于预先经鼠尾胶原处理的3块24孔培养板内,每组1块随机培养1、3及5天。每孔约0.6 ml RGCs悬液(细胞数为4×105个/孔),置于体积分数为5%的CO2培养箱内,于37℃下培养。12~24 h后,加入5-溴-2′-脱氧尿苷(20 μg/ml,美国Sigma公司产品)以抑制非神经细胞生长,48 h后更换培养液,每天于倒置显微镜下观察细胞生长过程及形态变化。
, http://www.100md.com
五、RGCs鉴定方法
1.形态学观察:每天于Olympus 倒置显微镜下观察活细胞形态。
2.细胞免疫化学检查:取培养1、3及5天的细胞行抗大鼠THY-1单克隆抗体(美国Sigma公司产品) 免疫细胞学检查,同时设立阴性对照组。方法: 每次实验用的3块24孔培养板中,每板随机取6块覆有细胞的载玻片,其中4块为实验组,2块为阴性对照组,实验组用0.01 mol/L磷酸盐缓冲液(PBS)(pH=7.4)清洗1或2次,4%多聚甲醛液固定2 h后,用含5%羊血清的PBS清洗3次,加入抗大鼠THY-1单克隆抗体(1∶20, PBS稀释);阴性对照组加入含1%牛血清白蛋白的PBS,置于4℃冰箱过夜,PBS清洗3次后,加入HRP标记的羊抗鼠IgG(1∶100, PBS稀释),置室温下1 h,PBS清洗3次,加入不含过氧化氢的邻苯二胺,置于暗处反应30 min后,加入含0.005%过氧化氢的邻苯二胺液显色5 min,PBS清洗终止反应,光镜下观察,随机计数每10个高倍镜下(high power,HP)(200倍)胞膜完整的阳性染色细胞数及阳性染色细胞中有轴突生长细胞的百分率(即RGCs轴突生长率)。
, 百拇医药
结果
一、形态学观察
Olympus倒置显微镜下观察, 可见经胰蛋白酶消化所获得的视网膜神经节细胞静置在覆有鼠尾胶原的培养板内。4~6 h开始贴壁;24 h后细胞基本完全贴壁,呈单层排列, 部分细胞聚集成团,细胞呈圆形或椭圆形,核圆且相对透明,少数细胞膜上伸出短而小的突起(图1);48 h后细胞体积较前稍增大,伸出突起细胞增多;72 h后,少数细胞形成典型的细胞突起,且突起相互连接(图2);5天后有明显突起的细胞增多,细胞开始死亡, 细胞数目减少;培养7天时,细胞体积明显变小,仅少数细胞残存,多数细胞死亡。


图1 培养1天的RGCs,可见少数细胞伸出轴突(箭头) ×40
, 百拇医药
图2 培养3天的RGCs,可见细胞伸出典型的轴突(箭头) ×40
二、免疫细胞化学检查
应用抗大鼠THY-1单克隆抗体对培养细胞行免疫细胞化学染色,显示RGCs胞浆和轴突染成棕黄色;培养第1天,每10个HP下可见抗鼠THY-1 单克隆抗体阳性染色细胞数平均为(401±9)个,染色阳性细胞中,有轴突生长的细胞数占25.34%;第3天,每10个HP下阳性染色细胞数平均为(351±6)个,有轴突生长的细胞数占35.16%(图3);第5天, 阳性染色细胞数平均为(109±8)个,有轴突生长的细胞数占69.84%(图4)。


图3 培养3天Thy-1免疫细胞化学染色,胞浆和轴突染成棕黄色(箭头) ×40
, 百拇医药
图4 培养5天Thy-1免疫细胞化学染色,见部分细胞轴突相互连接(箭头) ×40
讨论
一、RGCs培养的现状
自Raff等[4]采用完全消化法于体外成功地培养了生后2~3天大鼠RGCs以来,许多学者曾先后对其进行过研究[5,6]。目前常使用猫眼和鼠眼作为培养RGCs的材料来源,一般选用生后1~8周的猫或生后2~7天的鼠眼视网膜,此阶段的RGCs与中枢连接已经形成,且细胞已经特异化[6,7]。 本研究选取生后2~3天的Sprague-Dawley 大鼠视网膜细胞,在实验操作过程中尽量保持组织新鲜,以利于细胞存活。
RGCs的原代培养国内尚未见报道, 其主要的原因是神经细胞培养需要神经生长因子,且价格昂贵,加之神经细胞较难成活, 技术条件要求较高,故行原代培养较困难。我们通过调整DMEM 培养液中葡萄糖和氯化钾的浓度,适时增加谷氨酰胺和胎牛血清, 成功地使乳鼠RGCs在体外存活5天,较周明华等[8]采用RPMI1640和6%胎牛血清培养乳鼠RGCs 存活期延长3天,更利于体外实验研究。
, http://www.100md.com
二、培养板、皿的处理
RGCs的培养需要对培养物品进行处理,以利于其贴壁生长。Takahashi等[9] 采用先培养胶质细胞单层后,再接种RGCs的方法,以有利于其长期存活,但其缺点是培养时镜下难以辨认和分离RGCs。有学者将载玻片覆以聚-L-赖氨酸、聚-D-赖氨酸、Cell-Tak(一种生物聚合体)、板素和多聚鸟氨酸等进行处理,其中以聚-L-赖氨酸和板素最常见[6,8]。赵丽萍等[10]比较鸡胚前脑细胞在各种支持物上生长的情况显示各种支持物促前脑细胞生长的顺序依次为:人羊膜上皮面>鼠尾胶原>多聚鸟氨酸>板素>纤维连接蛋白>人羊膜基底面>I型胶原,但羊膜作为支持物时在显微镜下难以分辨细胞轮廓,而鼠尾胶原透明, 易于获得,本实验亦证明采用自制鼠尾胶原作为RGCs生长支持物可成功地培养鼠RGCs。
三、THY-1抗原与RGCs的鉴定
, 百拇医药
THY-1抗原是存在于啮齿类动物许多细胞表面的一种糖蛋白,鼠大脑和胸腺存在高浓度的THY-1抗原,大鼠视网膜THY-1 抗原表达开始于胚胎19天,且仅仅表达在RGCs 和其突起上,RGCs THY-1抗原表达直至生后14天才开始增加,其增加与内丛状层的厚度增加相平行,认为RGCs THY-1抗原表达与其轴突伸长、树突生长及与靶组织上丘开始建立突触联系有关[5]。Barnstable等[11]发现THY-1抗原是啮齿类动物RGCs特异性的标记物。Takahashi等[9]亦用抗鼠THY-1单克隆抗体鉴定鼠RGCs。本实验采用抗鼠THY-1单克隆抗体免疫细胞化学方法鉴定鼠RGCs,表明染色阳性细胞为RGCs。
本课题受国家自然科学基金资助(基金编号39570752)
参考文献
1 Aguayo AJ, Bray GM, Rasminsky M, et al. Synaptic connections made by axons regenerating in the central nervous system of adult mammals. J Exp Biol,1990,153 :199-224.
, 百拇医药
2 Shatz CJ, O′Leary DDM. Repair and replacement to restore sight. Arch Ophthalmol,1993,111:472-477.
3 王子淑,主编.动物细胞遗传实验技术.成都 :四川大学出版社,1987 .381-382.
4 Raff MC,Fields KL,Hakomori SI, et al. Cell-type-specific markers for distinguishing and studying neurons and the major classes of glial cells in culture. Brain Res,1979,174:283-308.
5 Leifer D,Lipton SA,Barnstable CJ,et al . Monoclonal antibody to Thy-1 enhances regeneration of processes by rat retinal ganglion cells in culture. Science,1984,224:303-306.
, 百拇医药
6 Montague PR,Friedlander MJ. Expression of an intrinsic growth strategy by mammalian retinal neurons. Proc Natl Acad Sci USA ,1989,86:7223-7227.
7 Lipton SA,Tauck DL. Voltage dependent conductances of solitary ganglion cells dissociated from the rat retina. J Physiol,1987, 385:361-391.
8 周明华,赵丽萍. 中脑顶盖提取液对培养在不 同支持物的初生大鼠视网膜神经细胞生长的影响.解剖学报,1991,22:195-198.
9 Takahashi N,Cummins D,Caprioli J. Rat retinal ganglion cells in cultures. Exp Eye Res,1991,53:565-572.
10 赵丽萍,周明华.鸡胚前脑细胞在各种支持物特别是人羊膜基底膜上生长的定量研究.解剖学报,1989,20:56-59.
11 Barnstable CJ,Drager UC. Thy-1 antigen: a ganglion cell specific marker in rodent retina. Neuroscience,1984, 11: 847-855.
(收稿: 1998-03-24 修回:1998-10-30), 百拇医药