反义核酸抑制人骨髓瘤细胞中的IL-6信号转导功能研究
作者:宋伦 黎燕 沈倍奋
单位:宋伦 黎燕 沈倍奋(军事医学科学院基础医学研究所 北京 100850)
关键词:IL-6;骨髓瘤;信号转导;反义核酸
中国肿瘤生物治疗杂志000202 摘 要 目的: 研究人骨髓瘤细胞的IL-6信号转导通路中哪一个环节可作为“IL-6功能拮抗剂”设计的目标靶位。方法: 首先通过凝胶阻滞电泳(electrophoretic mobility shift assay,EMSA)、免疫沉淀方法观察人骨髓瘤细胞Sko-007中参与IL-6信号转导功能的转录因子—STAT3,NF-IL-6和蛋白激酶ERK的诱导活化情况,继而构建和设计了针对这些信号分子的反义表达质粒和反义寡核苷酸,用同样方法观察反义核酸对IL-6信号转导功能的影响。结果: 这些反义核酸可以不同程度地抑制IL-6在Sko-007细胞中的信号转导功能。结论: 可通过进一步实验确定转录因子、蛋白激酶作为“胞内拮抗剂”作用目标靶位的可行性。
, 百拇医药
《中国图书资料分类法》分类号 R392.11
Antagonism Function of Anti-Sense Nucleic Acids on IL-6 Signal Transduction in Myeloma Cells
Song Lun Li Yan Shen Beifen
(Institute of Basic Medical Science, Acadmey of Military Medical Science, Beijing 100850)
Abstract Objective: To investigate which step of IL-6 signal transduction pathways in myeloma cells can be taken as the acting target of the antagonists for IL-6. Methods: EMSA and immunoprecipitation were used to detect the activation of transcription factors(TFs)-STAT3,NF-IL-6 and protein kinase ERK in a myeloma cell line-Sko-007 by IL-6, then anti-sense expression plasmids and anti-sense ODN for these signal moleculars were constructed and designed,the effects of these anti-sense nucleic acids on IL-6 signal transduction in Sko-007 cells were analyzed by the same methods. Results: IL-6 signal transduction could be antagonized by these anti-sense nucleic acids at different extent. Conclusion: TFs or protein kinases in IL-6 signal transduction pathways can be taken as the target for antagonists design.
, 百拇医药
Key words IL-6; multiple myeloma; signal transduction; anti-sense nucleic acid
多发性骨髓瘤(multiple myeloma,MM)是一种典型的IL-6表达异常相关性肿瘤,来自于瘤细胞本身自泌或骨髓基质细胞旁泌的IL-6是维持骨髓瘤细胞生存和促进其生长的一种最重要的细胞因子。因此,降低病人体内的IL-6,IL-6R含量或阻断IL-6的生物学功能成为治疗MM的主要措施[1]。在本文中,我们分别构建和设计了针对参与IL-6信号转导途径的蛋白激酶以及转录因子[2]的反义表达质粒和反义寡核苷酸,并证实它们能够抑制MM细胞系—Sko-007的IL-6信号转导功能;为寻找“新型IL-6功能拮抗剂”的胞内作用靶位奠定了基础。
1 材料与方法
1.1 主要试剂
, http://www.100md.com
重组人IL-6由军事医学科学院生物工程研究所提供;[α-32P]-dATP购自北京福瑞公司;用于转染细胞的硫代化修饰寡核苷酸由上海生工生物工程公司合成;抗ERK多克隆抗体购自Santa Cruz公司;抗磷酸酪氨酸抗体PY20购自Transduction Laboratory。
1.2 细胞系
人骨髓瘤细胞系Sko-007由本室保存,用含有10%小牛血清的RPMI 1640培养基传代培养。
1.3 质粒
pSVL和pCMV4为真核细胞瞬时表达载体,本室保存。携带有STAT3 cDNA的质粒PMS1由美国耶鲁大学傅新元博士提供;携带有NF-IL-6 cDNA的质粒pBlue610由南京军区医研所朱敏生博士提供。
1.4 重组质粒的构建等常规分子生物学技术
, 百拇医药
参见文献[3]。
1.5 质粒及寡核苷酸转染真核细胞
采用Gibco公司Lipofectamine并按其说明书方法进行。一般取2×106个细胞为一个转染样品,对应4 μg质粒DNA或1 μmol寡核苷酸和20 μl Lipofectamine。
1.6 细胞核蛋白提取及凝胶阻滞电泳(EMSA)
参见文献[4]。
1.7 免疫沉淀
取Sko-007细胞5×106~1×107个为一个样品,细胞预处理及刺激同核蛋白提取[4]。在刺激后的每一个细胞样品中加入0.25~0.5 ml的细胞裂解缓冲液(50 mmol/L Tris-Cl pH 7.5,150 mmol/L NaCl,1%NP40,0.5 mmol/L EDTA,0.5 mmol/L EGTA;临用前补加1 mmol/L Na3VO4,10 mmol/L NaF, 2 mmol/L PMSF和10 μg/ml aprotinin,pepstin,luepepstin)冰浴作用30 min后,12 000 g离心20 min,弃沉淀,上清即为细胞裂解蛋白。在以上每份蛋白产物中加入ERK抗体4 μg,4℃作用2 h,再加入prA-agarose珠(Gibco)20 μl,4℃作用4 h或过夜。在进行电泳前将agarose珠用洗涤缓冲液(除NP40浓度降至0.1%以外,其余成分同以上裂解缓冲液)和PBS溶液各洗3次,然后走10%SDS-PAGE电泳,按常规方法转印,并分别用抗ERK和抗磷酸酪氨酸抗体进行识别,用AP标记的二抗及其底物BCIP、NBT显色或HRP标记的二抗及ECL系统显色。
, 百拇医药
2 结 果
2.1 IL-6诱导Sko-007细胞中转录因子STAT3和NF-IL-6活化
目前的研究结果表明,IL-6在其靶细胞中的信号转导通路主要有两条:Jak/STAT途径和Ras/NF-IL-6途径。因此,我们首先用EMSA方法检测了Sko-007细胞中参予以上两条信号途径的转录因子STAT3和NF-IL-6在IL-6刺激前后的活化情况。我们以分别能够与STAT3和NF-IL-6结合的DNA反应成分APRE和NF-IL-6/ATF[4]作为探针,与100 ng/ml IL-6刺激前后的Sko-007细胞核蛋白相互作用,结果如图1所示,在正常培养的Sko-007细胞中存在有NF-IL-6的组成性激活,IL-6刺激后其活化信号显著增强;而STAT3在IL-6刺激前处于非活化状态,IL-6刺激后出现了明显的活化信号。说明这两种转录因子所参与的IL-6信号转导途径都能在Sko-007细胞中诱导激活。
, http://www.100md.com
2.2 蛋白激酶ERK(MAPK)在Sko-007细胞中的活化状态
在IL-6的两条信号途径中,催化转录因子NF-IL-6和STAT3活化的的蛋白激酶分别是ERK(MAPK)和Jak激酶家族分子Jak1,Jak2,Tyk2中的一种或几种。由于目前我们还没有购买到有效的抗JaK激酶抗体,因此,我们首先检测了Sko-007细胞中ERK的表达及其诱导活化情况。免疫沉淀结果如图2显示,在IL-6刺激前后,ERK的表达基本相同(图2A);在IL-6刺激前,ERK处于组成性激活状态,刺激后,ERK的活化信号显著增强(图2B),这与NF-IL-6的IL-6诱导活化情况一致。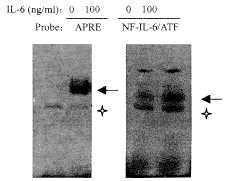
图1 STAT3和NF-IL-6在Sko-007细胞中的诱导激活
Fig.1 Activation of STAT3 and NF-IL-6 in Sko-007 cells by IL-6
, 百拇医药
Specific band and non-specific band are indicated by
arrow and star respectively
图2 蛋白激酶ERK在Sko-007细胞中的表达及激活状态
Fig.2 Expression and activation of ERK in Sko-007 cells by IL-6
IP: Immunoprecipitation; IB: Immunoblot; α-ERK: Antibodities
to ERK; α-p-Tyr: Antibodies to phosphotyrosine
, http://www.100md.com
2.3 STAT3和NF-IL-6反义表达质粒的构建
我们首先采用Xho-Ⅰ-Klenow和BglⅡ酶切处理PMS1质粒得到跨越STAT3基因翻译起始位点的一段556 bp的STAT3 cDNA片段,反向插入BglⅡ和SmaⅠ处理的pCMV4真核表达载体中,构建了STAT3反义表达质粒pAT-STAT3;同样我们用EcoRⅠ-Klenow和Xho-Ⅰ处理pBlue610质粒获得NF-IL-6 cDNA(1.0 kb),反向插入到Xho-Ⅰ,SmaⅠ处理的pSVL载体中获得了NF-IL-6反义表达质粒pAT-NFIL6。两质粒经酶切鉴定构建正确(电泳结果略)。
2.4 STAT3和ERK反义寡核苷酸设计
我们分别设计了针对STAT3翻译起始位点上游和下游以及蛋白激酶ERK的反义寡核苷酸,并以其相应的正义寡核苷酸作为对照:
, 百拇医药
STAT3- S1:5′ATG GCT CAG TGG AAC CAG 3′
STAT3-AS1: 5′CTG GTT CCA CTG AGC CAT 3′
STAT3-S2: 5′TGA CTG CAG CAG GAT GG 3′
STAT3-AS2: 5′CCA TCC TGC TGC AGT CA 3′
ERK-S: 5′ATG GCG GCG GCG GCG GC 3′
ERK-AS: 5′GCC GCC GCC GCC GCC AT 3′
以上各寡核苷酸的5′及3′端的核苷酸(下画线部分)采用硫代化修饰。
, 百拇医药
2.5 STAT3反义表达质粒及反义寡核苷酸对IL-6诱导的STAT3活化情况的影响
我们将STAT3反义表达质粒及反义寡核苷酸与它们的对照分别转染入Sko细胞,60 h后采用低剂量IL-6对细胞进行刺激,并提取核蛋白与APRE探针结合,EMSA结果如图3所示,pAT-STAT3转入Sko细胞后使IL-6诱导的STAT3活化信号明显减弱(图3A)。STAT3反义寡核苷酸与其对照相比,只有第一组产生了明显的抑制作用,第二组作用不显著(图3B),说明针对STAT3翻译起始位点下游的反义寡核苷酸的抑制功能是比较有效的。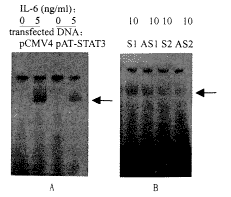
图3 pAT-STAT3及STAT3反义寡核苷酸对
IL-6诱导的STAT3活化情况的影响
Fig.3 Effect of pAT-STAT3 and anti-sense ODN of STAT3
, 百拇医药
on the activation of STAT3 in Sko-007 cells by IL-6
2.6 NF-IL-6反义表达质粒及MAPK反义寡核苷酸对IL-6诱导的NF-IL-6活化情况的影响
我们采用与以上STAT3实验完全相同的方法,只是EMSA实验改用NF-IL-6/ATF探针,结果如图4所示,pAT-NFIL6转入Sko细胞后可明显抑制IL-6诱导的NF-IL-6的活化(图4A);而ERK反义寡核苷酸的抑制效果更加显著,高剂量IL-6浓度(100 ng/mL)诱导的NF-IL-6活化信号几乎完全被抑制(图4B)。
图4 pAT-NFIL6及ERK反义寡核苷酸对IL-6
诱导的NF-IL-6活化情况的影响
, 百拇医药
Fig.4 Effect of pAT-NFIL6 and anti-sense ODN of ERK
on the activation of NF-IL-6 in Sko-007 cells by IL-6
3 讨 论
IL-6是影响多发性骨髓瘤发生和发展的一种非常重要的细胞因子。我们在MM细胞系Sko-007中观察到参与IL-6信号转导功能的蛋白激酶ERK(MAPK)以及转录因子STAT3和NF-IL-6在IL-6诱导下的显著活化,说明两条主要的IL-6信号转导途径Jak/STAT和Ras/NF-IL-6都可在Sko-007中诱导激活;不仅如此,Ras/MAPK/NF-IL-6途径还可以组成性激活状态存在,说明它不仅是Sko-007细胞的IL-6反应途径,而且也与细胞本身的生存有关。针对这两条途径的反义核酸在抑制效果上也存在一定差别:SATA3反义寡核苷酸只能微弱抑制IL-6诱导的STAT3的活化,而针对Ras途径中ERK的反义寡核苷酸几乎完全抑制了IL-6诱导的NF-IL-6的活化,说明“生存途径”中的信号分子对反义核酸抑制功能的反应性更强,同时也提示我们,蛋白激酶可能是优于转录因子的更好的拮抗剂设计目标靶位。
, 百拇医药
国家杰出青年科学基金(39925019)资助
宋伦,女,28岁,主要从事细胞因子信号转导的研究
参 考 文 献
1,Klein B. Update of gp130 cytokines in multiple myeloma. Curr Opin Hematol, 1998, 5: 186
2,宋 伦, 沈倍奋. IL-6信号转导的分子机制. 国外医学*免疫学分册, 1999, 22(2): 79
3,Ausubel FM, Kingston RE, Seidman JG, et al. Short protocols in molecular biology. 3rd ed. John Wiley&Sons,Inc., 1995, 17~23: 73
4,宋 伦, 黎 燕, 沈倍奋. 280位His残基对sIL-6R介导的IL-6信号转导功能的影响. 中国实验临床免疫学杂志, 1999, 5: 372
(1999-08-01收稿; 1999-10-03修回), 百拇医药
单位:宋伦 黎燕 沈倍奋(军事医学科学院基础医学研究所 北京 100850)
关键词:IL-6;骨髓瘤;信号转导;反义核酸
中国肿瘤生物治疗杂志000202 摘 要 目的: 研究人骨髓瘤细胞的IL-6信号转导通路中哪一个环节可作为“IL-6功能拮抗剂”设计的目标靶位。方法: 首先通过凝胶阻滞电泳(electrophoretic mobility shift assay,EMSA)、免疫沉淀方法观察人骨髓瘤细胞Sko-007中参与IL-6信号转导功能的转录因子—STAT3,NF-IL-6和蛋白激酶ERK的诱导活化情况,继而构建和设计了针对这些信号分子的反义表达质粒和反义寡核苷酸,用同样方法观察反义核酸对IL-6信号转导功能的影响。结果: 这些反义核酸可以不同程度地抑制IL-6在Sko-007细胞中的信号转导功能。结论: 可通过进一步实验确定转录因子、蛋白激酶作为“胞内拮抗剂”作用目标靶位的可行性。
, 百拇医药
《中国图书资料分类法》分类号 R392.11
Antagonism Function of Anti-Sense Nucleic Acids on IL-6 Signal Transduction in Myeloma Cells
Song Lun Li Yan Shen Beifen
(Institute of Basic Medical Science, Acadmey of Military Medical Science, Beijing 100850)
Abstract Objective: To investigate which step of IL-6 signal transduction pathways in myeloma cells can be taken as the acting target of the antagonists for IL-6. Methods: EMSA and immunoprecipitation were used to detect the activation of transcription factors(TFs)-STAT3,NF-IL-6 and protein kinase ERK in a myeloma cell line-Sko-007 by IL-6, then anti-sense expression plasmids and anti-sense ODN for these signal moleculars were constructed and designed,the effects of these anti-sense nucleic acids on IL-6 signal transduction in Sko-007 cells were analyzed by the same methods. Results: IL-6 signal transduction could be antagonized by these anti-sense nucleic acids at different extent. Conclusion: TFs or protein kinases in IL-6 signal transduction pathways can be taken as the target for antagonists design.
, 百拇医药
Key words IL-6; multiple myeloma; signal transduction; anti-sense nucleic acid
多发性骨髓瘤(multiple myeloma,MM)是一种典型的IL-6表达异常相关性肿瘤,来自于瘤细胞本身自泌或骨髓基质细胞旁泌的IL-6是维持骨髓瘤细胞生存和促进其生长的一种最重要的细胞因子。因此,降低病人体内的IL-6,IL-6R含量或阻断IL-6的生物学功能成为治疗MM的主要措施[1]。在本文中,我们分别构建和设计了针对参与IL-6信号转导途径的蛋白激酶以及转录因子[2]的反义表达质粒和反义寡核苷酸,并证实它们能够抑制MM细胞系—Sko-007的IL-6信号转导功能;为寻找“新型IL-6功能拮抗剂”的胞内作用靶位奠定了基础。
1 材料与方法
1.1 主要试剂
, http://www.100md.com
重组人IL-6由军事医学科学院生物工程研究所提供;[α-32P]-dATP购自北京福瑞公司;用于转染细胞的硫代化修饰寡核苷酸由上海生工生物工程公司合成;抗ERK多克隆抗体购自Santa Cruz公司;抗磷酸酪氨酸抗体PY20购自Transduction Laboratory。
1.2 细胞系
人骨髓瘤细胞系Sko-007由本室保存,用含有10%小牛血清的RPMI 1640培养基传代培养。
1.3 质粒
pSVL和pCMV4为真核细胞瞬时表达载体,本室保存。携带有STAT3 cDNA的质粒PMS1由美国耶鲁大学傅新元博士提供;携带有NF-IL-6 cDNA的质粒pBlue610由南京军区医研所朱敏生博士提供。
1.4 重组质粒的构建等常规分子生物学技术
, 百拇医药
参见文献[3]。
1.5 质粒及寡核苷酸转染真核细胞
采用Gibco公司Lipofectamine并按其说明书方法进行。一般取2×106个细胞为一个转染样品,对应4 μg质粒DNA或1 μmol寡核苷酸和20 μl Lipofectamine。
1.6 细胞核蛋白提取及凝胶阻滞电泳(EMSA)
参见文献[4]。
1.7 免疫沉淀
取Sko-007细胞5×106~1×107个为一个样品,细胞预处理及刺激同核蛋白提取[4]。在刺激后的每一个细胞样品中加入0.25~0.5 ml的细胞裂解缓冲液(50 mmol/L Tris-Cl pH 7.5,150 mmol/L NaCl,1%NP40,0.5 mmol/L EDTA,0.5 mmol/L EGTA;临用前补加1 mmol/L Na3VO4,10 mmol/L NaF, 2 mmol/L PMSF和10 μg/ml aprotinin,pepstin,luepepstin)冰浴作用30 min后,12 000 g离心20 min,弃沉淀,上清即为细胞裂解蛋白。在以上每份蛋白产物中加入ERK抗体4 μg,4℃作用2 h,再加入prA-agarose珠(Gibco)20 μl,4℃作用4 h或过夜。在进行电泳前将agarose珠用洗涤缓冲液(除NP40浓度降至0.1%以外,其余成分同以上裂解缓冲液)和PBS溶液各洗3次,然后走10%SDS-PAGE电泳,按常规方法转印,并分别用抗ERK和抗磷酸酪氨酸抗体进行识别,用AP标记的二抗及其底物BCIP、NBT显色或HRP标记的二抗及ECL系统显色。
, 百拇医药
2 结 果
2.1 IL-6诱导Sko-007细胞中转录因子STAT3和NF-IL-6活化
目前的研究结果表明,IL-6在其靶细胞中的信号转导通路主要有两条:Jak/STAT途径和Ras/NF-IL-6途径。因此,我们首先用EMSA方法检测了Sko-007细胞中参予以上两条信号途径的转录因子STAT3和NF-IL-6在IL-6刺激前后的活化情况。我们以分别能够与STAT3和NF-IL-6结合的DNA反应成分APRE和NF-IL-6/ATF[4]作为探针,与100 ng/ml IL-6刺激前后的Sko-007细胞核蛋白相互作用,结果如图1所示,在正常培养的Sko-007细胞中存在有NF-IL-6的组成性激活,IL-6刺激后其活化信号显著增强;而STAT3在IL-6刺激前处于非活化状态,IL-6刺激后出现了明显的活化信号。说明这两种转录因子所参与的IL-6信号转导途径都能在Sko-007细胞中诱导激活。
, http://www.100md.com
2.2 蛋白激酶ERK(MAPK)在Sko-007细胞中的活化状态
在IL-6的两条信号途径中,催化转录因子NF-IL-6和STAT3活化的的蛋白激酶分别是ERK(MAPK)和Jak激酶家族分子Jak1,Jak2,Tyk2中的一种或几种。由于目前我们还没有购买到有效的抗JaK激酶抗体,因此,我们首先检测了Sko-007细胞中ERK的表达及其诱导活化情况。免疫沉淀结果如图2显示,在IL-6刺激前后,ERK的表达基本相同(图2A);在IL-6刺激前,ERK处于组成性激活状态,刺激后,ERK的活化信号显著增强(图2B),这与NF-IL-6的IL-6诱导活化情况一致。

图1 STAT3和NF-IL-6在Sko-007细胞中的诱导激活
Fig.1 Activation of STAT3 and NF-IL-6 in Sko-007 cells by IL-6
, 百拇医药
Specific band and non-specific band are indicated by
arrow and star respectively

图2 蛋白激酶ERK在Sko-007细胞中的表达及激活状态
Fig.2 Expression and activation of ERK in Sko-007 cells by IL-6
IP: Immunoprecipitation; IB: Immunoblot; α-ERK: Antibodities
to ERK; α-p-Tyr: Antibodies to phosphotyrosine
, http://www.100md.com
2.3 STAT3和NF-IL-6反义表达质粒的构建
我们首先采用Xho-Ⅰ-Klenow和BglⅡ酶切处理PMS1质粒得到跨越STAT3基因翻译起始位点的一段556 bp的STAT3 cDNA片段,反向插入BglⅡ和SmaⅠ处理的pCMV4真核表达载体中,构建了STAT3反义表达质粒pAT-STAT3;同样我们用EcoRⅠ-Klenow和Xho-Ⅰ处理pBlue610质粒获得NF-IL-6 cDNA(1.0 kb),反向插入到Xho-Ⅰ,SmaⅠ处理的pSVL载体中获得了NF-IL-6反义表达质粒pAT-NFIL6。两质粒经酶切鉴定构建正确(电泳结果略)。
2.4 STAT3和ERK反义寡核苷酸设计
我们分别设计了针对STAT3翻译起始位点上游和下游以及蛋白激酶ERK的反义寡核苷酸,并以其相应的正义寡核苷酸作为对照:
, 百拇医药
STAT3- S1:5′ATG GCT CAG TGG AAC CAG 3′
STAT3-AS1: 5′CTG GTT CCA CTG AGC CAT 3′
STAT3-S2: 5′TGA CTG CAG CAG GAT GG 3′
STAT3-AS2: 5′CCA TCC TGC TGC AGT CA 3′
ERK-S: 5′ATG GCG GCG GCG GCG GC 3′
ERK-AS: 5′GCC GCC GCC GCC GCC AT 3′
以上各寡核苷酸的5′及3′端的核苷酸(下画线部分)采用硫代化修饰。
, 百拇医药
2.5 STAT3反义表达质粒及反义寡核苷酸对IL-6诱导的STAT3活化情况的影响
我们将STAT3反义表达质粒及反义寡核苷酸与它们的对照分别转染入Sko细胞,60 h后采用低剂量IL-6对细胞进行刺激,并提取核蛋白与APRE探针结合,EMSA结果如图3所示,pAT-STAT3转入Sko细胞后使IL-6诱导的STAT3活化信号明显减弱(图3A)。STAT3反义寡核苷酸与其对照相比,只有第一组产生了明显的抑制作用,第二组作用不显著(图3B),说明针对STAT3翻译起始位点下游的反义寡核苷酸的抑制功能是比较有效的。

图3 pAT-STAT3及STAT3反义寡核苷酸对
IL-6诱导的STAT3活化情况的影响
Fig.3 Effect of pAT-STAT3 and anti-sense ODN of STAT3
, 百拇医药
on the activation of STAT3 in Sko-007 cells by IL-6
2.6 NF-IL-6反义表达质粒及MAPK反义寡核苷酸对IL-6诱导的NF-IL-6活化情况的影响
我们采用与以上STAT3实验完全相同的方法,只是EMSA实验改用NF-IL-6/ATF探针,结果如图4所示,pAT-NFIL6转入Sko细胞后可明显抑制IL-6诱导的NF-IL-6的活化(图4A);而ERK反义寡核苷酸的抑制效果更加显著,高剂量IL-6浓度(100 ng/mL)诱导的NF-IL-6活化信号几乎完全被抑制(图4B)。

图4 pAT-NFIL6及ERK反义寡核苷酸对IL-6
诱导的NF-IL-6活化情况的影响
, 百拇医药
Fig.4 Effect of pAT-NFIL6 and anti-sense ODN of ERK
on the activation of NF-IL-6 in Sko-007 cells by IL-6
3 讨 论
IL-6是影响多发性骨髓瘤发生和发展的一种非常重要的细胞因子。我们在MM细胞系Sko-007中观察到参与IL-6信号转导功能的蛋白激酶ERK(MAPK)以及转录因子STAT3和NF-IL-6在IL-6诱导下的显著活化,说明两条主要的IL-6信号转导途径Jak/STAT和Ras/NF-IL-6都可在Sko-007中诱导激活;不仅如此,Ras/MAPK/NF-IL-6途径还可以组成性激活状态存在,说明它不仅是Sko-007细胞的IL-6反应途径,而且也与细胞本身的生存有关。针对这两条途径的反义核酸在抑制效果上也存在一定差别:SATA3反义寡核苷酸只能微弱抑制IL-6诱导的STAT3的活化,而针对Ras途径中ERK的反义寡核苷酸几乎完全抑制了IL-6诱导的NF-IL-6的活化,说明“生存途径”中的信号分子对反义核酸抑制功能的反应性更强,同时也提示我们,蛋白激酶可能是优于转录因子的更好的拮抗剂设计目标靶位。
, 百拇医药
国家杰出青年科学基金(39925019)资助
宋伦,女,28岁,主要从事细胞因子信号转导的研究
参 考 文 献
1,Klein B. Update of gp130 cytokines in multiple myeloma. Curr Opin Hematol, 1998, 5: 186
2,宋 伦, 沈倍奋. IL-6信号转导的分子机制. 国外医学*免疫学分册, 1999, 22(2): 79
3,Ausubel FM, Kingston RE, Seidman JG, et al. Short protocols in molecular biology. 3rd ed. John Wiley&Sons,Inc., 1995, 17~23: 73
4,宋 伦, 黎 燕, 沈倍奋. 280位His残基对sIL-6R介导的IL-6信号转导功能的影响. 中国实验临床免疫学杂志, 1999, 5: 372
(1999-08-01收稿; 1999-10-03修回), 百拇医药