人冻存脐血移植的裸鼠模型
作者:刘红雨 兰炯采 陈军 陈强 陈宪辉 孙倩 甘茂周
单位:刘红雨 陈军(325000 温州医学院附属第一医院);兰炯采 陈强 陈宪辉 孙倩 甘茂周(中国医学院中国协和医科大学输血研究所)
关键词:造血干细胞移植;脐血;冻存;裸鼠
中国肺癌杂志000313 【摘要】 目的 探讨长期深低温冻存脐血的移植活性及干细胞在裸鼠体内的迁移规律。方法 选取30只BALB/C nu+裸鼠,随机分为3组。经致死量放射线照射后分别给予裸鼠人冻存后脐血单个核细胞、新鲜脐血以及生理盐水外周静脉输入,观察并比较小鼠存活情况和移植存活证据,采用PCR法及流式细胞术检测干细胞在小鼠体内的迁移、定居情况。结果 冻存脐血组小鼠存活率及存活时间均显著高于生理盐水组,而与新鲜脐血组无显著性差异(P>0.05);PCR法及流式细胞术检测小鼠体内人特异性基因及细胞均证实人冻存脐血已在小鼠骨髓内定居并植入存活,持续至少130?d;但冻存脐血组干细胞的迁移情况与新鲜脐血组有所差异,裸鼠的肝和肾不易出现人特异性基因。结论 冻存可长期保存干细胞活性,但可能影响干细胞表面定居相关粘附分子,从而影响其迁移行为。
, http://www.100md.com
The nude mice model of human cryopreserved umbilical cord blood transplantation
LIU Hongyu, LAN Jiongcai, CHEN Jun, CHEN Qiang, CHEN Xianhui, SUN Qian, GAN Maozhou. The First Affiliated Hospital of Wenzhou Medical College, Wenzhou, Zhejiang 325000, P.R.China
【Abstract】 Objective To evaluate the hematopoietic potential of long-term cryopreserved human umbilical cord blood as well as the migration of the stem cells in nude mice. Methods Thirty lethally irradiated BALB/C nu+ mice were randomized into 3 groups. One group was injected cryopreserved human umbilical cord blood cells intravenously and one group was injected fresh cord blood and the other one was injected normal saline as control. The survival rates of mice and the successful transplantation evidence were observed and compared among three groups. The migration of the stem cells was analyzed by PCR and fluid cytometry. Results The survival rate of the cryopreserved group was much higher than that of the saline group, but there was no significant difference between the fresh group and the cryopreserved group. The evidence of human hematopoiesis was observed by PCR and fluid cytometry and lasted for at least 130 days. In addition, the migration of the cryopreserved stem cells was not the same as that of fresh cord blood, where human gene was hardly detected in liver and kidneys. Conclusion Cryopreservation can keep the hematopoietic potential of cord blood for a long time, but may influence the adhesion molecular of the stem cells, hence influence the homing behavior of the stem cells.
, 百拇医药
【Key words】 Hematopoietic stem cell transplantation Umbilical cord blood Cryopreservation Nude mice
This work was supported in part by a grant from Scientific Research Foundation of Sichuan Health Department (No.970105) and a grant from Sichuan Scientific Technical Committee Fund (No.75).
1988年,Gluckman等报告了世界上首例脐血造血干细胞移植(简称脐血移植),将HLA相符的同胞脐血成功移植给一名5岁的Fanconis贫血患儿[1]。随后脐血移植在临床上得到迅速推广,迄今为止,全世界已用脐血成功移植达数百例,患者的造血和免疫重建稳定而全面,且移植物抗宿主病(graft vs host disease, GVHD)发生率低。目前,许多国家和地区已建立了脐血库,冷冻保存脐血达数万份。
, http://www.100md.com
脐血移植和脐血库的建立,常需分离出脐血单个核细胞和作深低温冻存。已有文献报道,脐血作长期冻存后,其CFU-GM、CFU-GEMM、BFU-E等仍有较高的回收率[2,3],而有关冻存干细胞进入宿主体内后的迁移、定居情况迄今未见有文献报道。我们采用BALB/C nu+裸鼠,建立脐血移植的小鼠模型,初步探讨脐血干细胞进入宿主体内后的迁移、定居规律,并比较了新鲜或冻存脐血单个核细胞移植裸鼠的规律及差异,现将结果报告如下。
1 材料与方法
1.1 脐血 采自足月顺产的健康产妇,自胎儿娩出后断脐,穿刺脐静脉,获取脐血。经羟乙基淀粉沉降法分离脐血单个核细胞[4]。采用二甲基亚砜(DMSO)为保护剂的阶段降温法冻存脐血,冷冻保护液含70%的RPMI?1640,10%的人白蛋白,20%的DMSO。复温:从液氮中取出脐血后即置42℃水浴中快速摇晃,1?min内完全融化。冻存前后分别以流式细胞仪检测CD34+细胞和作CFU-GM培养。
, 百拇医药
1.2 裸鼠 采用7~8周龄BALB/C nu+裸鼠(华西医科大学实验动物中心提供),雌雄各半。将裸鼠随机分为三组,冻存脐血组9只,新鲜脐血组9只,空白对照组12只,置于无特定病原体条件下饲养。
1.3 移植前放射及移植 采用60Co直线加速器进行移植前放射,照射剂量率为84.08?cGy/min,校正因子1.072,照射时间8.88?min,照射源距小鼠距离为60?cm,照射总剂量800?cGy。放射后3?h内由小鼠外周静脉输入人冻存复苏后的单个核细胞1.07×107~1.87×107(0.4~0.7?ml),对照组输入新鲜脐血单个核细胞1.0×107~2.0×107(0.2~0.4?ml)或等体积生理盐水。前两组所输单个核细胞数无统计学差异。每日观察小鼠存活情况,并断尾取血作小鼠外周血白细胞计数。
1.4 PCR法人特异性基因植入分析 采用酚-氯仿法及快速盐析法抽取小鼠肝、脾、肺、肾及外周血、骨髓DNA[5,6]。PCR反应体系包括:10×buffer 2.5?μl,dNTP各0.2?mmol/L,TaqDNA聚合酶1?U,模板DNA?800?ng,四条引物各25?pgmol,反应总体积25?μl。第一对引物:5′-AATTTCAGCTGACTAAACA-3′,5′-TTTAGTTAGGTGC-AGTTAT-3′,扩增人类17号染色体上的α-卫星序列,产物为850?bp;内对照引物序列:5′-GAAGTTGGGTGCTTGGAGAC-3′和5′-GAGACTGCTCCTAGAATCG-3′,扩增小鼠β-珠蛋白基因,产物为401?bp。于94℃预变性5?min后,94℃变性30?s,57℃退火30?s,72℃延伸2?min,循环30次后,72℃延伸7?min。扩增产物以2%琼脂糖凝胶,8V/CM电泳40?min,紫外透射仪下分析结果。
, http://www.100md.com
1.5 流式细胞仪检测小鼠体内人CD45+细胞 异硫氰酸荧光素(FITC)标记的鼠抗人CD45抗体与小鼠骨髓细胞悬液或外周血避光孵育,溶血、洗涤后,上机检测,cellquest软件分析结果。
2 结果
2.1 CD34+细胞计数及CFU-GM培养 冻存28?d后取出脐血,复温。行台盼兰染色,检测活细胞。台盼兰拒染率即为冻存回收率。本组冻存回收率为92.4%。冻存前后脐血单个核细胞悬液中CD34+细胞分别为0.57%±0.02%和0.61%±0.02%;新鲜脐血培养每1×106个细胞形成集落(176±16)个,冻存28?d复苏后培养形成集落(191±21)个。
2.2 小鼠存活率 空白对照组12只小鼠有8只于放射后7~15?d内死亡,其余4只也于60?d内死亡,死亡率为100%;新鲜脐血组9只,除为鉴定处死部分小鼠外,无一只死亡;冻存组9只,于移植后第14天死亡一只,其余8只全部存活,生存130余天无死亡。经χ2检验,冻存脐血组及新鲜脐血组小鼠与空白对照组小鼠存活率有显著性差异(P<0.05),而前两组间无显著性差异(P>0.05)。小鼠存活率曲线见图1。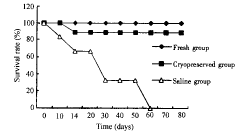
, 百拇医药
图 1 小鼠存活率曲线图
Fig 1 The curve of the mice survival rate
2.3 外周血白细胞计数 放射前小鼠白细胞计数为(16.003±1.778)×109/L。实验组及对照组小鼠放射后外周血白细胞数均急剧下降,于放射后6~10?d降至最低,约(0.100~0.700)×109/L,10?d以后开始回升。对照组小鼠白细胞回升缓慢,升至(2.000~4.000)×109/L后不再回升,直至死亡;脐血组回升迅速,至移植后30?d左右已接近放射前水平(图2)。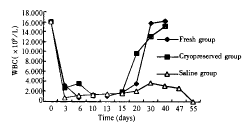
图 2 小鼠外周血白细胞计数变化
Fig 2 WBC count of the peripheral blood in the mice
, http://www.100md.com
2.4 人类特异性基因植入鉴定 新鲜脐血移植后3?d,处死小鼠的骨髓、肝、脾、肺、肾等多个器官内均查出850?bp人类特异性基因,此后脏器中人DNA逐渐减弱甚至消失,仅在骨髓及外周血中持续存在,至今已130?d仍能查到;冻存脐血移植与新鲜脐血移植干细胞迁移规律有所不同,直到20?d后才在肝脏及肾中查出人类特异性基因,至130?d时仍能查到(图3)。
图 3 PCR方法检测小鼠体内人特异性基因
A:新鲜脐血移植后3?d;B:冻存脐血移植后3?d;C:新鲜脐血移植后20?d;D:冻存脐血移植后20?d;E:新鲜脐血移植后130?d;F:冻存脐血移植后130?d。
1:脐血;2:骨髓;3:外周血;4:肝脏;5:脾;6:肺;7:肾;8:标准分子量
, http://www.100md.com
Fig 3 Human gene detection in the mice by PCR
A: Fresh cord blood (FCB) 3 days; B: Cryopreserved cord blood (CCB) 3 days; C: FCB 20 days; D: CCB 20 days; E: FCB 130 days; F: CCB 130 days.
1: Umbilical cord blood; 2: Bone marrow; 3: Peripheral blood; 4: Liver; 5: Spleen; 6: Lung; 7: Kidney; 8: Marker
2.5 小鼠体内人特异性CD45+细胞检测 在移植后80?d左右,小鼠骨髓中人CD45+细胞保持在0.1%~3%之间,以后缓慢下降,至移植后160?d及130?d仍能查到CD45+细胞,约在0.1%~0.22%之间。
, 百拇医药
3 讨论
理想的脐血低温保存方法是应用程控降温仪,液氮保存,目的是使干细胞能缓慢地通过“相变点”,减轻低温所造成的损伤。我们采用DMSO作为保护剂,以阶段降温法逐渐降温,控制降温速度在1~4?℃/min,最后液氮保存,复苏后脐血回收率好,CFU-GM培养显示集落生长良好,移植小鼠后的存活率和存活时间均显著高于对照组,而与新鲜脐血组无差异,这进一步证明冻存能很好地保存脐血干细胞的造血活性。
为了进一步研究冻存干细胞进入宿主体后的迁移、定居情况,以及与新鲜脐血干细胞是否有区别,我们在干细胞移植后的不同时间分别检测了小鼠的骨髓、外周血、肝、脾、肺、肾等器官、组织中人的基因和细胞的存在与否及其变化情况。以往的文献报道,新鲜脐血移植于重症联合免疫缺陷(SCID)小鼠后3?d,小鼠肺的支气管旁和血管旁淋巴结便出现大量的脐血细胞浸润;此后,脐血细胞又陆续出现于脾、肝、肾等器官,最后在小鼠的骨髓中长期定居,并增殖、分化为髓系和淋巴系细胞[7~9]。我们观察到的结果与此类似,在输入脐血后,人的脐血细胞先散布于小鼠全身多个器官,随后,器官中脐血细胞逐渐减少甚至消失,仅持续存在于小鼠骨髓达130?d以上,反映出脐血干细胞在小鼠体内迁移、定居的动态变化过程。同时,我们还观察到冻存后的脐血干细胞在小鼠体内的迁移、定居情况不同于新鲜脐血:骨髓、脾、肺等器官中较易出现人类细胞,而肝、肾等器官中始终不易出现。现在已经知道,深低温能影响淋巴细胞表面的某些分子而减低其反应性和刺激性[10],因此可以推测,深低温或防冻剂亦能影响脐血干细胞表面某些定居相关粘附分子,从而影响其进入宿主体内的迁移、定居行为,但并不影响其造血活性,然而这需要进一步的研究和论证。
, http://www.100md.com
本研究受四川省卫生厅科研基金(970105)和四川省科委基金(75)资助
参考文献
1,Gluckman E, Broxmeyer HE, Auerbach AD, et al. Hematopoietic reconstitution in a patient with Fanconis anemia by means of umbilical-cord blood from a HLA-identical sibling. N Engl J Med,1989,321(17)∶1174-1178.
2,Almici C, Carlo-Stella C, Wanger JE, et al. Clonogenic capacity and ex vivo expansion potential of umbilical cord blood progenitor cells are not impaired by cryopreservation. Bone Marrow Transplant,1997,19(5)∶1079-1084.
, 百拇医药
3,Broxmeyer HE, Cooper S. High efficiency recovery of immature hematopoietic progenitor cell with extensive proliferative capacity from human cord blood cryopreserved for 10 years. Clin Exp Immunol,1997,107(Suppl 1)∶45-53.
4,张洪泉.脐血造血细胞的分离与保存.中华血液学杂志,1992,13(3)∶180-181.
5,Ricordi C. Methods in cell transplantation. Austin: R.G. Lands Company,1995.351-353.
6,Warburton PE, Greig GM, Haaf T, et al. PCR amplification of chromosome-specific alpha satellite DNA: definition of centromeric STS markers and polymorphic analysis. Genomics,1991,11(5)∶324-333.
, 百拇医药
7,McCune JM, Namikawa R, Kaneshima H, et al. The SCID-hu mouse: murine model for the analysis of human hematolymphoid differentiation and function. Science,1988,241(9)∶1632-1639.
8,Fraster CC, Kaneshima H, Hansteen G, et al. Human allogeneic stem cell maintanance and differentiation in a long-term multilineage SCID-hu graft. Blood,1995,86(5)∶1680-1693.
9,Vormoor J, Lapidot T, Pflumio F, et al. Immature human cord blood progenitors engraft and proliferate to high levels in severe combined immunodeficient mice. Blood,1994,83(9)∶2489-2497.
10,韩颖,谭汉君,刘作斌,等.低温对人脐血淋巴细胞免疫活性的影响。实验血液学杂志,1995,3(2)∶210-211.
(收稿:2000-02-12 修回:2000-04-02), 百拇医药
单位:刘红雨 陈军(325000 温州医学院附属第一医院);兰炯采 陈强 陈宪辉 孙倩 甘茂周(中国医学院中国协和医科大学输血研究所)
关键词:造血干细胞移植;脐血;冻存;裸鼠
中国肺癌杂志000313 【摘要】 目的 探讨长期深低温冻存脐血的移植活性及干细胞在裸鼠体内的迁移规律。方法 选取30只BALB/C nu+裸鼠,随机分为3组。经致死量放射线照射后分别给予裸鼠人冻存后脐血单个核细胞、新鲜脐血以及生理盐水外周静脉输入,观察并比较小鼠存活情况和移植存活证据,采用PCR法及流式细胞术检测干细胞在小鼠体内的迁移、定居情况。结果 冻存脐血组小鼠存活率及存活时间均显著高于生理盐水组,而与新鲜脐血组无显著性差异(P>0.05);PCR法及流式细胞术检测小鼠体内人特异性基因及细胞均证实人冻存脐血已在小鼠骨髓内定居并植入存活,持续至少130?d;但冻存脐血组干细胞的迁移情况与新鲜脐血组有所差异,裸鼠的肝和肾不易出现人特异性基因。结论 冻存可长期保存干细胞活性,但可能影响干细胞表面定居相关粘附分子,从而影响其迁移行为。
, http://www.100md.com
The nude mice model of human cryopreserved umbilical cord blood transplantation
LIU Hongyu, LAN Jiongcai, CHEN Jun, CHEN Qiang, CHEN Xianhui, SUN Qian, GAN Maozhou. The First Affiliated Hospital of Wenzhou Medical College, Wenzhou, Zhejiang 325000, P.R.China
【Abstract】 Objective To evaluate the hematopoietic potential of long-term cryopreserved human umbilical cord blood as well as the migration of the stem cells in nude mice. Methods Thirty lethally irradiated BALB/C nu+ mice were randomized into 3 groups. One group was injected cryopreserved human umbilical cord blood cells intravenously and one group was injected fresh cord blood and the other one was injected normal saline as control. The survival rates of mice and the successful transplantation evidence were observed and compared among three groups. The migration of the stem cells was analyzed by PCR and fluid cytometry. Results The survival rate of the cryopreserved group was much higher than that of the saline group, but there was no significant difference between the fresh group and the cryopreserved group. The evidence of human hematopoiesis was observed by PCR and fluid cytometry and lasted for at least 130 days. In addition, the migration of the cryopreserved stem cells was not the same as that of fresh cord blood, where human gene was hardly detected in liver and kidneys. Conclusion Cryopreservation can keep the hematopoietic potential of cord blood for a long time, but may influence the adhesion molecular of the stem cells, hence influence the homing behavior of the stem cells.
, 百拇医药
【Key words】 Hematopoietic stem cell transplantation Umbilical cord blood Cryopreservation Nude mice
This work was supported in part by a grant from Scientific Research Foundation of Sichuan Health Department (No.970105) and a grant from Sichuan Scientific Technical Committee Fund (No.75).
1988年,Gluckman等报告了世界上首例脐血造血干细胞移植(简称脐血移植),将HLA相符的同胞脐血成功移植给一名5岁的Fanconis贫血患儿[1]。随后脐血移植在临床上得到迅速推广,迄今为止,全世界已用脐血成功移植达数百例,患者的造血和免疫重建稳定而全面,且移植物抗宿主病(graft vs host disease, GVHD)发生率低。目前,许多国家和地区已建立了脐血库,冷冻保存脐血达数万份。
, http://www.100md.com
脐血移植和脐血库的建立,常需分离出脐血单个核细胞和作深低温冻存。已有文献报道,脐血作长期冻存后,其CFU-GM、CFU-GEMM、BFU-E等仍有较高的回收率[2,3],而有关冻存干细胞进入宿主体内后的迁移、定居情况迄今未见有文献报道。我们采用BALB/C nu+裸鼠,建立脐血移植的小鼠模型,初步探讨脐血干细胞进入宿主体内后的迁移、定居规律,并比较了新鲜或冻存脐血单个核细胞移植裸鼠的规律及差异,现将结果报告如下。
1 材料与方法
1.1 脐血 采自足月顺产的健康产妇,自胎儿娩出后断脐,穿刺脐静脉,获取脐血。经羟乙基淀粉沉降法分离脐血单个核细胞[4]。采用二甲基亚砜(DMSO)为保护剂的阶段降温法冻存脐血,冷冻保护液含70%的RPMI?1640,10%的人白蛋白,20%的DMSO。复温:从液氮中取出脐血后即置42℃水浴中快速摇晃,1?min内完全融化。冻存前后分别以流式细胞仪检测CD34+细胞和作CFU-GM培养。
, 百拇医药
1.2 裸鼠 采用7~8周龄BALB/C nu+裸鼠(华西医科大学实验动物中心提供),雌雄各半。将裸鼠随机分为三组,冻存脐血组9只,新鲜脐血组9只,空白对照组12只,置于无特定病原体条件下饲养。
1.3 移植前放射及移植 采用60Co直线加速器进行移植前放射,照射剂量率为84.08?cGy/min,校正因子1.072,照射时间8.88?min,照射源距小鼠距离为60?cm,照射总剂量800?cGy。放射后3?h内由小鼠外周静脉输入人冻存复苏后的单个核细胞1.07×107~1.87×107(0.4~0.7?ml),对照组输入新鲜脐血单个核细胞1.0×107~2.0×107(0.2~0.4?ml)或等体积生理盐水。前两组所输单个核细胞数无统计学差异。每日观察小鼠存活情况,并断尾取血作小鼠外周血白细胞计数。
1.4 PCR法人特异性基因植入分析 采用酚-氯仿法及快速盐析法抽取小鼠肝、脾、肺、肾及外周血、骨髓DNA[5,6]。PCR反应体系包括:10×buffer 2.5?μl,dNTP各0.2?mmol/L,TaqDNA聚合酶1?U,模板DNA?800?ng,四条引物各25?pgmol,反应总体积25?μl。第一对引物:5′-AATTTCAGCTGACTAAACA-3′,5′-TTTAGTTAGGTGC-AGTTAT-3′,扩增人类17号染色体上的α-卫星序列,产物为850?bp;内对照引物序列:5′-GAAGTTGGGTGCTTGGAGAC-3′和5′-GAGACTGCTCCTAGAATCG-3′,扩增小鼠β-珠蛋白基因,产物为401?bp。于94℃预变性5?min后,94℃变性30?s,57℃退火30?s,72℃延伸2?min,循环30次后,72℃延伸7?min。扩增产物以2%琼脂糖凝胶,8V/CM电泳40?min,紫外透射仪下分析结果。
, http://www.100md.com
1.5 流式细胞仪检测小鼠体内人CD45+细胞 异硫氰酸荧光素(FITC)标记的鼠抗人CD45抗体与小鼠骨髓细胞悬液或外周血避光孵育,溶血、洗涤后,上机检测,cellquest软件分析结果。
2 结果
2.1 CD34+细胞计数及CFU-GM培养 冻存28?d后取出脐血,复温。行台盼兰染色,检测活细胞。台盼兰拒染率即为冻存回收率。本组冻存回收率为92.4%。冻存前后脐血单个核细胞悬液中CD34+细胞分别为0.57%±0.02%和0.61%±0.02%;新鲜脐血培养每1×106个细胞形成集落(176±16)个,冻存28?d复苏后培养形成集落(191±21)个。
2.2 小鼠存活率 空白对照组12只小鼠有8只于放射后7~15?d内死亡,其余4只也于60?d内死亡,死亡率为100%;新鲜脐血组9只,除为鉴定处死部分小鼠外,无一只死亡;冻存组9只,于移植后第14天死亡一只,其余8只全部存活,生存130余天无死亡。经χ2检验,冻存脐血组及新鲜脐血组小鼠与空白对照组小鼠存活率有显著性差异(P<0.05),而前两组间无显著性差异(P>0.05)。小鼠存活率曲线见图1。

, 百拇医药
图 1 小鼠存活率曲线图
Fig 1 The curve of the mice survival rate
2.3 外周血白细胞计数 放射前小鼠白细胞计数为(16.003±1.778)×109/L。实验组及对照组小鼠放射后外周血白细胞数均急剧下降,于放射后6~10?d降至最低,约(0.100~0.700)×109/L,10?d以后开始回升。对照组小鼠白细胞回升缓慢,升至(2.000~4.000)×109/L后不再回升,直至死亡;脐血组回升迅速,至移植后30?d左右已接近放射前水平(图2)。

图 2 小鼠外周血白细胞计数变化
Fig 2 WBC count of the peripheral blood in the mice
, http://www.100md.com
2.4 人类特异性基因植入鉴定 新鲜脐血移植后3?d,处死小鼠的骨髓、肝、脾、肺、肾等多个器官内均查出850?bp人类特异性基因,此后脏器中人DNA逐渐减弱甚至消失,仅在骨髓及外周血中持续存在,至今已130?d仍能查到;冻存脐血移植与新鲜脐血移植干细胞迁移规律有所不同,直到20?d后才在肝脏及肾中查出人类特异性基因,至130?d时仍能查到(图3)。

图 3 PCR方法检测小鼠体内人特异性基因
A:新鲜脐血移植后3?d;B:冻存脐血移植后3?d;C:新鲜脐血移植后20?d;D:冻存脐血移植后20?d;E:新鲜脐血移植后130?d;F:冻存脐血移植后130?d。
1:脐血;2:骨髓;3:外周血;4:肝脏;5:脾;6:肺;7:肾;8:标准分子量
, http://www.100md.com
Fig 3 Human gene detection in the mice by PCR
A: Fresh cord blood (FCB) 3 days; B: Cryopreserved cord blood (CCB) 3 days; C: FCB 20 days; D: CCB 20 days; E: FCB 130 days; F: CCB 130 days.
1: Umbilical cord blood; 2: Bone marrow; 3: Peripheral blood; 4: Liver; 5: Spleen; 6: Lung; 7: Kidney; 8: Marker
2.5 小鼠体内人特异性CD45+细胞检测 在移植后80?d左右,小鼠骨髓中人CD45+细胞保持在0.1%~3%之间,以后缓慢下降,至移植后160?d及130?d仍能查到CD45+细胞,约在0.1%~0.22%之间。
, 百拇医药
3 讨论
理想的脐血低温保存方法是应用程控降温仪,液氮保存,目的是使干细胞能缓慢地通过“相变点”,减轻低温所造成的损伤。我们采用DMSO作为保护剂,以阶段降温法逐渐降温,控制降温速度在1~4?℃/min,最后液氮保存,复苏后脐血回收率好,CFU-GM培养显示集落生长良好,移植小鼠后的存活率和存活时间均显著高于对照组,而与新鲜脐血组无差异,这进一步证明冻存能很好地保存脐血干细胞的造血活性。
为了进一步研究冻存干细胞进入宿主体后的迁移、定居情况,以及与新鲜脐血干细胞是否有区别,我们在干细胞移植后的不同时间分别检测了小鼠的骨髓、外周血、肝、脾、肺、肾等器官、组织中人的基因和细胞的存在与否及其变化情况。以往的文献报道,新鲜脐血移植于重症联合免疫缺陷(SCID)小鼠后3?d,小鼠肺的支气管旁和血管旁淋巴结便出现大量的脐血细胞浸润;此后,脐血细胞又陆续出现于脾、肝、肾等器官,最后在小鼠的骨髓中长期定居,并增殖、分化为髓系和淋巴系细胞[7~9]。我们观察到的结果与此类似,在输入脐血后,人的脐血细胞先散布于小鼠全身多个器官,随后,器官中脐血细胞逐渐减少甚至消失,仅持续存在于小鼠骨髓达130?d以上,反映出脐血干细胞在小鼠体内迁移、定居的动态变化过程。同时,我们还观察到冻存后的脐血干细胞在小鼠体内的迁移、定居情况不同于新鲜脐血:骨髓、脾、肺等器官中较易出现人类细胞,而肝、肾等器官中始终不易出现。现在已经知道,深低温能影响淋巴细胞表面的某些分子而减低其反应性和刺激性[10],因此可以推测,深低温或防冻剂亦能影响脐血干细胞表面某些定居相关粘附分子,从而影响其进入宿主体内的迁移、定居行为,但并不影响其造血活性,然而这需要进一步的研究和论证。
, http://www.100md.com
本研究受四川省卫生厅科研基金(970105)和四川省科委基金(75)资助
参考文献
1,Gluckman E, Broxmeyer HE, Auerbach AD, et al. Hematopoietic reconstitution in a patient with Fanconis anemia by means of umbilical-cord blood from a HLA-identical sibling. N Engl J Med,1989,321(17)∶1174-1178.
2,Almici C, Carlo-Stella C, Wanger JE, et al. Clonogenic capacity and ex vivo expansion potential of umbilical cord blood progenitor cells are not impaired by cryopreservation. Bone Marrow Transplant,1997,19(5)∶1079-1084.
, 百拇医药
3,Broxmeyer HE, Cooper S. High efficiency recovery of immature hematopoietic progenitor cell with extensive proliferative capacity from human cord blood cryopreserved for 10 years. Clin Exp Immunol,1997,107(Suppl 1)∶45-53.
4,张洪泉.脐血造血细胞的分离与保存.中华血液学杂志,1992,13(3)∶180-181.
5,Ricordi C. Methods in cell transplantation. Austin: R.G. Lands Company,1995.351-353.
6,Warburton PE, Greig GM, Haaf T, et al. PCR amplification of chromosome-specific alpha satellite DNA: definition of centromeric STS markers and polymorphic analysis. Genomics,1991,11(5)∶324-333.
, 百拇医药
7,McCune JM, Namikawa R, Kaneshima H, et al. The SCID-hu mouse: murine model for the analysis of human hematolymphoid differentiation and function. Science,1988,241(9)∶1632-1639.
8,Fraster CC, Kaneshima H, Hansteen G, et al. Human allogeneic stem cell maintanance and differentiation in a long-term multilineage SCID-hu graft. Blood,1995,86(5)∶1680-1693.
9,Vormoor J, Lapidot T, Pflumio F, et al. Immature human cord blood progenitors engraft and proliferate to high levels in severe combined immunodeficient mice. Blood,1994,83(9)∶2489-2497.
10,韩颖,谭汉君,刘作斌,等.低温对人脐血淋巴细胞免疫活性的影响。实验血液学杂志,1995,3(2)∶210-211.
(收稿:2000-02-12 修回:2000-04-02), 百拇医药