紫杉醇对Lewis肺癌抑制作用及机理的研究
作者:林宜先 江曼 刘铭球 刁路明 夏冬 杨桂芳
单位:林宜先 杨桂芳(430071 武汉,湖北医科大学附属第二医院病理科);江曼 刘铭球 刁路明 夏冬(湖北医科大学病理学教研室)
关键词:紫杉醇;Lewis肺癌;抑制作用
中国肺癌杂志000312 【摘要】 目的 探讨紫杉醇对Lewis肺癌生长和转移的抑制作用。方法 将Lewis肺癌细胞接种于C57BL/6小鼠皮下,腹腔注射紫杉醇10?mg/kg,连续10?d。处理动物后测量治疗组及对照组皮下瘤重、肺转移灶计数,应用流式细胞术测定肿瘤细胞凋亡率,并进行光镜和电镜观察。结果 对照组和治疗组皮下瘤重分别为(2.833±0.074)g和(0.588±0.040)g(P<0.01),肺转移灶计数分别为(5.500±0.926)个和(1.167±0.753)个(P<0.01),肿瘤细胞凋亡率分别为9.002%和25.772%(P<0.01)。电镜观察紫杉醇组可见典型的凋亡细胞和凋亡小体。结论 紫杉醇可明显抑制小鼠Lewis肺癌的生长和转移,并可诱导肿瘤细胞凋亡。
, 百拇医药
A study of paclitaxel on inhibiting effects and mechanisms for Lewis lung carcinoma
LIN Yixian*, JIANG Man, LIU Mingqiu, DIAO Luming, XIA Dong, YANG Guifang. *Department of Pathology, The Affiliated Second Hospital, Hubei Medical University, Wuhan, Hubei 430071, P.R.China
【Abstract】 Objective To research the inhibitory effect and mechanisms of paclitaxel on Lewis lung carcinoma(LLC) of C57BL/6 mice. Methods LLC cells were inoculated subcutaneously into C57BL/6 mice. Paclitaxel (10?mg/kg) was injected intraperitoneally in the treatment group for ten days. Then the growth and metastasis of LLC were observed and the apoptotic characteristics of LLC cells were detected by electron microscopy and flowcytes assay. Results The average weights of the tumors in treatment group and control group were (2.833±0.074) g and (0.588±0.040) g (P<0.01), the average numbers of lung metastasis were 5.500±0.926 and 1.167±0.753 (P<0.01), and the ratio of apoptosis of LLC cells were 9.002% and 25.772%(P<0.01), respectively. Some typical apoptotic cells and apoptotic bodies were observed through electron microscope. Conclusion Paclitaxel can effectively inhibit the growth, development and metastasis of the implanted LLC in C57BL/6 mice and it can induce apoptosis of the tumor cells apparently.
, 百拇医药
【Key words】 Paclitaxel Lewis lung carcinoma Inhibiting effect
This work was supported in part by a grant from Hubei Natural Science Fund (to Liu Mingqiu)(94J080) and a grant from Hubei Scientific Administer Committee (to Liu Mingqiu)(962P1106).
肺癌是严重威胁人类健康和生命的恶性肿瘤之一,其发病率及死亡率正迅速上升,而化疗仍然是治疗肺癌的主要方法之一。紫杉醇是近年来应用于临床的一种新型抗癌药物,体内外实验均证明它对多种肿瘤有较好的治疗作用。有关紫杉醇对肺癌的作用文献报道不多,本研究以接种Lewis肺癌细胞的C57BL/6小鼠为模型,探讨紫杉醇在动物体内对肺癌的抑制作用,旨在为其临床应用提供一些理论和实验依据。
, 百拇医药
1 材料与方法
1.1 实验动物 C57BL/6小鼠20只,雌雄各半,体重18~22?g,购自中国医学科学院医学实验动物研究所。紫杉醇注射液由中国医学科学院药物研究所方起程老师惠赠。
1.2 瘤细胞悬液制备 荷瘤小鼠断颈处死,无菌取出体内传代15?d左右的Lewis肺癌组织块,剔除包膜及出血坏死组织后将瘤组织剪成小块,加适量含10%新生牛血清的RPMI-1640培养液,匀浆制悬液,调细胞浓度为2.5×106个/ml。
1.3 动物模型 每只C57BL/6小鼠于右腋皮下接种Lewis肺癌细胞悬液0.5?ml(1.25×106个癌细胞),将动物随机分成2组,每组10只,雌雄各5只。接种后第五天起,对照组每日每只腹腔注射生理盐水0.2?ml,治疗组每日每只腹腔注射紫杉醇l0?mg/kg,均连续10?d。接种后第18天全部断颈处死。
, 百拇医药
1.4 肿瘤体积动态观察 接种后第7天起,每隔一日用游标卡尺测量肿瘤的最长径a和最短径b,以公式v=ab2/2计算肿瘤体积并绘制增长曲线。
1.5 肿瘤重量测量 动物处死后,完整剥离皮下瘤结节,用精度为1 mg的天平称重。
1.6 肺转移灶计数 采用铁苏木素大体染色透明计数法[1]。在放大镜下计数染成黑色的肺转移灶。
1.7 肺癌细胞凋亡率及细胞周期的检测 瘤组织取出后除去出血坏死组织,剪成糊状,按流式细胞仪检测要求常规处理标本,调细胞浓度为1×106/ml,以EB综合染液行“一步法”荧光染色4℃?30?min,上机检测分析细胞凋亡率和细胞周期。
1.8 光镜和透射电镜观察肺癌组织的形态及超微结构改变。
, 百拇医药
1.9 统计学处理 两组瘤重及肺转移灶计数的比较用t检验,凋亡率的比较用χ2检验。
2 结果
2.1 肿瘤体积及重量的变化 图1显示两组肿瘤体积增长曲线。对照组增长曲线陡直,治疗组增长曲线平缓,并位于对照组曲线下方。两组相应数据比较差异有显著性(P<0.05)。接种18?d后,两组瘤重分别为(2.833±0.074)g和(0.588±0.040)g,差异有显著性(P<0.01)。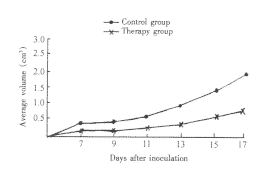
图1 肿瘤体积增长曲线
Fig 1 Curve of tumor volume increas
2.2 肺转移灶计数 对照组和治疗组肺转移灶平均分别为5.500±0.926和1.167±0.753,差异有显著性(P<0.01)。
, 百拇医药
2.3 凋亡率及细胞周期检测 治疗组凋亡率为25.772%,显著高于对照组的9.002%(P<0.01)。治疗组细胞周期各时相细胞数为G0/G1期80.266%,S期5.900%,G2/M期13.834%,对照组各期细胞数分别为92.326%、5.020%、2.654%。两组G2/M期细胞数差异有显著性(P<0.01),而G0/G1及S期细胞数两组间差异无显著性(P<0.05)。
2.4 组织学观察 对照组(图2、3)瘤组织边界不清,细胞密集排列,异型性明显,核分裂像多见。电镜见瘤细胞核大,不规则,核仁偏位或与核膜粘连,细胞器不发达。治疗组(图4、5)瘤组织中心及边缘常见灶状或大片状坏死,伴有炎性细胞浸润,纤维结缔组织增生并形成包裹。细胞间距增宽,部分核固缩,核分裂像较少。电镜下见瘤细胞核小而致密,核切迹少,核仁小,细胞器发达,部分线粒体扩张。可见细胞凋亡。
, 百拇医药
图2 对照组:癌细胞密集,边缘不清,浸润肌组织。HE×200
Fig 2 Control group: Dense cancer cells which had a vague border invased muscle tissue. HE×200
图3 对照组:癌细胞核大,形状不规则,核常染色质增多,核仁偏位或与核膜粘连,粗面内质网不发达,游离核糖体多。TEM×7000
Fig 3 Control group: Cancer cell had a large unregular nuclear, which had a increased euchromatin, unusual nucleolus site, rare rough surfaced endoplasmic reticulum and increased free ribosome. TEM×7000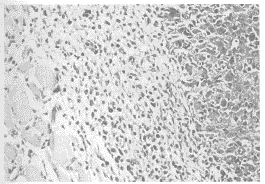
, 百拇医药
图4 治疗组:癌细胞边缘清晰,与肌组织间存在由炎性细胞和增生的纤维组织形成的反应带。HE×200
Fig 4 Treatment group: Cancer cell had a definite border. Response band consisting of inflammatory cells and fibrosis hyperplasia existed between muscle tissue and cancer tissue. HE×200
图5 治疗组:凋亡肿瘤细胞(箭头所示)被邻近肿瘤细胞吞噬。TEM×7000
Fig 5 Treatment group: Cancer cell engulfed apoptotic cell (arrow). TEM×7000
, 百拇医药
3 讨论
紫杉醇是1971年在美国首次从短叶紫杉树皮中提取的一种天然抗癌药,体外实验证实,紫杉醇常在低于人血清所能达到的浓度时,对人的卵巢癌、乳腺癌、头颈癌、前列腺癌、肺癌、白血病等均有细胞毒作用[2,3]。动物体内实验中紫杉醇也表现出了较好的抗瘤活性。韩锐等[4]以紫杉醇l0?mg/kg腹腔连续给药l0?d治疗小鼠黑色素瘤B16和肉瘤S180,瘤重明显降低。Sharma等[5]将紫杉醇用于接种B16F10恶性黑色素瘤的C57BL/6小鼠的治疗,肿瘤体积明显缩小,生存期明显延长。但关于紫杉醇对肺癌抑制作用较全面观察的报导甚少。本研究观察到治疗组肿瘤生长缓慢,体积和重量的增长均明显受抑制,肺部转移灶较对照组明显减少,组织学观察呈现瘤组织生长受抑、坏死明显等特点,均表明紫杉醇在动物体内对Lewis肺癌的生长和转移有显著的抑制作用。
紫杉醇的抗癌机理十分独特,它作用于肿瘤细胞微管[6],是一种有丝分裂抑制剂,但又与长春碱类不同。后者是微管聚合抑制物,诱导微管蛋白解聚 ,抑制有丝分裂纺锤丝形成,而紫杉醇则可选择性地与微管结合,促进微管蛋白双聚体聚合为多聚体并抑制解聚。由于正常有丝分裂终末相要求在纺锤体与染色体附着点上发生微管解聚,所以紫杉醇可通过阻止这一解聚过程而干扰肿瘤细胞有丝分裂,使瘤细胞周期阻滞于G2/M期而抑制肿瘤细胞增殖。另外,紫杉醇的抗瘤作用还与其诱导肿瘤细胞凋亡有关。Bhalla等[7]发现紫杉醇诱发早幼粒细胞性白血病细胞凋亡发生在分裂期阻滞之后,Donaldson等[8]发现紫杉醇对细胞周期同步在G2/M期的细胞可在20?h内诱发凋亡。本实验观察到紫杉醇有明显的诱导肿瘤细胞凋亡的作用。治疗组电镜下可见典型的凋亡细胞和凋亡小体。流式细胞术检测治疗组凋亡率较对照组明显上升,说明紫杉醇的诱凋亡作用是十分突出的。另外,治疗组G2/M期细胞明显增多,达13.834%,表明紫杉醇能使肺癌细胞阻滞于G2/M期。G2/M期细胞增多,可能激活某些促凋亡信号传递系统而使瘤细胞发生凋亡。我们认为细胞分裂期阻滞可能是凋亡发生的重要前提。
, 百拇医药
本研究受湖北省自然科学基金(94J080)与湖北省科委重点科研课题(962P1106)资助
参考文献
1,Qian SS, Gao J, Wang JX. A new method of counting experimental metastasis foci of lung. Cancer Res Prev Treat,1986,3(3)∶146-149.
2,Braakhuis BJM, Hill BT, Dietel M, et al. In vitro antiproliferative activity of docetaxel, paclitaxel and cisplatin against human tumor and normal bone marrow cells. Anticancer Res, 1994,14(1A)∶205-208.
, http://www.100md.com
3,Daniel D, VonHoff MD. Send this patient's tumor for culture and sensitivity. New Engl J Med,1983,308(3)∶154-155.
4,韩锐,何小庆,刘红岩,等.紫杉醇的抗肿瘤作用、药理及药代动力学研究.全国肿瘤防治学术讨论会论文集.北京:中国科技出版社,1989.3-7.
5,Sharma D, Chelvi TP, Kaur J, et al. Novel Taxol formulation:polyvinylpyrrolidone nanoparticle-encapsulated taxol for drug delivery in cancer therapy. Oncol Res,1996,8(7-8)∶281-286.
6,Rowinsky EK, Cazenave LA, Donehower RC. Taxol: a novel investigational antimicrotuble agent. J Natl Cancer Inst, 1990,82(15)∶1247-1259.
, http://www.100md.com
7,Bhalla K, Ibrado AM, Tourkina E, et al. Taxol induces internucleosomal DNA fragmentation associated with programmed cell death in human myeloid leukemia cell. Leukemia, 1993,7(4)∶563-568.
8,Donaldson KL, Godlsby G, Kiener DA, et al. Activation of p34cdc2 coincident with taxol induced apoptosis. Cell Growth Differ,1994,5(10)∶1041-1050.
(收稿:1999-11-01 修回:2000-02-28), 百拇医药
单位:林宜先 杨桂芳(430071 武汉,湖北医科大学附属第二医院病理科);江曼 刘铭球 刁路明 夏冬(湖北医科大学病理学教研室)
关键词:紫杉醇;Lewis肺癌;抑制作用
中国肺癌杂志000312 【摘要】 目的 探讨紫杉醇对Lewis肺癌生长和转移的抑制作用。方法 将Lewis肺癌细胞接种于C57BL/6小鼠皮下,腹腔注射紫杉醇10?mg/kg,连续10?d。处理动物后测量治疗组及对照组皮下瘤重、肺转移灶计数,应用流式细胞术测定肿瘤细胞凋亡率,并进行光镜和电镜观察。结果 对照组和治疗组皮下瘤重分别为(2.833±0.074)g和(0.588±0.040)g(P<0.01),肺转移灶计数分别为(5.500±0.926)个和(1.167±0.753)个(P<0.01),肿瘤细胞凋亡率分别为9.002%和25.772%(P<0.01)。电镜观察紫杉醇组可见典型的凋亡细胞和凋亡小体。结论 紫杉醇可明显抑制小鼠Lewis肺癌的生长和转移,并可诱导肿瘤细胞凋亡。
, 百拇医药
A study of paclitaxel on inhibiting effects and mechanisms for Lewis lung carcinoma
LIN Yixian*, JIANG Man, LIU Mingqiu, DIAO Luming, XIA Dong, YANG Guifang. *Department of Pathology, The Affiliated Second Hospital, Hubei Medical University, Wuhan, Hubei 430071, P.R.China
【Abstract】 Objective To research the inhibitory effect and mechanisms of paclitaxel on Lewis lung carcinoma(LLC) of C57BL/6 mice. Methods LLC cells were inoculated subcutaneously into C57BL/6 mice. Paclitaxel (10?mg/kg) was injected intraperitoneally in the treatment group for ten days. Then the growth and metastasis of LLC were observed and the apoptotic characteristics of LLC cells were detected by electron microscopy and flowcytes assay. Results The average weights of the tumors in treatment group and control group were (2.833±0.074) g and (0.588±0.040) g (P<0.01), the average numbers of lung metastasis were 5.500±0.926 and 1.167±0.753 (P<0.01), and the ratio of apoptosis of LLC cells were 9.002% and 25.772%(P<0.01), respectively. Some typical apoptotic cells and apoptotic bodies were observed through electron microscope. Conclusion Paclitaxel can effectively inhibit the growth, development and metastasis of the implanted LLC in C57BL/6 mice and it can induce apoptosis of the tumor cells apparently.
, 百拇医药
【Key words】 Paclitaxel Lewis lung carcinoma Inhibiting effect
This work was supported in part by a grant from Hubei Natural Science Fund (to Liu Mingqiu)(94J080) and a grant from Hubei Scientific Administer Committee (to Liu Mingqiu)(962P1106).
肺癌是严重威胁人类健康和生命的恶性肿瘤之一,其发病率及死亡率正迅速上升,而化疗仍然是治疗肺癌的主要方法之一。紫杉醇是近年来应用于临床的一种新型抗癌药物,体内外实验均证明它对多种肿瘤有较好的治疗作用。有关紫杉醇对肺癌的作用文献报道不多,本研究以接种Lewis肺癌细胞的C57BL/6小鼠为模型,探讨紫杉醇在动物体内对肺癌的抑制作用,旨在为其临床应用提供一些理论和实验依据。
, 百拇医药
1 材料与方法
1.1 实验动物 C57BL/6小鼠20只,雌雄各半,体重18~22?g,购自中国医学科学院医学实验动物研究所。紫杉醇注射液由中国医学科学院药物研究所方起程老师惠赠。
1.2 瘤细胞悬液制备 荷瘤小鼠断颈处死,无菌取出体内传代15?d左右的Lewis肺癌组织块,剔除包膜及出血坏死组织后将瘤组织剪成小块,加适量含10%新生牛血清的RPMI-1640培养液,匀浆制悬液,调细胞浓度为2.5×106个/ml。
1.3 动物模型 每只C57BL/6小鼠于右腋皮下接种Lewis肺癌细胞悬液0.5?ml(1.25×106个癌细胞),将动物随机分成2组,每组10只,雌雄各5只。接种后第五天起,对照组每日每只腹腔注射生理盐水0.2?ml,治疗组每日每只腹腔注射紫杉醇l0?mg/kg,均连续10?d。接种后第18天全部断颈处死。
, 百拇医药
1.4 肿瘤体积动态观察 接种后第7天起,每隔一日用游标卡尺测量肿瘤的最长径a和最短径b,以公式v=ab2/2计算肿瘤体积并绘制增长曲线。
1.5 肿瘤重量测量 动物处死后,完整剥离皮下瘤结节,用精度为1 mg的天平称重。
1.6 肺转移灶计数 采用铁苏木素大体染色透明计数法[1]。在放大镜下计数染成黑色的肺转移灶。
1.7 肺癌细胞凋亡率及细胞周期的检测 瘤组织取出后除去出血坏死组织,剪成糊状,按流式细胞仪检测要求常规处理标本,调细胞浓度为1×106/ml,以EB综合染液行“一步法”荧光染色4℃?30?min,上机检测分析细胞凋亡率和细胞周期。
1.8 光镜和透射电镜观察肺癌组织的形态及超微结构改变。
, 百拇医药
1.9 统计学处理 两组瘤重及肺转移灶计数的比较用t检验,凋亡率的比较用χ2检验。
2 结果
2.1 肿瘤体积及重量的变化 图1显示两组肿瘤体积增长曲线。对照组增长曲线陡直,治疗组增长曲线平缓,并位于对照组曲线下方。两组相应数据比较差异有显著性(P<0.05)。接种18?d后,两组瘤重分别为(2.833±0.074)g和(0.588±0.040)g,差异有显著性(P<0.01)。

图1 肿瘤体积增长曲线
Fig 1 Curve of tumor volume increas
2.2 肺转移灶计数 对照组和治疗组肺转移灶平均分别为5.500±0.926和1.167±0.753,差异有显著性(P<0.01)。
, 百拇医药
2.3 凋亡率及细胞周期检测 治疗组凋亡率为25.772%,显著高于对照组的9.002%(P<0.01)。治疗组细胞周期各时相细胞数为G0/G1期80.266%,S期5.900%,G2/M期13.834%,对照组各期细胞数分别为92.326%、5.020%、2.654%。两组G2/M期细胞数差异有显著性(P<0.01),而G0/G1及S期细胞数两组间差异无显著性(P<0.05)。
2.4 组织学观察 对照组(图2、3)瘤组织边界不清,细胞密集排列,异型性明显,核分裂像多见。电镜见瘤细胞核大,不规则,核仁偏位或与核膜粘连,细胞器不发达。治疗组(图4、5)瘤组织中心及边缘常见灶状或大片状坏死,伴有炎性细胞浸润,纤维结缔组织增生并形成包裹。细胞间距增宽,部分核固缩,核分裂像较少。电镜下见瘤细胞核小而致密,核切迹少,核仁小,细胞器发达,部分线粒体扩张。可见细胞凋亡。

, 百拇医药
图2 对照组:癌细胞密集,边缘不清,浸润肌组织。HE×200
Fig 2 Control group: Dense cancer cells which had a vague border invased muscle tissue. HE×200

图3 对照组:癌细胞核大,形状不规则,核常染色质增多,核仁偏位或与核膜粘连,粗面内质网不发达,游离核糖体多。TEM×7000
Fig 3 Control group: Cancer cell had a large unregular nuclear, which had a increased euchromatin, unusual nucleolus site, rare rough surfaced endoplasmic reticulum and increased free ribosome. TEM×7000

, 百拇医药
图4 治疗组:癌细胞边缘清晰,与肌组织间存在由炎性细胞和增生的纤维组织形成的反应带。HE×200
Fig 4 Treatment group: Cancer cell had a definite border. Response band consisting of inflammatory cells and fibrosis hyperplasia existed between muscle tissue and cancer tissue. HE×200

图5 治疗组:凋亡肿瘤细胞(箭头所示)被邻近肿瘤细胞吞噬。TEM×7000
Fig 5 Treatment group: Cancer cell engulfed apoptotic cell (arrow). TEM×7000
, 百拇医药
3 讨论
紫杉醇是1971年在美国首次从短叶紫杉树皮中提取的一种天然抗癌药,体外实验证实,紫杉醇常在低于人血清所能达到的浓度时,对人的卵巢癌、乳腺癌、头颈癌、前列腺癌、肺癌、白血病等均有细胞毒作用[2,3]。动物体内实验中紫杉醇也表现出了较好的抗瘤活性。韩锐等[4]以紫杉醇l0?mg/kg腹腔连续给药l0?d治疗小鼠黑色素瘤B16和肉瘤S180,瘤重明显降低。Sharma等[5]将紫杉醇用于接种B16F10恶性黑色素瘤的C57BL/6小鼠的治疗,肿瘤体积明显缩小,生存期明显延长。但关于紫杉醇对肺癌抑制作用较全面观察的报导甚少。本研究观察到治疗组肿瘤生长缓慢,体积和重量的增长均明显受抑制,肺部转移灶较对照组明显减少,组织学观察呈现瘤组织生长受抑、坏死明显等特点,均表明紫杉醇在动物体内对Lewis肺癌的生长和转移有显著的抑制作用。
紫杉醇的抗癌机理十分独特,它作用于肿瘤细胞微管[6],是一种有丝分裂抑制剂,但又与长春碱类不同。后者是微管聚合抑制物,诱导微管蛋白解聚 ,抑制有丝分裂纺锤丝形成,而紫杉醇则可选择性地与微管结合,促进微管蛋白双聚体聚合为多聚体并抑制解聚。由于正常有丝分裂终末相要求在纺锤体与染色体附着点上发生微管解聚,所以紫杉醇可通过阻止这一解聚过程而干扰肿瘤细胞有丝分裂,使瘤细胞周期阻滞于G2/M期而抑制肿瘤细胞增殖。另外,紫杉醇的抗瘤作用还与其诱导肿瘤细胞凋亡有关。Bhalla等[7]发现紫杉醇诱发早幼粒细胞性白血病细胞凋亡发生在分裂期阻滞之后,Donaldson等[8]发现紫杉醇对细胞周期同步在G2/M期的细胞可在20?h内诱发凋亡。本实验观察到紫杉醇有明显的诱导肿瘤细胞凋亡的作用。治疗组电镜下可见典型的凋亡细胞和凋亡小体。流式细胞术检测治疗组凋亡率较对照组明显上升,说明紫杉醇的诱凋亡作用是十分突出的。另外,治疗组G2/M期细胞明显增多,达13.834%,表明紫杉醇能使肺癌细胞阻滞于G2/M期。G2/M期细胞增多,可能激活某些促凋亡信号传递系统而使瘤细胞发生凋亡。我们认为细胞分裂期阻滞可能是凋亡发生的重要前提。
, 百拇医药
本研究受湖北省自然科学基金(94J080)与湖北省科委重点科研课题(962P1106)资助
参考文献
1,Qian SS, Gao J, Wang JX. A new method of counting experimental metastasis foci of lung. Cancer Res Prev Treat,1986,3(3)∶146-149.
2,Braakhuis BJM, Hill BT, Dietel M, et al. In vitro antiproliferative activity of docetaxel, paclitaxel and cisplatin against human tumor and normal bone marrow cells. Anticancer Res, 1994,14(1A)∶205-208.
, http://www.100md.com
3,Daniel D, VonHoff MD. Send this patient's tumor for culture and sensitivity. New Engl J Med,1983,308(3)∶154-155.
4,韩锐,何小庆,刘红岩,等.紫杉醇的抗肿瘤作用、药理及药代动力学研究.全国肿瘤防治学术讨论会论文集.北京:中国科技出版社,1989.3-7.
5,Sharma D, Chelvi TP, Kaur J, et al. Novel Taxol formulation:polyvinylpyrrolidone nanoparticle-encapsulated taxol for drug delivery in cancer therapy. Oncol Res,1996,8(7-8)∶281-286.
6,Rowinsky EK, Cazenave LA, Donehower RC. Taxol: a novel investigational antimicrotuble agent. J Natl Cancer Inst, 1990,82(15)∶1247-1259.
, http://www.100md.com
7,Bhalla K, Ibrado AM, Tourkina E, et al. Taxol induces internucleosomal DNA fragmentation associated with programmed cell death in human myeloid leukemia cell. Leukemia, 1993,7(4)∶563-568.
8,Donaldson KL, Godlsby G, Kiener DA, et al. Activation of p34cdc2 coincident with taxol induced apoptosis. Cell Growth Differ,1994,5(10)∶1041-1050.
(收稿:1999-11-01 修回:2000-02-28), 百拇医药