瑞血新防治肺癌化疗所致白细胞降低的多中心Ⅱ期临床随机试验
作者:周清华 邱萌 侯梅 任莉 李潞 易成 杨玉琼 刘伦旭 李志平 徐泳 罗德云 王奇侠 张力建 林江涛 石晶
单位:周清华 邱萌 侯梅 任莉 李潞 易成 杨玉琼 李志平 徐泳 罗德云(610041 成都,华西医科大学附属第一医院肿瘤中心);刘伦旭(胸心外科);王奇侠 张力建(北京肿瘤医院);林江涛(中日友好医院);石晶(第二军医大学长海医院)
关键词:肺肿瘤;重组人粒细胞集落刺激因子;瑞血新;化疗;白细胞下降
中国肺癌杂志000301 【摘要】 目的 观察国产重组人粒细胞集落刺激因子(rhG-CSF)瑞血新防治肺癌化疗所致白细胞(WBC)和中性粒细胞(ANC)减少的临床疗效和不良反应。方法 采用多中心、随机自身交叉对照试验方法将67例入组的肺癌患者随机分成AB组和BA组。AB组第一周期为治疗周期(A周期),采用化疗加瑞血新,第二周期为对照周期(B周期),单纯化疗不加瑞血新。BA组第一周期单纯化疗,第二周期加瑞血新。比较两周期WBC和ANC变化,并观察其不良反应。结果 本组67例患者中,6例因依从性等原因出组,1例因发热出组,余60例可供临床疗效评价,61例可作不良反应分析。A周期WBC下降及ANC下降持续的天数明显少于B周期(P<0.01);A周期WBC、ANC最低值显著高于B周期(P<0.01);化疗第21天时因WBC<4.0×109/L而延迟化疗的发生率A周期显著低于B周期(P<0.01)。不良反应总发生率为26.2%,主要为注射部位疼痛、硬结、乏力,一般均为轻度,不需作特殊处理。结论 瑞血新可明显降低肺癌患者化疗所致WBC和ANC减少的程度,缩短WBC和ANC下降的持续时间,促进WBC和ANC减少的早日恢复,有助于化疗按期进行,且不良反应轻微。
, 百拇医药
A multicenter randomized phase Ⅱ trial of domestic product of rhG-CSF(Rui Xue Xin) in preventing leukopenia caused by chemotherapy in patients with lung cancer
ZHOU Qinghua, QIU Meng, HOU Mei, REN Li, LI Lu, YI Cheng, YANG Yuqiong, LIU Lunxu, LI Zhiping, XU Yong, LUO Deyun, WANG Qixia, ZHANG Lijian, LIN Jiangtao, SHI Jing. Cancer Center, The First University Hospital, West China University of Medical Sciences, Chengdu, Sichuan 610041, P.R.China
, 百拇医药
【Abstract】 Objective To evaluate the effect and toxicity of the domestic product of rhG-CSF (Rui Xue Xin) in preventing leukopenia caused by chemotherapy in patients with lung cancer. Methods 67 patients in multicenter were randomly devided into AB group and BA group. The first cycle was a trial cycle (chemotherapy plus injection of Rui Xue Xin), and the second cycle was a control cycle (chemotherapy alone) in AB group. On the contrast, the first cycle was a control cycle, and the second cycle was a trial cycle in BA group. The changes of white blood cell (WBC) and absolute neutrophil counts (ANC), and the side effect of Rui Xue Xin were observed and compared between the trial cycle and control cycle. Results Of the 67 patients, 6 cases were out of the trial because of patient compliance, and the another one case due to fever, and the other 61 cases could be used to analyze and to evaluate the effects and toxicity of Rui Xue Xin. The duration of leukopenia and neutropenia in cycle A was significantly shorter than that in cycle B (P<0.01). The nadirs of WBC and ANC following chemotherapy were remarkably higher in cycle A than those in cycle B (P<0.01). The incidence of chemotherapy delay due to WBC<4.0×109/L on the 21st day after chemotherapy in cycle A was also significantly lower than that in cycle B (P<0.01). The total rate of side effects of Rui Xue Xin was 26.2%, including pain and scleroma on the injection sites, weakness, fever. But, all of them were mild and didn't need to give any treatment. Conclusion The results demonstrate that Rui Xue Xin is able to reduce the degree of leukopenia and neutropenia, and to shorten the duration of leukopenia and neutropenia caused by chemotherapy in patients with lung cancer. The toxicity is also slight.
, 百拇医药
【Key words】 Lung neoplasms rhG-CSF Rui Xue Xin Chemotherapy Leukopenia
利用基因工程技术生产的基因重组人粒细胞集落刺激因子(recombinant human granulocyte stimulating factor, rhG-CSF)在国内外均广泛应用于临床,并被证明具有刺激粒细胞集落形成单位(CFU-G)向人中性粒细胞的分化成熟,增加中性粒细胞的数量,并刺激其向外周血释放,对恶性肿瘤化疗后的粒细胞减少,具有明显预防和治疗作用[1~5]。根据卫生部药品评审中心(1997)卫药审中字第021号文下达的任务,我们对深圳市新鹏投资发展有限公司研制的rhG-CSF(商品名瑞血新)进行了多中心、单盲随机、自身交叉对照的Ⅱ期临床试验,以评价其防治化疗后白细胞和中性粒细胞降低的疗效,并观察其不良反应。现将结果报告如下。
1 材料与方法
, 百拇医药
1.1. 病例纳入标准 ①经病理学或细胞学检查证实,需行化疗治疗的肺癌患者;②年龄14~70岁;③一般状况评分KPS>60分,预计生存时间>3个月者;④无血液系统疾病。入组前两次检查白细胞总数(WBC)≥3.5×109/L,血小板计数(Plt)≥80.0×109/L;⑤入组前心、肝、肾等主要脏器功能正常;⑥既往未接受过放、化疗或放、化疗停止1个月以上;⑦自愿受试,已获得患者或家属知情同意。
1.2. 病例排除标准 ①孕妇和哺乳期妇女;②骨髓检查证实有肿瘤侵犯;③影响病情叙述、检查不合作的肺癌脑转移患者;④干扰骨、关节疼痛等不良反应观察的骨转移患者;⑤有高血压或低血压史者;⑥对本药或其它生物制品过敏者;⑦有其它化疗禁忌症者。
1.3 试验药品 本试验所用人重组粒细胞集落刺激因子(瑞血新)为深圳市新鹏投资发展有限公司研制,规格为150?μg/支注射液,批号9607,保存于4℃冰箱备用,有效期3年。
, 百拇医药
1.4 研究方法 本试验为多中心、单盲随机、自身交叉对照研究。
1.4.1 分组原则与方法 入组病例按统一规定的随机表,采用自身交叉对照,按入组顺序先后随机分入AB组和BA组,每1例患者连续观察2个周期。AB组患者第1周期为治疗周期(A周期),采用化疗加瑞血新治疗;第2周期为对照周期(B周期),采用单纯化疗。BA组第1周期为对照周期(B周期),采用单纯化疗;第2周期为治疗周期(A周期),采用化疗加瑞血新治疗。
1.4.2 化疗方案 采用CE(CBP?350?mg/m2静脉给药,第1天,VP-16?120?mg/m2静脉给药,第1~3天)或MVP(MMC?6?mg静脉给药,第1天,VDS?3?mg静脉给药,第1天,DDP?90~100?mg/m2静脉给药,第1或1~3天)方案,21?d为一周期。同一患者A、B周期化疗药物、剂量及用药顺序均完全一致。化疗中可酌情给予水化、止吐及其它对症处理。
, 百拇医药
1.4.3 瑞血新的用法及用量 所有患者自A周期化疗药物给药结束后48?h起,每日1次皮下注射瑞血新5?μg/kg,连续注射14?d或疗程>7?d后连续2次ANC≥5.0×109/L(或WBC≥10.0×109/L)停药。
1.5 观察项目 化疗前及化疗开始后隔日查血常规,每日测体温、脉搏、呼吸、血压各一次;每周期化疗前后各查肝、肾功能、尿常规、心电图各一次;每日详细记录有无不良反应,并记录其表现、发生时间、程度、处理经过及转归。不良反应按WHO毒性评价标准评定。
1.6 疗效评价参数及标准
1.6.1 根据化疗前及化疗开始后隔日检查血常规,以治疗周期开始给瑞血新的第1天为0天(对照周期则以相对应的时间为0天),分别计算出A周期与B周期逐次的外周血WBC、ANC计数的平均值,并绘出其相应的动态曲线。
, 百拇医药
1.6.2 分别计算出A周期与B周期病例的WBC及ANC最低值。
1.6.3 记录WBC<4.0×109/L、<3.0×109/L、<2.0×109/L、<1.0×109/L;ANC<2.0×109/L、<1.5×109/L、<1.0×109/L和<0.5×109/L的持续时间。
1.6.4 根据化疗第21天时WBC及ANC值,以及由于WBC及ANC降低而延迟化疗的病例数,计算化疗延迟的发生率。
1.7 统计学处理 逐日动态数据、WBC、ANC最低值,化疗第21天的WBC及ANC值的比较用交叉试验设计方差分析;WBC分别<1.0×109/L、<2.0×109/L、<3.0×109/L、<4.0×109/L及ANC分别<0.5×109/L、<1.0×109/L、<1.5×109/L和<2.0×109/L各持续天数的比较,用配伍比较秩和检验;化疗第21天WBC<4.0×109/L和ANC<2.0×109/L病例数比较,用配对χ2检验;逐日动态数据的趋势图用每个观察点均数在Excel软件下制作。以上统计学处理均在SAS for win 6.12中处理。
, 百拇医药
2 结果
2.1 一般资料 本研究共纳入67例,其中因经济原因出组3例,因患者依从性出组3例,因发热出组1例,故进入疗效评价60例,不良反应分析61例。该60例中男性37例,女性23例;年龄27~70岁,平均51.3岁;鳞癌24例,腺癌16例,大细胞癌6例,小细胞癌14例。有既往治疗史者21例,其中单纯化疗11例,单纯放疗5例,化疗加放疗5例。
2.2 瑞血新的临床疗效
2.2.1 研究周期与对照周期临床疗效比较 本研究60例A周期WBC最低值[(3.84±1.20)×109/L]显著高于B周期WBC最低值[(2.19±1.01)×109/L](P<0.01)(表1)。A周期ANC最低值[(2.57±1.41)×109/L]显著高于B周期ANC最低值[(1.08±0.73)×109/L](P<0.01)(表1)。A周期化疗第21天WBC值[(8.61±2.39)×109/L]明显高于B周期[(4.20±1.54)×109/L](P<0.01)(表2)。A周期化疗第21天ANC值[(6.49±1.51)×109/L]显著高于B周期[(2.68±1.50)×109/L](P<0.01)(表2)。A周期化疗第21天WBC<4.0×109/L病例数(6例)显著少于B周期(33例)(P<0.01)(表3)。A周期化疗第21天ANC<2.0×109/L病例数(4例)显著少于B周期(21例)(P<0.01)(表3)。A周期WBC分别<1.0×109/L、<2.0×109/L、<3.0×109/L或<4.0×109/L持续天数均显著少于B周期(P<0.01)(表4);A周期ANC分别<0.5×109/L、<1.0×109/L、<1.5×109/L和<2.0×109/L持续天数亦均显著少于B周期(P<0.01)(表5)。
, 百拇医药
2.2.2 A周期与B周期WBC及ANC变化趋势 A周期在注射瑞血新后WBC明显升高,并在用药后的第4天、第10~12天分别出现两个峰值,停药后WBC逐渐降低,B周期则在相对应的期间出现WBC明显降低,两组间比较均有非常显著差异(P<0.01)(图1)。A周期在注射瑞血新后ANC亦明显升高,并在用药后的第4天、第10~12天分别出现两个峰值,停药后ANC逐渐降低,B周期则在相对应的期间出现ANC明显降低,两组间比较均有非常显著差异(P<0.01)(图2)。
表1 A、B周期WBC、ANC最低值比较(×109/L,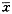 ±s)
±s)
Tab 1 Comparison of the nadirs of WBC and ANC between
cycle A and cycle B following chemotherapy (×109/L,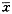 ±s) Items
±s) Items
, http://www.100md.com
n
Cycle A
Cycle B
P value
WBC
60
3.84±1.20
2.19±1.01
<0.01
ANC
60
2.57±1.41
1.08±0.73
, 百拇医药
<0.01
表2 A、B周期化疗第21天WBC、ANC值比较
(×109/L,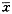 ±s)
±s)
Tab 2 Comparison of WBC and ANC on the 21st postchemo-
therapeutic days between cycle A and cycle B(×109/L,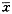 ±s) Items
±s) Items
n
Cycle A
, 百拇医药
Cycle B
P value
WBC
60
8.61±2.39
4.20±1.54
<0.01
ANC
60
6.49±1.51
2.68±1.50
<0.01
, 百拇医药 表3 A、B周期化疗第21天WBC<4.0×109/L、ANC<2.0×109/L病例数比较
Tab 3 Comparison of the cases of WBC<4.0×109/L,ANC<2.0×109/L on the 21st postchemotherapeutic days
between cycle A and cycle B Items
n
Cycle A
Cycle B
P value
WBC
, 百拇医药
60
6
33
<0.01
ANC
60
4
21
<0.01
表4 A、B周期WBC降低持续天数比较
Tab 4 Comparison of duration of leukopenia between cycle A and cycle B WBC
, http://www.100md.com
(×109/L)
n
Cycle A
Cycle B
P value
P50
P75
P95
P50
P75
P95
<1.0
60
, 百拇医药
0
0
0
0
0
1
>0.05
<2.0
60
0
0
1
0
4
, 百拇医药
9
<0.01
<3.0
60
0
0.5
3
6.5
10.5
18
<0.01
<4.0
60
, http://www.100md.com
0
2
8
13
16
21
<0.01
表5 A、B周期ANC降低持续天数比较
Tab 5 Comparison of duration of neutropenia between cycle A and cycle B WBC
(×109/L)
n
, 百拇医药
Cycle A
Cycle B
P value
P50
P75
P95
P50
P75
P95
<0.5
60
0
0
, 百拇医药
0
0
0
6
<0.01
<1.0
60
0
0
1.5
2
4
8
<0.01
, 百拇医药
<1.5
60
0
0
2
6
10
14
<0.01
<2.0
60
0
2
9
, 百拇医药
8
12
20
<0.01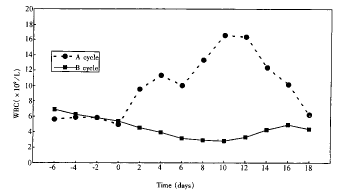
图1 A、B周期WBC平均值变化趋势
Fig 1 The change trends of WBC counts between cycle A and cycle B following chemotherapy. There were two peak values on the 4th and 10~14th day after injection of Rui Xue Xin in cycle A.
, 百拇医药
图2 A、B周期ANC平均值变化趋势
Fig 2 The change trends of ANC counts between cycle A and cycle B following chemotherapy. There were two peak values on the 4th and 10~14th day after injection of Rui Xue Xin in cycle A.
2.2.3 不良反应 在61例可分析不良反应的患者中,有16例共发生31例次不良反应,总的不良反应发生率为26.2%。主要不良反应有发热1例(1.6%),注射部位硬结8例(13.1%),乏力5例(8.2%),感冒样症状3例(4.9%),肌肉疼痛6例(9.8%),注射部位轻度疼痛8例(13.1%)。上述不良反应均为轻度,不需作特殊处理,均能完成治疗计划。全组未见有肝肾功能、心电图异常病例(表6)。
, 百拇医药
3 讨论
肿瘤化疗最常见的剂量限制性毒性是骨髓抑制,其中以白细胞和中性粒细胞的减少最为常见,既影响了化疗药物剂量强度的提高和化疗方案的按期进行,也增加了化疗所致白细胞、粒细胞减少所致感染和免疫功能降低的机会。人重组粒细胞集落刺激因子为解决这一肿瘤临床难题提供了有力手段[6~8]。人重组粒细胞集落刺激因子由中华仓鼠卵巢细胞表达,其氨基酸的排列顺序和糖链的位置与天然型rhG-CSF完全相同[9]。体外研究显示rhG-CSF能诱导人骨髓细胞形成粒细胞形成单位(CFU-G),集落的大小和数目都有增加。自1987年开始临床试用以来,已经证明rhG-CSF的主要作用是刺激中性粒细胞的增殖和分化,对肿瘤化疗、骨髓移植等所致的白细胞和中性粒细胞减少症,具有良好的预防和治疗作用[10~12]。
表6 与瑞血新有关的不良反应
Tab 6 The side effects after injection of Rui Xue Xin Side effects
, 百拇医药
No. of cases
(n=61)
%
Fever
1
1.6
Weakness
5
8.2
Symptom of cold
3
4.9
Muscular pain
, 百拇医药
6
9.8
Pain of injection site
8
13.1
Scleroma
8
13.1
Total number of cases
31
50.8
Total cases
, 百拇医药
16
26.2
本研究采用多中心、单盲随机、自身交叉对比方法,观察了深圳市新鹏投资发展公司研制的rhG-CSF(瑞血新)对肺癌化疗所致白细胞(WBC)和中性粒细胞(ANC)减少的防治作用及其不良反应。结果表明:瑞血新可明显减轻化疗过程中WBC、ABC下降的程度,缩短WBC、ANC降至正常值以下的持续时间,促进WBC、ANC恢复,明显减少了化疗第21天WBC<4.0×109/L的病例数和发生率,使化疗能按计划实施。本组A周期化疗第21天WBC<4.0×109/L的病例数为6例,B周期为33例,两组比较有非常显著差异(P<0.01);A周期化疗第21天ANC<2.0×109/L的病例数为4例,B周期为21例,两组间比较有非常显著差异(P<0.01);化疗第21天WBC平均值A周期为(8.61±2.39)×109/L,B周期为(4.20±1.54)×109/L;A周期化疗第21天ANC平均值为(6.49±1.51)×109/L,B周期为(2.68±1.50)×109/L,两组间比较均有非常显著差异(P<0.01)。此外,瑞血新对化疗过程中血小板、血色素的变化无明显影响,对外周血单核细胞亦无明显影响。这与国外的研究结果一致[10~12]。本研究还观察到rhG-CSF对化疗后WBC、ANC增加的刺激作用呈双峰曲线,与文献报道一致[6,10,11]。第1次升高可能是rhG-CSF促进骨髓中已成熟的中性粒细胞向外周血释放造成的,而第2次升高是对骨髓粒细胞系统造血祖细胞分化成熟的刺激和对粒系造血功能的激活造成的[3,4]。
, http://www.100md.com
文献报道rhG-CSF的不良反应在推荐剂量下多属轻中度,主要是发热,骨肌肉疼痛,乏力,注射局部红肿、硬结、皮疹等,较少反应有低血压、支气管痉挛、水肿和毛细血管渗漏等综合征[5~7]。本研究观察到本组不良反应主要为轻度发热、注射局部疼痛、轻度骨肌肉疼痛、乏力等。全组未见有肝肾功能、心电图异常以及低血压、支气管痉挛等严重反应。本研究证明深圳市新鹏投资发展有限公司研制的瑞血新临床应用安全、有效,为临床应用高剂量化疗治疗肺癌提供了可能性,值得临床推广应用。
参考文献
1,Mori K, Machida S, Yoshida T, et al. A phase Ⅱ study of irinotecan and infusional cisplatin with recombinant human granulocyte colony-stimulating factor support for advanced non-small-cell lung cancer. Cancer Chemother Pharmacol,1999,43(6)∶467-470.
, http://www.100md.com
2,Alexopoulos K, Kouroussis C, Androulakis N, et al. Docetaxel and granulocyte colony-stimulating factor in patients with advanced non-small-cell lung cancer previously treated with platinum-based chemotherapy: a multicenter phase Ⅱ trial. Cancer Chemother Pharmacol,1999,43(3)∶257-262.
3,Masters GA, Mauer AM, Hoffman PC, et al. A phase Ⅰ-Ⅱ study of paclitaxel, ifosfamide, and vinorelbine with filgrastim (rhG-CSF) support in advanced non-small cell lung cancer. Ann Oncol,1998,96(6)∶677-680.
, http://www.100md.com
4,Sandler A, Blanke C, Monaco F, et al. CODE (cisplatin, vincristine, doxorubicin, etoposide) plus granulocyte colony-stimulating factor in advanced non-small-cell lung cancer: a Hoosier Oncology Group phase Ⅱ trial. Am J Clin Oncol,1998,21(3)∶294-297.
5,Furuse K, Fukuoka M, Nishiwaki Y, et al. Phase Ⅲ study of intensive weekly chemotherapy with recombinant human granulocyte colony-stimulating factor versus standard chemotherapy in extensive-disease small-cell lung cancer. The Japan Clinial Oncology Group. J Clin Oncol,1998,16(6)∶2126-2132.
, 百拇医药
6,Okamoto H, Nagatomo A, Kunitoh H, et al. A phase Ⅰ clinical and pharmacologic study of a carboplatin and irinotecan regimen combined with recombinant human granulocyte-colony stimulating factor in the treatment of patients with advanced non-small cell lung carcinoma. Cancer,1998,82(11)∶2166-2172.
7,Ogawara M. Problems and recommendations for use of G-CSF in lung cancer patients with neutropenia after chemotherpay. Can To Kagaku Ryoho,1997,24(Suppl 3)∶439-444.
, http://www.100md.com
8,Scaqliotti GV, Ricardi U, Crino L, et la. Phase Ⅱ study of intensive chemotherapy with carboplatin, ifosfamide and etoposide plus recombinant human granulocyte colony-stimulating factor and sequential radiotherapy in locally advanced, unresectable non-small cell lung cancer. Cancer Chemother Pharmacol, 1996,38(6)∶561-565.
9,Nagata N, Tsuchiya M, Asano S, et al. Molecular cloning and expression of cDNA for human granulocyte colony stimulating factor. Nature,1986,319(6052)∶415-418.
, http://www.100md.com
10,Frasci G, Perillo G, Comella G, et al. Phase Ⅰ/Ⅱ study of carboplatin and oral etoposide with granulocyte colony stimulating facotr in advanced non-small cell lung cancer. Cancer,1995,75(7)∶1578-1588.
11,Tsuge I, Suzuki K, Moribe K, et al. Chemotherapy and granulocyte-colony stimulating factor for non-Hodgkin's lymphoma of the head an neck. Acta Otolaryngol Suppl Scockh,1996,525(1)∶129-134.
12,Nagai N, Takehara K, Murakami T, et al. Clinical evaluation of human granulocyte colony-stimulating factor in chemotherapy for ovarian cancer. Hiroshima J Med Sci,1995,44(4)∶99-103.
(收稿:1999-08-14 修回:1999-08-30), 百拇医药
单位:周清华 邱萌 侯梅 任莉 李潞 易成 杨玉琼 李志平 徐泳 罗德云(610041 成都,华西医科大学附属第一医院肿瘤中心);刘伦旭(胸心外科);王奇侠 张力建(北京肿瘤医院);林江涛(中日友好医院);石晶(第二军医大学长海医院)
关键词:肺肿瘤;重组人粒细胞集落刺激因子;瑞血新;化疗;白细胞下降
中国肺癌杂志000301 【摘要】 目的 观察国产重组人粒细胞集落刺激因子(rhG-CSF)瑞血新防治肺癌化疗所致白细胞(WBC)和中性粒细胞(ANC)减少的临床疗效和不良反应。方法 采用多中心、随机自身交叉对照试验方法将67例入组的肺癌患者随机分成AB组和BA组。AB组第一周期为治疗周期(A周期),采用化疗加瑞血新,第二周期为对照周期(B周期),单纯化疗不加瑞血新。BA组第一周期单纯化疗,第二周期加瑞血新。比较两周期WBC和ANC变化,并观察其不良反应。结果 本组67例患者中,6例因依从性等原因出组,1例因发热出组,余60例可供临床疗效评价,61例可作不良反应分析。A周期WBC下降及ANC下降持续的天数明显少于B周期(P<0.01);A周期WBC、ANC最低值显著高于B周期(P<0.01);化疗第21天时因WBC<4.0×109/L而延迟化疗的发生率A周期显著低于B周期(P<0.01)。不良反应总发生率为26.2%,主要为注射部位疼痛、硬结、乏力,一般均为轻度,不需作特殊处理。结论 瑞血新可明显降低肺癌患者化疗所致WBC和ANC减少的程度,缩短WBC和ANC下降的持续时间,促进WBC和ANC减少的早日恢复,有助于化疗按期进行,且不良反应轻微。
, 百拇医药
A multicenter randomized phase Ⅱ trial of domestic product of rhG-CSF(Rui Xue Xin) in preventing leukopenia caused by chemotherapy in patients with lung cancer
ZHOU Qinghua, QIU Meng, HOU Mei, REN Li, LI Lu, YI Cheng, YANG Yuqiong, LIU Lunxu, LI Zhiping, XU Yong, LUO Deyun, WANG Qixia, ZHANG Lijian, LIN Jiangtao, SHI Jing. Cancer Center, The First University Hospital, West China University of Medical Sciences, Chengdu, Sichuan 610041, P.R.China
, 百拇医药
【Abstract】 Objective To evaluate the effect and toxicity of the domestic product of rhG-CSF (Rui Xue Xin) in preventing leukopenia caused by chemotherapy in patients with lung cancer. Methods 67 patients in multicenter were randomly devided into AB group and BA group. The first cycle was a trial cycle (chemotherapy plus injection of Rui Xue Xin), and the second cycle was a control cycle (chemotherapy alone) in AB group. On the contrast, the first cycle was a control cycle, and the second cycle was a trial cycle in BA group. The changes of white blood cell (WBC) and absolute neutrophil counts (ANC), and the side effect of Rui Xue Xin were observed and compared between the trial cycle and control cycle. Results Of the 67 patients, 6 cases were out of the trial because of patient compliance, and the another one case due to fever, and the other 61 cases could be used to analyze and to evaluate the effects and toxicity of Rui Xue Xin. The duration of leukopenia and neutropenia in cycle A was significantly shorter than that in cycle B (P<0.01). The nadirs of WBC and ANC following chemotherapy were remarkably higher in cycle A than those in cycle B (P<0.01). The incidence of chemotherapy delay due to WBC<4.0×109/L on the 21st day after chemotherapy in cycle A was also significantly lower than that in cycle B (P<0.01). The total rate of side effects of Rui Xue Xin was 26.2%, including pain and scleroma on the injection sites, weakness, fever. But, all of them were mild and didn't need to give any treatment. Conclusion The results demonstrate that Rui Xue Xin is able to reduce the degree of leukopenia and neutropenia, and to shorten the duration of leukopenia and neutropenia caused by chemotherapy in patients with lung cancer. The toxicity is also slight.
, 百拇医药
【Key words】 Lung neoplasms rhG-CSF Rui Xue Xin Chemotherapy Leukopenia
利用基因工程技术生产的基因重组人粒细胞集落刺激因子(recombinant human granulocyte stimulating factor, rhG-CSF)在国内外均广泛应用于临床,并被证明具有刺激粒细胞集落形成单位(CFU-G)向人中性粒细胞的分化成熟,增加中性粒细胞的数量,并刺激其向外周血释放,对恶性肿瘤化疗后的粒细胞减少,具有明显预防和治疗作用[1~5]。根据卫生部药品评审中心(1997)卫药审中字第021号文下达的任务,我们对深圳市新鹏投资发展有限公司研制的rhG-CSF(商品名瑞血新)进行了多中心、单盲随机、自身交叉对照的Ⅱ期临床试验,以评价其防治化疗后白细胞和中性粒细胞降低的疗效,并观察其不良反应。现将结果报告如下。
1 材料与方法
, 百拇医药
1.1. 病例纳入标准 ①经病理学或细胞学检查证实,需行化疗治疗的肺癌患者;②年龄14~70岁;③一般状况评分KPS>60分,预计生存时间>3个月者;④无血液系统疾病。入组前两次检查白细胞总数(WBC)≥3.5×109/L,血小板计数(Plt)≥80.0×109/L;⑤入组前心、肝、肾等主要脏器功能正常;⑥既往未接受过放、化疗或放、化疗停止1个月以上;⑦自愿受试,已获得患者或家属知情同意。
1.2. 病例排除标准 ①孕妇和哺乳期妇女;②骨髓检查证实有肿瘤侵犯;③影响病情叙述、检查不合作的肺癌脑转移患者;④干扰骨、关节疼痛等不良反应观察的骨转移患者;⑤有高血压或低血压史者;⑥对本药或其它生物制品过敏者;⑦有其它化疗禁忌症者。
1.3 试验药品 本试验所用人重组粒细胞集落刺激因子(瑞血新)为深圳市新鹏投资发展有限公司研制,规格为150?μg/支注射液,批号9607,保存于4℃冰箱备用,有效期3年。
, 百拇医药
1.4 研究方法 本试验为多中心、单盲随机、自身交叉对照研究。
1.4.1 分组原则与方法 入组病例按统一规定的随机表,采用自身交叉对照,按入组顺序先后随机分入AB组和BA组,每1例患者连续观察2个周期。AB组患者第1周期为治疗周期(A周期),采用化疗加瑞血新治疗;第2周期为对照周期(B周期),采用单纯化疗。BA组第1周期为对照周期(B周期),采用单纯化疗;第2周期为治疗周期(A周期),采用化疗加瑞血新治疗。
1.4.2 化疗方案 采用CE(CBP?350?mg/m2静脉给药,第1天,VP-16?120?mg/m2静脉给药,第1~3天)或MVP(MMC?6?mg静脉给药,第1天,VDS?3?mg静脉给药,第1天,DDP?90~100?mg/m2静脉给药,第1或1~3天)方案,21?d为一周期。同一患者A、B周期化疗药物、剂量及用药顺序均完全一致。化疗中可酌情给予水化、止吐及其它对症处理。
, 百拇医药
1.4.3 瑞血新的用法及用量 所有患者自A周期化疗药物给药结束后48?h起,每日1次皮下注射瑞血新5?μg/kg,连续注射14?d或疗程>7?d后连续2次ANC≥5.0×109/L(或WBC≥10.0×109/L)停药。
1.5 观察项目 化疗前及化疗开始后隔日查血常规,每日测体温、脉搏、呼吸、血压各一次;每周期化疗前后各查肝、肾功能、尿常规、心电图各一次;每日详细记录有无不良反应,并记录其表现、发生时间、程度、处理经过及转归。不良反应按WHO毒性评价标准评定。
1.6 疗效评价参数及标准
1.6.1 根据化疗前及化疗开始后隔日检查血常规,以治疗周期开始给瑞血新的第1天为0天(对照周期则以相对应的时间为0天),分别计算出A周期与B周期逐次的外周血WBC、ANC计数的平均值,并绘出其相应的动态曲线。
, 百拇医药
1.6.2 分别计算出A周期与B周期病例的WBC及ANC最低值。
1.6.3 记录WBC<4.0×109/L、<3.0×109/L、<2.0×109/L、<1.0×109/L;ANC<2.0×109/L、<1.5×109/L、<1.0×109/L和<0.5×109/L的持续时间。
1.6.4 根据化疗第21天时WBC及ANC值,以及由于WBC及ANC降低而延迟化疗的病例数,计算化疗延迟的发生率。
1.7 统计学处理 逐日动态数据、WBC、ANC最低值,化疗第21天的WBC及ANC值的比较用交叉试验设计方差分析;WBC分别<1.0×109/L、<2.0×109/L、<3.0×109/L、<4.0×109/L及ANC分别<0.5×109/L、<1.0×109/L、<1.5×109/L和<2.0×109/L各持续天数的比较,用配伍比较秩和检验;化疗第21天WBC<4.0×109/L和ANC<2.0×109/L病例数比较,用配对χ2检验;逐日动态数据的趋势图用每个观察点均数在Excel软件下制作。以上统计学处理均在SAS for win 6.12中处理。
, 百拇医药
2 结果
2.1 一般资料 本研究共纳入67例,其中因经济原因出组3例,因患者依从性出组3例,因发热出组1例,故进入疗效评价60例,不良反应分析61例。该60例中男性37例,女性23例;年龄27~70岁,平均51.3岁;鳞癌24例,腺癌16例,大细胞癌6例,小细胞癌14例。有既往治疗史者21例,其中单纯化疗11例,单纯放疗5例,化疗加放疗5例。
2.2 瑞血新的临床疗效
2.2.1 研究周期与对照周期临床疗效比较 本研究60例A周期WBC最低值[(3.84±1.20)×109/L]显著高于B周期WBC最低值[(2.19±1.01)×109/L](P<0.01)(表1)。A周期ANC最低值[(2.57±1.41)×109/L]显著高于B周期ANC最低值[(1.08±0.73)×109/L](P<0.01)(表1)。A周期化疗第21天WBC值[(8.61±2.39)×109/L]明显高于B周期[(4.20±1.54)×109/L](P<0.01)(表2)。A周期化疗第21天ANC值[(6.49±1.51)×109/L]显著高于B周期[(2.68±1.50)×109/L](P<0.01)(表2)。A周期化疗第21天WBC<4.0×109/L病例数(6例)显著少于B周期(33例)(P<0.01)(表3)。A周期化疗第21天ANC<2.0×109/L病例数(4例)显著少于B周期(21例)(P<0.01)(表3)。A周期WBC分别<1.0×109/L、<2.0×109/L、<3.0×109/L或<4.0×109/L持续天数均显著少于B周期(P<0.01)(表4);A周期ANC分别<0.5×109/L、<1.0×109/L、<1.5×109/L和<2.0×109/L持续天数亦均显著少于B周期(P<0.01)(表5)。
, 百拇医药
2.2.2 A周期与B周期WBC及ANC变化趋势 A周期在注射瑞血新后WBC明显升高,并在用药后的第4天、第10~12天分别出现两个峰值,停药后WBC逐渐降低,B周期则在相对应的期间出现WBC明显降低,两组间比较均有非常显著差异(P<0.01)(图1)。A周期在注射瑞血新后ANC亦明显升高,并在用药后的第4天、第10~12天分别出现两个峰值,停药后ANC逐渐降低,B周期则在相对应的期间出现ANC明显降低,两组间比较均有非常显著差异(P<0.01)(图2)。
表1 A、B周期WBC、ANC最低值比较(×109/L,
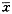 ±s)
±s)Tab 1 Comparison of the nadirs of WBC and ANC between
cycle A and cycle B following chemotherapy (×109/L,
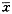 ±s) Items
±s) Items, http://www.100md.com
n
Cycle A
Cycle B
P value
WBC
60
3.84±1.20
2.19±1.01
<0.01
ANC
60
2.57±1.41
1.08±0.73
, 百拇医药
<0.01
表2 A、B周期化疗第21天WBC、ANC值比较
(×109/L,
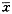 ±s)
±s)Tab 2 Comparison of WBC and ANC on the 21st postchemo-
therapeutic days between cycle A and cycle B(×109/L,
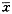 ±s) Items
±s) Itemsn
Cycle A
, 百拇医药
Cycle B
P value
WBC
60
8.61±2.39
4.20±1.54
<0.01
ANC
60
6.49±1.51
2.68±1.50
<0.01
, 百拇医药 表3 A、B周期化疗第21天WBC<4.0×109/L、ANC<2.0×109/L病例数比较
Tab 3 Comparison of the cases of WBC<4.0×109/L,ANC<2.0×109/L on the 21st postchemotherapeutic days
between cycle A and cycle B Items
n
Cycle A
Cycle B
P value
WBC
, 百拇医药
60
6
33
<0.01
ANC
60
4
21
<0.01
表4 A、B周期WBC降低持续天数比较
Tab 4 Comparison of duration of leukopenia between cycle A and cycle B WBC
, http://www.100md.com
(×109/L)
n
Cycle A
Cycle B
P value
P50
P75
P95
P50
P75
P95
<1.0
60
, 百拇医药
0
0
0
0
0
1
>0.05
<2.0
60
0
0
1
0
4
, 百拇医药
9
<0.01
<3.0
60
0
0.5
3
6.5
10.5
18
<0.01
<4.0
60
, http://www.100md.com
0
2
8
13
16
21
<0.01
表5 A、B周期ANC降低持续天数比较
Tab 5 Comparison of duration of neutropenia between cycle A and cycle B WBC
(×109/L)
n
, 百拇医药
Cycle A
Cycle B
P value
P50
P75
P95
P50
P75
P95
<0.5
60
0
0
, 百拇医药
0
0
0
6
<0.01
<1.0
60
0
0
1.5
2
4
8
<0.01
, 百拇医药
<1.5
60
0
0
2
6
10
14
<0.01
<2.0
60
0
2
9
, 百拇医药
8
12
20
<0.01

图1 A、B周期WBC平均值变化趋势
Fig 1 The change trends of WBC counts between cycle A and cycle B following chemotherapy. There were two peak values on the 4th and 10~14th day after injection of Rui Xue Xin in cycle A.

, 百拇医药
图2 A、B周期ANC平均值变化趋势
Fig 2 The change trends of ANC counts between cycle A and cycle B following chemotherapy. There were two peak values on the 4th and 10~14th day after injection of Rui Xue Xin in cycle A.
2.2.3 不良反应 在61例可分析不良反应的患者中,有16例共发生31例次不良反应,总的不良反应发生率为26.2%。主要不良反应有发热1例(1.6%),注射部位硬结8例(13.1%),乏力5例(8.2%),感冒样症状3例(4.9%),肌肉疼痛6例(9.8%),注射部位轻度疼痛8例(13.1%)。上述不良反应均为轻度,不需作特殊处理,均能完成治疗计划。全组未见有肝肾功能、心电图异常病例(表6)。
, 百拇医药
3 讨论
肿瘤化疗最常见的剂量限制性毒性是骨髓抑制,其中以白细胞和中性粒细胞的减少最为常见,既影响了化疗药物剂量强度的提高和化疗方案的按期进行,也增加了化疗所致白细胞、粒细胞减少所致感染和免疫功能降低的机会。人重组粒细胞集落刺激因子为解决这一肿瘤临床难题提供了有力手段[6~8]。人重组粒细胞集落刺激因子由中华仓鼠卵巢细胞表达,其氨基酸的排列顺序和糖链的位置与天然型rhG-CSF完全相同[9]。体外研究显示rhG-CSF能诱导人骨髓细胞形成粒细胞形成单位(CFU-G),集落的大小和数目都有增加。自1987年开始临床试用以来,已经证明rhG-CSF的主要作用是刺激中性粒细胞的增殖和分化,对肿瘤化疗、骨髓移植等所致的白细胞和中性粒细胞减少症,具有良好的预防和治疗作用[10~12]。
表6 与瑞血新有关的不良反应
Tab 6 The side effects after injection of Rui Xue Xin Side effects
, 百拇医药
No. of cases
(n=61)
%
Fever
1
1.6
Weakness
5
8.2
Symptom of cold
3
4.9
Muscular pain
, 百拇医药
6
9.8
Pain of injection site
8
13.1
Scleroma
8
13.1
Total number of cases
31
50.8
Total cases
, 百拇医药
16
26.2
本研究采用多中心、单盲随机、自身交叉对比方法,观察了深圳市新鹏投资发展公司研制的rhG-CSF(瑞血新)对肺癌化疗所致白细胞(WBC)和中性粒细胞(ANC)减少的防治作用及其不良反应。结果表明:瑞血新可明显减轻化疗过程中WBC、ABC下降的程度,缩短WBC、ANC降至正常值以下的持续时间,促进WBC、ANC恢复,明显减少了化疗第21天WBC<4.0×109/L的病例数和发生率,使化疗能按计划实施。本组A周期化疗第21天WBC<4.0×109/L的病例数为6例,B周期为33例,两组比较有非常显著差异(P<0.01);A周期化疗第21天ANC<2.0×109/L的病例数为4例,B周期为21例,两组间比较有非常显著差异(P<0.01);化疗第21天WBC平均值A周期为(8.61±2.39)×109/L,B周期为(4.20±1.54)×109/L;A周期化疗第21天ANC平均值为(6.49±1.51)×109/L,B周期为(2.68±1.50)×109/L,两组间比较均有非常显著差异(P<0.01)。此外,瑞血新对化疗过程中血小板、血色素的变化无明显影响,对外周血单核细胞亦无明显影响。这与国外的研究结果一致[10~12]。本研究还观察到rhG-CSF对化疗后WBC、ANC增加的刺激作用呈双峰曲线,与文献报道一致[6,10,11]。第1次升高可能是rhG-CSF促进骨髓中已成熟的中性粒细胞向外周血释放造成的,而第2次升高是对骨髓粒细胞系统造血祖细胞分化成熟的刺激和对粒系造血功能的激活造成的[3,4]。
, http://www.100md.com
文献报道rhG-CSF的不良反应在推荐剂量下多属轻中度,主要是发热,骨肌肉疼痛,乏力,注射局部红肿、硬结、皮疹等,较少反应有低血压、支气管痉挛、水肿和毛细血管渗漏等综合征[5~7]。本研究观察到本组不良反应主要为轻度发热、注射局部疼痛、轻度骨肌肉疼痛、乏力等。全组未见有肝肾功能、心电图异常以及低血压、支气管痉挛等严重反应。本研究证明深圳市新鹏投资发展有限公司研制的瑞血新临床应用安全、有效,为临床应用高剂量化疗治疗肺癌提供了可能性,值得临床推广应用。
参考文献
1,Mori K, Machida S, Yoshida T, et al. A phase Ⅱ study of irinotecan and infusional cisplatin with recombinant human granulocyte colony-stimulating factor support for advanced non-small-cell lung cancer. Cancer Chemother Pharmacol,1999,43(6)∶467-470.
, http://www.100md.com
2,Alexopoulos K, Kouroussis C, Androulakis N, et al. Docetaxel and granulocyte colony-stimulating factor in patients with advanced non-small-cell lung cancer previously treated with platinum-based chemotherapy: a multicenter phase Ⅱ trial. Cancer Chemother Pharmacol,1999,43(3)∶257-262.
3,Masters GA, Mauer AM, Hoffman PC, et al. A phase Ⅰ-Ⅱ study of paclitaxel, ifosfamide, and vinorelbine with filgrastim (rhG-CSF) support in advanced non-small cell lung cancer. Ann Oncol,1998,96(6)∶677-680.
, http://www.100md.com
4,Sandler A, Blanke C, Monaco F, et al. CODE (cisplatin, vincristine, doxorubicin, etoposide) plus granulocyte colony-stimulating factor in advanced non-small-cell lung cancer: a Hoosier Oncology Group phase Ⅱ trial. Am J Clin Oncol,1998,21(3)∶294-297.
5,Furuse K, Fukuoka M, Nishiwaki Y, et al. Phase Ⅲ study of intensive weekly chemotherapy with recombinant human granulocyte colony-stimulating factor versus standard chemotherapy in extensive-disease small-cell lung cancer. The Japan Clinial Oncology Group. J Clin Oncol,1998,16(6)∶2126-2132.
, 百拇医药
6,Okamoto H, Nagatomo A, Kunitoh H, et al. A phase Ⅰ clinical and pharmacologic study of a carboplatin and irinotecan regimen combined with recombinant human granulocyte-colony stimulating factor in the treatment of patients with advanced non-small cell lung carcinoma. Cancer,1998,82(11)∶2166-2172.
7,Ogawara M. Problems and recommendations for use of G-CSF in lung cancer patients with neutropenia after chemotherpay. Can To Kagaku Ryoho,1997,24(Suppl 3)∶439-444.
, http://www.100md.com
8,Scaqliotti GV, Ricardi U, Crino L, et la. Phase Ⅱ study of intensive chemotherapy with carboplatin, ifosfamide and etoposide plus recombinant human granulocyte colony-stimulating factor and sequential radiotherapy in locally advanced, unresectable non-small cell lung cancer. Cancer Chemother Pharmacol, 1996,38(6)∶561-565.
9,Nagata N, Tsuchiya M, Asano S, et al. Molecular cloning and expression of cDNA for human granulocyte colony stimulating factor. Nature,1986,319(6052)∶415-418.
, http://www.100md.com
10,Frasci G, Perillo G, Comella G, et al. Phase Ⅰ/Ⅱ study of carboplatin and oral etoposide with granulocyte colony stimulating facotr in advanced non-small cell lung cancer. Cancer,1995,75(7)∶1578-1588.
11,Tsuge I, Suzuki K, Moribe K, et al. Chemotherapy and granulocyte-colony stimulating factor for non-Hodgkin's lymphoma of the head an neck. Acta Otolaryngol Suppl Scockh,1996,525(1)∶129-134.
12,Nagai N, Takehara K, Murakami T, et al. Clinical evaluation of human granulocyte colony-stimulating factor in chemotherapy for ovarian cancer. Hiroshima J Med Sci,1995,44(4)∶99-103.
(收稿:1999-08-14 修回:1999-08-30), 百拇医药