共焦镜同时检测细胞内Ca2+和pH的变化
作者:黄行许 鲍永耀 黄辉张薇 霍霞 朴英杰
单位:510515 第一军医大学中心实验室
关键词:显微镜检查,荧光/方法;巨噬细胞/生理学;钙/分析;酸碱平衡;小鼠
摘 要 目的 细胞内游离Ca2 摘 要 目的 细胞内游离Ca2+与胞浆的pH在不同因素作用下可以改变。研究可以同时检
测游离Ca2+与pH变化的方法激光扫描共聚焦显微镜观察。方法 用胞内游离Ca2+和pH荧光探针
fluo-3/AM和SNARF-1/AM标记小鼠腹腔巨噬细胞后,在激光扫描共聚焦显微镜(ACAS570)下,同时用最适发射波长分别为530 nm和大于605 nm的检测器1和检测器2检测巨噬细胞内fluo-3/AM
, http://www.100md.com
和SNARF-1/AM的荧光强度变化。结果 检测器1和检测器2分别只检测反映细胞内游离Ca2+和
pH变化的fluo-3/AM和SNARF-1/AM所发荧光的变化;SNARF-1/AM和fluo-3/AM所发荧光相互不
影响。结论 激光扫描共聚焦显微镜可同时检测细胞内游离Ca2+和pH的变化。
中图号 R329.3
Simultaneous Detection of Free Cytosolic Calcium and Intracellular pH by Laser Scanning Confocal
, 百拇医药
Microscope Huang Xingxu, BaoYongyao, Huang Hui, et al.Central Laboratory, First Military Medical
University, 510515
Abstract Objective Free cytosolic calcium and intracellular pH can have some changes due to certain
factors.It is to explore a method for simultaneous detection on the changes,that is,observation with laser scanning
, http://www.100md.com
confocal microscope.Methods Ca2+-and pH-sensitive fluorescence probes of fluo-3/AM and SNARF-1/AM
were used to mark the peritoneal macrophages simultaneously. Then, the variations of the fluorescence were
detected with detector 1 (optimum emission wavelength: 530nm) and detector 2 (optimum emission wavelength:
>605nm) of the laser scanning confocal microscope (ACAS570). Results Detector 1 and 2 each detected the
, 百拇医药
variations of the fluorescence of fluo-3/Am or SNARF-1/AM of the Ca2+ or pH. The fluorescence of fluo-3/AM
and SNARF-1/AM did not influence each other. And the forms of the alteration in free cytosolic calcium and
intracellular pH of the macrophages varied when they were stimulated by different stimulators. Conclusion Laser
scanning confocal microscope could be used in simultaneous detection of free cytosolic calcium and intracellular
, http://www.100md.com
pH.
Key words microscopy,fluorescence/methods;macrophages/physiol;calcium/anal;acid-base equilibrium;
mice
细胞受各种因素作用时,胞内Ca2+和pH发生变化〔1〕,不过由于缺乏能同时检测胞内Ca2+和
pH动态变化的方法,二者之间的关系仍不很清楚。近年来,随着激光扫描共聚焦显微镜技术和荧
光探针的开发利用〔2〕,新一代的胞内游离Ca2+和pH荧光探针fluo-3/AM和SNARF-1/AM被分别用
, http://www.100md.com
于胞内游离Ca2+和pH变化的检测〔3,4〕。根据fluo-3/AM和胞内游离Ca2+结合后在波长530 nm处
荧光强度随游离Ca2+浓度升高而增强,而SNARF-1/AM的荧光强度在波长>605 nm时随胞内pH升高
而增强,它们的激发波长均为480 nm〔5,6〕以及fluo-3/AM的荧光强度不受SNARF-1/AM影响〔3〕
等特点,我们设计了本实验,拟利用fluo-3/AM和SNARF-1/AM混合物同时着染巨噬细胞,以观察
巨噬细胞内游离Ca2+和pH的动态变化。
材 料 和 方 法
, 百拇医药
一、主要材料
带双检测器的激光扫描共聚焦显微镜(ACAS570),美国Meridian 公司生产。fluo-3/AM、SNARF-1/AM,美国Molecular Probes Inc产品。RPMI-1640、Hepes购于Sigma公司。小牛血清,浙江杭州四青生物材料厂制品。其它试剂均为分析纯。
二、细胞培养
体重20 g左右雌性正常昆明小鼠,按照鄂征等人的方法〔7〕取腹腔巨噬细胞,以5×105个/cm2的浓度接种于改装35 mm Petri细胞培养皿底部的盖玻片上,用含10%小牛血清的RPMI-1640
培养于37oC含5%CO2的孵育箱内。
, http://www.100md.com
三、荧光探针标记
吸除培养皿内的培养液,用Hepes缓冲盐溶液洗三次,分别在不同培养皿中滴入10 μmol/L
fluo-3/AM、10 μmol/L SNARF-1/AM和含10 μmol/L fluo-3/AM和10 μmol/L SNARF-1/AM的混合
液0.3 ml,37oC孵育30~60分钟,吸除染液,用Hepes缓冲盐溶液洗3次,再加入0.5 ml Hepes缓
冲盐溶液。
四、ACAS570检测胞内Ca2+和pH
将培养皿置于ACAS570载物台上,选用40×物镜,7%滤光片,确定激发光波长为488 nm,进入Ratio-Generic-Image Scan程序,打开检测器1(最适发射波长530 nm)和检测器2(最适发
, 百拇医药
射波长大于605 nm),建立文件,作预扫描后选定最佳扫描参数,对选定视野扫描并存储所获
信息。主要扫描参数如下:Pinhole 1 600μm, PMT1 70%, PMT2 70%, Scanning Strength 20%, Laser
Power 10 mW。
五、单检Ca2+或pH时按张薇等人的方法〔4〕,分别打开检测器1或2进行。
六、分析
双检分析进入Ratio-Generic-Image Analysis程序,调入分析文件,得出同时反映细胞内Ca2+和pH动态变化的荧光强度变化曲线。单检分析进入Kinetics-Image-Analysis程序,分别调入分
, http://www.100md.com
析文件,得出各自反映细胞内Ca2+或pH动态变化的荧光强度变化曲线。
结 果
一、细胞荧光图像
图1和图2分别为检测器1和检测器2同时打开时检测到的fluo-3/AM和SNARF-1/AM的细胞荧光
图像。图1显示仅检测器1检测到fluo-3/AM所发荧光,同样,图2显示仅检测器2检测到SNARF-1/AM
所发荧光。
二、单测巨噬细胞内Ca2+和pH的变化
单检结果显示,小鼠巨噬细胞未受到刺激时,fluo-3/AM和SNARF-1/AM荧光强度不变,巨
, 百拇医药
噬细胞内的Ca2+和pH稳定;加入维拉帕米(终浓度1μmol/L)后200 sec,fluo-3/AM的荧光强度
下降了0.45,SNARF-1/AM的荧光强度下降了0.2;加入肾上腺素(终浓度1μmol/L)后200 sec,fluo-3/AM的荧光强度上升0.35,SNARF-1/AM荧光强度下降0.2。
三、双测巨噬细胞内Ca2+和pH的变化
双检结果显示,显示小鼠巨噬细胞未受到刺激时,fluo-3/AM和SNARF-1/AM荧光强度同样不
变。加入维拉帕米(终浓度1μmol/L)后200 sec,fluo-3/AM的荧光强度下降了0.42,SNARF-1/AM
的荧光强度下降了0.22(图3);加入肾上腺素(终浓度1×10μmol/L)后200 s,fluo-3/AM的荧光
, 百拇医药
强度上升0.36,SNARF-1/AM荧光强度下降0.21(图4)。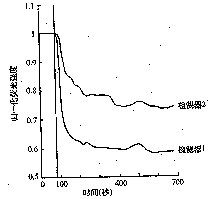 图3 归一化维拉帕米(1μmol/L)处理巨噬细胞内fluo-3/AM和SNARF-1/AM荧光强度变化曲线图,检
图3 归一化维拉帕米(1μmol/L)处理巨噬细胞内fluo-3/AM和SNARF-1/AM荧光强度变化曲线图,检
测器1表示fluo-3/AM的荧光强度变化,检测器2表示SNARF-1/AM的荧光强度变化,标记示加样时间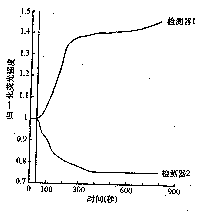
图4 归一化肾上腺素(1μmol/L)处理巨噬细胞内fluo-3/AM和SNARF-1/AM荧光强度变化曲线图,检
测器1表示fluo-3/AM的荧光强度变化,检测器2表示SNARF-1/AM的荧光强度变化,标记示加样时间 图1 细胞内游离钙特异性荧光屏 flou-3/AM荧光图,检测器1可检测到fluo-3/AM的荧光,但
图1 细胞内游离钙特异性荧光屏 flou-3/AM荧光图,检测器1可检测到fluo-3/AM的荧光,但
, 百拇医药
几乎未检测到任何SHARF-1/AM的荧光
图2 细胞胞浆PH特异性荧光探针SNARF-1/AM的荧光图,检测器2可检测到SNARF-1/AM的荧光,但几乎未检测到任何flou-3/AM的荧光
讨 论
检测器1和检测器2只检测到fluo-3/AM和SNARF-1/AM的细胞荧光图像,表明检测器1和检测
器2均有较严格的最适发射波长,适合同时检测波长不同,特别是波长相差较大的荧光。而且,经维拉帕米和肾上腺素作用后,单检和双检结果显示fluo-3/AM的荧光强度变化和SNARF-1/AM的
荧光强度变化均基本一致。这不仅证实了fluo-3/AM的荧光强度不受SNARF-1/AM影响〔3〕,也反
, 百拇医药
映出SNARF-1/AM的荧光强度不受fluo-3/AM影响。这些,肯定了在激光扫描共聚焦显微镜下可用
荧光探针fluo-3/AM和SNARF-1/AM同时检测活细胞内游离Ca2+和胞浆pH的动态变化,从而为探讨
细胞内游离Ca2+和胞浆pH之间的关系创造了条件。
实验结果表明,新近开发的激光扫描共聚焦显微镜技术不仅可作原位实时动态检测,具有实验
过程快速, 样品处理简便, 得到数据全面等优点〔2〕。还能显示单个细胞的荧光强度变化,将检
测提高到单细胞水平。而且由于共焦镜法实现了对活细胞荧光强度变化的连续追踪,因而可准
, 百拇医药
确反映细胞在加样瞬间的变化。
细胞内游离Ca2+和胞浆pH均与细胞功能相关〔8〕。心肌细胞内游离Ca2+升高伴随胞浆酸化〔9〕。
对巨噬细胞游离Ca2+及胞浆pH关系的初步研究结果显示,尽管经肾上腺素处理,巨噬细胞游离Ca2+
及胞浆pH的变化和心肌细胞相似。但经维拉帕米作用后,巨噬细胞胞浆pH和游离Ca2+均降低。这
表明巨噬细胞胞浆pH变化并不象心肌细胞一样由细胞内游离Ca2+升高引起。巨噬细胞内游离Ca2+和胞浆pH之间的确切关系仍需进一步探讨。
, 百拇医药 参 考 文 献1 Hayashi H, Miyata H, Noda N, et al. Intracellular Ca2+ concentration and pHi during metabolic inhibition.
Am J Physiol, 1992, 262C:635-643.
2 Davin MS. Confocal scanning optical microscopy and its applications for biological specimens. J Cell Science,1989, 94(2):175-206.
3 Rijkers GT, Justement LB, Griffioen AW, et al. Improved method for measuring intracellular Ca2+ with fluo-3.
, http://www.100md.com
Cytometry, 1990, 11: 923-927.
4 张薇,朴英杰,鲍永耀,等.粘附式细胞仪测定巨噬细胞内游离钙的方法.第一军医大学学报,1994, 14(1):43-45.
5 Seksek O, Henry Toulme N, Sureau F, et al. SNARF-1 as an intracellular pH indicator in laser
microspectrofluorometry: A critical assessment. Anal Biochem, 1991, 193: 49-54.
6 Richard PH, Molecular Probe. Handbook of fluorescent probes and research chemicals, 5th Edition, USA,1994:223-224.
, 百拇医药
7 鄂征主编.组织培养技术.北京:人民卫生出版社,1993:185-187.
8 Wray S. Smooth muscle intracellular pH: Measurement, regulation, and function. Am J Physiol,1988, 254C:213-225.
9 Daugirdas JT, Arrieta J, Ye MH, et al. Intracellular acidification associated with changes in free cytosolic
calcium. J Clin Invest, 1995, 95: 1480-1489.
(收稿 1997-07-29 修回 1997-12-31), 百拇医药
单位:510515 第一军医大学中心实验室
关键词:显微镜检查,荧光/方法;巨噬细胞/生理学;钙/分析;酸碱平衡;小鼠
摘 要 目的 细胞内游离Ca2 摘 要 目的 细胞内游离Ca2+与胞浆的pH在不同因素作用下可以改变。研究可以同时检
测游离Ca2+与pH变化的方法激光扫描共聚焦显微镜观察。方法 用胞内游离Ca2+和pH荧光探针
fluo-3/AM和SNARF-1/AM标记小鼠腹腔巨噬细胞后,在激光扫描共聚焦显微镜(ACAS570)下,同时用最适发射波长分别为530 nm和大于605 nm的检测器1和检测器2检测巨噬细胞内fluo-3/AM
, http://www.100md.com
和SNARF-1/AM的荧光强度变化。结果 检测器1和检测器2分别只检测反映细胞内游离Ca2+和
pH变化的fluo-3/AM和SNARF-1/AM所发荧光的变化;SNARF-1/AM和fluo-3/AM所发荧光相互不
影响。结论 激光扫描共聚焦显微镜可同时检测细胞内游离Ca2+和pH的变化。
中图号 R329.3
Simultaneous Detection of Free Cytosolic Calcium and Intracellular pH by Laser Scanning Confocal
, 百拇医药
Microscope Huang Xingxu, BaoYongyao, Huang Hui, et al.Central Laboratory, First Military Medical
University, 510515
Abstract Objective Free cytosolic calcium and intracellular pH can have some changes due to certain
factors.It is to explore a method for simultaneous detection on the changes,that is,observation with laser scanning
, http://www.100md.com
confocal microscope.Methods Ca2+-and pH-sensitive fluorescence probes of fluo-3/AM and SNARF-1/AM
were used to mark the peritoneal macrophages simultaneously. Then, the variations of the fluorescence were
detected with detector 1 (optimum emission wavelength: 530nm) and detector 2 (optimum emission wavelength:
>605nm) of the laser scanning confocal microscope (ACAS570). Results Detector 1 and 2 each detected the
, 百拇医药
variations of the fluorescence of fluo-3/Am or SNARF-1/AM of the Ca2+ or pH. The fluorescence of fluo-3/AM
and SNARF-1/AM did not influence each other. And the forms of the alteration in free cytosolic calcium and
intracellular pH of the macrophages varied when they were stimulated by different stimulators. Conclusion Laser
scanning confocal microscope could be used in simultaneous detection of free cytosolic calcium and intracellular
, http://www.100md.com
pH.
Key words microscopy,fluorescence/methods;macrophages/physiol;calcium/anal;acid-base equilibrium;
mice
细胞受各种因素作用时,胞内Ca2+和pH发生变化〔1〕,不过由于缺乏能同时检测胞内Ca2+和
pH动态变化的方法,二者之间的关系仍不很清楚。近年来,随着激光扫描共聚焦显微镜技术和荧
光探针的开发利用〔2〕,新一代的胞内游离Ca2+和pH荧光探针fluo-3/AM和SNARF-1/AM被分别用
, http://www.100md.com
于胞内游离Ca2+和pH变化的检测〔3,4〕。根据fluo-3/AM和胞内游离Ca2+结合后在波长530 nm处
荧光强度随游离Ca2+浓度升高而增强,而SNARF-1/AM的荧光强度在波长>605 nm时随胞内pH升高
而增强,它们的激发波长均为480 nm〔5,6〕以及fluo-3/AM的荧光强度不受SNARF-1/AM影响〔3〕
等特点,我们设计了本实验,拟利用fluo-3/AM和SNARF-1/AM混合物同时着染巨噬细胞,以观察
巨噬细胞内游离Ca2+和pH的动态变化。
材 料 和 方 法
, 百拇医药
一、主要材料
带双检测器的激光扫描共聚焦显微镜(ACAS570),美国Meridian 公司生产。fluo-3/AM、SNARF-1/AM,美国Molecular Probes Inc产品。RPMI-1640、Hepes购于Sigma公司。小牛血清,浙江杭州四青生物材料厂制品。其它试剂均为分析纯。
二、细胞培养
体重20 g左右雌性正常昆明小鼠,按照鄂征等人的方法〔7〕取腹腔巨噬细胞,以5×105个/cm2的浓度接种于改装35 mm Petri细胞培养皿底部的盖玻片上,用含10%小牛血清的RPMI-1640
培养于37oC含5%CO2的孵育箱内。
, http://www.100md.com
三、荧光探针标记
吸除培养皿内的培养液,用Hepes缓冲盐溶液洗三次,分别在不同培养皿中滴入10 μmol/L
fluo-3/AM、10 μmol/L SNARF-1/AM和含10 μmol/L fluo-3/AM和10 μmol/L SNARF-1/AM的混合
液0.3 ml,37oC孵育30~60分钟,吸除染液,用Hepes缓冲盐溶液洗3次,再加入0.5 ml Hepes缓
冲盐溶液。
四、ACAS570检测胞内Ca2+和pH
将培养皿置于ACAS570载物台上,选用40×物镜,7%滤光片,确定激发光波长为488 nm,进入Ratio-Generic-Image Scan程序,打开检测器1(最适发射波长530 nm)和检测器2(最适发
, 百拇医药
射波长大于605 nm),建立文件,作预扫描后选定最佳扫描参数,对选定视野扫描并存储所获
信息。主要扫描参数如下:Pinhole 1 600μm, PMT1 70%, PMT2 70%, Scanning Strength 20%, Laser
Power 10 mW。
五、单检Ca2+或pH时按张薇等人的方法〔4〕,分别打开检测器1或2进行。
六、分析
双检分析进入Ratio-Generic-Image Analysis程序,调入分析文件,得出同时反映细胞内Ca2+和pH动态变化的荧光强度变化曲线。单检分析进入Kinetics-Image-Analysis程序,分别调入分
, http://www.100md.com
析文件,得出各自反映细胞内Ca2+或pH动态变化的荧光强度变化曲线。
结 果
一、细胞荧光图像
图1和图2分别为检测器1和检测器2同时打开时检测到的fluo-3/AM和SNARF-1/AM的细胞荧光
图像。图1显示仅检测器1检测到fluo-3/AM所发荧光,同样,图2显示仅检测器2检测到SNARF-1/AM
所发荧光。
二、单测巨噬细胞内Ca2+和pH的变化
单检结果显示,小鼠巨噬细胞未受到刺激时,fluo-3/AM和SNARF-1/AM荧光强度不变,巨
, 百拇医药
噬细胞内的Ca2+和pH稳定;加入维拉帕米(终浓度1μmol/L)后200 sec,fluo-3/AM的荧光强度
下降了0.45,SNARF-1/AM的荧光强度下降了0.2;加入肾上腺素(终浓度1μmol/L)后200 sec,fluo-3/AM的荧光强度上升0.35,SNARF-1/AM荧光强度下降0.2。
三、双测巨噬细胞内Ca2+和pH的变化
双检结果显示,显示小鼠巨噬细胞未受到刺激时,fluo-3/AM和SNARF-1/AM荧光强度同样不
变。加入维拉帕米(终浓度1μmol/L)后200 sec,fluo-3/AM的荧光强度下降了0.42,SNARF-1/AM
的荧光强度下降了0.22(图3);加入肾上腺素(终浓度1×10μmol/L)后200 s,fluo-3/AM的荧光
, 百拇医药
强度上升0.36,SNARF-1/AM荧光强度下降0.21(图4)。
 图3 归一化维拉帕米(1μmol/L)处理巨噬细胞内fluo-3/AM和SNARF-1/AM荧光强度变化曲线图,检
图3 归一化维拉帕米(1μmol/L)处理巨噬细胞内fluo-3/AM和SNARF-1/AM荧光强度变化曲线图,检测器1表示fluo-3/AM的荧光强度变化,检测器2表示SNARF-1/AM的荧光强度变化,标记示加样时间

图4 归一化肾上腺素(1μmol/L)处理巨噬细胞内fluo-3/AM和SNARF-1/AM荧光强度变化曲线图,检
测器1表示fluo-3/AM的荧光强度变化,检测器2表示SNARF-1/AM的荧光强度变化,标记示加样时间
 图1 细胞内游离钙特异性荧光屏 flou-3/AM荧光图,检测器1可检测到fluo-3/AM的荧光,但
图1 细胞内游离钙特异性荧光屏 flou-3/AM荧光图,检测器1可检测到fluo-3/AM的荧光,但, 百拇医药
几乎未检测到任何SHARF-1/AM的荧光
图2 细胞胞浆PH特异性荧光探针SNARF-1/AM的荧光图,检测器2可检测到SNARF-1/AM的荧光,但几乎未检测到任何flou-3/AM的荧光
讨 论
检测器1和检测器2只检测到fluo-3/AM和SNARF-1/AM的细胞荧光图像,表明检测器1和检测
器2均有较严格的最适发射波长,适合同时检测波长不同,特别是波长相差较大的荧光。而且,经维拉帕米和肾上腺素作用后,单检和双检结果显示fluo-3/AM的荧光强度变化和SNARF-1/AM的
荧光强度变化均基本一致。这不仅证实了fluo-3/AM的荧光强度不受SNARF-1/AM影响〔3〕,也反
, 百拇医药
映出SNARF-1/AM的荧光强度不受fluo-3/AM影响。这些,肯定了在激光扫描共聚焦显微镜下可用
荧光探针fluo-3/AM和SNARF-1/AM同时检测活细胞内游离Ca2+和胞浆pH的动态变化,从而为探讨
细胞内游离Ca2+和胞浆pH之间的关系创造了条件。
实验结果表明,新近开发的激光扫描共聚焦显微镜技术不仅可作原位实时动态检测,具有实验
过程快速, 样品处理简便, 得到数据全面等优点〔2〕。还能显示单个细胞的荧光强度变化,将检
测提高到单细胞水平。而且由于共焦镜法实现了对活细胞荧光强度变化的连续追踪,因而可准
, 百拇医药
确反映细胞在加样瞬间的变化。
细胞内游离Ca2+和胞浆pH均与细胞功能相关〔8〕。心肌细胞内游离Ca2+升高伴随胞浆酸化〔9〕。
对巨噬细胞游离Ca2+及胞浆pH关系的初步研究结果显示,尽管经肾上腺素处理,巨噬细胞游离Ca2+
及胞浆pH的变化和心肌细胞相似。但经维拉帕米作用后,巨噬细胞胞浆pH和游离Ca2+均降低。这
表明巨噬细胞胞浆pH变化并不象心肌细胞一样由细胞内游离Ca2+升高引起。巨噬细胞内游离Ca2+和胞浆pH之间的确切关系仍需进一步探讨。
, 百拇医药 参 考 文 献1 Hayashi H, Miyata H, Noda N, et al. Intracellular Ca2+ concentration and pHi during metabolic inhibition.
Am J Physiol, 1992, 262C:635-643.
2 Davin MS. Confocal scanning optical microscopy and its applications for biological specimens. J Cell Science,1989, 94(2):175-206.
3 Rijkers GT, Justement LB, Griffioen AW, et al. Improved method for measuring intracellular Ca2+ with fluo-3.
, http://www.100md.com
Cytometry, 1990, 11: 923-927.
4 张薇,朴英杰,鲍永耀,等.粘附式细胞仪测定巨噬细胞内游离钙的方法.第一军医大学学报,1994, 14(1):43-45.
5 Seksek O, Henry Toulme N, Sureau F, et al. SNARF-1 as an intracellular pH indicator in laser
microspectrofluorometry: A critical assessment. Anal Biochem, 1991, 193: 49-54.
6 Richard PH, Molecular Probe. Handbook of fluorescent probes and research chemicals, 5th Edition, USA,1994:223-224.
, 百拇医药
7 鄂征主编.组织培养技术.北京:人民卫生出版社,1993:185-187.
8 Wray S. Smooth muscle intracellular pH: Measurement, regulation, and function. Am J Physiol,1988, 254C:213-225.
9 Daugirdas JT, Arrieta J, Ye MH, et al. Intracellular acidification associated with changes in free cytosolic
calcium. J Clin Invest, 1995, 95: 1480-1489.
(收稿 1997-07-29 修回 1997-12-31), 百拇医药