不同剂量60/sup>Co辐照异体血后T细胞亚群与红细胞免疫功能的变化
作者:李志强 徐文皓 陈卫宾 罗丽芳 徐钧
单位:李志强(上海市第六人民医院 200233);徐文皓(上海市第六人民医院 200233);陈卫宾(上海市第六人民医院 200233);罗丽芳(上海市第六人民医院 200233);徐钧(上海市第六人民医院 200233)
关键词:移植物抗宿主病;输血;免疫;T细胞;红细胞;60Co γ
中国输血杂志000306 中图分类号 R392.4 R815.5
为了减少输血相关性移植物抗宿主病(TA-GVHD),笔者应用不同剂量60Co γ射线辐照异体新鲜全血,观察异体全血照射前后T淋巴细胞亚群和红细胞免疫功能的变化,以探讨其临床价值。
1 材料与方法
, 百拇医药
1.1 材料 随机选择上海市血液中心提供健康献血者新鲜全血50U(1U含全血200ml及ACD保存液50ml),分别留取样本。再将每份样本一分为二,照射组与对照组(未照射组)各50个样本,照射组则根据单次照射剂量又分为5组,每组10个样本。
1.2 照射剂量 应用60Co γ射线照射源,照射剂量分别为15、20、25、30和35GY,予以单次均匀照射,剂量率77cGY/min,源物距80cm,照射后即刻测定。
1.3 T细胞亚群测定 血片制备:取ACD抗凝血10ml于3000r/min离心10min,提取棕黄层涂片,干燥即得。染色方法:应用免疫组化染色法。3%过氧化氢孵育5min,蒸馏水冲洗后Tris缓冲液浸泡5min,滴加1∶20稀释的正常马血清室温下孵育20min,再滴加适当稀释鼠抗血清(一抗),室温下孵育30min后冲洗,滴加1∶200稀释马抗鼠血清(二抗),室温孵育30min,最后滴加适当稀释过氧化酶-卵白素(三抗),显色复染后封片。试剂盒购自上海华美生物工程公司。
, http://www.100md.com
1.4 红细胞膜C3b受体活性(RBC-C3b)和红细胞粘附免疫复合物含量(IC)测定 分别应用红细胞膜C3b受体花环试验和红细胞免疫复合物花环试验,具体测定参照文献[1]方法进行。
1.5 统计学处理 各参数以均数±标准差(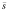 ±s)表示,经t检验求得P值。
±s)表示,经t检验求得P值。
2 结果
2.1 T细胞亚群测定 见附表。
附表 不同剂量60Co照射异体血后T细胞亚群与红细胞免疫功能的变化 照射剂量(GY)
T细胞亚群
, http://www.100md.com 红细胞免疫功能
CD+3
CD+4
CD+8
CD+4/CD+8
RBC-C3b
IC
15
69.10±3.37
47.28±2.97
, http://www.100md.com
24.76±3.01
1.93±0.24
26.90±5.97
7.20±1.32
20
63.18±2.45
44.00±4.39
22.86±2.89
1.95±0.33
30.60±5.46
7.40±1.43
25
, http://www.100md.com
62.86±4.74
41.35±3.75
22.78±3.57
1.87±0.36
28.98±4.92
7.03±1.58
30
63.32±4.15
39.44±2.57
22.52±3.13
1.88±0.30
30.40±4.98
, http://www.100md.com
6.20±1.20
35
56.16±6.32
35.92±3.36
19.21±2.73
1.89±0.30
21.80±3.33
5.40±1.35
对照组
71.06±5.84
46.05±5.40
27.42±3.26
, 百拇医药
1.70±0.27
28.68±6.74
7.65±3.20
2.1.1 CD+3T细胞值 除15GY剂量组与对照组相互比较无明显差异(t=1.33,P>0.05)外,余各剂量组分别与对照组比较均有显著性差异(t=6.97、4.80、4.99、6.90,P<0.01);35GY剂量组分别与其他剂量组相互比较有明显差异(t=5.53、3.28、3.10,P<0.01;t=2.68,P<0.05);15GY剂量组与20、25和30GY 剂量组相互比较分别也有明显差异(t=3.23、3.23、4.11,P<0.01);但20、25和30GY3个剂量组间相互比较则无明显差异(t=0.09、0.19、0.23,P>0.05)。
2.1.2 CD+4T细胞值 除15和20GY剂量组与对照组相互比较无明显差异(t=1.01、1.30,P>0.05)外,余各剂量组分别与对照组比较有显著性差异(t=3.33、5.95、7.73,P<0.01);35GY剂量组分别与其他剂量组比较有明显差异(t=2.62,P<0.05,t=8.00,4.62、3.43,P<0.01);15与20GY剂量组相互比较无明显差异(t=1.96,P>0.05),而与25、30GY剂量组比较则有显著性差异(t=3.93,6.32,P<0.01);但25与30GY剂量组相互比较则无明显差异(t=1.33,P>0.05)。
, 百拇医药
2.1.3 CD+8T细胞值 各剂量组分别与对照组相互比较有明显差异(t=2.51,P<0.05;t=4.47、3.80、4.50、8.39,P<0.01);除35GY剂量组分别与其他各剂量组相互比较有明显差异(t=4.31、2.90,P<0.01;t=2.51、2.53,P<0.05)外,余各剂量组间相互比较则无明显差异(t=0.06、0.17、0.25、1.34、1.44、1.64,P>0.05)。
2.1.4 CD+4/CD+8T细胞比值 15和20GY剂量组分别与对照组相互比较有明显差异(t=2.64、2.21,P<0.05);15和20GY剂量组相互比较无明显差异(t=0.15,P>0.05),25、30和35GY剂量组分别与对照组相互比较无明显差异(t=1.42、1.51、1.54,P>0.05),三组相互间及分别与15和20GY剂量组相互比较均无明显差异(t=1.01、1.10、1.12、1.21、1.32、1.43、1.51、1.78、1.82,P>0.05)。
, 百拇医药
2.2 RBC-C3b和IC 35GY剂量组RBC-C3b活性和IC含量明显降低,分别与对照组比较有显著性差异(t=3.84、4.01,P<0.01);另外,除35GY剂量组红细胞IC含量与30GY剂量组间无明显差异(t=1.61,P>0.05)外,与各剂量组的RBC-C3b和IC含量相互比较有明显性差异(t=2.92、2.98、3.06、3.35、3.64、3.82 ,P<0.01);但15、20和25、30GY剂量组RBC-C3b和IC含量相互间比较则无显著性差异(t=1.07、1.26、1.31、1.43、1.48、1.51、1.62、1.65、1.77、1.78、1.87、1.92,P>0.05)。
3 讨论
目前普遍认为受血者在免疫功能低下时,输入含免疫活性淋巴细胞的血液或血液成分制品,不能识别供者(献血者)淋巴细胞,且在其体内植活,进而攻击和破坏受血者体内细胞和组织,导致TA-GVHD[2],近年来国外文献此类报道明显增多,发生率可达1.5%,而国内至今报道甚少。此病发病急,临床症状不够典型,易与原发病症状相混淆,漏误诊率极高,且此病疗效极差,病死率可达90%以上,而目前最有效的预防方法是输血前对血液或血液成分制品进行60Go辐照[3,4]。据国外文献报道,淋巴细胞对电离辐射十分敏感,照射后的淋巴细胞不能修复已损伤的DNA,以致其不能复制和分化,使淋巴细胞失去免疫活性。即使淋巴细胞在受者体内存活,也不会对受血者机体产生免疫排斥和攻击能力[2,3]。AABB建议:如果使用无支架照射器,应对准防护罩的正中平面,若使用放疗仪则对准照射区中心平面,其照射剂量最小为25GY,在防护罩或照射区的任意点的最小剂量为15GY[5]。国内学者认为60Co辐照血液制品剂量为15~30GY均可[6]。本组实验分析表明:随着60Co γ射线辐照剂量逐渐增大,CD+3(全T细胞)、CD+4(辅助T细胞)和CD+8(抑制T细胞)值逐渐降低,二者呈负相关。另外,60Co辐照血液后,可使红细胞膜表面受到不同程度的影响,也与照射剂量呈负相关,但此种影响仅使红细胞部分功能丧失[9]。本组实验还表明当照射剂量达35GY时,RBC-C3b活性和IC含量明显降低。总之,为了更有效的预防TA-GVHD发生,应选择25~30GY照射量为宜,它既能有效抑制免疫T淋巴细胞,又能使红细胞免疫功能不受损伤或轻微受损。倘若照射剂量≤20GY或≥35GY,前者不能有效抑制免疫T淋巴细胞,后者则易导致红细胞免疫功能的严重损伤。
, 百拇医药
参考文献
1,郭 峰.红细胞免疫及其调节功能的测定方法.免疫学杂志,1990,6∶60
2,Anderson KC,Weinstein HJ.Transfusion-associated graftversus-host discase.N Engl J Med,1990,323∶315
3,Greenbum BH.Transfusion-associated graft-versus-host disease:historical perspectives,ineidence,and current use of irradiated blood products.J Clin Oncol,1991,9∶1889
4,Wuesz DL.Transfusion and stem cell,support in cancer treatment.Hematol,Oncol,1996,10∶406
5,美国血库联合会(AABB)标准委员会编肖 明译.血库和输血机构标准,北京:中国输血协会,1997,13
6,肖星甫主编.输血技术手册.成都:四川科学技术出版社,1992
7,Anderson G,Churchill WH.Effect of irradiation on red cell cation content and transport.Transfusion,1992,32∶246
1999-05-07收稿
2000-03-14修回, 百拇医药
单位:李志强(上海市第六人民医院 200233);徐文皓(上海市第六人民医院 200233);陈卫宾(上海市第六人民医院 200233);罗丽芳(上海市第六人民医院 200233);徐钧(上海市第六人民医院 200233)
关键词:移植物抗宿主病;输血;免疫;T细胞;红细胞;60Co γ
中国输血杂志000306 中图分类号 R392.4 R815.5
为了减少输血相关性移植物抗宿主病(TA-GVHD),笔者应用不同剂量60Co γ射线辐照异体新鲜全血,观察异体全血照射前后T淋巴细胞亚群和红细胞免疫功能的变化,以探讨其临床价值。
1 材料与方法
, 百拇医药
1.1 材料 随机选择上海市血液中心提供健康献血者新鲜全血50U(1U含全血200ml及ACD保存液50ml),分别留取样本。再将每份样本一分为二,照射组与对照组(未照射组)各50个样本,照射组则根据单次照射剂量又分为5组,每组10个样本。
1.2 照射剂量 应用60Co γ射线照射源,照射剂量分别为15、20、25、30和35GY,予以单次均匀照射,剂量率77cGY/min,源物距80cm,照射后即刻测定。
1.3 T细胞亚群测定 血片制备:取ACD抗凝血10ml于3000r/min离心10min,提取棕黄层涂片,干燥即得。染色方法:应用免疫组化染色法。3%过氧化氢孵育5min,蒸馏水冲洗后Tris缓冲液浸泡5min,滴加1∶20稀释的正常马血清室温下孵育20min,再滴加适当稀释鼠抗血清(一抗),室温下孵育30min后冲洗,滴加1∶200稀释马抗鼠血清(二抗),室温孵育30min,最后滴加适当稀释过氧化酶-卵白素(三抗),显色复染后封片。试剂盒购自上海华美生物工程公司。
, http://www.100md.com
1.4 红细胞膜C3b受体活性(RBC-C3b)和红细胞粘附免疫复合物含量(IC)测定 分别应用红细胞膜C3b受体花环试验和红细胞免疫复合物花环试验,具体测定参照文献[1]方法进行。
1.5 统计学处理 各参数以均数±标准差(
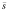 ±s)表示,经t检验求得P值。
±s)表示,经t检验求得P值。2 结果
2.1 T细胞亚群测定 见附表。
附表 不同剂量60Co照射异体血后T细胞亚群与红细胞免疫功能的变化 照射剂量(GY)
T细胞亚群
, http://www.100md.com 红细胞免疫功能
CD+3
CD+4
CD+8
CD+4/CD+8
RBC-C3b
IC
15
69.10±3.37
47.28±2.97
, http://www.100md.com
24.76±3.01
1.93±0.24
26.90±5.97
7.20±1.32
20
63.18±2.45
44.00±4.39
22.86±2.89
1.95±0.33
30.60±5.46
7.40±1.43
25
, http://www.100md.com
62.86±4.74
41.35±3.75
22.78±3.57
1.87±0.36
28.98±4.92
7.03±1.58
30
63.32±4.15
39.44±2.57
22.52±3.13
1.88±0.30
30.40±4.98
, http://www.100md.com
6.20±1.20
35
56.16±6.32
35.92±3.36
19.21±2.73
1.89±0.30
21.80±3.33
5.40±1.35
对照组
71.06±5.84
46.05±5.40
27.42±3.26
, 百拇医药
1.70±0.27
28.68±6.74
7.65±3.20
2.1.1 CD+3T细胞值 除15GY剂量组与对照组相互比较无明显差异(t=1.33,P>0.05)外,余各剂量组分别与对照组比较均有显著性差异(t=6.97、4.80、4.99、6.90,P<0.01);35GY剂量组分别与其他剂量组相互比较有明显差异(t=5.53、3.28、3.10,P<0.01;t=2.68,P<0.05);15GY剂量组与20、25和30GY 剂量组相互比较分别也有明显差异(t=3.23、3.23、4.11,P<0.01);但20、25和30GY3个剂量组间相互比较则无明显差异(t=0.09、0.19、0.23,P>0.05)。
2.1.2 CD+4T细胞值 除15和20GY剂量组与对照组相互比较无明显差异(t=1.01、1.30,P>0.05)外,余各剂量组分别与对照组比较有显著性差异(t=3.33、5.95、7.73,P<0.01);35GY剂量组分别与其他剂量组比较有明显差异(t=2.62,P<0.05,t=8.00,4.62、3.43,P<0.01);15与20GY剂量组相互比较无明显差异(t=1.96,P>0.05),而与25、30GY剂量组比较则有显著性差异(t=3.93,6.32,P<0.01);但25与30GY剂量组相互比较则无明显差异(t=1.33,P>0.05)。
, 百拇医药
2.1.3 CD+8T细胞值 各剂量组分别与对照组相互比较有明显差异(t=2.51,P<0.05;t=4.47、3.80、4.50、8.39,P<0.01);除35GY剂量组分别与其他各剂量组相互比较有明显差异(t=4.31、2.90,P<0.01;t=2.51、2.53,P<0.05)外,余各剂量组间相互比较则无明显差异(t=0.06、0.17、0.25、1.34、1.44、1.64,P>0.05)。
2.1.4 CD+4/CD+8T细胞比值 15和20GY剂量组分别与对照组相互比较有明显差异(t=2.64、2.21,P<0.05);15和20GY剂量组相互比较无明显差异(t=0.15,P>0.05),25、30和35GY剂量组分别与对照组相互比较无明显差异(t=1.42、1.51、1.54,P>0.05),三组相互间及分别与15和20GY剂量组相互比较均无明显差异(t=1.01、1.10、1.12、1.21、1.32、1.43、1.51、1.78、1.82,P>0.05)。
, 百拇医药
2.2 RBC-C3b和IC 35GY剂量组RBC-C3b活性和IC含量明显降低,分别与对照组比较有显著性差异(t=3.84、4.01,P<0.01);另外,除35GY剂量组红细胞IC含量与30GY剂量组间无明显差异(t=1.61,P>0.05)外,与各剂量组的RBC-C3b和IC含量相互比较有明显性差异(t=2.92、2.98、3.06、3.35、3.64、3.82 ,P<0.01);但15、20和25、30GY剂量组RBC-C3b和IC含量相互间比较则无显著性差异(t=1.07、1.26、1.31、1.43、1.48、1.51、1.62、1.65、1.77、1.78、1.87、1.92,P>0.05)。
3 讨论
目前普遍认为受血者在免疫功能低下时,输入含免疫活性淋巴细胞的血液或血液成分制品,不能识别供者(献血者)淋巴细胞,且在其体内植活,进而攻击和破坏受血者体内细胞和组织,导致TA-GVHD[2],近年来国外文献此类报道明显增多,发生率可达1.5%,而国内至今报道甚少。此病发病急,临床症状不够典型,易与原发病症状相混淆,漏误诊率极高,且此病疗效极差,病死率可达90%以上,而目前最有效的预防方法是输血前对血液或血液成分制品进行60Go辐照[3,4]。据国外文献报道,淋巴细胞对电离辐射十分敏感,照射后的淋巴细胞不能修复已损伤的DNA,以致其不能复制和分化,使淋巴细胞失去免疫活性。即使淋巴细胞在受者体内存活,也不会对受血者机体产生免疫排斥和攻击能力[2,3]。AABB建议:如果使用无支架照射器,应对准防护罩的正中平面,若使用放疗仪则对准照射区中心平面,其照射剂量最小为25GY,在防护罩或照射区的任意点的最小剂量为15GY[5]。国内学者认为60Co辐照血液制品剂量为15~30GY均可[6]。本组实验分析表明:随着60Co γ射线辐照剂量逐渐增大,CD+3(全T细胞)、CD+4(辅助T细胞)和CD+8(抑制T细胞)值逐渐降低,二者呈负相关。另外,60Co辐照血液后,可使红细胞膜表面受到不同程度的影响,也与照射剂量呈负相关,但此种影响仅使红细胞部分功能丧失[9]。本组实验还表明当照射剂量达35GY时,RBC-C3b活性和IC含量明显降低。总之,为了更有效的预防TA-GVHD发生,应选择25~30GY照射量为宜,它既能有效抑制免疫T淋巴细胞,又能使红细胞免疫功能不受损伤或轻微受损。倘若照射剂量≤20GY或≥35GY,前者不能有效抑制免疫T淋巴细胞,后者则易导致红细胞免疫功能的严重损伤。
, 百拇医药
参考文献
1,郭 峰.红细胞免疫及其调节功能的测定方法.免疫学杂志,1990,6∶60
2,Anderson KC,Weinstein HJ.Transfusion-associated graftversus-host discase.N Engl J Med,1990,323∶315
3,Greenbum BH.Transfusion-associated graft-versus-host disease:historical perspectives,ineidence,and current use of irradiated blood products.J Clin Oncol,1991,9∶1889
4,Wuesz DL.Transfusion and stem cell,support in cancer treatment.Hematol,Oncol,1996,10∶406
5,美国血库联合会(AABB)标准委员会编肖 明译.血库和输血机构标准,北京:中国输血协会,1997,13
6,肖星甫主编.输血技术手册.成都:四川科学技术出版社,1992
7,Anderson G,Churchill WH.Effect of irradiation on red cell cation content and transport.Transfusion,1992,32∶246
1999-05-07收稿
2000-03-14修回, 百拇医药