急性肺损伤环氧合酶同工酶mRNA表达的变化及地塞米松的影响
作者:王金生 陈正堂 廖伟
单位:王金生 陈正堂(第三军医大学附属新桥医院呼吸内科研究所,重庆 400039);廖伟(第三军医大学附属新桥医院儿科)
关键词:急性肺损伤;环氧合酶;地塞米松
中国急救医学000508 [摘 要] 目的 探讨急性肺损伤(ALI)环氧合酶(COX)同工酶的变化及地塞米松(DEX)的影响。方法 用内毒素(LPS)复制ALI模型,用逆转录多聚酶链反应(RT-PCR)测定COX-1和COX-2的mRNA表达。结果 COX-1 mRNA表达在对照组、LPS组、DEX组之间无显著差别(P>0.05),而COX-2 mRNA表达LPS组显著高于对照组(3倍)(P<0.01),DEX干预组显著低LPS组(P<0.01),和对照组无显著差别(P>0.05)。结论 COX-2的诱导性表达与ALI的发病有重要关系,而COX-1与ALI的发病无关,DEX可下调COX-2的表达,对COX-1表达无影响。
, http://www.100md.com
[中图分类号] R 563;R 977.1 [文献标识码] A
[文章编号] 1002-1949(2000)05-0274-03
Changes of cyclooxygenase isoenzyme in acute lung injury and effects of dexamethasone on its
WANG Jin-sheng CHEN Zheng-tang LIAO Wei
(Institute of Respiratory Disease,Xinqiao Hospital,Third Military Medical University,Chongqing 400039,China)
[Abstract] Objective To investigate the changs of cyclooxygenase (COX)isoenzyme mRNA and effects of dexamethasone (DEX) on its .Methods Using reversertanscription polymerase chain reaction (RT-PCR) We measured COX-1 and COX-2 mRNA expression in rats lungs with ALI induced by lipopolysaccharide.Results No difference in COX-1 mRNAexpression among the control group LPS-stimulated group and dex treated group(P>0.05).COX-2mRNA expression in LPS-stimulated group was significantly higher (3-fold) than that in control group (P<0.01),and COX-2 mRNA express in DEX treated group was significantly lower (3-fold) than in LPS stimulated group (P<0.01).Conclusion the upregulation of COX-2 may be involved in ALI,DEX can down-regulate COX-2 other than COX-1 mRNA exprexssion and It has no effects on COX-1.
, 百拇医药
[Key words] Actute lung injury; Cyclooxygenase; Dexamethasone
急性肺损伤(acute lung injury,ALI)实质上是一种过度炎症反应,以肺泡毛细血管膜损害,中性粒细胞浸润,肺水肿,严重气体交换障碍为特征[1]。尽管ALI的发病机制尚未完全清楚,但前列腺素(prostaglandins,PGs)在ALI发病中的重要作用已得到确切证实[2],如血栓素(thromboxane,TX)可使白细胞趋化,血小板聚集,肺微血管收缩,从而导致肺血管内皮细胞和肺泡上皮细胞损伤。环氧合酶(cyclooxygenase,COX)是在花生四烯酸(arachidonic aciel AA)合体PGs的重要限速酶,近年的研究发现它有两型同工酶,COX-1为组成型表达,在许多组织中都有表达,对正常的生理功能的维持有重要作用;COX-2为诱导性,在静息条件下,大多数组织细胞没有表达,相反,在炎症刺激下如细菌脂多糖(lipoplysaccharides,LPS)白介素-1(interleukin-1,IL-1)等作用下迅速大量表达,加速PGs的生成,与其它炎性介质和蛋白酶一起参与ALI的发病,因此研究ALI时COX同工酶的mRNA表达的变化对ALI的发病机制可能提供新的实验依据。
, http://www.100md.com
1 材料与方法
1.1 材料
选用健康Wistar雄性大鼠,体重250~300 g,由第三军医大学动物中心提供,大肠杆菌脂多糖(lipopolysaccharide,LPS O111B4)购自美国Sigma公司,总RNA提取试剂盒购自德国BM公司。
1.2 方法
1.2.1 实验分组 将Wistar 36只大鼠随机分为:①生理盐水对照组(n=12);②LPS刺激组(n=12);③地塞米松干预组(DEX干预组,n=12)。
1.2.2 ALI模型的复制 采用尾静脉注射LPS 5 mg/kg复制ALI模型。DEX干预组采用在注射LPS之前2 h注射地塞米松5 mg/kg,生理盐水对照组用等量生理盐水尾静脉注射,并于注射LPS 4 h后放血活杀,经动脉插管留取动脉血3 ml,取出双肺,分别留做肺湿、干比(W/D),HE染色,一侧肺迅速贮存于液氮中,供提取总RNA。
, 百拇医药
1.2.3 W/D测定 采用真空干燥法。肺组织称湿重后,置真空干燥箱内,70℃真空干燥,在0.53 kPa条件下烤24小时后称干重,计算肺W/D。
1.2.4 病理观察 肺组织经10%甲醛固定,常规切片,HE染色,光镜下观察。
1.2.5 COX-1和COX-2 mRNA表达 用反转录多聚酶链反应(RT-PCR)技术,用HPRT的mRNA表达作外对照。
肺组织RNA提取用一定热酚法,PCR引物合成由上海细胞研究所合成,引物序列参考Lee和Osawa等[3]设计的COX-1、COX-2 HPRT引物序列,如表1。
表1 COX-1、COX-2、HPRT引物序列 基 因
引物序列
, http://www.100md.com
目的片段
rCOX-1
上游引物:5’-GACTGTGGCTGTGGATGTCATC-3’
450bp
下游引物:5’-CACTAAGACAGACCCGTAATCTCC-3’
rCOX-2
上游引物:5’-ACTCACTAGTTTGTTGAGTCATTC-3’
583bp
下游引物:5’-TTTGATTAGTACTGTAGGGTTAATG-3’
rHPRT
, http://www.100md.com
上游引物:5’-GCTGGTGAAAAGGACCCTCTCG-3’
258bp
下游引物:5’-GCAGATGGCCACAGGACTAGA-3’
cDNA的合成 取总RNA 1 μg,依次加入400 U逆转录酶(M-mulv),0.5 μg Oligo(dT)15,5×M-Mulv缓冲碱4 μl,dNTP(10mm) 2 μl,RNA酶抑制剂40 U,总体积为20 μl,37 ℃孵育90 min,95 ℃10 min终止反应,完成cDNA等一条链的合成。
PCR扩增 取cDNA 5 μl,10×PCR缓冲碱(无Mg++)5 μl,引物0.2 μmol/L(终浓度),Taq DNA酶4 U,dNIP 200 μmol/L,总体积50 μl。HPRT和COX-1扩增程序,95℃ 5 min 1个循环,95℃ 1 min、60℃55 s、72℃ 3 min 30个循环,72℃ 10 min延伸,COX-2扩增程序:94℃ 5 min 1个循环,95℃ 1 min、58℃ 1 min、72℃ 3 min 30个循环,72℃ 10 min延伸。
, 百拇医药
琼脂糖凝胶电脉 上述反应完成后5 μl上述PCR产物在1.5%琼脂糖凝胶上电泳,在紫外线仪上照像,然后测黑白照片的积分光密度,以COX-1/HPRT、COX-2/HPRT积分光密度比值作数据分析,以反映COX-1和COX-2 mRNA表达程度。
1.2.6 统计学分析 所有数据以均数±标准差(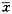 ±s)表示。用本校数学教研室提供的统计程序对数据行方差分析或t检验,结果以P<0.05为相差显著。
±s)表示。用本校数学教研室提供的统计程序对数据行方差分析或t检验,结果以P<0.05为相差显著。
2 结果
2.1 ALI时PaO2的变化
LPS组PaO2较生理盐水对照组显著下降,DEL干预组PaO2显著高于LPS组(如表2)。
, 百拇医药
表2 ALI鼠PaO2的变化 组 别
PaO2
Conrtol group
12.8±0.68
LPS-stimulated group
8.9±1.42*
DEX-treated group
10.6±1.13**
*P<0.01 vs Control;**P<0.01 vs LPS
, 百拇医药 2.2 W/D的变化
LPS组W/D显著高于生理盐水对照组(P<0.01),DEX组显著低于LPS组,(P<0.05),如表3。
表3 ALI大鼠W/D值的变化
组别
W/D
Control group
4.1±0.53
LPS-stimulated
4.9±0.32*
DEX-treated
, 百拇医药 4.6±0.36**
*P<0.01 **P<0.05 vs LPS
2.3 病理学改变
LPS组大鼠肺均有不同程度的充血,水肿。光镜下可见肺间质、肺泡水肿及出血、中性粒细胞浸润。DEX干预组较LPS组较轻,对照组未见上述改变。
2.4 COX-1和COX-2 mRNA表达的变化
LPS组COX-1 mRNA表达微高于对照组,相差不显著(P>0.05),DEX组COX-1 mRNA与LPS组和对照组表达不显著(P>0.05),见表4。
LPS组COX-2 mRNA表达显著高于对照组(近3倍)。DEX干预组COX-2 mRNA表达显著低于LPS组,与对照组无显著差异(P>0.05)。
, http://www.100md.com
表4 各组COX-1 mRNA和COX-2 mRNA表达的变化 组别
COX-1/HPRT
COX-2/HPRT
Control group
0.91±0.13
0.22±0.18
LPS-stimulated group
0.92±0.22
0.87±0.21*
DEX-treated group
, 百拇医药
0.91±0.08
0.21±0.08**
*P<0.01 vs control **P<0.01 vs LPS
3 讨论
本研究发现,尾静脉注射LPS 5 mg/kg 4 h后大鼠肺脏肿胀,出现肺间、肺泡水肿及出血,炎性细胞浸润,肺泡结构破坏,肺湿/干比增高等病理表现PaO2下降,提示ALI模型复制成功。DEX干预组病理改变及PaO2较LPS致伤组较轻,提示DEX对内毒素性ALI有一定治疗作用。
用RT-PCR技术测定ALI大鼠肺组织COX-1和COX-2 mRNA发现,在正常生理情况下,COX-1和COX-2 mRNA都有表达,和近期研究结果相似[4],表明在鼠肺COX-1 mRNA仅是组成型表达,COX-2 mRNA也是组成型表达。说明COX-1在正常生理状况下与内环境的稳定有重要关系,而COX-2不仅增加肺部的炎症反应,而且对正常肺部生理功能的调节也有重要关系,COX-1 mRNA表达在对照组、ALI组、DEX干预组之间无显著差别(P>0.05),表明COX-1基因表达的诱导性小,而且不受糖皮质激素的干扰,这和先前研究的结果相同[5],说明在ALI的发病中COX-1不起重要作用。在LPS致伤ALI组COX-2 mRNA表达相当于对照组表达的4倍,说明ALI时COX的主要变化是COX-2而不是COX-1,引起COX-2 mRNA表达升高的可能机制是:ALI实质上是肺部的过度炎症,主要因炎症细胞和炎症因子形成的复杂网络网。①体外研究发现[6],LPS、细胞因子可引起白细胞、肺泡巨噬细胞、肺成纤维细胞、肺泡和气管与支气管上皮细胞、肺微血管内皮细胞中的COX-2 mRNA表达升高,上述细胞是导致ALI主要效应细胞,是导致ALI时COX-2 mRNA表达升高的主要原因之一。②先前的研究表明前炎症介质如细菌内毒素(LPS)、细胞因子、有丝分裂原、肿瘤坏死因子(TNFα)等引起COX-2 mRNA表达升高的另一重要原因[7]。③ALI时导致机体缺氧,在缺氧情况下COX-2 mRNA表达通过NO、cAMP作用升高[8],肺产生过多的PGs通过负反馈机制引起COX-2 mRNA表达升高的。④COX-2基因启动子上存在核因子kB、活化子蛋白-1、cAMP反应条件结合蛋白等转录因子的结合位点,在炎症状态下上述转录因子活化,和COX-2基因的启动子上的结合位点结合加速COX-2 mRNA表达[9]。
, 百拇医药
本研究结果提示,DEX干预组COX-2 mRNA表达显著低于LPS致伤组,表明糖皮质激素可抑制COX-2 mRNA表达,其机制可能在转录水平及转录后下调COX-2 mRNA表达[9]。由此看来糖皮质激素可通过抑制COX-2 mRNA表达治疗ALI,但由于它能够增加感染等严重副作用限制了它的应用,而大多数非甾体抗炎药物(NSAIDs)非特异性地抑制COX-1和COX-2从而导致胃肠反应、肾损害等副作用。因此,研究开发选择性COX-2抑制剂是目前的发展方向。COX-2是参与ALI发病的主要同工酶,DEX主要抑制COX-2mRNA表达,而不影响COX-1的表达。
[基金来源] 国家自然科学基金资助(No.39670311)
[参考文献]
[1]Bernard GR,Artigas A,Brigham KJ,et al.Report of the American-European Consensus conference on ARDS:definifions,mechamisms,reclevant outcomes,and clinical trial coordination[J].Intensive Care Med,1994,20:225-236.
, 百拇医药
[2]Daniel P,Alan H,Stephensin,et al.Effect of eicosand inbibition on the development of pulmonary edema after acute lung injury[J]. J Appl Physiol,1996,80(3):915-923.
[3]Osawa M,Hamada KI,et al.Long term lyphopemat-opoietic reconstitution by as single C34-low/negactive hematiopoietic stem cell[J].Science,1996,273:242-245.
[4]Ermert L,Ermert M, Goppelt -struebe M,et al.Cyclooxygenase isoenzyme localization and mRNA expression in rat lungs[J].Am J Respir cell mol Biol,1998,18479-488.
, 百拇医药
[5]Strulbe MG.Molecular mechanisms involved in the regulation of prostaglandin biosynthesis by glucocorticoids[J].Biochem Pharmacol,1997,53:1389-1395.
[6]Tanita T,Ueda S,et al.Cyclooxygenase metabolites possibly produced by endothelial cells mediate the lung injury caused by stimulated leukocytes[J].Tohoku J EXP Med,1997,183(3):221-232.
[7]Mitchell JA,Belvisi MG,et al.Induction of cyclooxygenase-2 by cytokines in human pulmonary epithelial cells;regulation by eytokines in human pulmonary epithelial cells;regulation by dexamethasone[J].Br J Pharmacol,1994,113:1008-1014.
[8]Chida,Masayyuki,et al.Effects of acute and chronic hyoxia on rat lung cyclooxygenase[J]. AM J Physiol,1996,270(14):872-878.
[9]Barnes BJ, Adcock IM.Transcription factors and asthma[J].Eur Rexpir J,1998,12:221-234.
收稿:2000-03-26
, 百拇医药
单位:王金生 陈正堂(第三军医大学附属新桥医院呼吸内科研究所,重庆 400039);廖伟(第三军医大学附属新桥医院儿科)
关键词:急性肺损伤;环氧合酶;地塞米松
中国急救医学000508 [摘 要] 目的 探讨急性肺损伤(ALI)环氧合酶(COX)同工酶的变化及地塞米松(DEX)的影响。方法 用内毒素(LPS)复制ALI模型,用逆转录多聚酶链反应(RT-PCR)测定COX-1和COX-2的mRNA表达。结果 COX-1 mRNA表达在对照组、LPS组、DEX组之间无显著差别(P>0.05),而COX-2 mRNA表达LPS组显著高于对照组(3倍)(P<0.01),DEX干预组显著低LPS组(P<0.01),和对照组无显著差别(P>0.05)。结论 COX-2的诱导性表达与ALI的发病有重要关系,而COX-1与ALI的发病无关,DEX可下调COX-2的表达,对COX-1表达无影响。
, http://www.100md.com
[中图分类号] R 563;R 977.1 [文献标识码] A
[文章编号] 1002-1949(2000)05-0274-03
Changes of cyclooxygenase isoenzyme in acute lung injury and effects of dexamethasone on its
WANG Jin-sheng CHEN Zheng-tang LIAO Wei
(Institute of Respiratory Disease,Xinqiao Hospital,Third Military Medical University,Chongqing 400039,China)
[Abstract] Objective To investigate the changs of cyclooxygenase (COX)isoenzyme mRNA and effects of dexamethasone (DEX) on its .Methods Using reversertanscription polymerase chain reaction (RT-PCR) We measured COX-1 and COX-2 mRNA expression in rats lungs with ALI induced by lipopolysaccharide.Results No difference in COX-1 mRNAexpression among the control group LPS-stimulated group and dex treated group(P>0.05).COX-2mRNA expression in LPS-stimulated group was significantly higher (3-fold) than that in control group (P<0.01),and COX-2 mRNA express in DEX treated group was significantly lower (3-fold) than in LPS stimulated group (P<0.01).Conclusion the upregulation of COX-2 may be involved in ALI,DEX can down-regulate COX-2 other than COX-1 mRNA exprexssion and It has no effects on COX-1.
, 百拇医药
[Key words] Actute lung injury; Cyclooxygenase; Dexamethasone
急性肺损伤(acute lung injury,ALI)实质上是一种过度炎症反应,以肺泡毛细血管膜损害,中性粒细胞浸润,肺水肿,严重气体交换障碍为特征[1]。尽管ALI的发病机制尚未完全清楚,但前列腺素(prostaglandins,PGs)在ALI发病中的重要作用已得到确切证实[2],如血栓素(thromboxane,TX)可使白细胞趋化,血小板聚集,肺微血管收缩,从而导致肺血管内皮细胞和肺泡上皮细胞损伤。环氧合酶(cyclooxygenase,COX)是在花生四烯酸(arachidonic aciel AA)合体PGs的重要限速酶,近年的研究发现它有两型同工酶,COX-1为组成型表达,在许多组织中都有表达,对正常的生理功能的维持有重要作用;COX-2为诱导性,在静息条件下,大多数组织细胞没有表达,相反,在炎症刺激下如细菌脂多糖(lipoplysaccharides,LPS)白介素-1(interleukin-1,IL-1)等作用下迅速大量表达,加速PGs的生成,与其它炎性介质和蛋白酶一起参与ALI的发病,因此研究ALI时COX同工酶的mRNA表达的变化对ALI的发病机制可能提供新的实验依据。
, http://www.100md.com
1 材料与方法
1.1 材料
选用健康Wistar雄性大鼠,体重250~300 g,由第三军医大学动物中心提供,大肠杆菌脂多糖(lipopolysaccharide,LPS O111B4)购自美国Sigma公司,总RNA提取试剂盒购自德国BM公司。
1.2 方法
1.2.1 实验分组 将Wistar 36只大鼠随机分为:①生理盐水对照组(n=12);②LPS刺激组(n=12);③地塞米松干预组(DEX干预组,n=12)。
1.2.2 ALI模型的复制 采用尾静脉注射LPS 5 mg/kg复制ALI模型。DEX干预组采用在注射LPS之前2 h注射地塞米松5 mg/kg,生理盐水对照组用等量生理盐水尾静脉注射,并于注射LPS 4 h后放血活杀,经动脉插管留取动脉血3 ml,取出双肺,分别留做肺湿、干比(W/D),HE染色,一侧肺迅速贮存于液氮中,供提取总RNA。
, 百拇医药
1.2.3 W/D测定 采用真空干燥法。肺组织称湿重后,置真空干燥箱内,70℃真空干燥,在0.53 kPa条件下烤24小时后称干重,计算肺W/D。
1.2.4 病理观察 肺组织经10%甲醛固定,常规切片,HE染色,光镜下观察。
1.2.5 COX-1和COX-2 mRNA表达 用反转录多聚酶链反应(RT-PCR)技术,用HPRT的mRNA表达作外对照。
肺组织RNA提取用一定热酚法,PCR引物合成由上海细胞研究所合成,引物序列参考Lee和Osawa等[3]设计的COX-1、COX-2 HPRT引物序列,如表1。
表1 COX-1、COX-2、HPRT引物序列 基 因
引物序列
, http://www.100md.com
目的片段
rCOX-1
上游引物:5’-GACTGTGGCTGTGGATGTCATC-3’
450bp
下游引物:5’-CACTAAGACAGACCCGTAATCTCC-3’
rCOX-2
上游引物:5’-ACTCACTAGTTTGTTGAGTCATTC-3’
583bp
下游引物:5’-TTTGATTAGTACTGTAGGGTTAATG-3’
rHPRT
, http://www.100md.com
上游引物:5’-GCTGGTGAAAAGGACCCTCTCG-3’
258bp
下游引物:5’-GCAGATGGCCACAGGACTAGA-3’
cDNA的合成 取总RNA 1 μg,依次加入400 U逆转录酶(M-mulv),0.5 μg Oligo(dT)15,5×M-Mulv缓冲碱4 μl,dNTP(10mm) 2 μl,RNA酶抑制剂40 U,总体积为20 μl,37 ℃孵育90 min,95 ℃10 min终止反应,完成cDNA等一条链的合成。
PCR扩增 取cDNA 5 μl,10×PCR缓冲碱(无Mg++)5 μl,引物0.2 μmol/L(终浓度),Taq DNA酶4 U,dNIP 200 μmol/L,总体积50 μl。HPRT和COX-1扩增程序,95℃ 5 min 1个循环,95℃ 1 min、60℃55 s、72℃ 3 min 30个循环,72℃ 10 min延伸,COX-2扩增程序:94℃ 5 min 1个循环,95℃ 1 min、58℃ 1 min、72℃ 3 min 30个循环,72℃ 10 min延伸。
, 百拇医药
琼脂糖凝胶电脉 上述反应完成后5 μl上述PCR产物在1.5%琼脂糖凝胶上电泳,在紫外线仪上照像,然后测黑白照片的积分光密度,以COX-1/HPRT、COX-2/HPRT积分光密度比值作数据分析,以反映COX-1和COX-2 mRNA表达程度。
1.2.6 统计学分析 所有数据以均数±标准差(
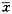 ±s)表示。用本校数学教研室提供的统计程序对数据行方差分析或t检验,结果以P<0.05为相差显著。
±s)表示。用本校数学教研室提供的统计程序对数据行方差分析或t检验,结果以P<0.05为相差显著。2 结果
2.1 ALI时PaO2的变化
LPS组PaO2较生理盐水对照组显著下降,DEL干预组PaO2显著高于LPS组(如表2)。
, 百拇医药
表2 ALI鼠PaO2的变化 组 别
PaO2
Conrtol group
12.8±0.68
LPS-stimulated group
8.9±1.42*
DEX-treated group
10.6±1.13**
*P<0.01 vs Control;**P<0.01 vs LPS
, 百拇医药 2.2 W/D的变化
LPS组W/D显著高于生理盐水对照组(P<0.01),DEX组显著低于LPS组,(P<0.05),如表3。
表3 ALI大鼠W/D值的变化
组别
W/D
Control group
4.1±0.53
LPS-stimulated
4.9±0.32*
DEX-treated
, 百拇医药 4.6±0.36**
*P<0.01 **P<0.05 vs LPS
2.3 病理学改变
LPS组大鼠肺均有不同程度的充血,水肿。光镜下可见肺间质、肺泡水肿及出血、中性粒细胞浸润。DEX干预组较LPS组较轻,对照组未见上述改变。
2.4 COX-1和COX-2 mRNA表达的变化
LPS组COX-1 mRNA表达微高于对照组,相差不显著(P>0.05),DEX组COX-1 mRNA与LPS组和对照组表达不显著(P>0.05),见表4。
LPS组COX-2 mRNA表达显著高于对照组(近3倍)。DEX干预组COX-2 mRNA表达显著低于LPS组,与对照组无显著差异(P>0.05)。
, http://www.100md.com
表4 各组COX-1 mRNA和COX-2 mRNA表达的变化 组别
COX-1/HPRT
COX-2/HPRT
Control group
0.91±0.13
0.22±0.18
LPS-stimulated group
0.92±0.22
0.87±0.21*
DEX-treated group
, 百拇医药
0.91±0.08
0.21±0.08**
*P<0.01 vs control **P<0.01 vs LPS
3 讨论
本研究发现,尾静脉注射LPS 5 mg/kg 4 h后大鼠肺脏肿胀,出现肺间、肺泡水肿及出血,炎性细胞浸润,肺泡结构破坏,肺湿/干比增高等病理表现PaO2下降,提示ALI模型复制成功。DEX干预组病理改变及PaO2较LPS致伤组较轻,提示DEX对内毒素性ALI有一定治疗作用。
用RT-PCR技术测定ALI大鼠肺组织COX-1和COX-2 mRNA发现,在正常生理情况下,COX-1和COX-2 mRNA都有表达,和近期研究结果相似[4],表明在鼠肺COX-1 mRNA仅是组成型表达,COX-2 mRNA也是组成型表达。说明COX-1在正常生理状况下与内环境的稳定有重要关系,而COX-2不仅增加肺部的炎症反应,而且对正常肺部生理功能的调节也有重要关系,COX-1 mRNA表达在对照组、ALI组、DEX干预组之间无显著差别(P>0.05),表明COX-1基因表达的诱导性小,而且不受糖皮质激素的干扰,这和先前研究的结果相同[5],说明在ALI的发病中COX-1不起重要作用。在LPS致伤ALI组COX-2 mRNA表达相当于对照组表达的4倍,说明ALI时COX的主要变化是COX-2而不是COX-1,引起COX-2 mRNA表达升高的可能机制是:ALI实质上是肺部的过度炎症,主要因炎症细胞和炎症因子形成的复杂网络网。①体外研究发现[6],LPS、细胞因子可引起白细胞、肺泡巨噬细胞、肺成纤维细胞、肺泡和气管与支气管上皮细胞、肺微血管内皮细胞中的COX-2 mRNA表达升高,上述细胞是导致ALI主要效应细胞,是导致ALI时COX-2 mRNA表达升高的主要原因之一。②先前的研究表明前炎症介质如细菌内毒素(LPS)、细胞因子、有丝分裂原、肿瘤坏死因子(TNFα)等引起COX-2 mRNA表达升高的另一重要原因[7]。③ALI时导致机体缺氧,在缺氧情况下COX-2 mRNA表达通过NO、cAMP作用升高[8],肺产生过多的PGs通过负反馈机制引起COX-2 mRNA表达升高的。④COX-2基因启动子上存在核因子kB、活化子蛋白-1、cAMP反应条件结合蛋白等转录因子的结合位点,在炎症状态下上述转录因子活化,和COX-2基因的启动子上的结合位点结合加速COX-2 mRNA表达[9]。
, 百拇医药
本研究结果提示,DEX干预组COX-2 mRNA表达显著低于LPS致伤组,表明糖皮质激素可抑制COX-2 mRNA表达,其机制可能在转录水平及转录后下调COX-2 mRNA表达[9]。由此看来糖皮质激素可通过抑制COX-2 mRNA表达治疗ALI,但由于它能够增加感染等严重副作用限制了它的应用,而大多数非甾体抗炎药物(NSAIDs)非特异性地抑制COX-1和COX-2从而导致胃肠反应、肾损害等副作用。因此,研究开发选择性COX-2抑制剂是目前的发展方向。COX-2是参与ALI发病的主要同工酶,DEX主要抑制COX-2mRNA表达,而不影响COX-1的表达。
[基金来源] 国家自然科学基金资助(No.39670311)
[参考文献]
[1]Bernard GR,Artigas A,Brigham KJ,et al.Report of the American-European Consensus conference on ARDS:definifions,mechamisms,reclevant outcomes,and clinical trial coordination[J].Intensive Care Med,1994,20:225-236.
, 百拇医药
[2]Daniel P,Alan H,Stephensin,et al.Effect of eicosand inbibition on the development of pulmonary edema after acute lung injury[J]. J Appl Physiol,1996,80(3):915-923.
[3]Osawa M,Hamada KI,et al.Long term lyphopemat-opoietic reconstitution by as single C34-low/negactive hematiopoietic stem cell[J].Science,1996,273:242-245.
[4]Ermert L,Ermert M, Goppelt -struebe M,et al.Cyclooxygenase isoenzyme localization and mRNA expression in rat lungs[J].Am J Respir cell mol Biol,1998,18479-488.
, 百拇医药
[5]Strulbe MG.Molecular mechanisms involved in the regulation of prostaglandin biosynthesis by glucocorticoids[J].Biochem Pharmacol,1997,53:1389-1395.
[6]Tanita T,Ueda S,et al.Cyclooxygenase metabolites possibly produced by endothelial cells mediate the lung injury caused by stimulated leukocytes[J].Tohoku J EXP Med,1997,183(3):221-232.
[7]Mitchell JA,Belvisi MG,et al.Induction of cyclooxygenase-2 by cytokines in human pulmonary epithelial cells;regulation by eytokines in human pulmonary epithelial cells;regulation by dexamethasone[J].Br J Pharmacol,1994,113:1008-1014.
[8]Chida,Masayyuki,et al.Effects of acute and chronic hyoxia on rat lung cyclooxygenase[J]. AM J Physiol,1996,270(14):872-878.
[9]Barnes BJ, Adcock IM.Transcription factors and asthma[J].Eur Rexpir J,1998,12:221-234.
收稿:2000-03-26
, 百拇医药