对1995年版《中国药典》一部凡例相关体例的商榷意见
作者:王汉章 刘红宇 邹国栋 廖安忠 漆俊芳
单位:王汉章(江西省药品检验所,江西 南昌 330046);刘红宇(江西省药品检验所,江西 南昌 330046);邹国栋(江西省药品检验所,江西 南昌 330046);廖安忠(江西省新余市药品检验所,江西 新余 338000);漆俊芳(江西省新余市制药厂,江西 新余 338000)
关键词:
New Page 1 《中国药典》“凡例”是药典的总纲,对于解释、正确进行品种检验及药品监督等使用方面具有十分重要的意义,又是整个《中国药典》科学、规范、严谨的体现,并肩负统一正文体例,减少不必要重复的重任。但是由于中药品种的复杂性以及正文体例尚未规范统一,以致“凡例”尚存在需要改进的问题,为此提出以下几点商榷意见。
1 凡例(二)应能充分指导品名目次的排序,品名目次的排序应符合凡例(二)规定。
, 百拇医药
《中国药典》凡例(二)谓:“中文名称按笔画数顺序排列,同笔画数的字按起笔笔形
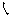 フ顺序排列”。此语显然系指品种中文名之“首字”的笔画数,而不是中文名称的总笔画数,故“首字”2字不可缺少;在排序工作中,同笔画数的字仅按起笔笔形是不够的,尚需用到第二或更多笔的笔形,故“起笔”2字当删去;此外,中文名称尚有许多首字相同的,甚至第二字相同的,需依据相同字后面第一个不同的字来排序。为了使凡例(二)确实能指导排序实际工作,建议将其修改为:正文品种,按中文名称首字笔画数及其笔形
フ顺序排列”。此语显然系指品种中文名之“首字”的笔画数,而不是中文名称的总笔画数,故“首字”2字不可缺少;在排序工作中,同笔画数的字仅按起笔笔形是不够的,尚需用到第二或更多笔的笔形,故“起笔”2字当删去;此外,中文名称尚有许多首字相同的,甚至第二字相同的,需依据相同字后面第一个不同的字来排序。为了使凡例(二)确实能指导排序实际工作,建议将其修改为:正文品种,按中文名称首字笔画数及其笔形 フ顺序排列,若名称前面的字相同时,则按下一个不同的字的笔画数和笔形顺序排列。
フ顺序排列,若名称前面的字相同时,则按下一个不同的字的笔画数和笔形顺序排列。
, 百拇医药
考察《中国药典》的品名目次,有不少地方的排列位置不符合凡例(二)之原则。如药材四画中的王不留行,按笔形而论,王不留行应从天仙子后第14位调至天仙子前面;又如五画中的玉竹及功劳木,玉竹理应排在功劳木的前面。现将药材四画与五画的品名重新编排(王天木五太瓦车牛毛片升化月丹乌火巴水玉功甘艾石龙平北生仙白瓜冬玄半丝),并与《中国药典》品名目次比较,即可发现多有变动。
为此,认为对整个品名目次的排序有复议重排之必要。此外,品名目次中文名称前序号的应用价值似乎不大,是否可考虑删去。
2 凡例(三)中的浸出物及注意是否应删去,以便正文中相应的体例更趋合理。
《生药学》[1]谓“浸出物含量测定法—适用于有效成分尚无精确定量方法的生药。根据已知有效成分的溶解度,选用水、醚或一定浓度的醇为溶媒,测定它的浸出物含量,也可以表示生药的品质。”此语明确指出浸出物是含量测定项目之一。更加值得一提的是,浸出物是建立在有效成分明确,只是对此成分无精确定量方法,也就是说同其他已有精确方法测定相比,只不过是粗提物而已。其实鞣质、挥发油或某类生物碱等的含量测定,也不都是单一成分。《中国药典》凡例及正文均将[浸出物]列在[检查]项及[含量测定]项之间,这就使其三者变成了并列而影响了体例的合理性。建议将浸出物从凡例(三)中删去,同时将正文中的浸出物并于[含量测定]项下。同理,成方及单味制剂中尚有“挥发性醚浸出物”,也应纳入[含量测定]项下。
, 百拇医药
此外,正文中各品种的[用法与用量]项下的[注意]也不宜单列。故建议将凡例(三)中的“(13)注意”删去,对于正文中的[用法与用量]下面的[注意]删去[]。“注意”二字保持黑体,以便仍能起到提示“注意”之目的。
3 依据凡例(八)之规定,中药材性状项下的物理常数当采用“记录”之体例,更宜调至[检查]项下。
按照《中国药典》凡例(八)“性状项下记载药品的外观,臭,味,溶解度以及物理常数”之规定,各中药材相应的特征(外观、色泽、断面、气、味)及溶解度、物理常数均系采用记载形式,然而物理常数,如肉桂油的相对密度及折光率,不是采用记录式(相对密度1.055~1.070,折光率1.602~1.614),而是采用了[检查]之体例,即相对密度应为1.055~1.070,(附录V11A),折光率应为1.602~1.614(附录V11 F)。这不但违背了凡例(八)“记载”之规定,而且是不恰当的。
若将物理常数仍放在性状项下,那么就需要改用记录形式,同时在检查项还得增加物理常数的检查规定。《日本药局方》[2]的麻油、蓖麻油等,以及《美国药典》[3]蓖麻油、橄榄油等条,也都未将物理常数载入性状项下,而是将各物理常数之检查与性状并列处理。为了避免[性状]及[检查]两处重复出现物理常数,并减少与《中国药典》附录17项中药材性状概念不相合之程度,再者又可与某些中成药的相对密度、pH值等已列入检查项的情况吻合。为此,建议将正文各相关品种的物理常数调至检查项。同时将凡例(八)中“物理常数”有关内容调至凡例(十)。
, 百拇医药
4 依据凡例(九),正文[鉴别]项中的体例统一问题。
从凡例(九)的“鉴别项下包括经验鉴别,显微鉴别和理化鉴别”一语可以得知,此3个鉴别是并列关系。然正文各药材鉴别项中的3个鉴别,因体例处理不当,以致失去了并列关系。如麝香经验鉴别收载了插针、洗香及火试3种方法,各方法前面分别冠有(1),(2),(3);又如三七的理化鉴别共收载了泡沫实验、荧光及薄层分析,各方法前面也分别冠有(2),(3),(4)。而显微鉴别虽然收载了横切面及粉末(或表面显微特征)2种方法,然只共冠一个顺序数,如此一来,就使整个显微鉴别项与经验鉴别、理化鉴别的“子项”平级,并且还可理解为横切面显微特征尚包括粉末显微特征(或表面显微特征)。故建议,只要显微鉴别收载了2个或2个以上鉴别方法时,在其各方法前均应分别冠以顺序数字。
5 关于凡例(二十七)条(4)款的修改与相对应的正文中体例统一的建议。
凡例(二十七)条(4)款(以下简称(4)款)是说明本药典关于百分比符号的含义及用法,自然应包括[检查]及[含量测定]项有关纯度及限度的百分比。(4)款中虽有%(ml/ml),%(ml/g)阐述之意,然均系指溶液浓度的表示方法。
, http://www.100md.com
此外,在《中国药典》正文中百分比“%”的表示法也不尽相同。如丹参中丹参酮ⅡA规定不得少于千分之二,用0.2 %表示;红粉中氧化物规定“不得更浓”后括弧中的十万分之六是用0.006 %表示,但对于冰片、石膏等药物中砷盐以及所有重金属检查,药材纯度的规定均采用中文“百万分之XX”表示。
为此,建议对“(4)款”做如下修改:百分比,一般只有“%”符号表示,但根据需要可采用符号%(g/g),%(ml/ml),%(ml/g)及%(g/ml)表示。溶液 的百分比,除另有规定外,系指溶液100 ml中含有溶质若干克;乙醇的百分比,系指在20 ℃时容量的比例。至于(4)款中的%(g/g)及%(ml/ml)等符号及后面的注释,是否可删去以节约版面。关于药品纯度及限度的百分比,建议也采用“%”符号表示,以便统一此类百分比表示的体例。砷盐及重金属的百万分之十及百万分之二是否也同丹参酮ⅡA(限量)及氯化物(纯度)百分比一样分别采用0.001 %,0.0002 %表示。
, 百拇医药
6 与凡例(二十八)条(5)款“按干燥品计算”相关问题之讨论。
6.1 哪些检测需按干燥品计算,凡例是否可统一规定。由于《中国药典》只在附录中对鞣质及浸出物有规定,而大多数都是在各品种项下分别规定,以致正文存有不尽人意之处。例如药材的含量测定项,初步统计要求按干燥品及按某干燥条件计算的(包括浸出物及可理解为按干燥品计算的药物,并除去可不必按干燥品计算的矿物等药物)约占67 %;约有40种植物类药材(挥发油21种,其他成分24种)的含量测定计算均未规定。由于植物类药材均含有不定量的水分,必然影响试验数据的稳定性和限度规定的科学性,所以除大多数矿物类、液体类药材外,其他药材均应规定按干燥品计算。如果在凡例中进行规定,不但可避免多处重复,而且各个正文限量前的“按干燥品计算”这几个字也可省去。
除含量测定(包括浸出物)外,[检查]项下要求严格的重金属及砷盐的限量以及剧毒药材如制川乌、制草乌的酯型生物碱的控制是否也可列入“规定”之范围内,否则因药材水分含量高而使本不符合规定的反而符合规定,从而使限度失去意义。
, 百拇医药
6.2 凡例是否还应统一规定含量测定用对照品及供试品的干燥方法。由于《中国药典》对此无统一规定,以致现已按干燥品或类似干燥品计算的各品种在含量测定中,对于对照品及供试品干燥方法的规定无法统一。故建议:对于含量测定用的对照品,哪些需要干燥,用什么方法干燥,可在附录XV中的相关品种右上角标注不同的符号,并在附录下方加以注释,凡例中只需注明按附录规定执行即可。对于供试品,凡例可根据药材是否含挥发性成分而统一规定105 ℃干燥或减压干燥测定干燥失重,也可统一规定用烘干法或减压干燥法测定水分,或参照对照品干燥方法进行干燥。
6.3 统一规定“按干燥品计算”后的相关问题之讨论。统一“规定”后,原来未按干燥品或类似干燥品计算的百分含量自然比原限量高,对于含量测定暂时可继续按原限量执行,待以后通过电脑广泛收集检测数据后再行修改。但是对于需严格控制的重金属、砷盐及剧毒成分的限量则需尽快重新制定。
对于正文各品种含量测定、重金属、砷盐及剧毒药材剧毒成分限量的“%”数,都不必再注明按干燥品计算,只要对不必扣除水分的某些药物另加说明。对于成方及单味制剂含量测定若能按每片、粒、袋等单位计算含量,除对照品需要考虑干燥外,供试品则不必考虑。
参考文献:
[1]楼之岑.生药学.北京:人民卫生出版社,1965.37.
[2]日本厚生省.日本药局方.第十二改正.1991.908,1030.
[3]U S A.Pharmacopeia.1995.282,2274.
收稿日期:1999-02-16, 百拇医药
单位:王汉章(江西省药品检验所,江西 南昌 330046);刘红宇(江西省药品检验所,江西 南昌 330046);邹国栋(江西省药品检验所,江西 南昌 330046);廖安忠(江西省新余市药品检验所,江西 新余 338000);漆俊芳(江西省新余市制药厂,江西 新余 338000)
关键词:
New Page 1 《中国药典》“凡例”是药典的总纲,对于解释、正确进行品种检验及药品监督等使用方面具有十分重要的意义,又是整个《中国药典》科学、规范、严谨的体现,并肩负统一正文体例,减少不必要重复的重任。但是由于中药品种的复杂性以及正文体例尚未规范统一,以致“凡例”尚存在需要改进的问题,为此提出以下几点商榷意见。
1 凡例(二)应能充分指导品名目次的排序,品名目次的排序应符合凡例(二)规定。
, 百拇医药
《中国药典》凡例(二)谓:“中文名称按笔画数顺序排列,同笔画数的字按起笔笔形
, 百拇医药
考察《中国药典》的品名目次,有不少地方的排列位置不符合凡例(二)之原则。如药材四画中的王不留行,按笔形而论,王不留行应从天仙子后第14位调至天仙子前面;又如五画中的玉竹及功劳木,玉竹理应排在功劳木的前面。现将药材四画与五画的品名重新编排(王天木五太瓦车牛毛片升化月丹乌火巴水玉功甘艾石龙平北生仙白瓜冬玄半丝),并与《中国药典》品名目次比较,即可发现多有变动。
为此,认为对整个品名目次的排序有复议重排之必要。此外,品名目次中文名称前序号的应用价值似乎不大,是否可考虑删去。
2 凡例(三)中的浸出物及注意是否应删去,以便正文中相应的体例更趋合理。
《生药学》[1]谓“浸出物含量测定法—适用于有效成分尚无精确定量方法的生药。根据已知有效成分的溶解度,选用水、醚或一定浓度的醇为溶媒,测定它的浸出物含量,也可以表示生药的品质。”此语明确指出浸出物是含量测定项目之一。更加值得一提的是,浸出物是建立在有效成分明确,只是对此成分无精确定量方法,也就是说同其他已有精确方法测定相比,只不过是粗提物而已。其实鞣质、挥发油或某类生物碱等的含量测定,也不都是单一成分。《中国药典》凡例及正文均将[浸出物]列在[检查]项及[含量测定]项之间,这就使其三者变成了并列而影响了体例的合理性。建议将浸出物从凡例(三)中删去,同时将正文中的浸出物并于[含量测定]项下。同理,成方及单味制剂中尚有“挥发性醚浸出物”,也应纳入[含量测定]项下。
, 百拇医药
此外,正文中各品种的[用法与用量]项下的[注意]也不宜单列。故建议将凡例(三)中的“(13)注意”删去,对于正文中的[用法与用量]下面的[注意]删去[]。“注意”二字保持黑体,以便仍能起到提示“注意”之目的。
3 依据凡例(八)之规定,中药材性状项下的物理常数当采用“记录”之体例,更宜调至[检查]项下。
按照《中国药典》凡例(八)“性状项下记载药品的外观,臭,味,溶解度以及物理常数”之规定,各中药材相应的特征(外观、色泽、断面、气、味)及溶解度、物理常数均系采用记载形式,然而物理常数,如肉桂油的相对密度及折光率,不是采用记录式(相对密度1.055~1.070,折光率1.602~1.614),而是采用了[检查]之体例,即相对密度应为1.055~1.070,(附录V11A),折光率应为1.602~1.614(附录V11 F)。这不但违背了凡例(八)“记载”之规定,而且是不恰当的。
若将物理常数仍放在性状项下,那么就需要改用记录形式,同时在检查项还得增加物理常数的检查规定。《日本药局方》[2]的麻油、蓖麻油等,以及《美国药典》[3]蓖麻油、橄榄油等条,也都未将物理常数载入性状项下,而是将各物理常数之检查与性状并列处理。为了避免[性状]及[检查]两处重复出现物理常数,并减少与《中国药典》附录17项中药材性状概念不相合之程度,再者又可与某些中成药的相对密度、pH值等已列入检查项的情况吻合。为此,建议将正文各相关品种的物理常数调至检查项。同时将凡例(八)中“物理常数”有关内容调至凡例(十)。
, 百拇医药
4 依据凡例(九),正文[鉴别]项中的体例统一问题。
从凡例(九)的“鉴别项下包括经验鉴别,显微鉴别和理化鉴别”一语可以得知,此3个鉴别是并列关系。然正文各药材鉴别项中的3个鉴别,因体例处理不当,以致失去了并列关系。如麝香经验鉴别收载了插针、洗香及火试3种方法,各方法前面分别冠有(1),(2),(3);又如三七的理化鉴别共收载了泡沫实验、荧光及薄层分析,各方法前面也分别冠有(2),(3),(4)。而显微鉴别虽然收载了横切面及粉末(或表面显微特征)2种方法,然只共冠一个顺序数,如此一来,就使整个显微鉴别项与经验鉴别、理化鉴别的“子项”平级,并且还可理解为横切面显微特征尚包括粉末显微特征(或表面显微特征)。故建议,只要显微鉴别收载了2个或2个以上鉴别方法时,在其各方法前均应分别冠以顺序数字。
5 关于凡例(二十七)条(4)款的修改与相对应的正文中体例统一的建议。
凡例(二十七)条(4)款(以下简称(4)款)是说明本药典关于百分比符号的含义及用法,自然应包括[检查]及[含量测定]项有关纯度及限度的百分比。(4)款中虽有%(ml/ml),%(ml/g)阐述之意,然均系指溶液浓度的表示方法。
, http://www.100md.com
此外,在《中国药典》正文中百分比“%”的表示法也不尽相同。如丹参中丹参酮ⅡA规定不得少于千分之二,用0.2 %表示;红粉中氧化物规定“不得更浓”后括弧中的十万分之六是用0.006 %表示,但对于冰片、石膏等药物中砷盐以及所有重金属检查,药材纯度的规定均采用中文“百万分之XX”表示。
为此,建议对“(4)款”做如下修改:百分比,一般只有“%”符号表示,但根据需要可采用符号%(g/g),%(ml/ml),%(ml/g)及%(g/ml)表示。溶液 的百分比,除另有规定外,系指溶液100 ml中含有溶质若干克;乙醇的百分比,系指在20 ℃时容量的比例。至于(4)款中的%(g/g)及%(ml/ml)等符号及后面的注释,是否可删去以节约版面。关于药品纯度及限度的百分比,建议也采用“%”符号表示,以便统一此类百分比表示的体例。砷盐及重金属的百万分之十及百万分之二是否也同丹参酮ⅡA(限量)及氯化物(纯度)百分比一样分别采用0.001 %,0.0002 %表示。
, 百拇医药
6 与凡例(二十八)条(5)款“按干燥品计算”相关问题之讨论。
6.1 哪些检测需按干燥品计算,凡例是否可统一规定。由于《中国药典》只在附录中对鞣质及浸出物有规定,而大多数都是在各品种项下分别规定,以致正文存有不尽人意之处。例如药材的含量测定项,初步统计要求按干燥品及按某干燥条件计算的(包括浸出物及可理解为按干燥品计算的药物,并除去可不必按干燥品计算的矿物等药物)约占67 %;约有40种植物类药材(挥发油21种,其他成分24种)的含量测定计算均未规定。由于植物类药材均含有不定量的水分,必然影响试验数据的稳定性和限度规定的科学性,所以除大多数矿物类、液体类药材外,其他药材均应规定按干燥品计算。如果在凡例中进行规定,不但可避免多处重复,而且各个正文限量前的“按干燥品计算”这几个字也可省去。
除含量测定(包括浸出物)外,[检查]项下要求严格的重金属及砷盐的限量以及剧毒药材如制川乌、制草乌的酯型生物碱的控制是否也可列入“规定”之范围内,否则因药材水分含量高而使本不符合规定的反而符合规定,从而使限度失去意义。
, 百拇医药
6.2 凡例是否还应统一规定含量测定用对照品及供试品的干燥方法。由于《中国药典》对此无统一规定,以致现已按干燥品或类似干燥品计算的各品种在含量测定中,对于对照品及供试品干燥方法的规定无法统一。故建议:对于含量测定用的对照品,哪些需要干燥,用什么方法干燥,可在附录XV中的相关品种右上角标注不同的符号,并在附录下方加以注释,凡例中只需注明按附录规定执行即可。对于供试品,凡例可根据药材是否含挥发性成分而统一规定105 ℃干燥或减压干燥测定干燥失重,也可统一规定用烘干法或减压干燥法测定水分,或参照对照品干燥方法进行干燥。
6.3 统一规定“按干燥品计算”后的相关问题之讨论。统一“规定”后,原来未按干燥品或类似干燥品计算的百分含量自然比原限量高,对于含量测定暂时可继续按原限量执行,待以后通过电脑广泛收集检测数据后再行修改。但是对于需严格控制的重金属、砷盐及剧毒成分的限量则需尽快重新制定。
对于正文各品种含量测定、重金属、砷盐及剧毒药材剧毒成分限量的“%”数,都不必再注明按干燥品计算,只要对不必扣除水分的某些药物另加说明。对于成方及单味制剂含量测定若能按每片、粒、袋等单位计算含量,除对照品需要考虑干燥外,供试品则不必考虑。
参考文献:
[1]楼之岑.生药学.北京:人民卫生出版社,1965.37.
[2]日本厚生省.日本药局方.第十二改正.1991.908,1030.
[3]U S A.Pharmacopeia.1995.282,2274.
收稿日期:1999-02-16, 百拇医药