尼莫的平对Alzheimer病大鼠海马和额叶细胞外液氨基酸的影响
作者:刘春风 戴永萍 章春园 张志琳 包仕尧
单位:苏州医学院附属第二医院神经内科 215004
关键词:Alzheimer病;兴奋性氨基酸;尼莫的平
临床神经病学杂志000505 【摘要】 目的 研究尼莫的平对Alzheimer 病大鼠海马和额叶兴奋性氨基酸的影响。方法 在立体定位下于迈内特基底核(NBM)注入β淀粉样蛋白(β-AP)10 μg建立Alzheimer 病模型,对照组在NBM注入生理盐水,治疗组在建立模型后腹腔注射尼莫的平,每天注射1次 至实验结束, 模型组不给任何药物。脑内微透析技术采集大鼠海马、额叶细胞外液,反相高 效液相色谱技术测定氨基酸类神经递质。结果 模型组海马和额叶细胞外 液4种氨基酸浓度均较对照组升高,谷氨酸最明显。尼莫的平治疗后谷氨酸明显降低。结论 由β-AP产生的Alzheimer病大鼠痴呆与兴奋毒性有关,其作用可能是由 钙离子介导。
, 百拇医药
Effects of nimodipine on extracellular amino acid of frontal lobe and hippocampu s in Alzheimer's disease rats
Liu Chunfeng Dai Yongping Zhang Chunyuan et al
(Department of Neurology,the Second Affiliated Hospital,Suzhou Medical Col lege,Suzhou 215004)
【Abstract】 Objective To study the effects of nimodipine on frontal lobe excitatory amino acid and hi ppocampus in Alzheimer's disease rats.Methods In stereotaxic β -AP (10 μg) was injected into NBM in rats and established the Alzheimer's dise ase model,the control group was injected NaCl (0.9%) in the same way.the treatme nt group was made with intraperitoneal injection of nimodipine once a day till t he end of the experiment,the model group wasn't administered any drug.The hippoc ampus,frontal lobe extracellular of rats were collected by intracerebral microdi alysis,the extracellular amino acid neurotransmission was detected by microdialy sis in vivo with HPLC.Results The extracellular 4 kinds of amino acids concentration of frontal lobe and hippocampus in the model group was higher than those in the control group,especially glutamate (Glu),Glu remarkable decreased with nimodipi ne treatment.Conclusions The rat's dementia with Alzheimer's di sease induced by β-AP was related to excitotoxicity, it might contribute to the loss of Ca2+ homeostasis.
, 百拇医药
【Key words】 Alzheimer's disease Excitatory amino acid Nimod ipine
神经生化研究发现在Alzheimer 病(AD)患者的脑内存在广泛的神经递 质改变[1],而兴奋性氨基酸在神经系统损害中起重要作用。为研究β淀粉样蛋白( β-AP)对兴奋性氨基酸的影响,我们观察β-AP注入大鼠迈内特基底核(NBM)后,额叶皮质、 海马区细胞外液中的谷氨酸(Glu)、甘氨酸(Gly)、牛磺酸(Tau)和γ-氨基丁酸(GABA)等4 种氨基酸浓度的改变以及尼莫的平的作用。
1 材料与方法
1.1 材料 健康雄性SD大鼠24只,3~4月龄,体重180~250 g(苏州医学院动物实验中心 提供),随机分成对照组、模型组和治疗组,每组8只大鼠。微透析系统(BAS BeeKeeper Sys tem,美国),透析膜的有效长度为2 mm。由2台Beckman 110B泵、157荧光检测器(9 μl检 测池)、Rheodyne进样器组成高效液相色谱检测系统。
, http://www.100md.com
1.2 方法
1.2.1 模型制备及给药方法 按照我们报告的方法[2],将10 μl的β-AP(RBI ,美国)在立体定位仪下注入大鼠NBM。对照组在NBM处注入生理盐水,治疗组在建立模型后 腹腔注射尼莫的平(Bayer公司,德国)50 μg/100 g体重,以后每天注射1次至实验结束. 模型组不给任何药物。
1.2.2 微透析方法的建立 注射β-AP后第10天于坐标前囟后1.4 mm、旁1.5 mm、深2 mm 和前囟后3 mm、旁2 mm、深2.5 mm处植入微透析基座。微透析基座通过螺丝和牙科水泥固定 于大鼠 的颅骨上,术后第3天开始进行细胞外液采样,将微透析探头插入基座,透析液平衡灌流90 分钟后开始收集样本。透析液为Ringer溶液,其组成为(mmol/L):NaCl 147,KCl 4.0,CaC l2 2.2。灌流速度2.5 μl/min。每15分钟收集1管。透析前在相同流速和室温条件下测定 探头的体外回收率。样本收集后-70 ℃冰箱保存待测。实验结束后进行常规病理检查以鉴 定探头插入的部位。
, 百拇医药
1.2.3 样本氨基酸类神经递质测定 采用反相高效液相色谱荧光法结合邻苯二甲醛(OPA)柱 前衍生技术进行测定。将27 mg OPA、2-巯基乙醇40 μl溶于5 ml甲醇中,再加入0.1 mmol /L四硼酸钠(pH=9.6)5 ml中混匀,配制衍生液。10 μl衍生液加样品20 μl,震荡30秒,静 置90秒后加入色谱柱。流动相A为含35%甲醇及四氢呋喃的缓冲液,流动相B为90%甲醇。流速 1.0 ml/min,激发波长280 nm,发射波长340 nm。进样后检测,由System Gold 对峰面积积 分,再以标准氨基酸浓度对峰面积作校正曲线,以外标法计算样品浓度。
1.2.4 统计学处理 数据以(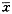 ±s)表示。用t检验进行分析。
±s)表示。用t检验进行分析。
2 结 果
2.1 各组大鼠额叶细胞外液氨基酸的浓度 见表1。模型组大鼠额叶细胞外液Glu、Gly、 T au水平均较对照组显著升高(P<0.01),特别是Glu,升高188%,而GABA无显著性差异( P>0.05)。治疗组除Tau外,Glu、Gly、GABA均显著降低(P<0.01,P<0.05)。
, 百拇医药
2.2 各组海马细胞外液氨基酸的浓度改变 见表2。结果表明模型组大鼠海马细胞外液除Gl y外,Glu、Tau、GABA水平较对照组均升高(P<0.01),Glu 升高最显著,升高314%。治 疗组均低于对照组和模型组(P<0.01,P<0.05)。
表1 额叶皮质细胞外液氨基酸浓度的改变(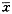 ±s,nmol/L) 组 别
±s,nmol/L) 组 别
只数
Glu
Gly
Tau
GABA
治疗组
, http://www.100md.com
8
147.6±49.6*#
758.3±257.1*△
1412.5±308.1*
406.1±208.8*△
模型组
8
830.9±160.1**
1460.3±455.4**
1416.0±383.1
, http://www.100md.com
680.0±271.9
对照组
8
281.0±96.3
1120.3±174.3
942.9±174.6
621.8±165.8
与对照组比*P<0.05,**P<0.01;与模型组比△P<0.05,# P<0.01表2 海马区细胞外液氨基酸浓度的改变(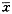 ±s,nmol/L) 组 别
±s,nmol/L) 组 别
, http://www.100md.com
只数
Glu
Gly
Tau
GABA
治疗组
8
132.5±58.9*#
735.1±225.5**#
1323.9±201.2△**
194.4±144.9**#
, http://www.100md.com
模型组
8
1010.4±269.5**
1370.9±548.1
1645.5±536.2**
803.3±442.6*
对照组
8
244.1±52.7
1195.5±328.9
773.0±236.5
, 百拇医药
552.4±219.7
与对照组比*P<0.05,**P<0 .01;与模型组比△P<0.05,#P<0.01
3 讨 论
大量研究表明β-AP 在脑内的沉积是AD的主要病因之一,并提出了β-AP 病因学说[ 1]。我们将β-AP 注入大鼠NBM建立AD动物模型,经行为学测试表明大鼠学习记忆能力 受 到损害[2]。尽管一些体外实验表明β-AP有神经毒性作用,但β-AP 的神经细胞 毒性确切机理尚不清楚。
谷氨酸是脑内重要的兴奋性神经递质,在神经系统生长、发育、学习和记忆中起十分重要的 作用。生理状态下通过与受体的应答反应,Ca2+通透性增加,流入细胞内作为第二信 使,引发一系列正常生理生化过程。当在体外添加高浓度的谷氨酸或在病理条件下造成局灶 周围谷氨酸大量聚积时,谷氨酸持续作用于受体,引起对受体的滥刺激,最终导致神经损伤 。动物试验表明,NMDA受体兴奋剂鹅膏蕈氨酸注入海马后,可造成大鼠基底神经外侧核的细 胞死亡,继而导致了类似于AD的病理与生化的变化[3]。Jimenez等[4] 发 现AD患者脑脊液中的Glu、Tau、Gly高于对照组,而对中枢神经系统具有抑制作用的GABA浓 度却较低。Glu载体的活性在AD时也有明显的改变,并在其疾病的过程中起重要作用。在体 外实验发现Glu引起细胞死亡和tau蛋白变化与其打开受体门控通道或激活磷酸肌醇环路,使 Ca2+内流,细胞内Ca2+增高有关[5] 。Yamada等[6] 报告在 20天胎龄大鼠海马神经元培养中,Glu与神经元接触15分钟,可引起海马神经元显著退化。
, http://www.100md.com
以上在体内和体外试验都证实兴奋性氨基酸在AD的病理生理过程中起着重要的作用。那么β -AP与兴奋性神经毒性之间有何关系呢?为进一步研究β-AP引起的神经元损害是否与兴 奋毒性有关,我们采用脑内微透析技术,观察β-AP 注入NBM后海马、额叶细胞外液中的几 种氨基酸浓度的改变。发现在β-AP注入NBM后大鼠海马、额叶细胞外液氨基酸类神经递质 水平升高,其中兴奋性氨基酸Glu升高尤为明显,而抑制性神经递质如GABA、Tau和Gly虽然 升高但没有Glu改变明显。这说明了β-AP的神经毒性作用与Glu的兴奋毒性有关。我们在实 验中还发现在尼莫的平治疗后细胞外液的兴奋性氨基酸几乎完全被抑制。根据这一结果我们 推测β-AP所引起的兴奋毒性可能是由钙离子介导的。
一些体外实验研究也支持这一推测。Parpura-Gill等[7]的研究表明β-AP能抑制 培养的海马胶质细胞糖摄取和谷氨酸的转运,从而产生毒性作用。Klegeris等[8] 发现β-AP能促进巨噬细胞产生自由基和Glu,β淀粉样前体蛋白能调节Glu载体活性,进而 调节突触位点的Glu水平。Mattson等[9]发现β-AP通过对Ca2+的作用进一 步影响Glu的作用,他们在人皮质神经细胞的培养研究中发现β-AP能使细胞内钙离子浓度 升高,增加神经细胞对兴奋性氨基酸的毒性作用。Arias 等[10]也发现β-AP能增 加去极化的海马脑片钙依赖的兴奋性氨基酸的释放。
, 百拇医药
虽然尼莫的平能完全抑制细胞外液兴奋性氨基酸的升高,但研究表明大鼠的行为学不能完全 改善,这说明在β-AP所引起的大鼠痴呆过程中除钙离子、兴奋毒性的作用以外还存在其它 机理,需要进一步研究。
志谢:在氨基酸浓度检测工作中上海医科大 学神经生物学国家重点实验室高慧女士给予了协助,特此致谢。
基金项目:江苏省青蓝工程基金资助
参 考 文 献
1,Cummings JL,Vinters HV,Cole GM,et al. Alzheimer's disease-etiologies, pathoph ysiology, cognitive reserve, and treatment opportunities. Neurology,1998,51 (S1) :2
, 百拇医药
2,刘春风,包仕尧,戴永萍,等.Alzheimer病大鼠局部脑血流量与行为学改变的研究.临床神经 病学杂志,1999,12:160
3,Dunnett SB,Whishaw IQ,Jones GH,et al.Behavioral, biochemical and histochemical e ffects of different neurotoxic amino acids injected into nucleus basalis magnoce llularis of rat. Neuroscience, 1991,20:653
4,Jimenez-Jimenez FJ, Molina JA, et al.Neurotransmitter amino acids in cerebro spinal fluid of patients with Alzheimer's disease.J Neural Transm,1998,105:269
, 百拇医药
5,Kure S,Tominaga T.Glutamate triggers internucleosomal DNA cleavage in neurona l cells. Biochem Biophys RES Commun, 1991,179:39
6,Yamada M,Hatanaka H.Interleukin-6 protects cultured rat hippocampal neurons against glutamate-induced cell death.Brain Res,1994,643:173
7,Parpura-Gill A, Beitz D, Uemura E.The inhibitory effects of beta-amyloid on utamate and glucose uptakes by cultured astrocytes. Brain Res, 1997,754:65
, http://www.100md.com
8,Klegeris A, McGeer PL.beta-Myloid protein enhances macrophage production of oxygen free radicals and glutamate. J Neurosci Res,1997,49:229
9,Mattson MP, Cheng B, Davis D,et al.beta-Amyloid peptides destabilize calcium ho meostasis and render human cortical neurons vulnerable to excitotoxicity. J Neur osci, 1992,12:376
10,Arias C, Arrieta I, Tapia R. beta-Amyloid peptide fragment 25-35 potentiates the calcium-dependent release of excitatory amino acids from depolarized hippo campal slices. J Neurosci Res,1995,41:561
收稿1999-12-13
修回2000-03-03, 百拇医药
单位:苏州医学院附属第二医院神经内科 215004
关键词:Alzheimer病;兴奋性氨基酸;尼莫的平
临床神经病学杂志000505 【摘要】 目的 研究尼莫的平对Alzheimer 病大鼠海马和额叶兴奋性氨基酸的影响。方法 在立体定位下于迈内特基底核(NBM)注入β淀粉样蛋白(β-AP)10 μg建立Alzheimer 病模型,对照组在NBM注入生理盐水,治疗组在建立模型后腹腔注射尼莫的平,每天注射1次 至实验结束, 模型组不给任何药物。脑内微透析技术采集大鼠海马、额叶细胞外液,反相高 效液相色谱技术测定氨基酸类神经递质。结果 模型组海马和额叶细胞外 液4种氨基酸浓度均较对照组升高,谷氨酸最明显。尼莫的平治疗后谷氨酸明显降低。结论 由β-AP产生的Alzheimer病大鼠痴呆与兴奋毒性有关,其作用可能是由 钙离子介导。
, 百拇医药
Effects of nimodipine on extracellular amino acid of frontal lobe and hippocampu s in Alzheimer's disease rats
Liu Chunfeng Dai Yongping Zhang Chunyuan et al
(Department of Neurology,the Second Affiliated Hospital,Suzhou Medical Col lege,Suzhou 215004)
【Abstract】 Objective To study the effects of nimodipine on frontal lobe excitatory amino acid and hi ppocampus in Alzheimer's disease rats.Methods In stereotaxic β -AP (10 μg) was injected into NBM in rats and established the Alzheimer's dise ase model,the control group was injected NaCl (0.9%) in the same way.the treatme nt group was made with intraperitoneal injection of nimodipine once a day till t he end of the experiment,the model group wasn't administered any drug.The hippoc ampus,frontal lobe extracellular of rats were collected by intracerebral microdi alysis,the extracellular amino acid neurotransmission was detected by microdialy sis in vivo with HPLC.Results The extracellular 4 kinds of amino acids concentration of frontal lobe and hippocampus in the model group was higher than those in the control group,especially glutamate (Glu),Glu remarkable decreased with nimodipi ne treatment.Conclusions The rat's dementia with Alzheimer's di sease induced by β-AP was related to excitotoxicity, it might contribute to the loss of Ca2+ homeostasis.
, 百拇医药
【Key words】 Alzheimer's disease Excitatory amino acid Nimod ipine
神经生化研究发现在Alzheimer 病(AD)患者的脑内存在广泛的神经递 质改变[1],而兴奋性氨基酸在神经系统损害中起重要作用。为研究β淀粉样蛋白( β-AP)对兴奋性氨基酸的影响,我们观察β-AP注入大鼠迈内特基底核(NBM)后,额叶皮质、 海马区细胞外液中的谷氨酸(Glu)、甘氨酸(Gly)、牛磺酸(Tau)和γ-氨基丁酸(GABA)等4 种氨基酸浓度的改变以及尼莫的平的作用。
1 材料与方法
1.1 材料 健康雄性SD大鼠24只,3~4月龄,体重180~250 g(苏州医学院动物实验中心 提供),随机分成对照组、模型组和治疗组,每组8只大鼠。微透析系统(BAS BeeKeeper Sys tem,美国),透析膜的有效长度为2 mm。由2台Beckman 110B泵、157荧光检测器(9 μl检 测池)、Rheodyne进样器组成高效液相色谱检测系统。
, http://www.100md.com
1.2 方法
1.2.1 模型制备及给药方法 按照我们报告的方法[2],将10 μl的β-AP(RBI ,美国)在立体定位仪下注入大鼠NBM。对照组在NBM处注入生理盐水,治疗组在建立模型后 腹腔注射尼莫的平(Bayer公司,德国)50 μg/100 g体重,以后每天注射1次至实验结束. 模型组不给任何药物。
1.2.2 微透析方法的建立 注射β-AP后第10天于坐标前囟后1.4 mm、旁1.5 mm、深2 mm 和前囟后3 mm、旁2 mm、深2.5 mm处植入微透析基座。微透析基座通过螺丝和牙科水泥固定 于大鼠 的颅骨上,术后第3天开始进行细胞外液采样,将微透析探头插入基座,透析液平衡灌流90 分钟后开始收集样本。透析液为Ringer溶液,其组成为(mmol/L):NaCl 147,KCl 4.0,CaC l2 2.2。灌流速度2.5 μl/min。每15分钟收集1管。透析前在相同流速和室温条件下测定 探头的体外回收率。样本收集后-70 ℃冰箱保存待测。实验结束后进行常规病理检查以鉴 定探头插入的部位。
, 百拇医药
1.2.3 样本氨基酸类神经递质测定 采用反相高效液相色谱荧光法结合邻苯二甲醛(OPA)柱 前衍生技术进行测定。将27 mg OPA、2-巯基乙醇40 μl溶于5 ml甲醇中,再加入0.1 mmol /L四硼酸钠(pH=9.6)5 ml中混匀,配制衍生液。10 μl衍生液加样品20 μl,震荡30秒,静 置90秒后加入色谱柱。流动相A为含35%甲醇及四氢呋喃的缓冲液,流动相B为90%甲醇。流速 1.0 ml/min,激发波长280 nm,发射波长340 nm。进样后检测,由System Gold 对峰面积积 分,再以标准氨基酸浓度对峰面积作校正曲线,以外标法计算样品浓度。
1.2.4 统计学处理 数据以(
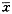 ±s)表示。用t检验进行分析。
±s)表示。用t检验进行分析。2 结 果
2.1 各组大鼠额叶细胞外液氨基酸的浓度 见表1。模型组大鼠额叶细胞外液Glu、Gly、 T au水平均较对照组显著升高(P<0.01),特别是Glu,升高188%,而GABA无显著性差异( P>0.05)。治疗组除Tau外,Glu、Gly、GABA均显著降低(P<0.01,P<0.05)。
, 百拇医药
2.2 各组海马细胞外液氨基酸的浓度改变 见表2。结果表明模型组大鼠海马细胞外液除Gl y外,Glu、Tau、GABA水平较对照组均升高(P<0.01),Glu 升高最显著,升高314%。治 疗组均低于对照组和模型组(P<0.01,P<0.05)。
表1 额叶皮质细胞外液氨基酸浓度的改变(
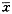 ±s,nmol/L) 组 别
±s,nmol/L) 组 别只数
Glu
Gly
Tau
GABA
治疗组
, http://www.100md.com
8
147.6±49.6*#
758.3±257.1*△
1412.5±308.1*
406.1±208.8*△
模型组
8
830.9±160.1**
1460.3±455.4**
1416.0±383.1
, http://www.100md.com
680.0±271.9
对照组
8
281.0±96.3
1120.3±174.3
942.9±174.6
621.8±165.8
与对照组比*P<0.05,**P<0.01;与模型组比△P<0.05,# P<0.01表2 海马区细胞外液氨基酸浓度的改变(
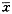 ±s,nmol/L) 组 别
±s,nmol/L) 组 别, http://www.100md.com
只数
Glu
Gly
Tau
GABA
治疗组
8
132.5±58.9*#
735.1±225.5**#
1323.9±201.2△**
194.4±144.9**#
, http://www.100md.com
模型组
8
1010.4±269.5**
1370.9±548.1
1645.5±536.2**
803.3±442.6*
对照组
8
244.1±52.7
1195.5±328.9
773.0±236.5
, 百拇医药
552.4±219.7
与对照组比*P<0.05,**P<0 .01;与模型组比△P<0.05,#P<0.01
3 讨 论
大量研究表明β-AP 在脑内的沉积是AD的主要病因之一,并提出了β-AP 病因学说[ 1]。我们将β-AP 注入大鼠NBM建立AD动物模型,经行为学测试表明大鼠学习记忆能力 受 到损害[2]。尽管一些体外实验表明β-AP有神经毒性作用,但β-AP 的神经细胞 毒性确切机理尚不清楚。
谷氨酸是脑内重要的兴奋性神经递质,在神经系统生长、发育、学习和记忆中起十分重要的 作用。生理状态下通过与受体的应答反应,Ca2+通透性增加,流入细胞内作为第二信 使,引发一系列正常生理生化过程。当在体外添加高浓度的谷氨酸或在病理条件下造成局灶 周围谷氨酸大量聚积时,谷氨酸持续作用于受体,引起对受体的滥刺激,最终导致神经损伤 。动物试验表明,NMDA受体兴奋剂鹅膏蕈氨酸注入海马后,可造成大鼠基底神经外侧核的细 胞死亡,继而导致了类似于AD的病理与生化的变化[3]。Jimenez等[4] 发 现AD患者脑脊液中的Glu、Tau、Gly高于对照组,而对中枢神经系统具有抑制作用的GABA浓 度却较低。Glu载体的活性在AD时也有明显的改变,并在其疾病的过程中起重要作用。在体 外实验发现Glu引起细胞死亡和tau蛋白变化与其打开受体门控通道或激活磷酸肌醇环路,使 Ca2+内流,细胞内Ca2+增高有关[5] 。Yamada等[6] 报告在 20天胎龄大鼠海马神经元培养中,Glu与神经元接触15分钟,可引起海马神经元显著退化。
, http://www.100md.com
以上在体内和体外试验都证实兴奋性氨基酸在AD的病理生理过程中起着重要的作用。那么β -AP与兴奋性神经毒性之间有何关系呢?为进一步研究β-AP引起的神经元损害是否与兴 奋毒性有关,我们采用脑内微透析技术,观察β-AP 注入NBM后海马、额叶细胞外液中的几 种氨基酸浓度的改变。发现在β-AP注入NBM后大鼠海马、额叶细胞外液氨基酸类神经递质 水平升高,其中兴奋性氨基酸Glu升高尤为明显,而抑制性神经递质如GABA、Tau和Gly虽然 升高但没有Glu改变明显。这说明了β-AP的神经毒性作用与Glu的兴奋毒性有关。我们在实 验中还发现在尼莫的平治疗后细胞外液的兴奋性氨基酸几乎完全被抑制。根据这一结果我们 推测β-AP所引起的兴奋毒性可能是由钙离子介导的。
一些体外实验研究也支持这一推测。Parpura-Gill等[7]的研究表明β-AP能抑制 培养的海马胶质细胞糖摄取和谷氨酸的转运,从而产生毒性作用。Klegeris等[8] 发现β-AP能促进巨噬细胞产生自由基和Glu,β淀粉样前体蛋白能调节Glu载体活性,进而 调节突触位点的Glu水平。Mattson等[9]发现β-AP通过对Ca2+的作用进一 步影响Glu的作用,他们在人皮质神经细胞的培养研究中发现β-AP能使细胞内钙离子浓度 升高,增加神经细胞对兴奋性氨基酸的毒性作用。Arias 等[10]也发现β-AP能增 加去极化的海马脑片钙依赖的兴奋性氨基酸的释放。
, 百拇医药
虽然尼莫的平能完全抑制细胞外液兴奋性氨基酸的升高,但研究表明大鼠的行为学不能完全 改善,这说明在β-AP所引起的大鼠痴呆过程中除钙离子、兴奋毒性的作用以外还存在其它 机理,需要进一步研究。
志谢:在氨基酸浓度检测工作中上海医科大 学神经生物学国家重点实验室高慧女士给予了协助,特此致谢。
基金项目:江苏省青蓝工程基金资助
参 考 文 献
1,Cummings JL,Vinters HV,Cole GM,et al. Alzheimer's disease-etiologies, pathoph ysiology, cognitive reserve, and treatment opportunities. Neurology,1998,51 (S1) :2
, 百拇医药
2,刘春风,包仕尧,戴永萍,等.Alzheimer病大鼠局部脑血流量与行为学改变的研究.临床神经 病学杂志,1999,12:160
3,Dunnett SB,Whishaw IQ,Jones GH,et al.Behavioral, biochemical and histochemical e ffects of different neurotoxic amino acids injected into nucleus basalis magnoce llularis of rat. Neuroscience, 1991,20:653
4,Jimenez-Jimenez FJ, Molina JA, et al.Neurotransmitter amino acids in cerebro spinal fluid of patients with Alzheimer's disease.J Neural Transm,1998,105:269
, 百拇医药
5,Kure S,Tominaga T.Glutamate triggers internucleosomal DNA cleavage in neurona l cells. Biochem Biophys RES Commun, 1991,179:39
6,Yamada M,Hatanaka H.Interleukin-6 protects cultured rat hippocampal neurons against glutamate-induced cell death.Brain Res,1994,643:173
7,Parpura-Gill A, Beitz D, Uemura E.The inhibitory effects of beta-amyloid on utamate and glucose uptakes by cultured astrocytes. Brain Res, 1997,754:65
, http://www.100md.com
8,Klegeris A, McGeer PL.beta-Myloid protein enhances macrophage production of oxygen free radicals and glutamate. J Neurosci Res,1997,49:229
9,Mattson MP, Cheng B, Davis D,et al.beta-Amyloid peptides destabilize calcium ho meostasis and render human cortical neurons vulnerable to excitotoxicity. J Neur osci, 1992,12:376
10,Arias C, Arrieta I, Tapia R. beta-Amyloid peptide fragment 25-35 potentiates the calcium-dependent release of excitatory amino acids from depolarized hippo campal slices. J Neurosci Res,1995,41:561
收稿1999-12-13
修回2000-03-03, 百拇医药