褪黑素对四氯化碳小鼠肝损伤的保护作用
作者:许建明 徐叔云 梅 俏 丁长海 周爱武
单位:(安徽医科大学临床药理研究所,合肥 230022)
关键词:褪黑素;四氯化碳;抗氧化剂;肝损伤
中国药理学通报990407 摘要 目的 探讨褪黑素对四氯化碳肝毒性的保护作用。方法 给予小鼠四氯化碳(5ml.kg-1),继后每隔6hip褪黑素10mg.kg-1。用胶原酶消化法分离小鼠肝细胞后,依次加用褪黑素(10 -5~10-11mol.L-1)和四氯化碳(20mmol.L-1)。以测定丙氨酸氨基转换酶(ALT),丙二醛(MDA)和谷胱甘肽过氧化物酶活力,作为四氯化碳肝损伤的指标。用MTT法检测肝细胞活力。结果 四氯化碳可使小鼠血液ALT活性和肝MDA含量明显上升。体内应用MT 10mg.kg-1,则明显降低肝匀浆MDA含量(P<0.01),对血浆ALT活性无明显影响。体外应用 MT(10-5~10-7mol.L-1)亦可使肝细胞MDA含量下降(P <0.05),同时还可使肝细胞ALT释放率下降,细胞活力上升(P<0.05)。结论 MT拮抗CCl4肝毒性的作用可能与其抗氧化能力有关。
, 百拇医药
中国图书分类号 R 347; R 975.5
文献标识码 A 文章编号 1001-1978(1999)04-0311 -03
Protective effect of melatonin on carbon tetrachloride
-induced oxidative liver damage in mice
XU Jian-Ming, XU Shu-Yun, MEI Qiao, DING Chang-Hai, ZHOU Ai-Wu
(Institute of Clinical Pharmacology, Anhui Medical University, Hefei 230032)
, http://www.100md.com
ABSTRACT AIM To investigate the pr otective effect of melatonin (MT) on carbon tetrachloride (CCl4)-induced liver damage in mice. METHODS Mice were treated with MT(10mg.kg-1) at interval of 6 hours after administration of CCl4(5ml.kg-1,ip). The preparation of mouse liver cells was performed by collagenase Ⅵ perfusion, and then the hopats was incubated with CCl4 in the presence and absence of MT(10-5~10-11 mol.L-1). The content of malo naldehyde (MDA)、 alanine aminotransferase (ALT) and glutathione peroxidase (GSH-px) activity were assayed as indications of CCl4-induced liver damage. Cell viability was measured by means of MTT method. RESULTS CCl4 induced significantly high levels of plasma ALT and liver MDA in mice. CCl4-induced MDA production in the liver was inhibited by MT treatment, but the elevated level of ALT was not reduced in mice. In in vitro study, MT pr evented CCl4-produced ALT release and MDA formation from hepatocytes in a concentration-dependent manner(10-5~10-7mol.L-1), and impr oved the cell viability (P<0.05). CONCLUSION MT confers protection against the deterious effect of CCl4 to mice liver, possibly due to its antioxidative capability.
, 百拇医药
KEY WORDS melatonin; carbon tetrachloride; antioxidant; liver damage
近年来发现褪黑素(melatonin, MT)具有强大的抗氧化能力,已在多种氧化性肝损伤中证明MT具有抗肝脏脂质过氧化作用[1]。本文针对四氯化碳对肝脏具有氧化性损伤的特点,分别在小鼠体内和体外应用MT,探讨该药拮抗肝损伤的作用。
1 材料和方法
1.1 材料
1.1.1 药品和试剂 褪黑素、胶原酶VI和四甲基偶氮唑蓝(MTT)均购自Sigma公司。1,1,3,1-四乙基丙烷(TEP)和5,5-二硫代一双-2-硝基苯甲酸(DTNB)购自瑞士Fluka公司。四氯化碳(CCl4)系上海新中化学试剂厂产品,临用前用精制花生油稀释。硫代巴比妥酸(TBA)购自上海试剂二厂,丙氨酸氨基转换酶(ALT)测定试剂盒系上海荣盛试剂厂产品。
, 百拇医药
1.1.2 动物 昆明种小鼠,♂,体重20~24g,安徽医科大学实验动物中心供应。在恒温(22℃)、光照周期12h∶12环境中饲养1wk后实验,实验前14h禁食,任意饮水。
1.2 实验方法
1.2.1 CCl4急性肝损伤模型的制备与药物处理 在实验日,动物被分为正常对照、模型对照和药物处理组。正常对照组ip精制花生油5ml.kg-1,模型组ip0.1% CCl4 5ml.kg-1,药物处理组在给予CCl4后,每隔6hip MT10mg.kg-1,共3次。16 h后拉颈处死动物,采集血和肝脏标本作有关检测。
1.2.2 肝细胞分离培养与药物处理 用胶原酶消化法[2]分离小鼠肝细胞。台盼蓝染色显示细胞活力达85%以上,用MEM调整细胞浓度每毫升5×105个。在肝细胞悬液中先后加入MT(10-5~10-11mol.L-1)和CCl4(20mmol.L -1)。孵育3 h后,测定上清的ALT活性和细胞MDA含量。
, 百拇医药
1.2.3 肝细胞活性检测[3] 将上述肝细胞悬液稀释10倍后,在96孔板中每孔接种0.1ml(5×103肝细胞),培养3h后,添加MTT溶液至每孔,终浓度为0.25mg.kg-1。再培养3 h后,离心,换用0.04mol.L-1HCl的酸化异丙醇以溶解黑色结晶。在微板读数仪测定其OD值,测定波长为570nm,参考波长为665nm。
1.2.4 丙二醛(MDA)含量测定[4] 用冷生理盐水制备成10%肝匀浆,取1ml,再依次加入300 g.L-1三氯乙酸1 ml和0.67%TBA 1ml,在沸水浴中加热30min,流水冷却至室温。以3000r.min-1离心10 min,取上清在分光光度仪535nm处测定吸光度(OD)值,按标准曲线推算MDA含量。肝细胞悬液的MDA 含量测定方法同上。
, http://www.100md.com
1.2.5 谷胱甘肽过氧化物酶(GSH-px)和丙氨酸氨基转换酶(ALT)活力测定 用Tris-HCl缓冲液制成100ml.L-1肝匀浆,按DTNB显色法[5]测定GSH-px活性。按试剂盒说明书的操作步骤,测定ALT活力。
1.2.6 统计学分析 数据以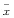 ±s表示,用卡方检验和t检验比较组间差异。
±s表示,用卡方检验和t检验比较组间差异。
2 结果
2.1 MT拮抗CCl4急性肝损伤的体内作用 如表1所示,与正常对照组比较,CCl4可使小鼠血浆转氨酶活力和肝脏MDA含量都明显升高(P<0.01),但GSH-px活性无明显改变。用MT处理CCl4小鼠肝损伤后,与同期模型组比较,肝脏 MDA含量明显下降(P<0.01),血浆ALT活性无明显改变。
, 百拇医药
Tab 1 Influences of MT on CCl4-induced acute liver injury in mice(n=10,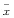 ±s) Group
±s) Group
Serum ALT/ku.L -1
MDA
/nmol.g-1 liver
GSH-px
/U.g-1 liver
Normal control
, 百拇医药
36.8±6.9
183.8±34.8
164.5±28.4
CCl4
356.6±38.9**
532.1±96.7**
161.3±23.1
CCl4+MT
322.7±35.8
321.8±58.2△△
, 百拇医药
168.2±29.4
**P<0.01, vs normal control group, △△P< 0.01,vs CCl4 group
2.2 MT拮抗CCl4肝细胞损伤的体外作用 肝细胞悬液中加入CCl4后,肝细胞活力明显下降,MDA含量和ALT活力明显上升(P<0.01)。体外预先加用不同浓度的MT,在10-5~10-7mol.L-1浓度范围内,肝细胞活力部分恢复,MDA含量和ALT释放率亦明显下降,与同期CCl4组比较,差异有显著性(P<0.05,表2)。
Tab 2 Influences of MT on CCl4-intoxicated mouse hep atocytes in vitro(n=3,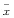 ±s) Group
±s) Group
, http://www.100md.com
ALT release/%
Cell viability
/%
MDA
/nmol+
Normal control
15.1±6.4
89.1±5.6
0.28±0.05
CCl4
38.6±8.8**
, 百拇医药
46.8±9.8**
0.72±0.22* *
CCl4+MT 10-5mol.L-1
26.5±9.2△
67.8±8.8△
0.48±0.18△
10-7mol.L-1
29.8±8.4△
, 百拇医药
61.5±12.1 △
0.51±0.16△
10-9mol.L-1
37.5±9.6
48.9±9.2
0.69±0. 19
10-11mol.L-1
39.7±10.2
45.3±10.8
, 百拇医药 0.74 ±0.24
**P<0.01,vs normal control group; △P<0 .05,vs CCl4 group;+Content of MDA in 5×105 cells
3 讨论
CCl4是一种有毒的环境生物损害剂,在肝氧化代谢中可产生三氯甲基自由基,继而攻击脂质细胞膜,造成肝细胞脂质过氧化性损伤[6]。本实验证实CCl4可使小鼠血浆转氨酶活力明显上升,同时肝匀浆脂质过氧化产物MDA含量明显增加。说明CCl4引起肝损伤的机制与脂质过氧化有关。近年来发现MT具有强大的抗氧化作用。已在黄樟精、百草枯、脂多糖和肝脏缺血再灌注模型中发现MT具有抗肝脏氧化性损伤的作用,主要表现为肝脏脂质过氧化产物MDA含量下降[7~10]。本研究发现CCl4造模后给予MT 10mg.kg-1,可使肝脏MDA含量明显下降,但血浆转氨酶水平无明显改变。这或许可能是由于MT在肝脏内被快速代谢,MT一旦被氧化就不能被还原[11],以致于MT对严重的肝氧化损伤的保护能力有限。Melchiorri[8]和Sewerynek[9]分别在用MT拮抗百草枯和脂多糖所致的肝氧化性损伤时,也未能发现血浆转氨酶活力下降。我们的研究结果与这些报告有类似之处。
, 百拇医药
为了进一步探讨MT对CCl4肝损伤的作用,我们在分离获得的肝细胞悬液中,先后加入不同剂量的MT和CCl4。发现在MT10-5~10-7mol.L-1浓度范围内,不仅肝细胞脂质过氧化产物MDA含量下降,而且肝细胞活力和ALT释放都获得好转,说明MT可直接拮抗CCl4对肝细胞的毒性作用。据国外报道的MT的化学构效关系,MT吲哚环第5位置上的甲氧基是清除自由基所必需的,其侧链上的乙酰基有协同灭活自由基的作用;加上MT是一种亲脂性的断链氧化剂,在脂质细胞膜中含量最高,可在原位拮抗细胞膜脂质过氧化[1]。故推论MT增强肝细胞对CCl4毒性的抵抗力与其拮抗肝脏脂质过氧化的能力有关。
*安徽省自然科学基金项目,No 95-医-08
作者简介:许建明,男,43岁,博士,副教授,安徽省消化学会主任委员;
, 百拇医药
徐叔云,男,教授,博士生导师,中国药理学会副理事长
参考文献
1 Reiter RJ, Melchiorri D, Sewerynek E et al.A review of th e evidence supporting melatonin's role as an antioxidant. J Pineal Res, 199 5;18:1~11
2 Seglen P.Preparation of rat liver cells. 3.Enzymatic requirement for tissue dispersion. Exp Cell Res,1973;82:391~42
3 郑永唐,贲昆龙.测定细胞存活和增殖的MTT方法的建立.免疫学杂志,1992;8:266~9
, http://www.100md.com
4 Gavino VG, Miller JS . Effect of polyunsaturated fatty acid and antioxidants on lipid . J Lipid Res, 1981;22:763~769
5 夏奕明,朱莲珍.血和组织中谷胱甘肽过氧化物酶活力的测定方法.I.DTNB法.卫生研究,1986;16:29~33
6 Recknagel RO,Glende EA, Dolak JA, Waller RL.Mechanisms of carbon tetrachloride toxicity. Pharmac Ther,1989;43:139~54
7 Tan DX, Poeggeler B, Reiter RJ et al. The pineal hormane melatonin inhibits DNA adduct formation induced by the chemical carcinogen safrole in vivo. Cancer Lett, 1993;70:65~71
, http://www.100md.com
8 Melchiorri D, Reiter RJ, Attia AM et al. Potent protective effect of melatonin on in vivo parapuat-induced oxidative damage in rats. Life Sci,1995;56:83~9
9 Sewerynek E, Abe M, Reiter RJ et al. Melatonin administration pre vents lipopolysaccharide-induced oxidative damage in phenobarbital-treated ani mals. J Cell Biochem, 1995;58:436~44
10 Sewerynek E, Reiter RJ,Melchiorri D et al. Oxidative damage in the liver induced by ischemia-reperfusion:protection by melatonin.Hepatogastroenterology, 1996;43: 498~905
11 Yu Hs, Tsin ATC, Reiter RJ. Melatonin:history, biosynthesis, and assay methodology. In:Yu Hs, Reiter RJ eds. Melatonin:biosynthesis, Physiolgical Effects and Clinical Applications, Boca Ration: CRC Press Inc, 1993;1~16
1998-11-25收稿,1999-02-14修回, http://www.100md.com
单位:(安徽医科大学临床药理研究所,合肥 230022)
关键词:褪黑素;四氯化碳;抗氧化剂;肝损伤
中国药理学通报990407 摘要 目的 探讨褪黑素对四氯化碳肝毒性的保护作用。方法 给予小鼠四氯化碳(5ml.kg-1),继后每隔6hip褪黑素10mg.kg-1。用胶原酶消化法分离小鼠肝细胞后,依次加用褪黑素(10 -5~10-11mol.L-1)和四氯化碳(20mmol.L-1)。以测定丙氨酸氨基转换酶(ALT),丙二醛(MDA)和谷胱甘肽过氧化物酶活力,作为四氯化碳肝损伤的指标。用MTT法检测肝细胞活力。结果 四氯化碳可使小鼠血液ALT活性和肝MDA含量明显上升。体内应用MT 10mg.kg-1,则明显降低肝匀浆MDA含量(P<0.01),对血浆ALT活性无明显影响。体外应用 MT(10-5~10-7mol.L-1)亦可使肝细胞MDA含量下降(P <0.05),同时还可使肝细胞ALT释放率下降,细胞活力上升(P<0.05)。结论 MT拮抗CCl4肝毒性的作用可能与其抗氧化能力有关。
, 百拇医药
中国图书分类号 R 347; R 975.5
文献标识码 A 文章编号 1001-1978(1999)04-0311 -03
Protective effect of melatonin on carbon tetrachloride
-induced oxidative liver damage in mice
XU Jian-Ming, XU Shu-Yun, MEI Qiao, DING Chang-Hai, ZHOU Ai-Wu
(Institute of Clinical Pharmacology, Anhui Medical University, Hefei 230032)
, http://www.100md.com
ABSTRACT AIM To investigate the pr otective effect of melatonin (MT) on carbon tetrachloride (CCl4)-induced liver damage in mice. METHODS Mice were treated with MT(10mg.kg-1) at interval of 6 hours after administration of CCl4(5ml.kg-1,ip). The preparation of mouse liver cells was performed by collagenase Ⅵ perfusion, and then the hopats was incubated with CCl4 in the presence and absence of MT(10-5~10-11 mol.L-1). The content of malo naldehyde (MDA)、 alanine aminotransferase (ALT) and glutathione peroxidase (GSH-px) activity were assayed as indications of CCl4-induced liver damage. Cell viability was measured by means of MTT method. RESULTS CCl4 induced significantly high levels of plasma ALT and liver MDA in mice. CCl4-induced MDA production in the liver was inhibited by MT treatment, but the elevated level of ALT was not reduced in mice. In in vitro study, MT pr evented CCl4-produced ALT release and MDA formation from hepatocytes in a concentration-dependent manner(10-5~10-7mol.L-1), and impr oved the cell viability (P<0.05). CONCLUSION MT confers protection against the deterious effect of CCl4 to mice liver, possibly due to its antioxidative capability.
, 百拇医药
KEY WORDS melatonin; carbon tetrachloride; antioxidant; liver damage
近年来发现褪黑素(melatonin, MT)具有强大的抗氧化能力,已在多种氧化性肝损伤中证明MT具有抗肝脏脂质过氧化作用[1]。本文针对四氯化碳对肝脏具有氧化性损伤的特点,分别在小鼠体内和体外应用MT,探讨该药拮抗肝损伤的作用。
1 材料和方法
1.1 材料
1.1.1 药品和试剂 褪黑素、胶原酶VI和四甲基偶氮唑蓝(MTT)均购自Sigma公司。1,1,3,1-四乙基丙烷(TEP)和5,5-二硫代一双-2-硝基苯甲酸(DTNB)购自瑞士Fluka公司。四氯化碳(CCl4)系上海新中化学试剂厂产品,临用前用精制花生油稀释。硫代巴比妥酸(TBA)购自上海试剂二厂,丙氨酸氨基转换酶(ALT)测定试剂盒系上海荣盛试剂厂产品。
, 百拇医药
1.1.2 动物 昆明种小鼠,♂,体重20~24g,安徽医科大学实验动物中心供应。在恒温(22℃)、光照周期12h∶12环境中饲养1wk后实验,实验前14h禁食,任意饮水。
1.2 实验方法
1.2.1 CCl4急性肝损伤模型的制备与药物处理 在实验日,动物被分为正常对照、模型对照和药物处理组。正常对照组ip精制花生油5ml.kg-1,模型组ip0.1% CCl4 5ml.kg-1,药物处理组在给予CCl4后,每隔6hip MT10mg.kg-1,共3次。16 h后拉颈处死动物,采集血和肝脏标本作有关检测。
1.2.2 肝细胞分离培养与药物处理 用胶原酶消化法[2]分离小鼠肝细胞。台盼蓝染色显示细胞活力达85%以上,用MEM调整细胞浓度每毫升5×105个。在肝细胞悬液中先后加入MT(10-5~10-11mol.L-1)和CCl4(20mmol.L -1)。孵育3 h后,测定上清的ALT活性和细胞MDA含量。
, 百拇医药
1.2.3 肝细胞活性检测[3] 将上述肝细胞悬液稀释10倍后,在96孔板中每孔接种0.1ml(5×103肝细胞),培养3h后,添加MTT溶液至每孔,终浓度为0.25mg.kg-1。再培养3 h后,离心,换用0.04mol.L-1HCl的酸化异丙醇以溶解黑色结晶。在微板读数仪测定其OD值,测定波长为570nm,参考波长为665nm。
1.2.4 丙二醛(MDA)含量测定[4] 用冷生理盐水制备成10%肝匀浆,取1ml,再依次加入300 g.L-1三氯乙酸1 ml和0.67%TBA 1ml,在沸水浴中加热30min,流水冷却至室温。以3000r.min-1离心10 min,取上清在分光光度仪535nm处测定吸光度(OD)值,按标准曲线推算MDA含量。肝细胞悬液的MDA 含量测定方法同上。
, http://www.100md.com
1.2.5 谷胱甘肽过氧化物酶(GSH-px)和丙氨酸氨基转换酶(ALT)活力测定 用Tris-HCl缓冲液制成100ml.L-1肝匀浆,按DTNB显色法[5]测定GSH-px活性。按试剂盒说明书的操作步骤,测定ALT活力。
1.2.6 统计学分析 数据以
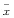 ±s表示,用卡方检验和t检验比较组间差异。
±s表示,用卡方检验和t检验比较组间差异。2 结果
2.1 MT拮抗CCl4急性肝损伤的体内作用 如表1所示,与正常对照组比较,CCl4可使小鼠血浆转氨酶活力和肝脏MDA含量都明显升高(P<0.01),但GSH-px活性无明显改变。用MT处理CCl4小鼠肝损伤后,与同期模型组比较,肝脏 MDA含量明显下降(P<0.01),血浆ALT活性无明显改变。
, 百拇医药
Tab 1 Influences of MT on CCl4-induced acute liver injury in mice(n=10,
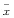 ±s) Group
±s) GroupSerum ALT/ku.L -1
MDA
/nmol.g-1 liver
GSH-px
/U.g-1 liver
Normal control
, 百拇医药
36.8±6.9
183.8±34.8
164.5±28.4
CCl4
356.6±38.9**
532.1±96.7**
161.3±23.1
CCl4+MT
322.7±35.8
321.8±58.2△△
, 百拇医药
168.2±29.4
**P<0.01, vs normal control group, △△P< 0.01,vs CCl4 group
2.2 MT拮抗CCl4肝细胞损伤的体外作用 肝细胞悬液中加入CCl4后,肝细胞活力明显下降,MDA含量和ALT活力明显上升(P<0.01)。体外预先加用不同浓度的MT,在10-5~10-7mol.L-1浓度范围内,肝细胞活力部分恢复,MDA含量和ALT释放率亦明显下降,与同期CCl4组比较,差异有显著性(P<0.05,表2)。
Tab 2 Influences of MT on CCl4-intoxicated mouse hep atocytes in vitro(n=3,
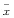 ±s) Group
±s) Group, http://www.100md.com
ALT release/%
Cell viability
/%
MDA
/nmol+
Normal control
15.1±6.4
89.1±5.6
0.28±0.05
CCl4
38.6±8.8**
, 百拇医药
46.8±9.8**
0.72±0.22* *
CCl4+MT 10-5mol.L-1
26.5±9.2△
67.8±8.8△
0.48±0.18△
10-7mol.L-1
29.8±8.4△
, 百拇医药
61.5±12.1 △
0.51±0.16△
10-9mol.L-1
37.5±9.6
48.9±9.2
0.69±0. 19
10-11mol.L-1
39.7±10.2
45.3±10.8
, 百拇医药 0.74 ±0.24
**P<0.01,vs normal control group; △P<0 .05,vs CCl4 group;+Content of MDA in 5×105 cells
3 讨论
CCl4是一种有毒的环境生物损害剂,在肝氧化代谢中可产生三氯甲基自由基,继而攻击脂质细胞膜,造成肝细胞脂质过氧化性损伤[6]。本实验证实CCl4可使小鼠血浆转氨酶活力明显上升,同时肝匀浆脂质过氧化产物MDA含量明显增加。说明CCl4引起肝损伤的机制与脂质过氧化有关。近年来发现MT具有强大的抗氧化作用。已在黄樟精、百草枯、脂多糖和肝脏缺血再灌注模型中发现MT具有抗肝脏氧化性损伤的作用,主要表现为肝脏脂质过氧化产物MDA含量下降[7~10]。本研究发现CCl4造模后给予MT 10mg.kg-1,可使肝脏MDA含量明显下降,但血浆转氨酶水平无明显改变。这或许可能是由于MT在肝脏内被快速代谢,MT一旦被氧化就不能被还原[11],以致于MT对严重的肝氧化损伤的保护能力有限。Melchiorri[8]和Sewerynek[9]分别在用MT拮抗百草枯和脂多糖所致的肝氧化性损伤时,也未能发现血浆转氨酶活力下降。我们的研究结果与这些报告有类似之处。
, 百拇医药
为了进一步探讨MT对CCl4肝损伤的作用,我们在分离获得的肝细胞悬液中,先后加入不同剂量的MT和CCl4。发现在MT10-5~10-7mol.L-1浓度范围内,不仅肝细胞脂质过氧化产物MDA含量下降,而且肝细胞活力和ALT释放都获得好转,说明MT可直接拮抗CCl4对肝细胞的毒性作用。据国外报道的MT的化学构效关系,MT吲哚环第5位置上的甲氧基是清除自由基所必需的,其侧链上的乙酰基有协同灭活自由基的作用;加上MT是一种亲脂性的断链氧化剂,在脂质细胞膜中含量最高,可在原位拮抗细胞膜脂质过氧化[1]。故推论MT增强肝细胞对CCl4毒性的抵抗力与其拮抗肝脏脂质过氧化的能力有关。
*安徽省自然科学基金项目,No 95-医-08
作者简介:许建明,男,43岁,博士,副教授,安徽省消化学会主任委员;
, 百拇医药
徐叔云,男,教授,博士生导师,中国药理学会副理事长
参考文献
1 Reiter RJ, Melchiorri D, Sewerynek E et al.A review of th e evidence supporting melatonin's role as an antioxidant. J Pineal Res, 199 5;18:1~11
2 Seglen P.Preparation of rat liver cells. 3.Enzymatic requirement for tissue dispersion. Exp Cell Res,1973;82:391~42
3 郑永唐,贲昆龙.测定细胞存活和增殖的MTT方法的建立.免疫学杂志,1992;8:266~9
, http://www.100md.com
4 Gavino VG, Miller JS . Effect of polyunsaturated fatty acid and antioxidants on lipid . J Lipid Res, 1981;22:763~769
5 夏奕明,朱莲珍.血和组织中谷胱甘肽过氧化物酶活力的测定方法.I.DTNB法.卫生研究,1986;16:29~33
6 Recknagel RO,Glende EA, Dolak JA, Waller RL.Mechanisms of carbon tetrachloride toxicity. Pharmac Ther,1989;43:139~54
7 Tan DX, Poeggeler B, Reiter RJ et al. The pineal hormane melatonin inhibits DNA adduct formation induced by the chemical carcinogen safrole in vivo. Cancer Lett, 1993;70:65~71
, http://www.100md.com
8 Melchiorri D, Reiter RJ, Attia AM et al. Potent protective effect of melatonin on in vivo parapuat-induced oxidative damage in rats. Life Sci,1995;56:83~9
9 Sewerynek E, Abe M, Reiter RJ et al. Melatonin administration pre vents lipopolysaccharide-induced oxidative damage in phenobarbital-treated ani mals. J Cell Biochem, 1995;58:436~44
10 Sewerynek E, Reiter RJ,Melchiorri D et al. Oxidative damage in the liver induced by ischemia-reperfusion:protection by melatonin.Hepatogastroenterology, 1996;43: 498~905
11 Yu Hs, Tsin ATC, Reiter RJ. Melatonin:history, biosynthesis, and assay methodology. In:Yu Hs, Reiter RJ eds. Melatonin:biosynthesis, Physiolgical Effects and Clinical Applications, Boca Ration: CRC Press Inc, 1993;1~16
1998-11-25收稿,1999-02-14修回, http://www.100md.com