重组人粒细胞-巨噬细胞集落刺激因子双体融合分子的三级结构模建
作者:饶严 顾维丰 马大龙
单位:北京医科大学免疫学系,北京 100083
关键词:粒细胞巨噬细胞集落刺激因子;基因重排;蛋白质结构;三级;重组融合蛋白质类
北京医科大学学报990502 摘 要 目的:验证重组人粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)双体融合分子(G2)较GM-CSF单体分子具有高活性的结构机制。方法:利用Insight II软件,采用同源性模建结合手工拼接的方法模建出G2融合分子的空间三级结构,并将其与GM-CSF单体的结构相比较。结果:模建出的G2融合分子前后两个结构单元在空间位置上相对独立,二者各自的三级构象及二级结构组成均与GM-CSF非常相似。另外,从受体结合位点的分析结果来看,G2分子在结构上有能力同时结合两分子的GM-CSF受体。结论:G2融合分子中的两个GM-CSF结构单元在结构上基本保持了GM-CSF单体分子的三级结构,其空间结构允许两分子的GM-CSF受体同时结合,引发受体间的交联,从而产生高活性。
, http://www.100md.com
中国图书资料分类法分类号 R73-3
Modeling for the three dimensional structure of recombinant human granulocyte-macrophage colony-stimulating factor homodimmer fusion protein
RAO Yan, GU Wei-Feng, MA Da-Long
(Department of Immunology, Beijing Medical University, Beijing 100083)
MeSH Granulocyte-macrophage colony-stimulating factor Protein structure, tertiary Gene rearrangement Recombinant fusion protein
, 百拇医药
ABSTRACT Objective: To elucidate the structural mechanism for which recombinant human GM-CSF homodimmer fusion protein(G2) exhibits about ten-fold higher bioactivity than GM-CSF monomer. Methods: Homology modeling with Insight II software combined with manual linking. Results: From the modeled structure, it could be seen that the upstream and the downstream GM-CSF structural domains of G2 were relatively independent in spatial position. Also, both of the two domains presented very similar three-dimensional conformation and secondary structure composition to those of GM-CSF monomer. In addition, the result of receptor binding sites analysis suggested that G2 had the structural capability to bind two GM-CSF receptors simultaneously. Conclusion: The two GM-CSF structural domains of G2 fusion protein retained the original basic tertiary structure of GM-CSF monomer. G2 has the capability to bind two GM-CSF receptors simultaneously and to induce the linkage between two receptors, which might explain its remarkably elevated bioactivity.
, http://www.100md.com
(J Beijing Med Univ, 1999,31:387-390)
人粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)在肿瘤放化疗后的辅助治疗中有重要意义。我室曾利用基因重组的技术成功地在大肠杆菌表达了重组人GM-CSF双体分子(G2),发现 G2具有高于GM-CSF单体分子10倍的刺激TF-1细胞增殖的活性[1]。本文在此基础上,利用同源性模建结合手工拼接的方法,模建出了G2分子的空间三级结构,并且从结构上证明了G2分子有可能同时结合两分子的GM-CSF受体,引发受体间的交联,从而表现出高活性。
1 材料与方法
1.1 主要材料
O2计算机工作站,SGI公司生产;工作软件Insight II(MSI/BIOSYM公司),其中使用模块homology,discover,biopolymer,analysis,viewer。
, 百拇医药
1.2 分子模建过程
1.2.1 linker区域的构象搜索
G2的linker序列主要来自于人IL-3的N端14个氨基酸[1],根据linker区肽段的一级序列,得到单个残基构象完全舒展的linker区的结构。
利用分子动力学模拟搜索linker区的构象:在310K的温度下,进行35ps的模拟,从5ps开始,每间隔一段时间取一个时间点的构象,共取了5ps,10ps,15ps,30ps,35ps等5个构象。
1.2.2 G2融合蛋白的结构模建
手工拼接出G2的空间构象:根据GM-CSF单体的结晶三级结构信息[2],利用手工拼接的方法使前一个GM-CSF结构单元的C-末端残基Ser与linker的第一位残基Tyr及linker最后一位残基Val与后一个GM-CSF结构单元的第一位残基Ala形成omega=±180°的肽键。模建时选用30ps处的linker区构象。
, http://www.100md.com
对G2进行分子力学优化:设定forcefield为amber进行分子力学优化:先对侧链原子进行优化;一些固定参数设定为:dielectric=4.0,dist-dependent=On,scale-terms中P1-4=0.5。之后再对骨架原子进行力学优化。
对G2进行分子动力学模拟:先对侧链原子进行模拟,再对全部原子进行15ps的模拟。
再次对G2分子进行分子力学优化:先对侧链原子进行优化,再逐渐对主链原子进行优化,最后整个分子系统的rms derivative=0.000 97
2 结果
linker区的模建结果见图1。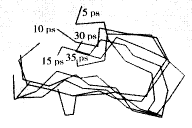
, 百拇医药 图1 linker区域在动力学搜索过程中5 ps,10 ps,15 ps,30 ps,35 ps等5个时间点处的构象
Figure 1 different conformations of linker segment at 5 ps,10 ps,15 ps,30 ps,35 ps time points during dynamics simulation
G2融合分子的三级结构模建结果见图2。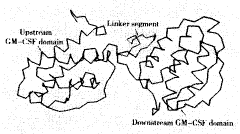
图2 G2分子的三级结构模建结果
Figure 2 Modeling result for the three-dimensional structure of G2 fusion protein
, http://www.100md.com
G2分子模建结果的一般特性及参数:
G2分子总表面积=13756.17A2
极性表面积/非极性表面积=0.94
通过与GM-CSF单体分子的三级结构重叠结果显示,前一个GM-CSF结构单元与GM-CSF分子在三级结构上的偏差为rms derivative=1.99;后一个GM-CSF结构单元与GM-CSF分子的空间结构上的偏差为RMS derivative=1.38。
通过Kabsh-sander法则[3]确定G2的二级结构组成与hGM-CSF的二级结构组成比较(表1、2)。
表1 G2与GM-CSF的α-螺旋组成比较及相应部分结构偏差分析
, http://www.100md.com
Table 1 Comparison of alpha-helices composition between G2 and GM-CSF and analysis of structural difference α-helices
1
2
3
4
5
6
7
8
9
10
, 百拇医药
11
G2
Trp13-
Asn27
Ala33-
Asn37
Gln56-
Gln64
Lys74-
His87
Phe103-
Leu115
Trp156-
, http://www.100md.com
Asn170
Ala176-
Asn180
Leu198-
Gln207
Lys217-
Ala224
Tyr227-
His230
Phe246-
Val259
GM-CSF
, 百拇医药
Trp13-
Leu28
Ala33-
Asn37
Leu55-
Gln64
Lys74-
His87
Phe103-
Val116
Trp156-
Leu171
, 百拇医药 Als176-
Asn180
Leu198-
Gln207
Lys217-
His230
Lys217-
His230
Phe246-
Val259
rms
derivative
, 百拇医药
0.328
0.215
0.422
0.367
0.577
0.650
0.221
0.333
0.861
0.861
0.665
表2 G2与GM-CSF的β-片层组成比较
, 百拇医药
Table 2 Comparison of β-sheets composition between G2 and GM-CSF β-sheets
1
2
3
4
G2
Thr39-Ile43
Thr98-Thr103
Thr182-Ile186
Thr241-Thr245
hGM-CSF
, 百拇医药
Thr39-Ile42
Thr98-Thr102
Thr182-Ile185
Thr241-Thr245
根据文献报道的GM-CSF分子上的受体结合位点[2,4],在图3上标出由这些残基所形成的溶液可接触表面。其中较为重要的包括:E14,N17,E21,R23,R24,N27,K72及M79。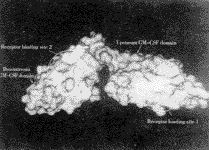
图3 G2分子上的两个受体结合面
Figure 3 Two receptor binding sites on G2
, http://www.100md.com
3 讨论
在构建基因工程的融合蛋白时,linker序列的设计是重要的环节。本室在G2的构建中首次采用来自于hIL-3的N-末端的14个氨基酸残基和2个附加的氨基酸Tyr和Pro的序列,获得了较好的结果。本文进一步从结构分析中证明了linker序列具有较好的延伸型。在pdb数据库中的hIL-3的结构信息文件中只含有14~125位残基的结构信息[5]。另外,从linker区的构象搜索结果看,linker区16个氨基酸的构象在不同的时间点各不相同。由此可见,hIL-3的N-末端13个残基在溶液中并无确定构象,其结构具有相当大的延展性。这一现象与选择该段序列作为linker区的目的相吻合。本室曾经成功地利用这一linker表达了具有生物学活性的人源化IL-2免疫毒素、IL-2-PreS融合蛋白等[6,7],证明这一序列有广泛应用价值。
从模建结果看,G2分子中前后两个GM-CSF结构单元在空间位置上相对独立。结合上述linker区高伸展性的结果,溶液中两个GM-CSF结构单元的相互位置可能处于不断变化的状态。GM-CSF与其他集落刺激因子、IL-3、IL-5、生长激素、干扰素等同属于4α-螺旋结构分子超家族成员[8],其三级结构中最稳定、保守的区域即为4个呈“上-上-下-下”排列的长α-螺旋。从前后两个GM-CSF结构单元与野生型hGM-CSF的结构比较的结果来看,二者与野生型GM-CSF在结构上的偏差均不大。值得一提的是,G2分子中对应于GM-CSF的二级结构中的每个α-螺旋区部分的结构偏差(rms derivative均小于1.00)更是明显小于总体偏差。这说明G2分子中的结构变化主要存在于具有较高伸展性的Loop区与不规则卷曲区,而分子内部的4α-螺旋主结构部分则相当稳定。
, http://www.100md.com
G2分子的模建结果其中第一个GM-CSF结构单元与原始GM-CSF分子中的二级结构组成基本完全相同;第二个GM-CSF结构单元中在225,226位残基处,原有α-螺旋结构有一定程度的破坏。从结构上分析,其原因可能有:(1)原来的217-230区段的α-螺旋从Ser225处被拉长,超出O-H间氢键的键长,故α-螺旋从此处被破坏。从分子内氢键组成来看,His226残基中的HN与Thr153残基中的O可形成氢键,His230残基中的O与Gln269残基中的HN可形成氢键,而这两个氢键在前一个GM-CSF结构单元中是不存在的,因而有可能对原来的α-螺旋结构产生影响。这两个附加氢键的产生可能与linker的存在有关;(2)由于linker区域的肽段的构象具有较高的伸展性,故在溶液中此区域的构象应处于不断变化的状态,即并非为某一个确定的构象。从linker区含16个残基的小肽的分子动力学模拟的结果来看,从5个时间点获取的各个构象并不完全相同,相互间的差别大小不等。本模建工作中选用30 ps处的linker构象。对于上述分析中由于linker区域中残基而产生的对后一个GM-CSF结构单元的构象可能发生的影响,本模建结果可以认为是G2分子在溶液中某个时刻的过渡状态的构象。
, 百拇医药
以克分子浓度为单位, G2比活性要高于单体GM-CSF 10倍以上, 其作用机制可能为: 双体分子引起GM-CSF受体的交联, 从而产生强刺激信号; 或者双体分子与GM-CSF受体的亲和力明显高于单体分子。从上面的结果可见,形成融合分子后前后两个GM-CSF结构单元在空间结构上基本保持原状;另外,由于linker区肽段的高活动性,前后两个GM-CSF结构单元之间的距离可在一定范围内自由变化。由此推断,G2分子在溶液中可以同时结合两个受体分子,因而可能促进受体之间的交联。
融合分子是基因工程药物的一个重要组成部分,其优点在于比活度的增加远大于物质量的增加。但是,大多数融合分子在构建过程中均涉及到连接区(linker)的问题。作为linker,要求具有高活动性和低抗原性。目前国际上最为流行的linker是多聚甘氨酸。另外,linker要有足够的长度,以便使融合分子的不同功能单位能独立发挥生物学活性,并且保持结构上的完整性。我室使用的linker是来从hIL-3的N-末端序列,因此其异种抗原性很小,而且结构活动性也很高。从实验结果及模建结果看,该linker在G2分子中发挥了这种优势。因此,今后对于类似的融合分子,在实际构建前可以通过分子模建的方法先预测linker是否合适,即是否会对重要的功能单位的结构产生空间上的影响与破坏。这样不仅可节省大量的人力物力,而且可以帮助分析出融合分子的作用机制。
, 百拇医药
参考文献
1 马大龙,张颖妹,宋泉声,等. 高活性人重组双体GM-CSF在大肠杆菌的表达与鉴定. 中华微生物学与免疫学杂志,1995,15:168-171
2 Diederichs K, Boone T, Karplus PA, et al. Novel fold and putative receptor binding sites of granulocyte-macrophage colony-stimulating factor. Science, 1991, 254: 1 779-1 782
3 Rost B, Sander C. Prediction of protein secondary structure at better than 70% accuracy. J Mol Biol, 1995, 232: 584-599
, 百拇医药
4 Lyne PD. Molecular modeling of the GM-CSF and IL-3 receptor complex. Protein Science, 1995, 4: 2 223-2 233
5 Feng Y, Klein BK, Mcwherter CA, et al. Three-dimensional solution structure and backbone dynamics of a variant of human interleukin-3. J Mol Biol, 1996, 259: 524-541
6 王 露,马大龙,张颖妹,等. 人源化IL-2免疫毒素的构建和鉴定,中华微生物和免疫学杂志,1996,16:117-120
7 陈章国,马大龙,张颖妹,等.白细胞介素2-乙型肝炎病毒前S抗原融合蛋白的免疫原性研究.中华医学杂志,1996,76:34-37
8 Boulay JL, Paul WE. The interleukin-4-related lymphokines and their binding to hematopoietin receptors. J Biol Chem, 1992,267:20 525-20 528
(1999-09-22收稿), 百拇医药
单位:北京医科大学免疫学系,北京 100083
关键词:粒细胞巨噬细胞集落刺激因子;基因重排;蛋白质结构;三级;重组融合蛋白质类
北京医科大学学报990502 摘 要 目的:验证重组人粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)双体融合分子(G2)较GM-CSF单体分子具有高活性的结构机制。方法:利用Insight II软件,采用同源性模建结合手工拼接的方法模建出G2融合分子的空间三级结构,并将其与GM-CSF单体的结构相比较。结果:模建出的G2融合分子前后两个结构单元在空间位置上相对独立,二者各自的三级构象及二级结构组成均与GM-CSF非常相似。另外,从受体结合位点的分析结果来看,G2分子在结构上有能力同时结合两分子的GM-CSF受体。结论:G2融合分子中的两个GM-CSF结构单元在结构上基本保持了GM-CSF单体分子的三级结构,其空间结构允许两分子的GM-CSF受体同时结合,引发受体间的交联,从而产生高活性。
, http://www.100md.com
中国图书资料分类法分类号 R73-3
Modeling for the three dimensional structure of recombinant human granulocyte-macrophage colony-stimulating factor homodimmer fusion protein
RAO Yan, GU Wei-Feng, MA Da-Long
(Department of Immunology, Beijing Medical University, Beijing 100083)
MeSH Granulocyte-macrophage colony-stimulating factor Protein structure, tertiary Gene rearrangement Recombinant fusion protein
, 百拇医药
ABSTRACT Objective: To elucidate the structural mechanism for which recombinant human GM-CSF homodimmer fusion protein(G2) exhibits about ten-fold higher bioactivity than GM-CSF monomer. Methods: Homology modeling with Insight II software combined with manual linking. Results: From the modeled structure, it could be seen that the upstream and the downstream GM-CSF structural domains of G2 were relatively independent in spatial position. Also, both of the two domains presented very similar three-dimensional conformation and secondary structure composition to those of GM-CSF monomer. In addition, the result of receptor binding sites analysis suggested that G2 had the structural capability to bind two GM-CSF receptors simultaneously. Conclusion: The two GM-CSF structural domains of G2 fusion protein retained the original basic tertiary structure of GM-CSF monomer. G2 has the capability to bind two GM-CSF receptors simultaneously and to induce the linkage between two receptors, which might explain its remarkably elevated bioactivity.
, http://www.100md.com
(J Beijing Med Univ, 1999,31:387-390)
人粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)在肿瘤放化疗后的辅助治疗中有重要意义。我室曾利用基因重组的技术成功地在大肠杆菌表达了重组人GM-CSF双体分子(G2),发现 G2具有高于GM-CSF单体分子10倍的刺激TF-1细胞增殖的活性[1]。本文在此基础上,利用同源性模建结合手工拼接的方法,模建出了G2分子的空间三级结构,并且从结构上证明了G2分子有可能同时结合两分子的GM-CSF受体,引发受体间的交联,从而表现出高活性。
1 材料与方法
1.1 主要材料
O2计算机工作站,SGI公司生产;工作软件Insight II(MSI/BIOSYM公司),其中使用模块homology,discover,biopolymer,analysis,viewer。
, 百拇医药
1.2 分子模建过程
1.2.1 linker区域的构象搜索
G2的linker序列主要来自于人IL-3的N端14个氨基酸[1],根据linker区肽段的一级序列,得到单个残基构象完全舒展的linker区的结构。
利用分子动力学模拟搜索linker区的构象:在310K的温度下,进行35ps的模拟,从5ps开始,每间隔一段时间取一个时间点的构象,共取了5ps,10ps,15ps,30ps,35ps等5个构象。
1.2.2 G2融合蛋白的结构模建
手工拼接出G2的空间构象:根据GM-CSF单体的结晶三级结构信息[2],利用手工拼接的方法使前一个GM-CSF结构单元的C-末端残基Ser与linker的第一位残基Tyr及linker最后一位残基Val与后一个GM-CSF结构单元的第一位残基Ala形成omega=±180°的肽键。模建时选用30ps处的linker区构象。
, http://www.100md.com
对G2进行分子力学优化:设定forcefield为amber进行分子力学优化:先对侧链原子进行优化;一些固定参数设定为:dielectric=4.0,dist-dependent=On,scale-terms中P1-4=0.5。之后再对骨架原子进行力学优化。
对G2进行分子动力学模拟:先对侧链原子进行模拟,再对全部原子进行15ps的模拟。
再次对G2分子进行分子力学优化:先对侧链原子进行优化,再逐渐对主链原子进行优化,最后整个分子系统的rms derivative=0.000 97
2 结果
linker区的模建结果见图1。

, 百拇医药 图1 linker区域在动力学搜索过程中5 ps,10 ps,15 ps,30 ps,35 ps等5个时间点处的构象
Figure 1 different conformations of linker segment at 5 ps,10 ps,15 ps,30 ps,35 ps time points during dynamics simulation
G2融合分子的三级结构模建结果见图2。

图2 G2分子的三级结构模建结果
Figure 2 Modeling result for the three-dimensional structure of G2 fusion protein
, http://www.100md.com
G2分子模建结果的一般特性及参数:
G2分子总表面积=13756.17A2
极性表面积/非极性表面积=0.94
通过与GM-CSF单体分子的三级结构重叠结果显示,前一个GM-CSF结构单元与GM-CSF分子在三级结构上的偏差为rms derivative=1.99;后一个GM-CSF结构单元与GM-CSF分子的空间结构上的偏差为RMS derivative=1.38。
通过Kabsh-sander法则[3]确定G2的二级结构组成与hGM-CSF的二级结构组成比较(表1、2)。
表1 G2与GM-CSF的α-螺旋组成比较及相应部分结构偏差分析
, http://www.100md.com
Table 1 Comparison of alpha-helices composition between G2 and GM-CSF and analysis of structural difference α-helices
1
2
3
4
5
6
7
8
9
10
, 百拇医药
11
G2
Trp13-
Asn27
Ala33-
Asn37
Gln56-
Gln64
Lys74-
His87
Phe103-
Leu115
Trp156-
, http://www.100md.com
Asn170
Ala176-
Asn180
Leu198-
Gln207
Lys217-
Ala224
Tyr227-
His230
Phe246-
Val259
GM-CSF
, 百拇医药
Trp13-
Leu28
Ala33-
Asn37
Leu55-
Gln64
Lys74-
His87
Phe103-
Val116
Trp156-
Leu171
, 百拇医药 Als176-
Asn180
Leu198-
Gln207
Lys217-
His230
Lys217-
His230
Phe246-
Val259
rms
derivative
, 百拇医药
0.328
0.215
0.422
0.367
0.577
0.650
0.221
0.333
0.861
0.861
0.665
表2 G2与GM-CSF的β-片层组成比较
, 百拇医药
Table 2 Comparison of β-sheets composition between G2 and GM-CSF β-sheets
1
2
3
4
G2
Thr39-Ile43
Thr98-Thr103
Thr182-Ile186
Thr241-Thr245
hGM-CSF
, 百拇医药
Thr39-Ile42
Thr98-Thr102
Thr182-Ile185
Thr241-Thr245
根据文献报道的GM-CSF分子上的受体结合位点[2,4],在图3上标出由这些残基所形成的溶液可接触表面。其中较为重要的包括:E14,N17,E21,R23,R24,N27,K72及M79。

图3 G2分子上的两个受体结合面
Figure 3 Two receptor binding sites on G2
, http://www.100md.com
3 讨论
在构建基因工程的融合蛋白时,linker序列的设计是重要的环节。本室在G2的构建中首次采用来自于hIL-3的N-末端的14个氨基酸残基和2个附加的氨基酸Tyr和Pro的序列,获得了较好的结果。本文进一步从结构分析中证明了linker序列具有较好的延伸型。在pdb数据库中的hIL-3的结构信息文件中只含有14~125位残基的结构信息[5]。另外,从linker区的构象搜索结果看,linker区16个氨基酸的构象在不同的时间点各不相同。由此可见,hIL-3的N-末端13个残基在溶液中并无确定构象,其结构具有相当大的延展性。这一现象与选择该段序列作为linker区的目的相吻合。本室曾经成功地利用这一linker表达了具有生物学活性的人源化IL-2免疫毒素、IL-2-PreS融合蛋白等[6,7],证明这一序列有广泛应用价值。
从模建结果看,G2分子中前后两个GM-CSF结构单元在空间位置上相对独立。结合上述linker区高伸展性的结果,溶液中两个GM-CSF结构单元的相互位置可能处于不断变化的状态。GM-CSF与其他集落刺激因子、IL-3、IL-5、生长激素、干扰素等同属于4α-螺旋结构分子超家族成员[8],其三级结构中最稳定、保守的区域即为4个呈“上-上-下-下”排列的长α-螺旋。从前后两个GM-CSF结构单元与野生型hGM-CSF的结构比较的结果来看,二者与野生型GM-CSF在结构上的偏差均不大。值得一提的是,G2分子中对应于GM-CSF的二级结构中的每个α-螺旋区部分的结构偏差(rms derivative均小于1.00)更是明显小于总体偏差。这说明G2分子中的结构变化主要存在于具有较高伸展性的Loop区与不规则卷曲区,而分子内部的4α-螺旋主结构部分则相当稳定。
, http://www.100md.com
G2分子的模建结果其中第一个GM-CSF结构单元与原始GM-CSF分子中的二级结构组成基本完全相同;第二个GM-CSF结构单元中在225,226位残基处,原有α-螺旋结构有一定程度的破坏。从结构上分析,其原因可能有:(1)原来的217-230区段的α-螺旋从Ser225处被拉长,超出O-H间氢键的键长,故α-螺旋从此处被破坏。从分子内氢键组成来看,His226残基中的HN与Thr153残基中的O可形成氢键,His230残基中的O与Gln269残基中的HN可形成氢键,而这两个氢键在前一个GM-CSF结构单元中是不存在的,因而有可能对原来的α-螺旋结构产生影响。这两个附加氢键的产生可能与linker的存在有关;(2)由于linker区域的肽段的构象具有较高的伸展性,故在溶液中此区域的构象应处于不断变化的状态,即并非为某一个确定的构象。从linker区含16个残基的小肽的分子动力学模拟的结果来看,从5个时间点获取的各个构象并不完全相同,相互间的差别大小不等。本模建工作中选用30 ps处的linker构象。对于上述分析中由于linker区域中残基而产生的对后一个GM-CSF结构单元的构象可能发生的影响,本模建结果可以认为是G2分子在溶液中某个时刻的过渡状态的构象。
, 百拇医药
以克分子浓度为单位, G2比活性要高于单体GM-CSF 10倍以上, 其作用机制可能为: 双体分子引起GM-CSF受体的交联, 从而产生强刺激信号; 或者双体分子与GM-CSF受体的亲和力明显高于单体分子。从上面的结果可见,形成融合分子后前后两个GM-CSF结构单元在空间结构上基本保持原状;另外,由于linker区肽段的高活动性,前后两个GM-CSF结构单元之间的距离可在一定范围内自由变化。由此推断,G2分子在溶液中可以同时结合两个受体分子,因而可能促进受体之间的交联。
融合分子是基因工程药物的一个重要组成部分,其优点在于比活度的增加远大于物质量的增加。但是,大多数融合分子在构建过程中均涉及到连接区(linker)的问题。作为linker,要求具有高活动性和低抗原性。目前国际上最为流行的linker是多聚甘氨酸。另外,linker要有足够的长度,以便使融合分子的不同功能单位能独立发挥生物学活性,并且保持结构上的完整性。我室使用的linker是来从hIL-3的N-末端序列,因此其异种抗原性很小,而且结构活动性也很高。从实验结果及模建结果看,该linker在G2分子中发挥了这种优势。因此,今后对于类似的融合分子,在实际构建前可以通过分子模建的方法先预测linker是否合适,即是否会对重要的功能单位的结构产生空间上的影响与破坏。这样不仅可节省大量的人力物力,而且可以帮助分析出融合分子的作用机制。
, 百拇医药
参考文献
1 马大龙,张颖妹,宋泉声,等. 高活性人重组双体GM-CSF在大肠杆菌的表达与鉴定. 中华微生物学与免疫学杂志,1995,15:168-171
2 Diederichs K, Boone T, Karplus PA, et al. Novel fold and putative receptor binding sites of granulocyte-macrophage colony-stimulating factor. Science, 1991, 254: 1 779-1 782
3 Rost B, Sander C. Prediction of protein secondary structure at better than 70% accuracy. J Mol Biol, 1995, 232: 584-599
, 百拇医药
4 Lyne PD. Molecular modeling of the GM-CSF and IL-3 receptor complex. Protein Science, 1995, 4: 2 223-2 233
5 Feng Y, Klein BK, Mcwherter CA, et al. Three-dimensional solution structure and backbone dynamics of a variant of human interleukin-3. J Mol Biol, 1996, 259: 524-541
6 王 露,马大龙,张颖妹,等. 人源化IL-2免疫毒素的构建和鉴定,中华微生物和免疫学杂志,1996,16:117-120
7 陈章国,马大龙,张颖妹,等.白细胞介素2-乙型肝炎病毒前S抗原融合蛋白的免疫原性研究.中华医学杂志,1996,76:34-37
8 Boulay JL, Paul WE. The interleukin-4-related lymphokines and their binding to hematopoietin receptors. J Biol Chem, 1992,267:20 525-20 528
(1999-09-22收稿), 百拇医药