活性氧对豚鼠心室肌细胞不同钾通道离子电流的影响
作者:徐长庆 李玉荣 孙可青 杨宝峰 单宏丽 娄延平 傅国辉
单位:徐长庆 单宏丽 娄延平 傅国辉:哈尔滨医科大学 病理生理教研室;李玉荣:生理教研室;杨宝峰:药理教研室 哈尔滨 150086;孙可青:黑龙江省医院
关键词:过氧化氢;豚鼠;心肌;离子通道;心律失常
中国病理生理杂志990902 摘 要 目的:揭示氧自由基导致跨膜电位变化的离子电流基础。方法:采用全细胞膜片钳技术,观察了H2O2(lmmol/L)对豚鼠单个心室肌细胞不同钾通道的影响。结果:H2O2使豚鼠心肌细胞静息电位(RP)降低,动作电位时程(APD)显著缩短的同时,明显抑制超极化时的内向整流钾电流(IK1),致(IK1)正常呈N字型I-V曲线几乎变成一条斜线;增强延迟整流钾电流(IK)的快组分(IKr)和慢组分(IKs),尤其IKr增加更显著,并使电流电压曲线向右上偏移。结论:氧自由基对心室肌细胞的IK1和IK的不同影响,是其所致跨膜电位变化和心律失常的可能离子机制。
, http://www.100md.com
Effect of H2O2 on different potassium channel ionic currents
of ventricular myocytes of guinea pig
XU Chang-Qing, LI Yu-Rong, SUN Ke-Qing, YANG Bao-Feng,SAN Hong-Li, LOU Yan-Ping, FU Guo-Hui
Department of Pathophysiology, Physiology, Pharmacology, Harbin Medical University, Harbin (150086)
Abstract AIM: To reveal ionic current basis of the change of transmembrane potential induced by oxygen free radical. METHOD:The whole cell recording patch clamp technique was used to investigate the effect of H2O2 (1 mmol/L) on different potassium channel ionic currents of ventricular myocytes of guinea pig. RESULTS:It was found that H2O2 reduced rest potential (RP) and shortened action potential duration (APD) significantly, inhibited the inward rectifier K current (IK1) markedly. H2O2 changed the current-voltage (I-V) relation to IK1 from a N shape to a /shape and enhanced the rapid component (IKr) and the slow component (IKs) of the delayed outward retifier K current (IK), especially IKr, and made IK I-V curve shift to up-right. CONCLUSION:Different effects of oxygen free radical on IK1 and IK of ventricular myocytes is a possible ionic mechanism for the change of transmembrane potential and arrhythmia induced by oxygen free redical.
, 百拇医药
MeSH Hydrogen peroxide; Guinea pigs; Myocardium; Ion channels; Arrhythmia
氧自由基参与了细胞内钙超载和再灌注心律失常的发生[1],其确切机制尚有待深入研究。H2O2作为外源性羟自由基的生成系统,广泛用于氧自由基对单个心肌细胞电生理活动影响的探讨。无论常规微电极和膜片钳技术之间,还是采用同种方法的不同实验室之间,得出的结论不尽相同,有的甚至截然相反[2~4]。为了进一步明确有关问题,我们观察了H2O2对豚鼠心室肌细胞不同钾通道离子电流的影响,并分析了其与动作电位的关系。
材料与方法
(一) 单个心室肌细胞的分离:实验用豚鼠,由本校动物中心提供,体重(312±23) g,雌雄不拘。分离方法及条件与先前报道基本相同[5]。即将豚鼠击头致昏后,迅速开胸取心,主动脉插管,使用Langendorff灌流装置,经冠状动脉首先灌注正常台氏液(mmol/L:NaCl 116,NaH2PO4 1.4,KCl 5.4,NaHCO3 15,MgSO4 1,CaCl2 1.8和glucose 15)冲出积血,接着灌注无钙台氏液4~5 min使心脏停跳,最后用含有Ⅰ型胶原酶(0.250~0.375 g/L)的低钙台氏液(150μmol/L)反复消化40~60 min,灌流速度为7~8 mL/min。所有的液体均用95%O2+5%CO2饱和,温度为(37±0.5) ℃。在不同时间间隔分别于心尖部位连续剪取心肌组织。将消化好的心室肌进行吹打,振荡,加含白蛋白(0.5 mg/mL) KB溶液保存备用。
, 百拇医药
用该法分离心肌细胞,由于细胞取自不同的消化时间,总有一个或几个时段的细胞消化分离“恰到好处”,故每次都能获得60%~80%的横纹清晰、质膜完整、呈杆状的耐钙心室肌细胞,且容易封接。
(二) 膜电流和膜电位的记录:将分离的单个豚鼠心室肌细胞放入倒置显微镜(OLYMPUSIMT-2)载物台上的灌流槽中,灌流液体为改进的台氏液(NaCl 136,NaH2PO4 1.2,KCl 5.4,MgSO4 1.2,CaCl2 1.8,glucose 15和HEPES 5 mmol/L,pH用NaOH调至7.3),灌流速度为1.0~1.5 mL/min。上述操作在室温下(25±1) ℃进行。使用膜片钳放大器(AxoPATCH200A)、数模转换系统(DigiData 1200)和pCLAMP 6.02微机程序,全细胞式记录方法,用电流钳检测单细胞跨膜电位,同时用电压钳检测内向整流钾电流(inward rectifier potassium current,IK1)和延迟整流钾电流(delayed outward potassium current,IK),动态采样、储存和分析[5]。IK1和IK为电压依赖性钾电流,其刺激程序见后面图1和图3。
, 百拇医药
用两步拉制器(NARISHIGE)将硬质玻璃毛细管(内径小于 4μm)拉制成微管电极,其尖端直径约2~4 μm,电阻为3.3~6.2 MΩ,内含细胞内液成分:K-aspartate 125; KCl 20; EGTA 10; HEPES 5; MgCl2 10; ATP-Na 5 mmol/L; pH用KOH调至7.2。
(三)药物和试剂:胶原酶、维拉帕米、天门冬氨酸钾、HEPES、白蛋白等由Sigma Co. 生产。余为分析纯。
(四)实验分组:实验分为正常对照组(加药前)、H2O2(1 mmol/L)实验组和冲洗后恢复组。所有观察指标均在同一细胞内完成,系处理前后对照。在各种处置作用8~12 min采集实验数据。
(五)资料分析:数据以x±s表示,用配对t检验进行均数差异显著性测定。
, http://www.100md.com
结果
一、H2O2对豚鼠心室肌细胞跨膜电位的影响:
本实验采用的H2O2(1 mmol/L),引起豚鼠心室肌细胞静息电位(rest potential, RP)明显降低(P<0.05),动作电位时程(action potential duration, APD)显著缩短(P<0.01),但对动作电位幅度(action potential amplitude, APA)和超射(overshoot, OS)均无明显影响(见表1)。
表1 H2O2(1 mmol/L)对豚鼠单个心室肌细胞跨膜电位的影响
Tab 1 Effect of H2O2 (1 mmol/L) on the transmembrane potential in guinea pig ventricular myocytes (x±s, n=8)
, http://www.100md.com
RP(mV)
APA(mV)
OS(mV)
APD50(ms)
APD90(ms)
Control
-73.0±9.8
112.0±16.0
38.9±7.0
409.0±233.4
515.0±234.0
, 百拇医药
H2O2
-65.3±11.3*
107.9±15.2
42.7±6.2
169.5±176.0**
238.4±210.3
*P<0.05, **P<0.01, vs control
二、H2O2(1 mmol/L)对豚鼠心室肌细胞内向整流钾电流(IK1)的影响:
, http://www.100md.com H2O2(1 mmol/L)明显抑制IK1,尤其在超极化时更是如此。例如,指令电位为-120 mV和-110 mV时,IK1由对照组的(-2133.5±570.4) pA和(-1671.3±469.0) pA分别降低到(-567.0±218.0) mV和(-490.0±169.0) mV(n=8, P<0.01)。图1为其中1次的实验记录。



Fig 1 Effect of H2O2(1 mmol/L) on the inward rectifier K current (IK1) in guinea pig ventricular myocytes
, 百拇医药
图1 H2O2(1 mmol/L) 对豚鼠单个心室肌细胞IK1的影响


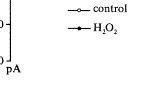
Fig 2 Effect of H2O2 (1 mmol/L) on the current-voltage (I-V) relation for IK1 in guinea pig ventricular myocytes
图2 H2O2(1 mmol/L)对豚鼠单个心室肌细胞IK1的电流-电压曲线关系的影响
, http://www.100md.com
在本实验条件下,正常对照组的IK1的I-V曲线呈N字型,与电压轴线有3个交点,H2O2明显抑制超极化时的内向电流,取消了-10至+20 mV间的内向电流,并使+20 mV以上的外向电流有所增强,致I-V曲线几乎变化一条斜线(图2)。
三、H2O2(1 mmol/L)对豚鼠心室肌细胞延迟整流钾电流(IK)的影响:
H2O2(1 mmol/L)可使IK增强,其中其快组分(IKr)增加显著,而慢组分(IKs)增加不甚显著。例如,在指令电位为40 mV时,IKr由(290.8±277.2) pA增强至(630.3±130.6) pA (n=6,P<0.05),IKs由(826.2±215.8) pA增加至(1089.8±473.8) pA (n=6,P>0.05)。图3为其中1次的实验记录。
, 百拇医药
在本实验条件下,正常对照组的IKr具有内向整流特点,其I-V曲线呈V字型,与电压轴线有两个交点(-10 mV,+20 mV),H2O2明显抑制IKr的内向电流,增强外向电流,使I-V曲线向右上移位(图4)。正常IKs均为外向电流,I-V曲线呈/型,H2O2增强这种外向电流,使I-V曲线向右上移位(图5)。







, 百拇医药
Fig 3 Effect of H2O2(1 mmol/L) on the delayed rectifier K current (IK) in guinea pig ventricular myocytes
图3 H2O2(1 mmol/L) 对豚鼠单个心室肌细胞IK的影响



Fig 4 Effect of H2O2 (1 mmol/L) on the current-voltage (I-V) relation for IKr in guinea pig ventricular myocytes
, 百拇医药
图4 H2O2(1 mmol/L)对豚鼠单个心室肌细胞IKr的电流-电压曲线关系的影响



Fig 5 Effect of H2O2 (1 mmol/L) on the current-voltage (I-V) relation for IKs in guinea pig ventricular myocytes
图5 H2O2(1 mmol/L)对豚鼠单个心室肌细胞IKs的电流-电压曲线关系的影响
, 百拇医药
讨论
本实验发现H2O2在使豚鼠心肌细胞RP降低和APD显著缩短的同时,明显抑制IK1和增强IK。
Satoh等采用全细胞电压钳方法,观察到H2O2(100 μmol/L)可抑制豚鼠心室肌细胞ICa和增强IK[4]。Haruaki Nakaya等观察到异丙基苯过氧化氢(cumene hydroperoxide)显著抑制豚鼠心室肌细胞IK1[6]。这些与我们观察到的情况相一致。
我们在早年发表的论文中,提出了APD10(复极达10%所需时间)相当于复极1期(快速复极早期),APD50-10(复极达50%所需时间与复极达10%所需时间之差)相当于复极2期(平台期,缓慢复极期),APD90-50(复极达90%所需时间与复极达50%所需时间之差)相当于复极3期(快速复极晚期)的看法[7]。近来,通过将膜片钳技术测得的药物抑制L型钙电流和缩短动作电位时程效应的资料进行相关性分析,进一步证实上述观点的正确[8]。
, 百拇医药
IK1主要负责维持心肌细胞的RP和动作电位(AP)3期快速复极化过程,IK则参与整个复极过程,和ICa一起共同维持AP的平台期[9,10]。IK1的抑制,必然导致RP降低和AP复极3期的延长。本实验中,H2O2引起的豚鼠心室肌细胞RP的降低(由-73.0±9.8 mV降至-65.3±11.3 mV),APD90-50(复极3期)占整个APD的比例平均由18.9%增加到26.3%,显然与H2O2显著抑制IK1有关。H2O2引起的IK增强及ICa的抑制(资料另文报道),共同导致APD的显著缩短。IK1减少应导致APD延长,IK增大则可导致APD缩短。APD究竟如何,取决于两者作用大小。本实验结果,进一步说明IK是控制APD长短的主要钾通道离子电流。
, 百拇医药
氧自由基与缺血时心功能障碍、缺血后心肌“顿挫”和再灌注损伤(包括再灌注性心律失常)有关,得到许多临床观察和动物实验的证实[1~4]。H2O2属于活性氧,它在体内可转变成细胞毒性极强的OH。人们可利用H2O2作为外源性自由基生成系统,观察自由基对机体的影响。H2O2引起RP降低,使RP和阈电位距离变小,可使心肌兴奋性增强;对背景钾电流IK1的抑制,可导致心肌自律性增强;使APD缩短,必然使有效不应期也相应缩短。这些均可成为氧自由基引起心律失常的电生理机制。
氧自由基对心肌细胞离子电流影响,各家报道不一。例如,内向整流钾电流(IK1)减小或不受影响,L-型ICa增大、减小或很少受影响等[2]。我们认为,这种混乱而矛盾的结果的产生,除与种属的差异、实验方法的不同有关以外,恐怕亦与动物的个体差异有关。
, 百拇医药
为什么H2O2对不同的钾通道作用不一致,抑制IK1却增强IK,有待于进一步深入研究。
* 国家自然科学基金资助(No 39570305)
参考文献
1 Goldhaber JI. Free radicals enhance Na+/Ca2+ exchange in ventricular myocytes. Am J Physiol, 1996, 271(3 Pt 2):H823.
2 Peggy L, Barrington. Interactions of H2O2, EGTA and patch pipette recording methods in feline ventricular myocytes. J Mol Cell Cardial, 1994, 26:557.
, 百拇医药
3 Elisabetta Cerbai, Giuseppe Ambrosio, Francesco, et al.Cellular electrophysiological basis for oxygen radical-induced arrhythmias. A patch-clamp study in guinea pig ventricular myocytes. Circulation, 1991, 84(4):1773.
4 Satoh H, Matsui K. Electrical and mechanical modulations by oxygen-derived free-radical generating systems in guinea-pig heart muscles. J Pharm Pharmacol, 1997, 49(5):505.
5 徐长庆,王孝铭,范劲松,等.丹参酮II-A对豚鼠单个心室细胞跨膜电位及L-型钙电流的影响.中国病理生理杂志,1997,13(1):43.
, 百拇医药
6 Haruaki Nakaya, Youji Takeda, Noritsugu tohse, et al. Mechanism of the membrane depolarization induced by oxidative stress in guinea pig ventricular cells. J Mol Cell Cardiol, 1992, 24:523.
7 徐长庆,李哲泓,王孝铭,等.丹参对豚鼠乳头肌动作电位的影响.哈尔滨医科大学学报,1991, 25(6):409.
8 徐长庆,娄延平,杨宝峰,等.丹参酮II-A抑制豚鼠单个心肌细胞L型钙电流和缩短动作电位时程效应的相关性分析.中国药理学通报,1998,14(5):428.
9 Carmeliet E. K+ channels and control of ventricular repolarization in the heart. Fundam Clin Pharmacol, 1993, 7(1):19.
10 Surawicz B. Role of potassium channels in cycle length dependent regulation of action potential duration in mammalian cardiac Purkinje and ventricular muscle fibres. Cardiovasc Res, 1992, 26(11):1021.
(1998年12月25日收稿,1999年4月20日修回), http://www.100md.com
单位:徐长庆 单宏丽 娄延平 傅国辉:哈尔滨医科大学 病理生理教研室;李玉荣:生理教研室;杨宝峰:药理教研室 哈尔滨 150086;孙可青:黑龙江省医院
关键词:过氧化氢;豚鼠;心肌;离子通道;心律失常
中国病理生理杂志990902 摘 要 目的:揭示氧自由基导致跨膜电位变化的离子电流基础。方法:采用全细胞膜片钳技术,观察了H2O2(lmmol/L)对豚鼠单个心室肌细胞不同钾通道的影响。结果:H2O2使豚鼠心肌细胞静息电位(RP)降低,动作电位时程(APD)显著缩短的同时,明显抑制超极化时的内向整流钾电流(IK1),致(IK1)正常呈N字型I-V曲线几乎变成一条斜线;增强延迟整流钾电流(IK)的快组分(IKr)和慢组分(IKs),尤其IKr增加更显著,并使电流电压曲线向右上偏移。结论:氧自由基对心室肌细胞的IK1和IK的不同影响,是其所致跨膜电位变化和心律失常的可能离子机制。
, http://www.100md.com
Effect of H2O2 on different potassium channel ionic currents
of ventricular myocytes of guinea pig
XU Chang-Qing, LI Yu-Rong, SUN Ke-Qing, YANG Bao-Feng,SAN Hong-Li, LOU Yan-Ping, FU Guo-Hui
Department of Pathophysiology, Physiology, Pharmacology, Harbin Medical University, Harbin (150086)
Abstract AIM: To reveal ionic current basis of the change of transmembrane potential induced by oxygen free radical. METHOD:The whole cell recording patch clamp technique was used to investigate the effect of H2O2 (1 mmol/L) on different potassium channel ionic currents of ventricular myocytes of guinea pig. RESULTS:It was found that H2O2 reduced rest potential (RP) and shortened action potential duration (APD) significantly, inhibited the inward rectifier K current (IK1) markedly. H2O2 changed the current-voltage (I-V) relation to IK1 from a N shape to a /shape and enhanced the rapid component (IKr) and the slow component (IKs) of the delayed outward retifier K current (IK), especially IKr, and made IK I-V curve shift to up-right. CONCLUSION:Different effects of oxygen free radical on IK1 and IK of ventricular myocytes is a possible ionic mechanism for the change of transmembrane potential and arrhythmia induced by oxygen free redical.
, 百拇医药
MeSH Hydrogen peroxide; Guinea pigs; Myocardium; Ion channels; Arrhythmia
氧自由基参与了细胞内钙超载和再灌注心律失常的发生[1],其确切机制尚有待深入研究。H2O2作为外源性羟自由基的生成系统,广泛用于氧自由基对单个心肌细胞电生理活动影响的探讨。无论常规微电极和膜片钳技术之间,还是采用同种方法的不同实验室之间,得出的结论不尽相同,有的甚至截然相反[2~4]。为了进一步明确有关问题,我们观察了H2O2对豚鼠心室肌细胞不同钾通道离子电流的影响,并分析了其与动作电位的关系。
材料与方法
(一) 单个心室肌细胞的分离:实验用豚鼠,由本校动物中心提供,体重(312±23) g,雌雄不拘。分离方法及条件与先前报道基本相同[5]。即将豚鼠击头致昏后,迅速开胸取心,主动脉插管,使用Langendorff灌流装置,经冠状动脉首先灌注正常台氏液(mmol/L:NaCl 116,NaH2PO4 1.4,KCl 5.4,NaHCO3 15,MgSO4 1,CaCl2 1.8和glucose 15)冲出积血,接着灌注无钙台氏液4~5 min使心脏停跳,最后用含有Ⅰ型胶原酶(0.250~0.375 g/L)的低钙台氏液(150μmol/L)反复消化40~60 min,灌流速度为7~8 mL/min。所有的液体均用95%O2+5%CO2饱和,温度为(37±0.5) ℃。在不同时间间隔分别于心尖部位连续剪取心肌组织。将消化好的心室肌进行吹打,振荡,加含白蛋白(0.5 mg/mL) KB溶液保存备用。
, 百拇医药
用该法分离心肌细胞,由于细胞取自不同的消化时间,总有一个或几个时段的细胞消化分离“恰到好处”,故每次都能获得60%~80%的横纹清晰、质膜完整、呈杆状的耐钙心室肌细胞,且容易封接。
(二) 膜电流和膜电位的记录:将分离的单个豚鼠心室肌细胞放入倒置显微镜(OLYMPUSIMT-2)载物台上的灌流槽中,灌流液体为改进的台氏液(NaCl 136,NaH2PO4 1.2,KCl 5.4,MgSO4 1.2,CaCl2 1.8,glucose 15和HEPES 5 mmol/L,pH用NaOH调至7.3),灌流速度为1.0~1.5 mL/min。上述操作在室温下(25±1) ℃进行。使用膜片钳放大器(AxoPATCH200A)、数模转换系统(DigiData 1200)和pCLAMP 6.02微机程序,全细胞式记录方法,用电流钳检测单细胞跨膜电位,同时用电压钳检测内向整流钾电流(inward rectifier potassium current,IK1)和延迟整流钾电流(delayed outward potassium current,IK),动态采样、储存和分析[5]。IK1和IK为电压依赖性钾电流,其刺激程序见后面图1和图3。
, 百拇医药
用两步拉制器(NARISHIGE)将硬质玻璃毛细管(内径小于 4μm)拉制成微管电极,其尖端直径约2~4 μm,电阻为3.3~6.2 MΩ,内含细胞内液成分:K-aspartate 125; KCl 20; EGTA 10; HEPES 5; MgCl2 10; ATP-Na 5 mmol/L; pH用KOH调至7.2。
(三)药物和试剂:胶原酶、维拉帕米、天门冬氨酸钾、HEPES、白蛋白等由Sigma Co. 生产。余为分析纯。
(四)实验分组:实验分为正常对照组(加药前)、H2O2(1 mmol/L)实验组和冲洗后恢复组。所有观察指标均在同一细胞内完成,系处理前后对照。在各种处置作用8~12 min采集实验数据。
(五)资料分析:数据以x±s表示,用配对t检验进行均数差异显著性测定。
, http://www.100md.com
结果
一、H2O2对豚鼠心室肌细胞跨膜电位的影响:
本实验采用的H2O2(1 mmol/L),引起豚鼠心室肌细胞静息电位(rest potential, RP)明显降低(P<0.05),动作电位时程(action potential duration, APD)显著缩短(P<0.01),但对动作电位幅度(action potential amplitude, APA)和超射(overshoot, OS)均无明显影响(见表1)。
表1 H2O2(1 mmol/L)对豚鼠单个心室肌细胞跨膜电位的影响
Tab 1 Effect of H2O2 (1 mmol/L) on the transmembrane potential in guinea pig ventricular myocytes (x±s, n=8)
, http://www.100md.com
RP(mV)
APA(mV)
OS(mV)
APD50(ms)
APD90(ms)
Control
-73.0±9.8
112.0±16.0
38.9±7.0
409.0±233.4
515.0±234.0
, 百拇医药
H2O2
-65.3±11.3*
107.9±15.2
42.7±6.2
169.5±176.0**
238.4±210.3
*P<0.05, **P<0.01, vs control
二、H2O2(1 mmol/L)对豚鼠心室肌细胞内向整流钾电流(IK1)的影响:
, http://www.100md.com H2O2(1 mmol/L)明显抑制IK1,尤其在超极化时更是如此。例如,指令电位为-120 mV和-110 mV时,IK1由对照组的(-2133.5±570.4) pA和(-1671.3±469.0) pA分别降低到(-567.0±218.0) mV和(-490.0±169.0) mV(n=8, P<0.01)。图1为其中1次的实验记录。




Fig 1 Effect of H2O2(1 mmol/L) on the inward rectifier K current (IK1) in guinea pig ventricular myocytes
, 百拇医药
图1 H2O2(1 mmol/L) 对豚鼠单个心室肌细胞IK1的影响



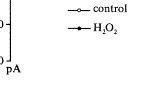
Fig 2 Effect of H2O2 (1 mmol/L) on the current-voltage (I-V) relation for IK1 in guinea pig ventricular myocytes
图2 H2O2(1 mmol/L)对豚鼠单个心室肌细胞IK1的电流-电压曲线关系的影响
, http://www.100md.com
在本实验条件下,正常对照组的IK1的I-V曲线呈N字型,与电压轴线有3个交点,H2O2明显抑制超极化时的内向电流,取消了-10至+20 mV间的内向电流,并使+20 mV以上的外向电流有所增强,致I-V曲线几乎变化一条斜线(图2)。
三、H2O2(1 mmol/L)对豚鼠心室肌细胞延迟整流钾电流(IK)的影响:
H2O2(1 mmol/L)可使IK增强,其中其快组分(IKr)增加显著,而慢组分(IKs)增加不甚显著。例如,在指令电位为40 mV时,IKr由(290.8±277.2) pA增强至(630.3±130.6) pA (n=6,P<0.05),IKs由(826.2±215.8) pA增加至(1089.8±473.8) pA (n=6,P>0.05)。图3为其中1次的实验记录。
, 百拇医药
在本实验条件下,正常对照组的IKr具有内向整流特点,其I-V曲线呈V字型,与电压轴线有两个交点(-10 mV,+20 mV),H2O2明显抑制IKr的内向电流,增强外向电流,使I-V曲线向右上移位(图4)。正常IKs均为外向电流,I-V曲线呈/型,H2O2增强这种外向电流,使I-V曲线向右上移位(图5)。








, 百拇医药
Fig 3 Effect of H2O2(1 mmol/L) on the delayed rectifier K current (IK) in guinea pig ventricular myocytes
图3 H2O2(1 mmol/L) 对豚鼠单个心室肌细胞IK的影响




Fig 4 Effect of H2O2 (1 mmol/L) on the current-voltage (I-V) relation for IKr in guinea pig ventricular myocytes
, 百拇医药
图4 H2O2(1 mmol/L)对豚鼠单个心室肌细胞IKr的电流-电压曲线关系的影响




Fig 5 Effect of H2O2 (1 mmol/L) on the current-voltage (I-V) relation for IKs in guinea pig ventricular myocytes
图5 H2O2(1 mmol/L)对豚鼠单个心室肌细胞IKs的电流-电压曲线关系的影响
, 百拇医药
讨论
本实验发现H2O2在使豚鼠心肌细胞RP降低和APD显著缩短的同时,明显抑制IK1和增强IK。
Satoh等采用全细胞电压钳方法,观察到H2O2(100 μmol/L)可抑制豚鼠心室肌细胞ICa和增强IK[4]。Haruaki Nakaya等观察到异丙基苯过氧化氢(cumene hydroperoxide)显著抑制豚鼠心室肌细胞IK1[6]。这些与我们观察到的情况相一致。
我们在早年发表的论文中,提出了APD10(复极达10%所需时间)相当于复极1期(快速复极早期),APD50-10(复极达50%所需时间与复极达10%所需时间之差)相当于复极2期(平台期,缓慢复极期),APD90-50(复极达90%所需时间与复极达50%所需时间之差)相当于复极3期(快速复极晚期)的看法[7]。近来,通过将膜片钳技术测得的药物抑制L型钙电流和缩短动作电位时程效应的资料进行相关性分析,进一步证实上述观点的正确[8]。
, 百拇医药
IK1主要负责维持心肌细胞的RP和动作电位(AP)3期快速复极化过程,IK则参与整个复极过程,和ICa一起共同维持AP的平台期[9,10]。IK1的抑制,必然导致RP降低和AP复极3期的延长。本实验中,H2O2引起的豚鼠心室肌细胞RP的降低(由-73.0±9.8 mV降至-65.3±11.3 mV),APD90-50(复极3期)占整个APD的比例平均由18.9%增加到26.3%,显然与H2O2显著抑制IK1有关。H2O2引起的IK增强及ICa的抑制(资料另文报道),共同导致APD的显著缩短。IK1减少应导致APD延长,IK增大则可导致APD缩短。APD究竟如何,取决于两者作用大小。本实验结果,进一步说明IK是控制APD长短的主要钾通道离子电流。
, 百拇医药
氧自由基与缺血时心功能障碍、缺血后心肌“顿挫”和再灌注损伤(包括再灌注性心律失常)有关,得到许多临床观察和动物实验的证实[1~4]。H2O2属于活性氧,它在体内可转变成细胞毒性极强的OH。人们可利用H2O2作为外源性自由基生成系统,观察自由基对机体的影响。H2O2引起RP降低,使RP和阈电位距离变小,可使心肌兴奋性增强;对背景钾电流IK1的抑制,可导致心肌自律性增强;使APD缩短,必然使有效不应期也相应缩短。这些均可成为氧自由基引起心律失常的电生理机制。
氧自由基对心肌细胞离子电流影响,各家报道不一。例如,内向整流钾电流(IK1)减小或不受影响,L-型ICa增大、减小或很少受影响等[2]。我们认为,这种混乱而矛盾的结果的产生,除与种属的差异、实验方法的不同有关以外,恐怕亦与动物的个体差异有关。
, 百拇医药
为什么H2O2对不同的钾通道作用不一致,抑制IK1却增强IK,有待于进一步深入研究。
* 国家自然科学基金资助(No 39570305)
参考文献
1 Goldhaber JI. Free radicals enhance Na+/Ca2+ exchange in ventricular myocytes. Am J Physiol, 1996, 271(3 Pt 2):H823.
2 Peggy L, Barrington. Interactions of H2O2, EGTA and patch pipette recording methods in feline ventricular myocytes. J Mol Cell Cardial, 1994, 26:557.
, 百拇医药
3 Elisabetta Cerbai, Giuseppe Ambrosio, Francesco, et al.Cellular electrophysiological basis for oxygen radical-induced arrhythmias. A patch-clamp study in guinea pig ventricular myocytes. Circulation, 1991, 84(4):1773.
4 Satoh H, Matsui K. Electrical and mechanical modulations by oxygen-derived free-radical generating systems in guinea-pig heart muscles. J Pharm Pharmacol, 1997, 49(5):505.
5 徐长庆,王孝铭,范劲松,等.丹参酮II-A对豚鼠单个心室细胞跨膜电位及L-型钙电流的影响.中国病理生理杂志,1997,13(1):43.
, 百拇医药
6 Haruaki Nakaya, Youji Takeda, Noritsugu tohse, et al. Mechanism of the membrane depolarization induced by oxidative stress in guinea pig ventricular cells. J Mol Cell Cardiol, 1992, 24:523.
7 徐长庆,李哲泓,王孝铭,等.丹参对豚鼠乳头肌动作电位的影响.哈尔滨医科大学学报,1991, 25(6):409.
8 徐长庆,娄延平,杨宝峰,等.丹参酮II-A抑制豚鼠单个心肌细胞L型钙电流和缩短动作电位时程效应的相关性分析.中国药理学通报,1998,14(5):428.
9 Carmeliet E. K+ channels and control of ventricular repolarization in the heart. Fundam Clin Pharmacol, 1993, 7(1):19.
10 Surawicz B. Role of potassium channels in cycle length dependent regulation of action potential duration in mammalian cardiac Purkinje and ventricular muscle fibres. Cardiovasc Res, 1992, 26(11):1021.
(1998年12月25日收稿,1999年4月20日修回), http://www.100md.com