流式细胞术检测LAK细胞的杀伤活性
作者:陈金虹 杨云纺 金志军 吴直江 高奇蓉
单位:
关键词:杀伤细胞,淋巴因子激活;流式细胞术
第二军医大学学报000429 【中图分类号】R 446.63 【文献标识码】B
【文章编号】0258-879X(2000)04-0394-02
LAK细胞的过继免疫治疗已在国内外广泛开展,并取得了令人瞩目的成就。如今肿瘤的过继免疫治疗已经与手术、化疗、放疗等并列而成为肿瘤治疗的一个模式。为监控LAK细胞过继免疫治疗的质量、疗效,LAK细胞活性的测定显得十分重要。目前常用的比较经典的LAK细胞活性检测方法是同位素检测法,而此法有同位素污染、半衰期限制、操作繁琐、费时较长等缺点。应用流式细胞术(flow cytometry,FCM)检测细胞毒细胞的活性,国外已有类似报道,但国内报道甚少。本研究即应用FCM检测LAK细胞活性,并与3H-TdR检测法进行比较,旨在探讨用FCM检测LAK细胞活性的可行性与可靠性,为临床LAK细胞免疫治疗的检测提供 新的安全、可靠、快捷、简便的方法。
, http://www.100md.com
1 材料和方法
1.1 材料 (1)人脐带血:无菌条件下断脐后脐静脉穿刺取脐带血,63例平均40 ml,肝素抗凝;(2)肿瘤细胞株:人淋巴瘤细胞株(Raji),由中科院上海细胞所提供; (3)3H-TdR:3H胸腺嘧啶核苷,中科院原子核所提供。比放射性活度1.11 TBq/mmol,总强度37MBq;(4)β-液闪计数仪:TRL-CARB,460CD型 Packard产品;(5) 流式细 胞仪: FACSCalibur美国Becton Dickinson公司产品,氩离子激器 Innova 90-5 。
1.2 方法 (1) PBMC的分离:正常脐带血肝素抗凝,以RPMI 1640稀释后按Fico ll-Hypaque 细胞分离液(相对密度 1.077)密度梯度离心,以常规方法分离PBMC;(2) 效应细胞的培养: 将分离的PBMC置于含10%灭活人AB血清及rIL-2 1 000 u/ ml的RPMI 1 640培养液中调整细胞密度为1×106/ml,另加PHA 30 μl 置37℃,5%CO2培养箱中诱 导培养,每2 d换新鲜培养液一次;(3) 流式细胞术和3H-TdR释放法检测LAK细胞活性 : 取同一份脐血LAK细胞作为3H-TdR组与FCM组的效应细胞。取同一培养时间的Raji 细胞用3H-TdR 标记后作为3H-TdR组的靶细胞,未标记的作为FCM组的靶细胞,均取 1∶1~64∶1的效、靶比作用相同的时间后两组分别进行实验:① 3 H-TdR组: 将24支试管离心,弃上清,加0.25%DNA酶及1.6%胰酶各100 μl,置37℃水浴40 min后取 出。每管加含10%小牛血清的培养液1 ml,终止反应1~2 h。置混旋器摇匀后,抽滤器抽取 细胞于玻璃纤维滤膜上,干燥。加闪烁液1.2 ml,常温下作用30 min后取出。于β-液体闪 烁计数仪测量放射性活度。特异性释放率(%)=1-(实验组放射活度值÷对照组放射活度值 )×100% 。② FCM组:用吸管将细胞从一次性试管移入上机试管中,每个效靶比有3复管,另设LAK自然死亡对照,Raji自然死亡对照。离心,吸弃上清,留0.3 ml混匀。每管加5 0 μg/ ml碘化丙碇(PI) 30 μl,置4℃避光作用20 min后取出。流式细胞仪采样检测。 杀伤率(%)=实验组靶细胞死亡率(%)- 对照组靶细胞自然死亡率(%)。
, 百拇医药
1.3 统计学处理 数据以 ±s表示,两种检测方法数据进行相关性 检验。使用SAS软件包。
±s表示,两种检测方法数据进行相关性 检验。使用SAS软件包。
2 结 果
结果如表1所示,在1∶1~64∶1的效靶比的情况,3 H-TdR释放法检测的 放射性活度值换算所得LAK细胞杀伤率与流式细胞术直接检测的结果相近,经统计学处理两 种方法具有极好的相关性。相关方程为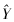 =1.025 7x-3.735 1,相关系数为r=0.984。且FCM法误差小,平均误差为1.65;而3H-TdR释放 法的平均误差为7.47。
=1.025 7x-3.735 1,相关系数为r=0.984。且FCM法误差小,平均误差为1.65;而3H-TdR释放 法的平均误差为7.47。
表 1 两种方法检测细胞毒活性的比较 效、靶比
, http://www.100md.com 3 H-TdR释放法
流式细胞术
杀伤率(%)
(A/Bq)
杀伤率(%)
1∶1
116.6±36.8
30.6±9.3
28.8±0.76
2∶1
81.0±23.0
51.8±15.8
, 百拇医药
44.5±1.00
4∶1
67.9±7.8
59.6±6.5
61.8±2.30
8∶1
50.5±12.4
70.0±14 .8
68.1±2.10
16∶1
29.3±2.6
82.5±6.6
, 百拇医药
75.6±1.48
32∶1
27.5±1.1
83.6±3.4
84.1±2.76
64∶1
24.2±1.7
85.6±5.9
86.7±1.18
3 讨 论
流式细胞技术是以流式细胞仪为工具来完成细胞等生物粒子理化特性研究的重要方法。细胞 对光的散射是细胞在未遭受任何破坏如固定、染色时也可以进行的,因此可以利用散射光的 信号对未染色的活细胞进行分析和分选[1]。前向角散射(FSC)光的强度与细胞大小 有关,侧向散射(SSC)与细胞内结构有关,它对细胞膜、胞质、核膜的折射率很敏感,对胞 质内较大的颗粒有反应。LAK细胞与肿瘤靶细胞在形态大小、内部结构、细胞内颗粒密度等 方面均有不同,故二者的FSC与SSC强度均不同。在FSC-SSC形成的二维图中所处的位置不同 。另外利用FCM的窗口功能可以框出肿瘤靶细胞进行单独分析。 LAK细胞杀伤肿瘤细胞一般 有坏死和凋亡两种机制[2],穿孔素在介导肿瘤坏死中起主要作用。它主要损伤靶 细胞的细胞膜,导致PI(碘化丙啶)这种能与细胞核特异结合的荧光染料进入细胞,从而使该 受损的靶细胞SSC强度增加。PI不能穿透活细胞的细胞膜,因此活细胞拒染,其光散强度不 会改变。凋亡的细胞胞质和核异常浓缩、细胞缩小、染色体凝集、细胞间突触消失、核断裂 、胞质空泡变性、细胞碎裂成凋亡小体[3]。由于凋亡细胞的上述改变其SSC强度增 加,而正常活的肿瘤靶细胞无此改变。因此,靶细胞被LAK细胞杀伤后,不论是坏死和凋亡,其侧向光散强度总是增加的,在FSC-SSC二维图上的位置就会不同于正常靶细胞。故利用 流式细胞术可以区分出LAK效应细胞和肿瘤靶细胞,也可区分出死的和活的肿瘤靶细胞。结 合窗口功能利用Cell Quest软件系统,框出靶细胞,单独分析其死亡细胞的百分率,以判定 LAK细胞活性的高低。3H-TdR释放法是很常用的检测杀伤细胞杀伤活性的方法。同位素法 具有敏感、重复性好,能够定量等优点。但也有放射防护、同位素污染、费时长、操作繁琐 等问题。而流式细胞术检测法不仅安全、方便、步骤少,减少了误差和操作时间,可适于大 批量标本的检测;而且联合应用计算机软件程序、对数据进行快速处理,获取结果快,可直 接获得细胞死亡率。另外流式细胞术检测在获得数字处理结果同时,还可获得效应细胞、靶 细胞形态、活率的直观图形。本实验结果证实用流式细胞术检测结果与3H-TdR释放法有 极好的一致性,因此应用流式细胞术检测LAK细胞活性是可靠且可取的。
, http://www.100md.com
【参考文献】
[1]Melamed MR.Flow cytometry and sorting[M].Second editio n.New York:John Wiley and Sons Press,1990.1-5.
[2]Zchlinsk A,Zheng LM,Liu CC,et al.Cytolytic lymphocytes induce both necrosis and apoptosis in target cells[J].J Immunol,1991,146(1) :393-400.
[3]Majno G,Joris I,Apoptosis oncosis and necrosis an overview of cell disease[J].Am.J Pathol,1995,146(1):3-15.
【收稿日期】1999-11-23
【修回日期】2000-02-25, http://www.100md.com
单位:
关键词:杀伤细胞,淋巴因子激活;流式细胞术
第二军医大学学报000429 【中图分类号】R 446.63 【文献标识码】B
【文章编号】0258-879X(2000)04-0394-02
LAK细胞的过继免疫治疗已在国内外广泛开展,并取得了令人瞩目的成就。如今肿瘤的过继免疫治疗已经与手术、化疗、放疗等并列而成为肿瘤治疗的一个模式。为监控LAK细胞过继免疫治疗的质量、疗效,LAK细胞活性的测定显得十分重要。目前常用的比较经典的LAK细胞活性检测方法是同位素检测法,而此法有同位素污染、半衰期限制、操作繁琐、费时较长等缺点。应用流式细胞术(flow cytometry,FCM)检测细胞毒细胞的活性,国外已有类似报道,但国内报道甚少。本研究即应用FCM检测LAK细胞活性,并与3H-TdR检测法进行比较,旨在探讨用FCM检测LAK细胞活性的可行性与可靠性,为临床LAK细胞免疫治疗的检测提供 新的安全、可靠、快捷、简便的方法。
, http://www.100md.com
1 材料和方法
1.1 材料 (1)人脐带血:无菌条件下断脐后脐静脉穿刺取脐带血,63例平均40 ml,肝素抗凝;(2)肿瘤细胞株:人淋巴瘤细胞株(Raji),由中科院上海细胞所提供; (3)3H-TdR:3H胸腺嘧啶核苷,中科院原子核所提供。比放射性活度1.11 TBq/mmol,总强度37MBq;(4)β-液闪计数仪:TRL-CARB,460CD型 Packard产品;(5) 流式细 胞仪: FACSCalibur美国Becton Dickinson公司产品,氩离子激器 Innova 90-5 。
1.2 方法 (1) PBMC的分离:正常脐带血肝素抗凝,以RPMI 1640稀释后按Fico ll-Hypaque 细胞分离液(相对密度 1.077)密度梯度离心,以常规方法分离PBMC;(2) 效应细胞的培养: 将分离的PBMC置于含10%灭活人AB血清及rIL-2 1 000 u/ ml的RPMI 1 640培养液中调整细胞密度为1×106/ml,另加PHA 30 μl 置37℃,5%CO2培养箱中诱 导培养,每2 d换新鲜培养液一次;(3) 流式细胞术和3H-TdR释放法检测LAK细胞活性 : 取同一份脐血LAK细胞作为3H-TdR组与FCM组的效应细胞。取同一培养时间的Raji 细胞用3H-TdR 标记后作为3H-TdR组的靶细胞,未标记的作为FCM组的靶细胞,均取 1∶1~64∶1的效、靶比作用相同的时间后两组分别进行实验:① 3 H-TdR组: 将24支试管离心,弃上清,加0.25%DNA酶及1.6%胰酶各100 μl,置37℃水浴40 min后取 出。每管加含10%小牛血清的培养液1 ml,终止反应1~2 h。置混旋器摇匀后,抽滤器抽取 细胞于玻璃纤维滤膜上,干燥。加闪烁液1.2 ml,常温下作用30 min后取出。于β-液体闪 烁计数仪测量放射性活度。特异性释放率(%)=1-(实验组放射活度值÷对照组放射活度值 )×100% 。② FCM组:用吸管将细胞从一次性试管移入上机试管中,每个效靶比有3复管,另设LAK自然死亡对照,Raji自然死亡对照。离心,吸弃上清,留0.3 ml混匀。每管加5 0 μg/ ml碘化丙碇(PI) 30 μl,置4℃避光作用20 min后取出。流式细胞仪采样检测。 杀伤率(%)=实验组靶细胞死亡率(%)- 对照组靶细胞自然死亡率(%)。
, 百拇医药
1.3 统计学处理 数据以
 ±s表示,两种检测方法数据进行相关性 检验。使用SAS软件包。
±s表示,两种检测方法数据进行相关性 检验。使用SAS软件包。2 结 果
结果如表1所示,在1∶1~64∶1的效靶比的情况,3 H-TdR释放法检测的 放射性活度值换算所得LAK细胞杀伤率与流式细胞术直接检测的结果相近,经统计学处理两 种方法具有极好的相关性。相关方程为
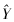 =1.025 7x-3.735 1,相关系数为r=0.984。且FCM法误差小,平均误差为1.65;而3H-TdR释放 法的平均误差为7.47。
=1.025 7x-3.735 1,相关系数为r=0.984。且FCM法误差小,平均误差为1.65;而3H-TdR释放 法的平均误差为7.47。表 1 两种方法检测细胞毒活性的比较 效、靶比
, http://www.100md.com 3 H-TdR释放法
流式细胞术
杀伤率(%)
(A/Bq)
杀伤率(%)
1∶1
116.6±36.8
30.6±9.3
28.8±0.76
2∶1
81.0±23.0
51.8±15.8
, 百拇医药
44.5±1.00
4∶1
67.9±7.8
59.6±6.5
61.8±2.30
8∶1
50.5±12.4
70.0±14 .8
68.1±2.10
16∶1
29.3±2.6
82.5±6.6
, 百拇医药
75.6±1.48
32∶1
27.5±1.1
83.6±3.4
84.1±2.76
64∶1
24.2±1.7
85.6±5.9
86.7±1.18
3 讨 论
流式细胞技术是以流式细胞仪为工具来完成细胞等生物粒子理化特性研究的重要方法。细胞 对光的散射是细胞在未遭受任何破坏如固定、染色时也可以进行的,因此可以利用散射光的 信号对未染色的活细胞进行分析和分选[1]。前向角散射(FSC)光的强度与细胞大小 有关,侧向散射(SSC)与细胞内结构有关,它对细胞膜、胞质、核膜的折射率很敏感,对胞 质内较大的颗粒有反应。LAK细胞与肿瘤靶细胞在形态大小、内部结构、细胞内颗粒密度等 方面均有不同,故二者的FSC与SSC强度均不同。在FSC-SSC形成的二维图中所处的位置不同 。另外利用FCM的窗口功能可以框出肿瘤靶细胞进行单独分析。 LAK细胞杀伤肿瘤细胞一般 有坏死和凋亡两种机制[2],穿孔素在介导肿瘤坏死中起主要作用。它主要损伤靶 细胞的细胞膜,导致PI(碘化丙啶)这种能与细胞核特异结合的荧光染料进入细胞,从而使该 受损的靶细胞SSC强度增加。PI不能穿透活细胞的细胞膜,因此活细胞拒染,其光散强度不 会改变。凋亡的细胞胞质和核异常浓缩、细胞缩小、染色体凝集、细胞间突触消失、核断裂 、胞质空泡变性、细胞碎裂成凋亡小体[3]。由于凋亡细胞的上述改变其SSC强度增 加,而正常活的肿瘤靶细胞无此改变。因此,靶细胞被LAK细胞杀伤后,不论是坏死和凋亡,其侧向光散强度总是增加的,在FSC-SSC二维图上的位置就会不同于正常靶细胞。故利用 流式细胞术可以区分出LAK效应细胞和肿瘤靶细胞,也可区分出死的和活的肿瘤靶细胞。结 合窗口功能利用Cell Quest软件系统,框出靶细胞,单独分析其死亡细胞的百分率,以判定 LAK细胞活性的高低。3H-TdR释放法是很常用的检测杀伤细胞杀伤活性的方法。同位素法 具有敏感、重复性好,能够定量等优点。但也有放射防护、同位素污染、费时长、操作繁琐 等问题。而流式细胞术检测法不仅安全、方便、步骤少,减少了误差和操作时间,可适于大 批量标本的检测;而且联合应用计算机软件程序、对数据进行快速处理,获取结果快,可直 接获得细胞死亡率。另外流式细胞术检测在获得数字处理结果同时,还可获得效应细胞、靶 细胞形态、活率的直观图形。本实验结果证实用流式细胞术检测结果与3H-TdR释放法有 极好的一致性,因此应用流式细胞术检测LAK细胞活性是可靠且可取的。
, http://www.100md.com
【参考文献】
[1]Melamed MR.Flow cytometry and sorting[M].Second editio n.New York:John Wiley and Sons Press,1990.1-5.
[2]Zchlinsk A,Zheng LM,Liu CC,et al.Cytolytic lymphocytes induce both necrosis and apoptosis in target cells[J].J Immunol,1991,146(1) :393-400.
[3]Majno G,Joris I,Apoptosis oncosis and necrosis an overview of cell disease[J].Am.J Pathol,1995,146(1):3-15.
【收稿日期】1999-11-23
【修回日期】2000-02-25, http://www.100md.com