IL-1诱导血管内皮细胞表达HLA-DR抗原对癌细胞粘附作用的研究
作者:顾立刚 刘积良
单位:北京中医药大学微生物学与免疫学教研室(北京100029);深圳市红十字会医院肿瘤科
关键词:白细胞介素-1;HLA-DR抗原;肿瘤细胞,培养的;内皮,血管
肿瘤990506 摘要:目的 探讨白细胞介素-1(IL-1)作用于人脐带血管内皮细胞(HEC)表达HLA-DR抗原,以及对人肝癌细胞(H7401)的粘附作用。方法 应用微量细胞毒试验和中性红染色法检测肝癌细胞对HEC的粘附作用。结果 研究发现,IL-1 100 U/ml作用于HEC 24 h后,与对照组比较,IL-1能诱导HEC表达HLA-DR抗原,同时发现,还能显著增加对肝癌细胞的粘附,与对照组比较,粘附百分率增加36%,(P<0.05)。当IL-1 1000 U/ml时,对癌细胞粘附则表现为抑制。肝癌细胞与IL-1 100 U/ml预处理6 h后,对HEC的粘附作用比对照组显著增加24.6%,(P<0.05)。结论 IL-1能增加HLA-DR抗原的表达,但IL-1对肝癌细胞粘附HEC具有浓度选择作用。
, 百拇医药
EFFECT OF INTERLEUKIN-1 INDUCED HLA-DR ANTIGEN ON HUMAN ENDOTHELIAL CELL TO THE TUMOR CELL ADHESION
GU Li-gang,LIU Ji-liang.
(Department of Microbiology and Immunology,Beijing University of Traditional Chinese Medicine,Beijing 100029,China)
Abstract:Objective To investigate the role of IL-1 induced HLA-DR antigen on human endothelial cells(HEC) and on human hepatocellular carcinoma cell adhesion.Methods Microcytotoxicity and neutral red staining were used to observe the adhesion of HEC on human hepatocellular carcinoma cell line H7401 in vitro.Results IL-1 100 U/ml could induce the expression of HLA-DR antigen on HEC. HEC pretreated with IL-1 for 24 h could significantly increase adhesion with tumor cells by 36%(in compare with control,P<0.05). And tumor cell pretreated with IL-1 for 6 h also promotes adhesion by 24.6%(P<0.05).Conclusions IL-1 could increase the expression of HLA-DR antigen on HEC,and IL-1 also shows a dosage dependent effect on cultured human hepatocellular carcinoma cell adhesion.
, 百拇医药
Key words: IL-1;HLA-DR antigen;Tumor cell,cultured; Endothelium,vascular
细胞因子在机体正常情况下能够调节免疫功能,刺激抗肿瘤免疫反应。但机体一旦发生恶性肿瘤,癌细胞能自分泌一些细胞因子,打破机体的正常调节,使细胞因子和细胞因子受体失调。并且这种癌细胞自分泌因子能通过自身受体激活,刺激癌细胞自身生长。如人类急性骨髓性白血病和T细胞白血病细胞能产生IL-1[1],人类骨髓瘤和慢性淋巴性白血病细胞能产生IL-6[2],慢性淋巴细胞性白血病细胞能产生TNF[3]。恶性肿瘤的生长增殖与癌细胞自分泌因子有密切的关系,而这些细胞因子的形成常是癌细胞基因激活的结果[4]。本文研究有关细胞因子刺激血管内皮细胞表达HLA-DR抗原对人肝癌细胞粘附作用的影响。
材料和方法
, 百拇医药
一、体外传代肿瘤细胞的培养和制备
体外传代肿瘤细胞株人肝癌细胞(H7401),由中日友好医院临床研究所细胞生物室提供,癌细胞用完全RPMI-1640培养基传代培养,实验用癌细胞取自传代培养24小时对数生长期的细胞。
二、血管内皮细胞的分离和培养
用Hanks液冲洗新鲜人脐带静脉腔至残血洗净,注入0.1%胶原酶(Sigmal型)约7 ml,夹闭脐带两端,37℃水浴中消化5~10 min,吸出静脉腔内胶原酶溶液,用适量无血清RPMI-1640培养液冲洗数次,离心收集细胞,最后用199培养基(含20%胎牛血清,内皮细胞生长因子50 μg/ml,肝素100 μg/ml)配成细胞悬液,接种到预先包被0.2%明胶的塑料培养瓶内,置37℃,5% CO2培养箱培养。细胞生长汇合后,用0.1%胰酶-0.02% EDTA常规消化传代。实验用细胞浓度为5×105/ml。
, 百拇医药
三、IL-1诱导血管内皮细胞对HLA-DR抗原表达的微量细胞毒试验,按实验方法[5]进行。抗人HLA-DR单克隆抗体和抗T细胞抗体,购于邦定生物医学公司。
四、IL-1促进血管内皮细胞对肝癌细胞粘附
血管内皮细胞5×105/ml,加入96孔培养板100 μl/孔,同时加入IL-1浓度分别为10 U/ml、100 U/ml、1000 U/ml,各0.1 ml/孔,对照孔加入完全RPMI-1640培养基,37℃,5% CO2培养24 h后,用PBS液洗孔3次,加入用0.075%中性红染色的人肝癌细胞H7401 1×104/孔,37℃,5% CO2培养30 min,取出弃上清液,洗涤3遍后,加入细胞溶解液0.1 ml/孔,在酶标仪570 nm处测A值。
, 百拇医药
五、IL-1作用肝癌细胞后对血管内皮细胞粘附作用
IL-1浓度分别为10 U/ml,100 U/ml,1000 U/ml,与肝癌细胞共同培养37℃,5% CO2 6 h后用PBS液洗3次,加入用0.075%中性红染色30 min,用PBS液洗3次,刮取细胞,调节癌细胞浓度为1×105/ml,0.1 ml加入血管内皮细胞单层,37 ℃,5% CO2培养30 min,取出弃上清液,洗涤3遍后,加入细胞溶解液0.1 ml/孔,在酶标仪570 nm处测A值。
结果
一、IL-1诱导血管内皮细胞表达HLA-DR抗原的影响 血管内皮细胞用100 U/ml作用24 h后,经抗HLA-DR单克隆抗体37℃下作用1.5 h后,加入补体在37℃下培养2 h,伊红浸染2 min后加入中性福尔马林液中止反应。镜下可见,被杀伤细胞染色呈暗红色,体积膨大,而未被杀伤的细胞不着色。另外,用抗T细胞单克隆抗体作用于HLA-DR阴性或阳性的内皮细胞,均不出现杀伤作用(见表1)。
, 百拇医药
表1 IL-1诱导血管内皮细胞表达HLA-DR抗原的微量细胞毒试验 血管内皮细胞
诱导处理
抗HLA-DR
单克隆抗体
抗T细胞
单克隆抗体
对照组
-
-
IL-1 100 U/ml
+
-
, 百拇医药
+:杀伤细胞百分率>60%;-:杀伤细胞百分率<60%。
二、IL-1促进HEC对肝癌细胞(H7401)粘附作用 IL-1 10 U/ml、100 U/ml、1000 U/ml分别单独在体外作用于HEC 24 h后,对肝癌细胞的粘附百分率(见表2)。
表2 IL-1诱导血管内皮细胞对肝癌细胞粘附的影响* 组别
剂量
(U/ml)
A值(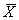 ±s)
±s)
粘附%
P值
, http://www.100md.com
对照组
-
0.130±0.034
IL-1
10
0.164±0.22
26
100
0.178±0.036
36.0
<0.05
1000
0.121±0.04
, 百拇医药
-9
*:IL-1作用于内皮细胞24 h后,内皮细胞对肿瘤细胞的粘附
三、肝癌细胞用IL-1处理后对HEC的粘附作用的影响 IL-1 100 U/ml作用于癌细胞6 h后,对HEC粘附有明显的促进作用,而IL-1 1000 U/ml则表现为抑制作用(见表3)。
表3 IL-1对肝癌细胞粘附血管内皮细胞的影响* 组别
剂量(U/ml)
A值(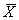 ±s)
±s)
粘附%
P值
, http://www.100md.com
对照组
-
0.081±0.011
IL-1
10
0.087±0.013
6.9
100
0.101±0.015
24.6
<0.05
1000
0.0623±0.004;
, 百拇医药
-23.2
<0.05
*:IL-1作用于肝癌细胞6 h后,后者与内皮细胞的粘附作用讨论
内皮细胞与肿瘤细胞的粘附是肿瘤转移过程中,癌细胞穿越血管壁向靶器官游走的关键步骤。目前已知,这种粘附作用的分子基础是与内皮细胞和肿瘤细胞表面粘附分子的相互作用有关[6]。但有关癌细胞自分泌因子促进癌细胞粘附、迁移的有关细节尚不清楚。尽管最近Bertomeo报道,IL-1能诱导血管内皮细胞表达粘附分子,增加癌细胞粘附,并促进癌细胞转移[7]。但对于癌细胞从血管壁迁出到达特异转移部位,生长繁殖形成转移灶,IL-1诱导血管内皮细胞异常表达HLA-DR抗原,使其获得吞噬样细胞作用和产生趋化因子,促进癌细胞粘附,形成肿瘤转移灶的关系尚未见报道。本实验从单个细胞因子刺激血管内皮细胞,使其表达HLA-DR抗原,促进肝癌细胞粘附的实验结果提示,IL-1在适当浓度下,能诱导血管内皮细胞表达HLA-DR抗原,增强对癌细胞的粘附作用。大剂量则能抑制癌细胞的粘附,其作用机理可能与血管内皮细胞经一定浓度的IL-1刺激后能表达HLA-DR抗原,并使其获得吞噬细胞样特性和分泌趋化因子、促进肝癌细胞对血管内皮细胞的粘附。
, http://www.100md.com
基金项目:人事部非教育系统回国留学人员B类课题经费资助
作者简介:顾立刚,男,博士后,教授。
参考文献
[1]Cozzolino F,Rubartelli A, Aldinucci D.Interleukin 1 as an autocrine growth factor for acute myeloid leukemia cells.Proc Natl Acad Sci USA,1989,86:2369
[2]Siegall CB,Schwab G,Nordan RP, et al. Expression of the interleukin 6 receptor and interleukin 6 in prostate carcinoma cells.Cancer Res,1990,50:7786
, 百拇医药
[3]张平综述:癌细胞的自分泌.国外医学肿瘤学分册,1989,16(2):65
[4]Lang RA,Burgess AW.Autocrine growth factors and tumorigenic transformation.Immunol Today,1990,(11):244
[5]汪 建,汪秀明,卢泳才,等.IL-2诱导的内皮细胞HLA-DR抗原表达.中国免疫学杂志,1988,4(6):327
[6]Dejana E,Bertocchi F, Bortolami MC.Interleukin 1 promotes tumor cell adhesion to cultured human endothelial cells.J Clin Invest,1988,82:1466
[7]Bertomeo MC, et al. Interleukin 1 induced cancer cell/endothelial cell adhesion in vitro and its relationship to metastasis in vivo:role of vessel well B-HODE synthesis and integrin expression.Clin Exp Metatasis,1993,11:243
(收稿日期:1998-01-04), 百拇医药
单位:北京中医药大学微生物学与免疫学教研室(北京100029);深圳市红十字会医院肿瘤科
关键词:白细胞介素-1;HLA-DR抗原;肿瘤细胞,培养的;内皮,血管
肿瘤990506 摘要:目的 探讨白细胞介素-1(IL-1)作用于人脐带血管内皮细胞(HEC)表达HLA-DR抗原,以及对人肝癌细胞(H7401)的粘附作用。方法 应用微量细胞毒试验和中性红染色法检测肝癌细胞对HEC的粘附作用。结果 研究发现,IL-1 100 U/ml作用于HEC 24 h后,与对照组比较,IL-1能诱导HEC表达HLA-DR抗原,同时发现,还能显著增加对肝癌细胞的粘附,与对照组比较,粘附百分率增加36%,(P<0.05)。当IL-1 1000 U/ml时,对癌细胞粘附则表现为抑制。肝癌细胞与IL-1 100 U/ml预处理6 h后,对HEC的粘附作用比对照组显著增加24.6%,(P<0.05)。结论 IL-1能增加HLA-DR抗原的表达,但IL-1对肝癌细胞粘附HEC具有浓度选择作用。
, 百拇医药
EFFECT OF INTERLEUKIN-1 INDUCED HLA-DR ANTIGEN ON HUMAN ENDOTHELIAL CELL TO THE TUMOR CELL ADHESION
GU Li-gang,LIU Ji-liang.
(Department of Microbiology and Immunology,Beijing University of Traditional Chinese Medicine,Beijing 100029,China)
Abstract:Objective To investigate the role of IL-1 induced HLA-DR antigen on human endothelial cells(HEC) and on human hepatocellular carcinoma cell adhesion.Methods Microcytotoxicity and neutral red staining were used to observe the adhesion of HEC on human hepatocellular carcinoma cell line H7401 in vitro.Results IL-1 100 U/ml could induce the expression of HLA-DR antigen on HEC. HEC pretreated with IL-1 for 24 h could significantly increase adhesion with tumor cells by 36%(in compare with control,P<0.05). And tumor cell pretreated with IL-1 for 6 h also promotes adhesion by 24.6%(P<0.05).Conclusions IL-1 could increase the expression of HLA-DR antigen on HEC,and IL-1 also shows a dosage dependent effect on cultured human hepatocellular carcinoma cell adhesion.
, 百拇医药
Key words: IL-1;HLA-DR antigen;Tumor cell,cultured; Endothelium,vascular
细胞因子在机体正常情况下能够调节免疫功能,刺激抗肿瘤免疫反应。但机体一旦发生恶性肿瘤,癌细胞能自分泌一些细胞因子,打破机体的正常调节,使细胞因子和细胞因子受体失调。并且这种癌细胞自分泌因子能通过自身受体激活,刺激癌细胞自身生长。如人类急性骨髓性白血病和T细胞白血病细胞能产生IL-1[1],人类骨髓瘤和慢性淋巴性白血病细胞能产生IL-6[2],慢性淋巴细胞性白血病细胞能产生TNF[3]。恶性肿瘤的生长增殖与癌细胞自分泌因子有密切的关系,而这些细胞因子的形成常是癌细胞基因激活的结果[4]。本文研究有关细胞因子刺激血管内皮细胞表达HLA-DR抗原对人肝癌细胞粘附作用的影响。
材料和方法
, 百拇医药
一、体外传代肿瘤细胞的培养和制备
体外传代肿瘤细胞株人肝癌细胞(H7401),由中日友好医院临床研究所细胞生物室提供,癌细胞用完全RPMI-1640培养基传代培养,实验用癌细胞取自传代培养24小时对数生长期的细胞。
二、血管内皮细胞的分离和培养
用Hanks液冲洗新鲜人脐带静脉腔至残血洗净,注入0.1%胶原酶(Sigmal型)约7 ml,夹闭脐带两端,37℃水浴中消化5~10 min,吸出静脉腔内胶原酶溶液,用适量无血清RPMI-1640培养液冲洗数次,离心收集细胞,最后用199培养基(含20%胎牛血清,内皮细胞生长因子50 μg/ml,肝素100 μg/ml)配成细胞悬液,接种到预先包被0.2%明胶的塑料培养瓶内,置37℃,5% CO2培养箱培养。细胞生长汇合后,用0.1%胰酶-0.02% EDTA常规消化传代。实验用细胞浓度为5×105/ml。
, 百拇医药
三、IL-1诱导血管内皮细胞对HLA-DR抗原表达的微量细胞毒试验,按实验方法[5]进行。抗人HLA-DR单克隆抗体和抗T细胞抗体,购于邦定生物医学公司。
四、IL-1促进血管内皮细胞对肝癌细胞粘附
血管内皮细胞5×105/ml,加入96孔培养板100 μl/孔,同时加入IL-1浓度分别为10 U/ml、100 U/ml、1000 U/ml,各0.1 ml/孔,对照孔加入完全RPMI-1640培养基,37℃,5% CO2培养24 h后,用PBS液洗孔3次,加入用0.075%中性红染色的人肝癌细胞H7401 1×104/孔,37℃,5% CO2培养30 min,取出弃上清液,洗涤3遍后,加入细胞溶解液0.1 ml/孔,在酶标仪570 nm处测A值。
, 百拇医药
五、IL-1作用肝癌细胞后对血管内皮细胞粘附作用
IL-1浓度分别为10 U/ml,100 U/ml,1000 U/ml,与肝癌细胞共同培养37℃,5% CO2 6 h后用PBS液洗3次,加入用0.075%中性红染色30 min,用PBS液洗3次,刮取细胞,调节癌细胞浓度为1×105/ml,0.1 ml加入血管内皮细胞单层,37 ℃,5% CO2培养30 min,取出弃上清液,洗涤3遍后,加入细胞溶解液0.1 ml/孔,在酶标仪570 nm处测A值。
结果
一、IL-1诱导血管内皮细胞表达HLA-DR抗原的影响 血管内皮细胞用100 U/ml作用24 h后,经抗HLA-DR单克隆抗体37℃下作用1.5 h后,加入补体在37℃下培养2 h,伊红浸染2 min后加入中性福尔马林液中止反应。镜下可见,被杀伤细胞染色呈暗红色,体积膨大,而未被杀伤的细胞不着色。另外,用抗T细胞单克隆抗体作用于HLA-DR阴性或阳性的内皮细胞,均不出现杀伤作用(见表1)。
, 百拇医药
表1 IL-1诱导血管内皮细胞表达HLA-DR抗原的微量细胞毒试验 血管内皮细胞
诱导处理
抗HLA-DR
单克隆抗体
抗T细胞
单克隆抗体
对照组
-
-
IL-1 100 U/ml
+
-
, 百拇医药
+:杀伤细胞百分率>60%;-:杀伤细胞百分率<60%。
二、IL-1促进HEC对肝癌细胞(H7401)粘附作用 IL-1 10 U/ml、100 U/ml、1000 U/ml分别单独在体外作用于HEC 24 h后,对肝癌细胞的粘附百分率(见表2)。
表2 IL-1诱导血管内皮细胞对肝癌细胞粘附的影响* 组别
剂量
(U/ml)
A值(
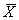 ±s)
±s)粘附%
P值
, http://www.100md.com
对照组
-
0.130±0.034
IL-1
10
0.164±0.22
26
100
0.178±0.036
36.0
<0.05
1000
0.121±0.04
, 百拇医药
-9
*:IL-1作用于内皮细胞24 h后,内皮细胞对肿瘤细胞的粘附
三、肝癌细胞用IL-1处理后对HEC的粘附作用的影响 IL-1 100 U/ml作用于癌细胞6 h后,对HEC粘附有明显的促进作用,而IL-1 1000 U/ml则表现为抑制作用(见表3)。
表3 IL-1对肝癌细胞粘附血管内皮细胞的影响* 组别
剂量(U/ml)
A值(
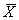 ±s)
±s)粘附%
P值
, http://www.100md.com
对照组
-
0.081±0.011
IL-1
10
0.087±0.013
6.9
100
0.101±0.015
24.6
<0.05
1000
0.0623±0.004;
, 百拇医药
-23.2
<0.05
*:IL-1作用于肝癌细胞6 h后,后者与内皮细胞的粘附作用讨论
内皮细胞与肿瘤细胞的粘附是肿瘤转移过程中,癌细胞穿越血管壁向靶器官游走的关键步骤。目前已知,这种粘附作用的分子基础是与内皮细胞和肿瘤细胞表面粘附分子的相互作用有关[6]。但有关癌细胞自分泌因子促进癌细胞粘附、迁移的有关细节尚不清楚。尽管最近Bertomeo报道,IL-1能诱导血管内皮细胞表达粘附分子,增加癌细胞粘附,并促进癌细胞转移[7]。但对于癌细胞从血管壁迁出到达特异转移部位,生长繁殖形成转移灶,IL-1诱导血管内皮细胞异常表达HLA-DR抗原,使其获得吞噬样细胞作用和产生趋化因子,促进癌细胞粘附,形成肿瘤转移灶的关系尚未见报道。本实验从单个细胞因子刺激血管内皮细胞,使其表达HLA-DR抗原,促进肝癌细胞粘附的实验结果提示,IL-1在适当浓度下,能诱导血管内皮细胞表达HLA-DR抗原,增强对癌细胞的粘附作用。大剂量则能抑制癌细胞的粘附,其作用机理可能与血管内皮细胞经一定浓度的IL-1刺激后能表达HLA-DR抗原,并使其获得吞噬细胞样特性和分泌趋化因子、促进肝癌细胞对血管内皮细胞的粘附。
, http://www.100md.com
基金项目:人事部非教育系统回国留学人员B类课题经费资助
作者简介:顾立刚,男,博士后,教授。
参考文献
[1]Cozzolino F,Rubartelli A, Aldinucci D.Interleukin 1 as an autocrine growth factor for acute myeloid leukemia cells.Proc Natl Acad Sci USA,1989,86:2369
[2]Siegall CB,Schwab G,Nordan RP, et al. Expression of the interleukin 6 receptor and interleukin 6 in prostate carcinoma cells.Cancer Res,1990,50:7786
, 百拇医药
[3]张平综述:癌细胞的自分泌.国外医学肿瘤学分册,1989,16(2):65
[4]Lang RA,Burgess AW.Autocrine growth factors and tumorigenic transformation.Immunol Today,1990,(11):244
[5]汪 建,汪秀明,卢泳才,等.IL-2诱导的内皮细胞HLA-DR抗原表达.中国免疫学杂志,1988,4(6):327
[6]Dejana E,Bertocchi F, Bortolami MC.Interleukin 1 promotes tumor cell adhesion to cultured human endothelial cells.J Clin Invest,1988,82:1466
[7]Bertomeo MC, et al. Interleukin 1 induced cancer cell/endothelial cell adhesion in vitro and its relationship to metastasis in vivo:role of vessel well B-HODE synthesis and integrin expression.Clin Exp Metatasis,1993,11:243
(收稿日期:1998-01-04), 百拇医药