活化的硝酸纤维膜用于HIV抗体滴金免疫法测定
作者:周文达 俞炳耀 甄子刚 盛婪 金怡
单位:上海第二医科大学医学检验实验室,上海200025
关键词:HIV;多肽抗原;活化膜;SPA胶体金
临床检验杂志990313 本文比较了硝酸纤维膜的活化与不活化用于HIV抗体的滴金免疫测定,且对方法学进行了考核。
1 材料
1.1 HIV多肽抗原 本室制备[1]。
1.2 血清标本 15份HIV抗体阳性血清由澳大利亚皇家布里斯班医院、亚历山德拉公主医院及上海市卫生防疫站提供,56份正常人血清经Abbott anti-HIV EIA检测为阴性,由上海市卫生防疫站提供。
, 百拇医药
1.3 硝酸纤维膜 孔径0.45 μm,美国Bio-Rad公司产品。
1.4 SPA胶体金 按文献[2,4]制备,最后得到的纯化金标SPA经透射电镜观察金颗粒在15 nm左右[3,4]。
1.5 滴金测定装置 为一个4×3×0.6 cm的塑料扁盒,盖上有直径0.5 cm的圆孔,内装有硝酸纤维膜和吸水填料[3]。
2 方法
2.1 硝酸纤维膜的活化[5] 先用二乙烯砜和乙二胺使硝酸纤维膜上形成手臂和氨基,用Antoni报道的显色方法[6]对活化膜上氨基进行测定,以鉴定活化效果。然后再加入戊二醛在手臂上形成自由醛基(见图1)。
2.2 点样 在膜中央点加HIV多肽抗原0.2 g/L 2 μl,45℃,15 min。多肽与活化膜的活性基团反应过程见图2。
, 百拇医药
2.3 测定过程 参见文献[4]。
2.4 结果观察 5 min内若在膜上出现红色斑点为阳性,否则为阴性。
3 结果
3.1 纤维膜的选择及膜活化效果检测 经实验测试,Bio-Rad公司孔径0.45 μm的硝酸纤维膜的渗滤速度较满意,国产硝酸纤维膜均一性较差。膜活化后经Antoni显色法[6]检测活化效果良好。
3.2 封闭液的选择 点样后的膜分别用多种封闭液封闭,实验结果表明,pH 7.4,0.02 mol/L PBS(含10 g/L BSA、0.5%吐温-20)封闭效果最佳,阳性斑点清晰,背景几近白色。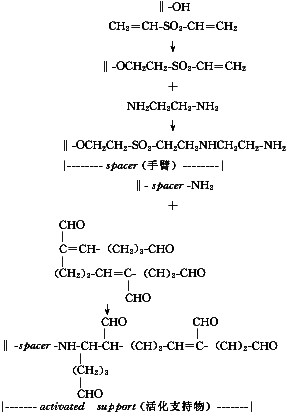
, 百拇医药 图1 硝酸纤维素膜的活化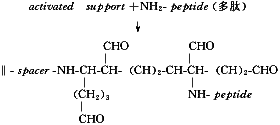
图2 活化膜与多肽联接
3.3 普通膜与活化膜的比较 普通膜通过摸索最佳点样浓度为2 g/L,活化膜最佳点样浓度为0.2 g/L。用这两种膜检测同一份阳性标本,结果在活化膜上血清稀释度最高可至1∶20仍为阳性,而普通膜仅为1∶5。
3.4 已点样的活化膜和SPA胶体金稳定性观察 已点样的活化膜和SPA胶体金置4℃保存,每隔一定时间取出检测一次,观察膜上抗原和SPA胶体金的稳定性。共观察6个月余,检测效果无改变。表明联接在硝酸纤维膜上多肽抗原和SPA胶体金在4℃至少可保存6个月。
3.5 方法的重复性观察 取HIV抗体阳性、阴性血清各3份,同一批试验各做5份。结果阳性标本全部阳性,阴性标本均阴性。将上述标本分批先后做4次实验,结果同前。
, 百拇医药
3.6 与ELISA的比较 用本法测定15份经Abbott抗HIV EIA试剂盒检测阳性的血清,结果全部阳性。另测定56份阴性血清,结果均为阴性。
4 讨论
本研究用化学交联的方法使多肽抗原直接联接在硝酸纤维膜上,该活化方法是丹麦学者于1990年首先报道[5]。其优点为,①避免了小肽抗原与载体(如牛血清白蛋白)联接步骤。小肽抗原不容易直接吸附在固相载体上,而且直接吸附会影响抗原与抗体反应,因此必须使其联接在一个较大分子上如BSA等,然后再吸附在固相载体上,才能更好地进行抗原抗体反应。但BSA往往会引起非特异性反应,导致实验结果不准确,通过化学交联可免去与BSA联接。②由于通过化学交联反应形成化学手臂,使多肽抗原能够在空间更好地暴露,减少了多肽抗原之间的空间位阻,使抗原能够更好的与抗体结合,增加了反应的灵敏度。③因为抗原与固相载体是化学交联结合在一起,其结合程度较普通的物理吸附更为牢固,因此为方法的稳定性提供了保证。④与普通的物理吸附方法相比较,化学交联减少了多肽抗原的包被量,提高了多肽抗原使用效率,降低了实验的成本,提高了检测灵敏度。
, 百拇医药
本研究建立的HIV抗体滴金免疫测定法,其特异性和敏感性已在临床初步试验中得到证实,经与美国E.Y公司金标HIV抗体试剂盒对比检测,结果有良好的一致性。本法不需任何仪器设备,操作简便、快速,可单份测定,受检病人可及时得到结果。
参考文献
[1]周文达,等.中华传染病杂志,1991;9(3):156
[2]Hayat M A.Colloidal gold-principles,Methods and Applications.Vol I,San Diego;Academic Press.1989,39
[3]徐霞、周文达,等.上海免疫学杂志,1996,16(3):158
[4]徐霞、周文达,等.临床检验杂志,1996,14(4):179
[5]Lauritzen E,et al.J Immunol Methods,1990,131:257
[6]Antoni G,et al.Anal Biochem,1983,129:60
(1998-05-25收稿), 百拇医药
单位:上海第二医科大学医学检验实验室,上海200025
关键词:HIV;多肽抗原;活化膜;SPA胶体金
临床检验杂志990313 本文比较了硝酸纤维膜的活化与不活化用于HIV抗体的滴金免疫测定,且对方法学进行了考核。
1 材料
1.1 HIV多肽抗原 本室制备[1]。
1.2 血清标本 15份HIV抗体阳性血清由澳大利亚皇家布里斯班医院、亚历山德拉公主医院及上海市卫生防疫站提供,56份正常人血清经Abbott anti-HIV EIA检测为阴性,由上海市卫生防疫站提供。
, 百拇医药
1.3 硝酸纤维膜 孔径0.45 μm,美国Bio-Rad公司产品。
1.4 SPA胶体金 按文献[2,4]制备,最后得到的纯化金标SPA经透射电镜观察金颗粒在15 nm左右[3,4]。
1.5 滴金测定装置 为一个4×3×0.6 cm的塑料扁盒,盖上有直径0.5 cm的圆孔,内装有硝酸纤维膜和吸水填料[3]。
2 方法
2.1 硝酸纤维膜的活化[5] 先用二乙烯砜和乙二胺使硝酸纤维膜上形成手臂和氨基,用Antoni报道的显色方法[6]对活化膜上氨基进行测定,以鉴定活化效果。然后再加入戊二醛在手臂上形成自由醛基(见图1)。
2.2 点样 在膜中央点加HIV多肽抗原0.2 g/L 2 μl,45℃,15 min。多肽与活化膜的活性基团反应过程见图2。
, 百拇医药
2.3 测定过程 参见文献[4]。
2.4 结果观察 5 min内若在膜上出现红色斑点为阳性,否则为阴性。
3 结果
3.1 纤维膜的选择及膜活化效果检测 经实验测试,Bio-Rad公司孔径0.45 μm的硝酸纤维膜的渗滤速度较满意,国产硝酸纤维膜均一性较差。膜活化后经Antoni显色法[6]检测活化效果良好。
3.2 封闭液的选择 点样后的膜分别用多种封闭液封闭,实验结果表明,pH 7.4,0.02 mol/L PBS(含10 g/L BSA、0.5%吐温-20)封闭效果最佳,阳性斑点清晰,背景几近白色。
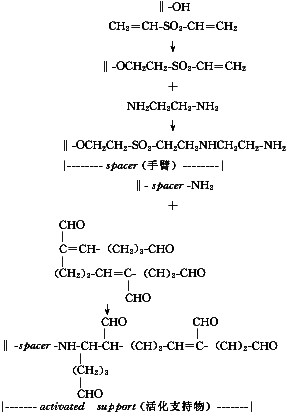
, 百拇医药 图1 硝酸纤维素膜的活化

图2 活化膜与多肽联接
3.3 普通膜与活化膜的比较 普通膜通过摸索最佳点样浓度为2 g/L,活化膜最佳点样浓度为0.2 g/L。用这两种膜检测同一份阳性标本,结果在活化膜上血清稀释度最高可至1∶20仍为阳性,而普通膜仅为1∶5。
3.4 已点样的活化膜和SPA胶体金稳定性观察 已点样的活化膜和SPA胶体金置4℃保存,每隔一定时间取出检测一次,观察膜上抗原和SPA胶体金的稳定性。共观察6个月余,检测效果无改变。表明联接在硝酸纤维膜上多肽抗原和SPA胶体金在4℃至少可保存6个月。
3.5 方法的重复性观察 取HIV抗体阳性、阴性血清各3份,同一批试验各做5份。结果阳性标本全部阳性,阴性标本均阴性。将上述标本分批先后做4次实验,结果同前。
, 百拇医药
3.6 与ELISA的比较 用本法测定15份经Abbott抗HIV EIA试剂盒检测阳性的血清,结果全部阳性。另测定56份阴性血清,结果均为阴性。
4 讨论
本研究用化学交联的方法使多肽抗原直接联接在硝酸纤维膜上,该活化方法是丹麦学者于1990年首先报道[5]。其优点为,①避免了小肽抗原与载体(如牛血清白蛋白)联接步骤。小肽抗原不容易直接吸附在固相载体上,而且直接吸附会影响抗原与抗体反应,因此必须使其联接在一个较大分子上如BSA等,然后再吸附在固相载体上,才能更好地进行抗原抗体反应。但BSA往往会引起非特异性反应,导致实验结果不准确,通过化学交联可免去与BSA联接。②由于通过化学交联反应形成化学手臂,使多肽抗原能够在空间更好地暴露,减少了多肽抗原之间的空间位阻,使抗原能够更好的与抗体结合,增加了反应的灵敏度。③因为抗原与固相载体是化学交联结合在一起,其结合程度较普通的物理吸附更为牢固,因此为方法的稳定性提供了保证。④与普通的物理吸附方法相比较,化学交联减少了多肽抗原的包被量,提高了多肽抗原使用效率,降低了实验的成本,提高了检测灵敏度。
, 百拇医药
本研究建立的HIV抗体滴金免疫测定法,其特异性和敏感性已在临床初步试验中得到证实,经与美国E.Y公司金标HIV抗体试剂盒对比检测,结果有良好的一致性。本法不需任何仪器设备,操作简便、快速,可单份测定,受检病人可及时得到结果。
参考文献
[1]周文达,等.中华传染病杂志,1991;9(3):156
[2]Hayat M A.Colloidal gold-principles,Methods and Applications.Vol I,San Diego;Academic Press.1989,39
[3]徐霞、周文达,等.上海免疫学杂志,1996,16(3):158
[4]徐霞、周文达,等.临床检验杂志,1996,14(4):179
[5]Lauritzen E,et al.J Immunol Methods,1990,131:257
[6]Antoni G,et al.Anal Biochem,1983,129:60
(1998-05-25收稿), 百拇医药