边缘前脑内重要升、降压区调节血压的机制
作者:顾蕴辉
单位:北京大学医学部生理学系, 北京 100083
关键词:边缘前脑;情绪;应激;升压区;降压区
生理科学进展000405 摘要 边缘前脑在调节情绪和应激反应、水和电解质平衡中起重要作用。这些活动都伴有心血管活动的变化。边缘前脑内很多升、降压区参与这些活动。近年来随着脑干各区调节血压机制研究的深入,边缘前脑调节血压机制的研究也有很大进展。本文综述了边缘前脑各升、降压区间,以及它们与脑干各区间的机能联系及参与的递质和受体。
学科分类号 R338
Mechanisms Underlying Effects of Pressor- and Depressor-Areas in Limbic Forebrain
, 百拇医药
GU (KU) Yun-Hui
(Department of Physiology, Health Science Center, Peking University, Beijing 100083)
Abstract The limbic forebrain plays an importent role in regulation of emotion and stress, water- and electrolyte-balance. All these activities are accompanied with changes of cardiovascular activities, and many pressor- and depressor- areas in the limbic forebrain are involved in regulating these activities. Recently, along with the studies on the mechanisms underlying cardiovascular effects of various areas in brainstem, studies on mechanisms underlying effects of pressor- and depressor-areas in forebrain have also made great progress. This review briefly introduces the relationships among cardiovascular centers in limbic forebrain, and the functional connections between these centers and brainstem areas, including the transmitters and receptors involved.
, 百拇医药
Key words Limbic forebrain; Emotion; Stress; Pressor area; Depressor area
边缘前脑内很多区参与情绪反应,水和电解质平衡失调引起的血流动力学变化。但迄今对边缘前脑调节血压的机制研究得比较少,主要因为:长期以来,脑干调节血压机制的研究由于各实验室所采用的不同方法和条件存在某些缺点和局限性,其结果很不一致。现经方法上的改进,脑干调节血压机制的研究已有很大的进展[1], 对前脑调节血压机制的研究也已进一步深入。现简要综述如下:
一、 边缘前脑升压区效应的机制
(一) 室旁核(nucleus paraventricularis, NPV) Sanchez等(1999)报道NPV内合成一氧化氮 (NO) 的神经元参与各种不同类型急性应激刺激引起的反应。谷氨酸(Glu)兴奋NPV可引起升压和增心率反应(常彦忠等.1992)。Glu兴奋NPV既可通过“大细胞区-垂体通路” 释放血管升压素(VP)入血(VP具有极强的缩血管作用)引起升压反应,还可通过“小细胞区-下丘脑以外脑脊髓通路”直接或间接兴奋交感-肾上腺髓质系统使血压升高、心率加快; Martin和Haywood (1992)的实验提示,后一种机制是主要的。 (二) 外侧下丘脑/穹窿周围区(lateral hypothalamus/perifornical region,LH/PF) Allen和Cechetto (1991) 观察到兴奋外侧下丘脑不同部位引起不同的心血管反应: 化学刺激LH/PF引起升压反应,而刺激结节- 和后- 外侧下丘脑区引起降压反应。Smith等(1990)指出LH/PF的神经元控制与情绪有关的心血管反应(包括肾血管收缩、血压和心率升高,以及肌肉血流增加等), 在情绪引起的血压、心率增加反应中起重要作用。刺激LH/PF引起的升压反应可被双侧延髓头端腹外侧区(RVL)内注射Glu阻断剂衰减(Sun等.1986;王益光等.1997a)。此外,我们的实验还曾显示LC (CRF-和SP -受体)-RVL (α-、β-、M-受体)、PAG (CRF-和SP-受体)-RVL(α-、β-受体)、NPB(CRF -受体)-RVL(α-受体)系统介导LH/PF-升压反应[2,3],心迷走中枢的抑制也参与此反应(王益光等.1997a)。1985年Mugnaini 和Oertel报道后外侧下丘脑区含丰富的GABA能神经元,占细胞总数的50%~90%,我们在该区注射荷包牡丹碱 (Bicu)能衰减Glu兴奋该区引起的减压反应,而且RVL内的α-、β-、M-受体及外周交感缩血管、心交感、心迷走神经也都介导该反应,从而提示后外侧下丘脑减压反应可能是由于GABA能中间神经元抑制了LH/PF所致(王益光等.1997b)。
, 百拇医药
(三) 背内侧和腹内侧核(nucleus dorsomedialis and nucleus ventromedialis, NDM和NVM)
Smith 等(1980)将未麻醉的狒狒束缚在椅中引起急性情绪性心血管反应,包括血压、心率、终末主动脉血流 (terminal aortic flow) 增加和肾血流双相减少,电解损毁下丘脑的一个关键区:包括LH的内侧部、腹内侧核的背外侧部,背内侧核的腹外侧部及插入这些结构之间的小细胞和纤维系统,可消除急性情绪性心血管反应,而运动、进食和压杠杆引起的心血管反应保留不变。本实验室近年来的实验结果表明:兴奋腹内侧核引起的升压反应是通过背内侧核作用于NPV和RVL实现的,各环节都有CRF和SP参与[4,5,10]。
(四)下丘脑后核(nucleus hypothalamus posterior, HP) HP是重要的升压区:无论电刺激(Juskevich 等.1978)或谷氨酸(Ohta 等.1985)兴奋HP都引起明显的血压升高、心率加快反应。1984年Winternitz等报道,它参与自发性高血压大鼠的发病过程,具有自发性、肾性或类固醇-盐(steroid-salt)性高血压的觉醒大鼠损毁HP后血压立即下降(Bunag等.1976)。
, 百拇医药
HP升压反应机制的研究显示: HP内胆碱能神经元,可直接(或间接通过LC)作用于RVL-交感兴奋神经元,引起升压反应。由于RVL有纤维投射至大鼠T4~T13的交感节前神经元,调节至肾上腺的交感输出(Strack 等. 1989),电刺激HP不仅使血压升高,还使肾上腺髓质分泌(Eferakeya, Bunag. 1974)。静脉注射不易通过血脑屏障的甲基阿托品阻断心迷走神经的作用后, HP的升压增心率反应基本不变,表明HP升压反应主要通过交感神经系统实现。
实验还显示HP和LC之间有双向机能联系,不仅HP部分通过LC实现其升压反应,LC升压反应也部分通过HP-RVL系统实现(常彦忠等.1992)。
(五)外侧隔腹外侧部 (lateral septum, SL)和缰核(Habenula, HB) De France (1976) 报道隔可能在整合情绪和自主性反应中起重要作用。乌拉坦麻醉大鼠电刺激外侧隔引起血压升高(Calaresu等. 1972)。我们实验室[6]观察到乌拉坦麻醉大鼠外侧隔腹外侧部内注入Glu也引起升压反应,并证明Gelsma和Calaresu (1987)将Glu注入外侧隔引起血压降低是由于他们所用Glu量过大,Glu溶液的高渗透压和高浓度对外侧隔神经元产生损伤作用所致。Pirola等(1980)在乌拉坦麻醉大鼠外侧隔内给予ACh引起交感神经系统介导的动脉血压升高与我们的实验结果一致。我们进一步的实验显示缰核-LC-RVL系统介导外侧隔腹外侧部升压反应,各联系环节都有M-受体参与[6]。
, 百拇医药
缰核是边缘前脑至脑干的重要驿站(Wang等.1977)。王绍实验室曾对刺激缰核引起的升压、增心率反应的机制进行了分析,他们曾报道LC、NPB和RVL参与缰核升压反应(高云玲等.1988;杨绍平等.1988)。我们实验室观察到[6] LC(M-受体)-RVL(M-受体)介导化学刺激缰核引起的升压反应; 静脉注射甲基阿托品对缰核升压反应无明显影响, 表明缰核升压反应主要通过交感神经系统实现。
以上实验结果表明:外侧隔腹外侧部-HB(M-受体)-LC(M-受体)-RVL(M-受体)交感兴奋系统可能是情绪引起高血压的脑内神经基础之一。
(六) 穹窿下器(subfornical organ, SFO) SFO, OVLT (organum vasculosum of lemina terminalis)和最后区(area postrema, AP)都属于脑室周围器,该处缺乏血脑屏障,是血管紧张素Ⅱ(AⅡ)起作用的中枢部位。椎动脉或脑室注射AⅡ的实验结果显示AⅡ的中枢升压效应通过三条途径实现:(1) 中枢性兴奋交感神经; (2) 抑制迷走中枢; (3) 促进血管升压素(VP)释放(Phillips. 1987)。
, 百拇医药
已证明脑内存在肾素-血管紧张素系统。AⅡ免疫反应性胞体在下列部位发现: NPV和视上核(SON)的大细胞部,室周器中发现胞体和纤维,延髓中胞体只在孤束核(NTS)中发现;而纤维则广泛分布于整个神经轴,包括脊髓 (Lind等. 1985)。双标记的研究显示SFO的AⅡ能纤维投射至NPV(Lind等.1984)。电刺激SFO可引起双相升压反应,该反应被损毁NPV衰减;实验还曾证明SFO双相升压反应中的初始短潜伏期、短持续时间成分是由交感激活引起的(Gutman等. 1985), 可能是由向延髓和脊髓投射的NPV小细胞区介导的;而第二相长潜伏期、长持续时间成分则可能(虽尚未证实)是通过NPV的大细胞区-神经垂体通路,使VP释放入血引起的。Bains等(1992)进一步证明NPV内微量注入AⅡ,可作用于AT1受体引起升压反应。我们实验室的研究显示:SFO内注入AⅡ引起的升压反应可被双侧NPV内或RVL内注入[Sar1, Thr8] ANG Ⅱ (ST-AⅡ, AⅡ拮抗剂)明显衰减, NPV内注入AⅡ引起的升压反应也可被RVL内注入ST-AⅡ削弱[7];双侧PAG用ST-AⅡ预处理后,AⅡ引起的NPV- 或SFO-升压反应也均明显减小[8], 从而证明:SFO的AⅡ能投射纤维作用于NPV的AⅡ能神经元,通过它们直接或间接(通过PAG)兴奋RVL-交感兴奋神经元而引起升压反应,SFO-NPV(AⅡ受体)-(RVL(AⅡ受体)升压系统是AⅡ中枢升压作用机制的重要组成部分。1994年Muratani等指出RVL内的AⅡ在自发性高血压大鼠发展高血压中起重要作用,但AⅡ的来源不明,上述工作证明它是由NPV的AⅡ能投射纤维末梢释放的,并提示SFO-NPV-RVL这一AⅡ系统活动的增强,可能即是自发性高血压大鼠发展高血压的神经生理基础。
, 百拇医药
(七) 中央杏仁核 (nucleus amygdaloideus centralis, AC) Amiragova (1985) 曾观察到长期情绪紧张可引起内分泌反应增强和血压升高反应的发展。一系列的资料提示AC在长期情绪紧张引起高血压的发病过程中起重要作用:如文献报道AC介导冲突行为(Shibata等.1986)及与恐惧有关的行为-自主性反应(Le Doux等. 1988) ,参与由伤害性刺激引起的情绪性,自主性和/或行为反应(Bernard等. 1990)以及听源性情绪反应(Iwata等.1986);胞体兴奋剂L-谷氨酸钠刺激中央杏仁核可引起血压升高(梁翌等.1995);高噪音环境也可以引起血压升高,损毁双侧AC可减弱血压升高的程度(Galeno等.1984);在自发性高血压大鼠(SHR)幼年血压尚未升高时损毁双侧AC,可抑制其成年后高血压的发展(Galeno等.1982)等。
形态学的研究显示AC的神经纤维投射到多个升压区: 包括蓝斑(Cedarbaum等.1978)、臂旁核(Moga等.1985)、 PAG (Rizvi等. 1991)、外侧下丘脑(Krettek等.1978)、下丘脑室旁核(Gray等. 1989)、NVM(李中坤等.1990)。大鼠AC内含10多种免疫反应性神经元,其中CRF和SP免疫反应性神经元可能与AC升压反应关系最大。我们实验室在上述形态学研究的基础上进行Glu兴奋AC引起升压反应的机制分析,实验显示: (1)上述AC投射区内注入CRF或SP均能引起升压反应[9,10];(2) AC可直接通过LC(CRF-和SP-受体 )-RVL系统、NPB(CRF- 和SP- 受体)-RVL系统、PAG(CRF-和SP-受体)-RVL系统,并间接通过LH/PF(CRF-和SP-受体)与LC-RVL、NPB-RVL 、PAG-RVL系统的联系,使交感神经系统(包括交感缩血管神经和心交感神经)兴奋而引起升压反应[2,11],室旁核及其内的CRF-受体[2]和SP-受体(梁翌等.1995)也参与此升压反应;(3) AC还可通过NVM-NDM作用于NPV和RVL引起升压反应,各环节也均有CRF- 和 SP-受体参与[2,4,5,9~11]。但AC升压反应是否部分由NPV通过后垂体释放血管升压素(VP)入血实现,还有待进一步研究证实。因为Poter和Brody(1985)曾报道外周VP-受体被阻断后并不影响电刺激NPV引起的升压反应。
, 百拇医药
(八) 岛皮层 (insular cortex, INS) 岛皮层也参与情绪反应(Kolb.1984),且有纤维投射至AC (Kapp等.1985), 兴奋岛皮层引起血压升高[12,13], 血浆和器官中去甲肾上腺素增加(Oppenheimer等.1992)。我们的实验显示岛皮层依次兴奋中央杏仁核(Glu受体)和LH/PF(SP-受体)[13],通过它们与脑干升压系统的联系使交感缩血管神经活动增加而实现其升压反应(心交感和心迷走神经不起重要作用[12]),下丘脑室旁核(SP受体)也参与此反应[13]。鉴于岛皮层、AC和LH/PF都参与情绪反应,它们兴奋时都引起升压反应,三者间又有上述机能联系,提示边缘前脑内的INS-AC-LH/PF系统可能是情绪引起高血压的神经生理基础之重要组成部分。
二、边缘前脑降压区效应的机制
(一) AV3V区(Anteroventral third ventricle region) AV3V区是脑内心房肽免疫反应性胞体最集中的部位(Standaert 等. 1986),现认为AV3V和心房肽均参与血压和水盐平衡的调节 (Brody 等.1980)。过去曾因为损毁AV3V区能阻止肾性高血压、类固醇-盐性和自发性高血压的发展,认为该区在数种实验性高血压模型的高血压发展和维持中起重要作用(Brody 等. 1978); 但有一些研究提示富有心房肽免疫反应性神经元的AV3V区兴奋时可能产生降压反应。因此我们实验室用Glu兴奋AV3V区检验其效应,实验证明Glu兴奋AV3V引起降压反应(心率不变),该反应可被双侧NPV内注射心房肽Ⅲ抗血清和静脉注射甲基阿托品衰减,表明AV3V-降压反应是由其内的心房肽免疫反应性神经元实现,由NPV介导的,迷走中枢兴奋也参与此反应[14]。自发性高血压大鼠SFO内心房肽(6-33)结合部位的数目及亲和力降低(Saavedra 等.1986),提示脑内心房肽系统的活动降低可能是高血压发展的机理之一。
, http://www.100md.com
Hartle等(1982)的实验曾提示: 源于腹侧AV3V区的AⅡ-升压通路沿终板(lamina terminalis)上行至前联合水平,然后下行通过前下丘脑。看来过去观察到损毁AV3V区能阻止数类实验性高血压模型发展高血压可能是由于损毁了此AⅡ升压通路所致。
有趣的是AV3V区与下丘脑前核(NHA)前后紧相邻接,均参与调节血压和水盐平衡,又都富有心房肽样免疫反应性神经元;但Glu兴奋前者引起减压反应, Glu兴奋后者引起升压反应。我们进行了分析,证明NHA内的心房肽样免疫性神经元投射纤维末梢释放的心房肽Ⅲ可抑制AV3V的心房肽样免疫反应性神经元,从而使NPV神经元脱抑制而产生升压反应(顾蕴辉等.1996)。
(二) 弓状核(nucleus arcuatus, AR) 脑内存在二群β-内啡肽(β-EP)能神经元,一群在AR (Bloom等. 1978), 另一群在孤束核(Joseph等.1983)。AR (Mezey等. 1987)和NTS (Ross等. 1985)都有纤维投射至RVL。文献曾报道β-EP在失血性休克 (Faden 等. 1978)和中毒性休克(Holaday等.1978)引起的低血压中起重要作用。我们实验室曾证明(初志国等.1991) Glu兴奋该二核团均可引起降压反应,还分析了其中枢机制:实验显示RVL后区内分别注射纳洛酮(Nx)或β-EP抗血清均可明显衰减AR- 和NTS-降压反应,表明AR和NTS的β-EP能神经元均可直接抑制RVL-交感兴奋神经元而起降压作用。鉴于AR的β-EP能神经元也投射至NTS (Mezey等.1987), NTS内注射β-EP可引起降压反应,此反应被该核团内注射Nx或β-EP抗血清衰减 (Patty 等.1982), 看来AR降压反应部分通过NTS-RVL系统实现。
, 百拇医药
本实验室系列研究显示上述各升压、降压核团的机能联系如附图所示。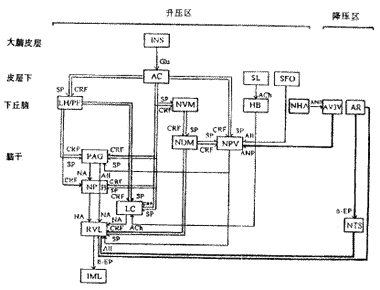
附图 边缘前脑内重要升压、降压区与脑干内升压、降压区间的机能联系
INS:岛皮层, AC:中央杏仁核, SL:外侧隔, SFO:穹窿下器, LH/PF:外侧下丘脑/穹窿周围区, NVM:腹内侧核, NDM:背内侧核, NPV:室旁核, HB:缰核, NHA:下丘脑前核, AV3V:第三脑室前腹侧区, AR:弓状核, PAG:中脑导水管周围灰质, NPB:臂旁核, LC:蓝斑, RVL:延髓头端腹外侧区, NTS:孤束核, IML:脊髓的中间外侧柱
综上所述,边缘前脑内存在很多升压区,绝大多数参与情绪和应激反应: INS可通过AC广泛与其它参与情绪和应激的核团联系,最终激活NPV和RVL使VP分泌和交感神经系统兴奋,这可能就是长期情绪紧张引起高血压的神经生理基础。SFO-NPV(AⅡ受体)-RVL(AⅡ受体)系统则是AⅡ中枢升压作用机制的重要组成部分,该系统活动增加可能是自发性高血压大鼠发展高血压的重要因素。前脑内AV3V的心房肽能神经元可对抗AⅡ的中枢升压作用和VP的释放,参与血压和水盐平衡的调节;至于AR-NTS-RVL系统,则是在应激情况下被激活(Arrigo-Reina等.1980; Millan等.1981),与应激情况下的升压反应相抗衡的系统; 该二系统活动的降低可能也是自发性高血压发展的因素。由此可见,边缘前脑内心血管调节和水盐平衡调节机能失调与高血压的发展密切相关。
, 百拇医药
国家自然科学基金(39170899)及卫生部科研基金(91501354)资助课题
参考文献
1,顾蕴辉. 脑干升压和降压区调节血压的中枢机制及其与延髓头端腹外侧 区的机能联系.生理科学进展, 1994, 25∶ 205~211.
2,李利生, 顾蕴辉, 谭璐, 等.CRF在谷氨酸兴奋中央杏仁核引起的升压反应中之作用. 中国应用生理学杂志, 1998, 14∶ 193~197.
3,王益光,顾蕴辉,吕贻春,等. P物质在谷氨酸兴奋外侧下丘脑-穹窿周围区引起的升压反应中之作用. 中国应用生理学杂志, 1997, 13∶ 337~341.
4,丁欣, 吴金胜, 顾蕴辉,等. 谷氨酸注入下丘脑的背内侧核引起升压反应的机制. 北京医科大学学报, 1999, 31∶ 124~126.
, http://www.100md.com
5,吴金胜,顾蕴辉.促肾上腺皮质激素释放因子在腹内侧核升压反应中的作用. 北京医科大学学报, 1999, 31(2) 增刊∶ 93~94.
6,Zou CJ, Ku YH. Functional connections between the pressor responses induced by glutamate injection into habenula and lateral septum.Chin J Physiol Sci, 1992, 8∶ 300~308.
7,Ku YH, Jia YF, Chang YZ. Mechanisms underlying pressor response of subfornical organ to angiotensin Ⅱ. Peptides, 1999, 20∶ 171~176.
8,常彦忠, 顾蕴辉. 脑内血管紧张素Ⅱ系统在穹窿下器升压反应中的作用. 生理学报, 1999, 51∶ 38~43.
, http://www.100md.com
9,Ku YH, Tan L, Li LS, et al. Role of corticotropin releasing factor and substance P in pressor responses of nuclei controlling emotion and stress. Peptides, 1998, 19∶ 677~682.
10,Wu JS, Ku YH, Li LS, et al. Corticotropin releasing factor and substance P mediate the nucleus amygdaloideus centralis - nucleus ventromedialis
-nucleus dorsomedialis pressor system. Brain Res, 1999, 842∶ 392~398.
11,吕贻春, 顾蕴辉, 梁翌,等.脑内P物质在谷氨酸兴奋中央杏仁核引起的升压反应中的作用. 生理学报, 1997, 49∶419~426.
12,徐伟科, 顾蕴辉.延髓头端腹外侧区-交感缩血管神经系统介导岛皮层升压反应. 生理学报, 1994, 46∶ 591~596.
13,顾蕴辉, 徐伟科, 吕贻春, 等. 中央杏仁核,外侧下丘脑/穹窿周围区, 室旁核均参与岛皮层升压反应. 生理学报, 1997, 49∶ 221~226.
14,Ku YH, Zhang T. Brain atriopeptin mediates AV3V-depressor response. Peptides, 1994, 15∶ 1053~1056., http://www.100md.com
单位:北京大学医学部生理学系, 北京 100083
关键词:边缘前脑;情绪;应激;升压区;降压区
生理科学进展000405 摘要 边缘前脑在调节情绪和应激反应、水和电解质平衡中起重要作用。这些活动都伴有心血管活动的变化。边缘前脑内很多升、降压区参与这些活动。近年来随着脑干各区调节血压机制研究的深入,边缘前脑调节血压机制的研究也有很大进展。本文综述了边缘前脑各升、降压区间,以及它们与脑干各区间的机能联系及参与的递质和受体。
学科分类号 R338
Mechanisms Underlying Effects of Pressor- and Depressor-Areas in Limbic Forebrain
, 百拇医药
GU (KU) Yun-Hui
(Department of Physiology, Health Science Center, Peking University, Beijing 100083)
Abstract The limbic forebrain plays an importent role in regulation of emotion and stress, water- and electrolyte-balance. All these activities are accompanied with changes of cardiovascular activities, and many pressor- and depressor- areas in the limbic forebrain are involved in regulating these activities. Recently, along with the studies on the mechanisms underlying cardiovascular effects of various areas in brainstem, studies on mechanisms underlying effects of pressor- and depressor-areas in forebrain have also made great progress. This review briefly introduces the relationships among cardiovascular centers in limbic forebrain, and the functional connections between these centers and brainstem areas, including the transmitters and receptors involved.
, 百拇医药
Key words Limbic forebrain; Emotion; Stress; Pressor area; Depressor area
边缘前脑内很多区参与情绪反应,水和电解质平衡失调引起的血流动力学变化。但迄今对边缘前脑调节血压的机制研究得比较少,主要因为:长期以来,脑干调节血压机制的研究由于各实验室所采用的不同方法和条件存在某些缺点和局限性,其结果很不一致。现经方法上的改进,脑干调节血压机制的研究已有很大的进展[1], 对前脑调节血压机制的研究也已进一步深入。现简要综述如下:
一、 边缘前脑升压区效应的机制
(一) 室旁核(nucleus paraventricularis, NPV) Sanchez等(1999)报道NPV内合成一氧化氮 (NO) 的神经元参与各种不同类型急性应激刺激引起的反应。谷氨酸(Glu)兴奋NPV可引起升压和增心率反应(常彦忠等.1992)。Glu兴奋NPV既可通过“大细胞区-垂体通路” 释放血管升压素(VP)入血(VP具有极强的缩血管作用)引起升压反应,还可通过“小细胞区-下丘脑以外脑脊髓通路”直接或间接兴奋交感-肾上腺髓质系统使血压升高、心率加快; Martin和Haywood (1992)的实验提示,后一种机制是主要的。 (二) 外侧下丘脑/穹窿周围区(lateral hypothalamus/perifornical region,LH/PF) Allen和Cechetto (1991) 观察到兴奋外侧下丘脑不同部位引起不同的心血管反应: 化学刺激LH/PF引起升压反应,而刺激结节- 和后- 外侧下丘脑区引起降压反应。Smith等(1990)指出LH/PF的神经元控制与情绪有关的心血管反应(包括肾血管收缩、血压和心率升高,以及肌肉血流增加等), 在情绪引起的血压、心率增加反应中起重要作用。刺激LH/PF引起的升压反应可被双侧延髓头端腹外侧区(RVL)内注射Glu阻断剂衰减(Sun等.1986;王益光等.1997a)。此外,我们的实验还曾显示LC (CRF-和SP -受体)-RVL (α-、β-、M-受体)、PAG (CRF-和SP-受体)-RVL(α-、β-受体)、NPB(CRF -受体)-RVL(α-受体)系统介导LH/PF-升压反应[2,3],心迷走中枢的抑制也参与此反应(王益光等.1997a)。1985年Mugnaini 和Oertel报道后外侧下丘脑区含丰富的GABA能神经元,占细胞总数的50%~90%,我们在该区注射荷包牡丹碱 (Bicu)能衰减Glu兴奋该区引起的减压反应,而且RVL内的α-、β-、M-受体及外周交感缩血管、心交感、心迷走神经也都介导该反应,从而提示后外侧下丘脑减压反应可能是由于GABA能中间神经元抑制了LH/PF所致(王益光等.1997b)。
, 百拇医药
(三) 背内侧和腹内侧核(nucleus dorsomedialis and nucleus ventromedialis, NDM和NVM)
Smith 等(1980)将未麻醉的狒狒束缚在椅中引起急性情绪性心血管反应,包括血压、心率、终末主动脉血流 (terminal aortic flow) 增加和肾血流双相减少,电解损毁下丘脑的一个关键区:包括LH的内侧部、腹内侧核的背外侧部,背内侧核的腹外侧部及插入这些结构之间的小细胞和纤维系统,可消除急性情绪性心血管反应,而运动、进食和压杠杆引起的心血管反应保留不变。本实验室近年来的实验结果表明:兴奋腹内侧核引起的升压反应是通过背内侧核作用于NPV和RVL实现的,各环节都有CRF和SP参与[4,5,10]。
(四)下丘脑后核(nucleus hypothalamus posterior, HP) HP是重要的升压区:无论电刺激(Juskevich 等.1978)或谷氨酸(Ohta 等.1985)兴奋HP都引起明显的血压升高、心率加快反应。1984年Winternitz等报道,它参与自发性高血压大鼠的发病过程,具有自发性、肾性或类固醇-盐(steroid-salt)性高血压的觉醒大鼠损毁HP后血压立即下降(Bunag等.1976)。
, 百拇医药
HP升压反应机制的研究显示: HP内胆碱能神经元,可直接(或间接通过LC)作用于RVL-交感兴奋神经元,引起升压反应。由于RVL有纤维投射至大鼠T4~T13的交感节前神经元,调节至肾上腺的交感输出(Strack 等. 1989),电刺激HP不仅使血压升高,还使肾上腺髓质分泌(Eferakeya, Bunag. 1974)。静脉注射不易通过血脑屏障的甲基阿托品阻断心迷走神经的作用后, HP的升压增心率反应基本不变,表明HP升压反应主要通过交感神经系统实现。
实验还显示HP和LC之间有双向机能联系,不仅HP部分通过LC实现其升压反应,LC升压反应也部分通过HP-RVL系统实现(常彦忠等.1992)。
(五)外侧隔腹外侧部 (lateral septum, SL)和缰核(Habenula, HB) De France (1976) 报道隔可能在整合情绪和自主性反应中起重要作用。乌拉坦麻醉大鼠电刺激外侧隔引起血压升高(Calaresu等. 1972)。我们实验室[6]观察到乌拉坦麻醉大鼠外侧隔腹外侧部内注入Glu也引起升压反应,并证明Gelsma和Calaresu (1987)将Glu注入外侧隔引起血压降低是由于他们所用Glu量过大,Glu溶液的高渗透压和高浓度对外侧隔神经元产生损伤作用所致。Pirola等(1980)在乌拉坦麻醉大鼠外侧隔内给予ACh引起交感神经系统介导的动脉血压升高与我们的实验结果一致。我们进一步的实验显示缰核-LC-RVL系统介导外侧隔腹外侧部升压反应,各联系环节都有M-受体参与[6]。
, 百拇医药
缰核是边缘前脑至脑干的重要驿站(Wang等.1977)。王绍实验室曾对刺激缰核引起的升压、增心率反应的机制进行了分析,他们曾报道LC、NPB和RVL参与缰核升压反应(高云玲等.1988;杨绍平等.1988)。我们实验室观察到[6] LC(M-受体)-RVL(M-受体)介导化学刺激缰核引起的升压反应; 静脉注射甲基阿托品对缰核升压反应无明显影响, 表明缰核升压反应主要通过交感神经系统实现。
以上实验结果表明:外侧隔腹外侧部-HB(M-受体)-LC(M-受体)-RVL(M-受体)交感兴奋系统可能是情绪引起高血压的脑内神经基础之一。
(六) 穹窿下器(subfornical organ, SFO) SFO, OVLT (organum vasculosum of lemina terminalis)和最后区(area postrema, AP)都属于脑室周围器,该处缺乏血脑屏障,是血管紧张素Ⅱ(AⅡ)起作用的中枢部位。椎动脉或脑室注射AⅡ的实验结果显示AⅡ的中枢升压效应通过三条途径实现:(1) 中枢性兴奋交感神经; (2) 抑制迷走中枢; (3) 促进血管升压素(VP)释放(Phillips. 1987)。
, 百拇医药
已证明脑内存在肾素-血管紧张素系统。AⅡ免疫反应性胞体在下列部位发现: NPV和视上核(SON)的大细胞部,室周器中发现胞体和纤维,延髓中胞体只在孤束核(NTS)中发现;而纤维则广泛分布于整个神经轴,包括脊髓 (Lind等. 1985)。双标记的研究显示SFO的AⅡ能纤维投射至NPV(Lind等.1984)。电刺激SFO可引起双相升压反应,该反应被损毁NPV衰减;实验还曾证明SFO双相升压反应中的初始短潜伏期、短持续时间成分是由交感激活引起的(Gutman等. 1985), 可能是由向延髓和脊髓投射的NPV小细胞区介导的;而第二相长潜伏期、长持续时间成分则可能(虽尚未证实)是通过NPV的大细胞区-神经垂体通路,使VP释放入血引起的。Bains等(1992)进一步证明NPV内微量注入AⅡ,可作用于AT1受体引起升压反应。我们实验室的研究显示:SFO内注入AⅡ引起的升压反应可被双侧NPV内或RVL内注入[Sar1, Thr8] ANG Ⅱ (ST-AⅡ, AⅡ拮抗剂)明显衰减, NPV内注入AⅡ引起的升压反应也可被RVL内注入ST-AⅡ削弱[7];双侧PAG用ST-AⅡ预处理后,AⅡ引起的NPV- 或SFO-升压反应也均明显减小[8], 从而证明:SFO的AⅡ能投射纤维作用于NPV的AⅡ能神经元,通过它们直接或间接(通过PAG)兴奋RVL-交感兴奋神经元而引起升压反应,SFO-NPV(AⅡ受体)-(RVL(AⅡ受体)升压系统是AⅡ中枢升压作用机制的重要组成部分。1994年Muratani等指出RVL内的AⅡ在自发性高血压大鼠发展高血压中起重要作用,但AⅡ的来源不明,上述工作证明它是由NPV的AⅡ能投射纤维末梢释放的,并提示SFO-NPV-RVL这一AⅡ系统活动的增强,可能即是自发性高血压大鼠发展高血压的神经生理基础。
, 百拇医药
(七) 中央杏仁核 (nucleus amygdaloideus centralis, AC) Amiragova (1985) 曾观察到长期情绪紧张可引起内分泌反应增强和血压升高反应的发展。一系列的资料提示AC在长期情绪紧张引起高血压的发病过程中起重要作用:如文献报道AC介导冲突行为(Shibata等.1986)及与恐惧有关的行为-自主性反应(Le Doux等. 1988) ,参与由伤害性刺激引起的情绪性,自主性和/或行为反应(Bernard等. 1990)以及听源性情绪反应(Iwata等.1986);胞体兴奋剂L-谷氨酸钠刺激中央杏仁核可引起血压升高(梁翌等.1995);高噪音环境也可以引起血压升高,损毁双侧AC可减弱血压升高的程度(Galeno等.1984);在自发性高血压大鼠(SHR)幼年血压尚未升高时损毁双侧AC,可抑制其成年后高血压的发展(Galeno等.1982)等。
形态学的研究显示AC的神经纤维投射到多个升压区: 包括蓝斑(Cedarbaum等.1978)、臂旁核(Moga等.1985)、 PAG (Rizvi等. 1991)、外侧下丘脑(Krettek等.1978)、下丘脑室旁核(Gray等. 1989)、NVM(李中坤等.1990)。大鼠AC内含10多种免疫反应性神经元,其中CRF和SP免疫反应性神经元可能与AC升压反应关系最大。我们实验室在上述形态学研究的基础上进行Glu兴奋AC引起升压反应的机制分析,实验显示: (1)上述AC投射区内注入CRF或SP均能引起升压反应[9,10];(2) AC可直接通过LC(CRF-和SP-受体 )-RVL系统、NPB(CRF- 和SP- 受体)-RVL系统、PAG(CRF-和SP-受体)-RVL系统,并间接通过LH/PF(CRF-和SP-受体)与LC-RVL、NPB-RVL 、PAG-RVL系统的联系,使交感神经系统(包括交感缩血管神经和心交感神经)兴奋而引起升压反应[2,11],室旁核及其内的CRF-受体[2]和SP-受体(梁翌等.1995)也参与此升压反应;(3) AC还可通过NVM-NDM作用于NPV和RVL引起升压反应,各环节也均有CRF- 和 SP-受体参与[2,4,5,9~11]。但AC升压反应是否部分由NPV通过后垂体释放血管升压素(VP)入血实现,还有待进一步研究证实。因为Poter和Brody(1985)曾报道外周VP-受体被阻断后并不影响电刺激NPV引起的升压反应。
, 百拇医药
(八) 岛皮层 (insular cortex, INS) 岛皮层也参与情绪反应(Kolb.1984),且有纤维投射至AC (Kapp等.1985), 兴奋岛皮层引起血压升高[12,13], 血浆和器官中去甲肾上腺素增加(Oppenheimer等.1992)。我们的实验显示岛皮层依次兴奋中央杏仁核(Glu受体)和LH/PF(SP-受体)[13],通过它们与脑干升压系统的联系使交感缩血管神经活动增加而实现其升压反应(心交感和心迷走神经不起重要作用[12]),下丘脑室旁核(SP受体)也参与此反应[13]。鉴于岛皮层、AC和LH/PF都参与情绪反应,它们兴奋时都引起升压反应,三者间又有上述机能联系,提示边缘前脑内的INS-AC-LH/PF系统可能是情绪引起高血压的神经生理基础之重要组成部分。
二、边缘前脑降压区效应的机制
(一) AV3V区(Anteroventral third ventricle region) AV3V区是脑内心房肽免疫反应性胞体最集中的部位(Standaert 等. 1986),现认为AV3V和心房肽均参与血压和水盐平衡的调节 (Brody 等.1980)。过去曾因为损毁AV3V区能阻止肾性高血压、类固醇-盐性和自发性高血压的发展,认为该区在数种实验性高血压模型的高血压发展和维持中起重要作用(Brody 等. 1978); 但有一些研究提示富有心房肽免疫反应性神经元的AV3V区兴奋时可能产生降压反应。因此我们实验室用Glu兴奋AV3V区检验其效应,实验证明Glu兴奋AV3V引起降压反应(心率不变),该反应可被双侧NPV内注射心房肽Ⅲ抗血清和静脉注射甲基阿托品衰减,表明AV3V-降压反应是由其内的心房肽免疫反应性神经元实现,由NPV介导的,迷走中枢兴奋也参与此反应[14]。自发性高血压大鼠SFO内心房肽(6-33)结合部位的数目及亲和力降低(Saavedra 等.1986),提示脑内心房肽系统的活动降低可能是高血压发展的机理之一。
, http://www.100md.com
Hartle等(1982)的实验曾提示: 源于腹侧AV3V区的AⅡ-升压通路沿终板(lamina terminalis)上行至前联合水平,然后下行通过前下丘脑。看来过去观察到损毁AV3V区能阻止数类实验性高血压模型发展高血压可能是由于损毁了此AⅡ升压通路所致。
有趣的是AV3V区与下丘脑前核(NHA)前后紧相邻接,均参与调节血压和水盐平衡,又都富有心房肽样免疫反应性神经元;但Glu兴奋前者引起减压反应, Glu兴奋后者引起升压反应。我们进行了分析,证明NHA内的心房肽样免疫性神经元投射纤维末梢释放的心房肽Ⅲ可抑制AV3V的心房肽样免疫反应性神经元,从而使NPV神经元脱抑制而产生升压反应(顾蕴辉等.1996)。
(二) 弓状核(nucleus arcuatus, AR) 脑内存在二群β-内啡肽(β-EP)能神经元,一群在AR (Bloom等. 1978), 另一群在孤束核(Joseph等.1983)。AR (Mezey等. 1987)和NTS (Ross等. 1985)都有纤维投射至RVL。文献曾报道β-EP在失血性休克 (Faden 等. 1978)和中毒性休克(Holaday等.1978)引起的低血压中起重要作用。我们实验室曾证明(初志国等.1991) Glu兴奋该二核团均可引起降压反应,还分析了其中枢机制:实验显示RVL后区内分别注射纳洛酮(Nx)或β-EP抗血清均可明显衰减AR- 和NTS-降压反应,表明AR和NTS的β-EP能神经元均可直接抑制RVL-交感兴奋神经元而起降压作用。鉴于AR的β-EP能神经元也投射至NTS (Mezey等.1987), NTS内注射β-EP可引起降压反应,此反应被该核团内注射Nx或β-EP抗血清衰减 (Patty 等.1982), 看来AR降压反应部分通过NTS-RVL系统实现。
, 百拇医药
本实验室系列研究显示上述各升压、降压核团的机能联系如附图所示。

附图 边缘前脑内重要升压、降压区与脑干内升压、降压区间的机能联系
INS:岛皮层, AC:中央杏仁核, SL:外侧隔, SFO:穹窿下器, LH/PF:外侧下丘脑/穹窿周围区, NVM:腹内侧核, NDM:背内侧核, NPV:室旁核, HB:缰核, NHA:下丘脑前核, AV3V:第三脑室前腹侧区, AR:弓状核, PAG:中脑导水管周围灰质, NPB:臂旁核, LC:蓝斑, RVL:延髓头端腹外侧区, NTS:孤束核, IML:脊髓的中间外侧柱
综上所述,边缘前脑内存在很多升压区,绝大多数参与情绪和应激反应: INS可通过AC广泛与其它参与情绪和应激的核团联系,最终激活NPV和RVL使VP分泌和交感神经系统兴奋,这可能就是长期情绪紧张引起高血压的神经生理基础。SFO-NPV(AⅡ受体)-RVL(AⅡ受体)系统则是AⅡ中枢升压作用机制的重要组成部分,该系统活动增加可能是自发性高血压大鼠发展高血压的重要因素。前脑内AV3V的心房肽能神经元可对抗AⅡ的中枢升压作用和VP的释放,参与血压和水盐平衡的调节;至于AR-NTS-RVL系统,则是在应激情况下被激活(Arrigo-Reina等.1980; Millan等.1981),与应激情况下的升压反应相抗衡的系统; 该二系统活动的降低可能也是自发性高血压发展的因素。由此可见,边缘前脑内心血管调节和水盐平衡调节机能失调与高血压的发展密切相关。
, 百拇医药
国家自然科学基金(39170899)及卫生部科研基金(91501354)资助课题
参考文献
1,顾蕴辉. 脑干升压和降压区调节血压的中枢机制及其与延髓头端腹外侧 区的机能联系.生理科学进展, 1994, 25∶ 205~211.
2,李利生, 顾蕴辉, 谭璐, 等.CRF在谷氨酸兴奋中央杏仁核引起的升压反应中之作用. 中国应用生理学杂志, 1998, 14∶ 193~197.
3,王益光,顾蕴辉,吕贻春,等. P物质在谷氨酸兴奋外侧下丘脑-穹窿周围区引起的升压反应中之作用. 中国应用生理学杂志, 1997, 13∶ 337~341.
4,丁欣, 吴金胜, 顾蕴辉,等. 谷氨酸注入下丘脑的背内侧核引起升压反应的机制. 北京医科大学学报, 1999, 31∶ 124~126.
, http://www.100md.com
5,吴金胜,顾蕴辉.促肾上腺皮质激素释放因子在腹内侧核升压反应中的作用. 北京医科大学学报, 1999, 31(2) 增刊∶ 93~94.
6,Zou CJ, Ku YH. Functional connections between the pressor responses induced by glutamate injection into habenula and lateral septum.Chin J Physiol Sci, 1992, 8∶ 300~308.
7,Ku YH, Jia YF, Chang YZ. Mechanisms underlying pressor response of subfornical organ to angiotensin Ⅱ. Peptides, 1999, 20∶ 171~176.
8,常彦忠, 顾蕴辉. 脑内血管紧张素Ⅱ系统在穹窿下器升压反应中的作用. 生理学报, 1999, 51∶ 38~43.
, http://www.100md.com
9,Ku YH, Tan L, Li LS, et al. Role of corticotropin releasing factor and substance P in pressor responses of nuclei controlling emotion and stress. Peptides, 1998, 19∶ 677~682.
10,Wu JS, Ku YH, Li LS, et al. Corticotropin releasing factor and substance P mediate the nucleus amygdaloideus centralis - nucleus ventromedialis
-nucleus dorsomedialis pressor system. Brain Res, 1999, 842∶ 392~398.
11,吕贻春, 顾蕴辉, 梁翌,等.脑内P物质在谷氨酸兴奋中央杏仁核引起的升压反应中的作用. 生理学报, 1997, 49∶419~426.
12,徐伟科, 顾蕴辉.延髓头端腹外侧区-交感缩血管神经系统介导岛皮层升压反应. 生理学报, 1994, 46∶ 591~596.
13,顾蕴辉, 徐伟科, 吕贻春, 等. 中央杏仁核,外侧下丘脑/穹窿周围区, 室旁核均参与岛皮层升压反应. 生理学报, 1997, 49∶ 221~226.
14,Ku YH, Zhang T. Brain atriopeptin mediates AV3V-depressor response. Peptides, 1994, 15∶ 1053~1056., http://www.100md.com