β内啡肽对慢性缺氧大鼠呼吸的影响
作者:许欣 李强 孙学军 张世明 张殿尧 王成海
单位:200433 上海,第二军医大学附属长海医院呼吸内科(许欣现在解放军第一○七医院呼吸内科264002),神经生物教研室(孙学军、王成海)
关键词:β内啡肽;缺氧症;大鼠;呼吸
New Page 2 【摘要】 目的 探讨β内啡肽(β-EP)在慢性缺氧大鼠呼吸调控中的作用。方法 采用放射免疫法测定慢性缺氧大鼠模型血浆及延髓、桥脑、下丘脑、中央灰质等神经核团中β-EP的含量变化,以及不同给药途径给予外源性β-EP对慢性缺氧大鼠呼吸功能的影响。正常大鼠侧脑室注射β-EP后,观察记录呼吸频率(RR);102只慢性缺氧大鼠随机分为:(1)静脉组36只,分别给予阿片受体拮抗剂纳洛酮(NLX)和不同剂量β-EP,记录RR和潮气量(VT);(2)侧脑室组48只,微量注射NLX、β-EP,测定RR、VT及血气指标;(3)孤束核组18只,分别注射β-EP和人工脑脊液(ACSF),测定RR和VT。结果慢性缺氧模型延髓、桥脑、下丘脑、中央灰质和血浆β-EP的含量较对照组均显著升高(P<0.01)。给正常大鼠侧脑室注射β-EP后,RR显著下降(P<0.05)。慢性缺氧大鼠静脉给予不同剂量β-EP和NLX后,RR和VT变化差异无显著性(P>0.05)。侧脑室注射NLX后,RR显著增高(P<0.05)。侧脑室及孤束核注射β-EP后显著降低RR、VT。侧脑室注射NLX 30分钟时MV/PaCO2较对照组显著升高(t=2.76,P<0.05),侧脑室注射β-EP 30分钟时MV/PaCO2较对照组显著降低(t=4.01,P<0.01)。结论 慢性缺氧可造成机体中枢及外周血β-EP含量显著升高,通过中枢途径给予β-EP后显著抑制慢性缺氧模型的呼吸功能。
, http://www.100md.com
Respiratory effects of beta-endorphin in chronic hypoxic rats
XU Xin, LI Qiang, SUN Xuejun, et al.
Department of Respiratory Diseases, Changhai Hospital, Shanghai 200433
【Abstract】 Objective To assess the role of β-EP in the physiological and pathophysiological process of respiratory regulation in chronic hypoxic rats. Methods The chronic hypoxic rat model was established by intravenous injections of papain 6 times, once a week. The concentration of β-endorphin in medulla, pons, hypothalamus, central gray and plasma of chronic hypoxic rats were measured by radioimmunoassay. All animals were pretreated with sodium pentobartital (35 mg/kg) before experiment. 102 rats were randomly divided into three groups. Group 1 (n=36). The respiratory rate (RR) and tidal volume (VT) were measured after intravenous injection of naloxone (NLX, 2 mg/kg), β-EP (40 μg/kg, 160 μg/kg) or normal saline, Group 2 (n=48) By the intracerebroventricular administration of NLX and β-EP to the models, RR, VT and PaCO2 were observed after microinjection 5, 15, 30, 45, 60 min. Group 3 (n=18). The respiratory effects of β-EP after directly into the nucleus tractus solitari of the anaesthetised rats were investigated. Results The β-EP contents in medulla, pons, hypothalamus, central gray and plasma of chronic hypoxic rats were significantly increased compared with control subjects (P<0.01). It suggested that the pathophysiology of chronic hypoxic process infleuced the contents of β-EP in the CNS and plasma in rats. Intracerebroventricular microinjection of β-EP in normal rats, resulted in a significant decrease in RR (P<0.05). No significant difference in RR and VT was observved after intravenous injection of naloxone (2 mg/kg) and β-EP (40 μg/kg, 160 μg/kg) in treatment group compared with the control group (P>0.05), Intracerebroventricular microinjection of NLX in chronic hypoxic rats, resulted in a marked increase in RR (P<0.05) and central hypercapnic-sensitivity (t=2.76, P<0.05), Intracerebroventriculalr microinjection of β-EP in chronic hypoxic models, resulted in severe respiratory depression after injection 15, 30, 45, 60 min (RR t=3.41, 6.54, 6.97, 7.87, P<0.01; VT t=3.07, 7.27, 6.14, 6.08). Conclusions These results indicate the β-endorphin may be involved in central respiratory control of chronic hypoxic rats.
, 百拇医药
【Key words】 beta-Endorphin Anoxia Rats Respiration
β内啡肽(β-EP)是一种由31个氨基酸组成的内源性阿片肽,广泛存在于机体的中枢及外周组织,作为激素或神经介质,参与机体系统功能的调节,并与多种疾病和应激反应的病理生理过程密切相关。有关β-EP的呼吸调控作用得出的结论不尽一致。采用静脉注射、侧脑室及神经核团微量注射β-EP的方法,观察慢性缺氧模型呼吸参数的变化,以探讨其中β-EP的作用及其机制。
材料与方法
一、实验动物
健康雄性SD大鼠,体重220~260 g,饲养条件:室温(20±2)℃,每日光照12小时,随意饮水和进食。由上海计划生育研究所动物饲养批发中心提供。
二、主要试剂和药品
, http://www.100md.com
β-EP(美国Peninsula Lab),抑肽酶(德国Bayer公司),Na I125(英国Amersham公司),戊巴比妥钠(Serva公司),纳洛酮(NLX)(北京四环制药厂),木瓜蛋白酶(Serva公司),牙托粉、牙托水、磷酸锌粘固粉、粘固液(均为上海齿科材料厂)。
三、实验仪器
江湾Ⅰ型C立体定向仪(第二军医大学),0.5 μl及10 μl微量进样器(上海医用激光仪器厂),侧脑室套管(第二军医大学),AVL995血气分析仪(瑞士AVL公司),冷冻离心机(德国Hermale公司),SN-682型放射免疫γ计数器(上海日环仪器厂),MPA-Ⅳ型多道生物信号分析系统(第二军医大学)。
四、实验方法
1.慢性缺氧模型的制备:参照Snider等[1]方法,由模型组大鼠尾静脉注入0.5 ml生理盐水,内含木瓜蛋白酶5 mg,每周1次,共6周。对照组从尾静脉注入生理盐水0.5 mg,每周1次,共6周。第6周时将大鼠仰卧固定,用经1%肝素冲洗的注射器,于左胸壁心搏最强处刺入左心室,采血1 ml送检作血气分析。模型组动脉血氧分压(PaO2)为(69±9) mm Hg(1 mm Hg=0.133 kPa),较对照组(104±12) mm Hg显著降低(t=2.965,P<0.01)。
, 百拇医药
2.慢性缺氧大鼠中枢及血浆β-EP水平的测定:具体操作参见文献[2,3]。
3.静脉、侧脑室和神经核团的给药方法:(1)动物经戊巴比妥钠(35 mg/kg)腹腔麻醉后,从尾静脉分别注入剂量为40 μg/kg、160 μg/kg的β-EP及NLX 2 mg/kg,分别以生理盐水为对照,测定记录给药后5、15、30、45、60分钟时呼吸频率(RR)及潮气量(VT)。(2)将经戊巴比妥钠麻醉的动物置于江湾I型C立体定向仪上,依照包新民等[4]所著图谱定位(A:1 mm R:1.6 mm H:3.5 mm),钻开颅骨,将侧脑室套管置埋其中,套管末端离颅骨表面3.6 mm,并用牙科水泥、磷酸锌凝固剂及502强力胶将套管固定。1周后即可实验,给药时,用10 μl微量进样器通过软导管(由头皮针管制成)沿套管插入针头,使末端稍长于套管下端,将药液缓慢注入侧脑室(5分钟内完成),注射管留置2分钟后撤出,以防药液外溢。实验结束后,注入少量染料,以核对套管位置是否准确,定位不准者均弃用。(3)动物经麻醉后,参照Pellegrino鼠脑定向图谱,在江湾I型C立体定向仪引导下将注射针头插入,用0.5 μl微量进样器在2分钟内将0.4 μg/kg β-EP注入大鼠孤束核,留针2分钟,对照组则注入相同体积的人工脑脊液(ACSF)。
, http://www.100md.com
4.呼吸功能指标的测定:将经麻醉及相应处理后的大鼠仰卧于手术台上,手术分离右颈总动脉,结扎远心端,近心端插入充满含肝素的生理盐水的三通开关导管。作气管插管,通过换能器将信号放大后由采样器输入MPA-Ⅳ型多道生物信号分析系统,在注药后相应时刻记录RR和VT值,同时由颈总动脉导管抽取动脉血作血气分析。
5.统计学处理:实验数据以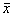 ±s表示,显著性检验采用t检验。
±s表示,显著性检验采用t检验。
结果
一、慢性缺氧大鼠中枢及血浆β-EP的含量变化
慢性缺氧大鼠延髓、桥脑、下丘脑、中央灰质和血浆的β-EP含量显著增加(P<0.01),见表1。
, http://www.100md.com
二、侧脑室注射β-EP对正常大鼠RR的影响
侧脑室注射β-EP后正常大鼠RR在注药后15、30、45、60分钟时显著下降(P均<0.05),结果见图1。
表1 慢性缺氧大鼠中枢及血浆β-EP水平变化(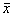 ±s)
±s)
组别
鼠数
延髓(pg/mg△)
桥脑(pg/mg△)
下丘脑(pg/mg△)
, http://www.100md.com
中央灰质(pg/mg△)
血浆(pg/ml)
对照组
10
3.6±0.3
3.4±0.3
18.5±1.7
172±14
124±10
模型组
10
38.2±3.5*
, 百拇医药
34.7±2.7*
77.1±3.9
338±19*
212±8*
注:△指毫克组织,*与对照组比较P<0.01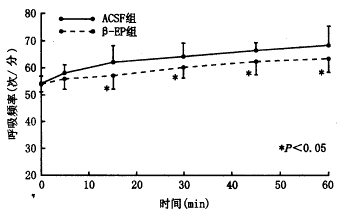
图1 正常大鼠侧脑室注射β-EP后RR的变化
三、静脉注射NLX和β-EP对慢性缺氧模型呼吸指标的影响
, http://www.100md.com
静脉分别注射NLX(2 mg/kg)、β-EP(40 μg/kg、160 μg/kg)及生理盐水后,在注药后5、15、30、45、60分钟时,观察记录RR及VT的变化,结果表明差异无显著性(P>0.05),见表2。
表2 静脉注射NLX和β-EP后RR及VT的变化(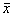 ±s)
±s)
组别
鼠数
注药后时间(min)
5
15
, 百拇医药
30
45
60
生理盐水组RR
9
58±6
60±3
60±4
62±5
64±4
VT
(0.82±0.14)
(0.78±0.18)
, 百拇医药
(0.89±0.12)
(0.92±0.09)
(1.02±0.23)
NLX组RR
9
58±7
60±7
61±5
61±3
63±5
VT
(0.88±0.09)
, 百拇医药
(0.84±0.15)
(0.97±0.29)
(0.96±0.13)
(0.98±0.20)
β-ET(40 μg/kg)组RR
9
61±4
59±4
58±6
58±4
59±5
VT
, 百拇医药
(0.91±0.18)
(0.89±0.20)
(0.90±0.12)
(0.92±0.07)
(0.87±0.35)
β-ET(160 μg/kg)组RR
9
61±5
58±4
60±4
61±5
62±5
, http://www.100md.com
VT
(0.85±0.17)
(0.83±0.10)
(0.85±0.21)
(0.90±0.18)
(1.06±0.12)
注:RR单位为次/分,括号内为VT值(单位:ml)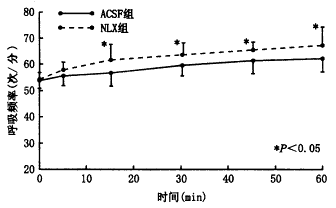
图2 慢性缺氧模型侧脑室注射NLX后RR的变化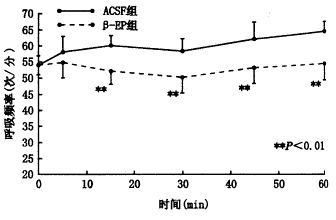
, 百拇医药
图3 慢性缺氧模型侧脑室注射β-EP后RR的变化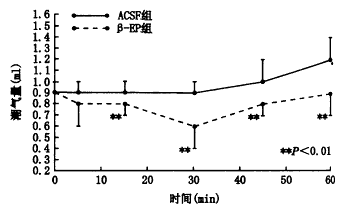
图4 慢性缺氧模型侧脑室注射β-EP后VT的变化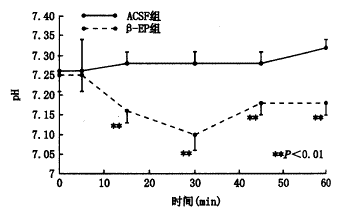
图5 慢性缺氧模型侧脑室注射β-EP后动脉血pH值的变化
四、侧脑室注射NLX及β-EP后对慢性缺氧大鼠呼吸的影响
侧脑室注射NLX后,RR显著增高。侧脑室注射β-EP(1 μg/kg)后在15、30、45、60分钟时RR、VT较对照组显著降低(RRt=3.41、6.54、6.97、7.87次/分,P<0.01;VT t=3.07、7.27、6.14、6.08 ml,P<0.01)。将β-EP组与对照组在侧脑室注药后30分钟时每只动物的MV/PaCO2值进行t检验,结果表明差异有非常显著性(t=4.01,P<0.01)。侧脑室注射NLX后30分钟时MV/PaCO2与对照组比较差异有显著性(t=2.76,P<0.05)。见图2~5。
, http://www.100md.com
五、孤束核微量注射β-EP对慢性缺氧模型呼吸指标的影响
孤束核注射0.4 μg/kg β-EP后,RR及VT在注射后15、30、45、60分钟时与对照组降低非常显著(RR t=3.17、8.19、6.91、5.09 次/分,P<0.01;VT t=3.42、6.41、6.36、7.59 ml,P<0.01),VT在注药5分钟后与对照组比较有显著下降(t=2.45,P<0.05)见图6,7。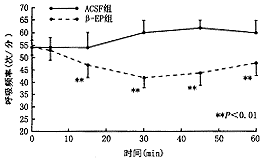
图6 慢性缺氧模型孤束核注射β-EP后RR的变化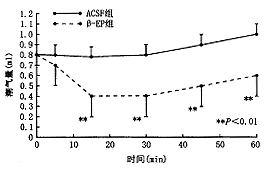
, http://www.100md.com
图7 慢性缺氧模型孤束核注射β-EP后VT的变化
讨论
自从1975年Hughs发现脑腓肽以来,有关内源性阿片肽(EOP)的生理作用受到普遍关注。作为激素或神经介质,EOP的作用极为广泛,几乎参与机体各系统功能的调节。在各种应激状态下(如疼痛、休克、缺氧等),EOP系统被动员,导致合成与释放增加,并且其增高程度与应激强度之间存在某种相关性。在应激状态下,EOP的合成与分泌增加是机体通过神经内分泌环路调节机体以适应环境改变,减轻应激因素对机体产生不利影响的一种保护性反应,其作用具体反映在EOP对机体心血管、消化、呼吸、神经、内分泌及免疫系统进行一系列调节。
为了复制出更接近人类慢性阻塞性肺气肿的模型,我们从大鼠尾静脉注射木瓜蛋白酶破坏肺的正常组织结构以造成机体内缺氧状态,并曾报道[2]慢性缺氧大鼠脑内及血浆β-EP水平除垂体外普遍显著升高。其中相当于呼吸中枢部位的神经核团β-EP含量增幅最为显著。国外研究表明EOP可直接或间接影响呼吸调节,其中以β-EP的作用最强。为了探讨β-EP的呼吸调节作用及其可能的途径,进一步阐明慢性缺氧所造成的中枢及外周β-EP含量变化的意义,本组实验首先采用静脉给予阿片受体拮抗剂NLX和不同剂量的β-EP,观察其对于RR和VT的影响,结果实验组与对照组比较差异无显著性,(P>0.05),表明β-EP在外周对呼吸调节无显著作用。侧脑室注射NLX后,显著增高RR,并可提高呼吸中枢对CO2的敏感度。侧脑室及孤束核微量注射β-EP后显著抑制动物的RR、VT,同时显著降低中枢对CO2的敏感度,表明β-EP具有显著的中枢性呼吸抑制作用。有学者提出,缺氧时机体β-EP合成与分泌增加以抑制呼吸可能有益于呼吸肌的保护,防止其因过度舒缩而迅速进入疲劳状态。
, 百拇医药
β-EP抑制呼吸的详尽机制尚不十分明确,一般认为[5],β-EP通过作用于中枢内某些部位的阿片受体μ受体及δ受体而对呼吸产生抑制作用。这些部位包括孤束核、疑核和下丘脑前区等。现已证实延髓腹侧表面、桥脑、孤束核和疑核等位点存在密度很高的阿片受体和β-EP能神经元及其末梢。β-EP通过选择性作用于相应的受体而发挥其呼吸抑制作用。当运用μ受体及δ受体激动剂均可减少鼠的延髓呼吸神经元的放电频率,提示μ受体和δ受体均参与呼吸调控过程。其中μ受体在呼吸控制中起重要作用,进一步研究发现它又可分成μ1和μ2两种亚型,其中μ2受体介导呼吸抑制。有研究表明[6],μ受体通过G蛋白介导,作用于延髓中与控制节律有关的神经元对呼吸节律的调控产生影响。我们认为机体因慢性缺氧造成外周中枢β-EP合成与分泌增加,脑内β-EP神经元自分泌或旁分泌的β-EP和通过全身循环而来的外周β-EP均与呼吸中枢上的阿片受体结合而产生呼吸抑制效应。我们在临床测定了慢性阻塞性肺疾病(COPD)患者血浆β-EP含量,同时行血气分析和通气功能测定,结果表明COPD患者体内β-EP释放增多,且与患者的通气功能、动脉血PaO2和PaCO2及病情具有良好的相关性,应用NLX后,对患者通气功能、血气指标及临床症状均有不同程度的改善,这表明应用阿片受体拮抗剂对于提高COPD及呼吸衰竭的防治水平具有潜在价值。
, 百拇医药
β-EP内啡肽影响呼吸所涉及的病理生理过程十分复杂,但随着阿片受体分子结构的确定,μ型阿片受体内源性配体内吗啡肽的发现[7]以及各种合成的阿片肽类似物的应用,有关β-EP影响呼吸调控的内在机制将会不断得到揭示。
本课题受国家自然科学基金资助(基金编号:39300060)
参考文献
1 Snider GL, Lucey EC, Stone PJ. Animal models of emphysema. Am Rev Respir Dis, 1986,133:149-169.
2 许欣,李强,孙学军,等.慢性缺氧大鼠中枢及血浆β-内啡肽水平的变化.中华结核和呼吸杂志,1998,6:375.
3 祝元祥,管小滨,崔瑞耀,等. β内啡肽的抗血清制备及其放射免疫测定.第二军医大学学报,1986,7:332-336.
, 百拇医药
4 包新民,主编.大鼠脑立体定位图谱.北京:人民卫生出版社,1991.32.
5 Mansour A, Fox CA, Akil H, et al. Opioid-receptor mRNA expression in rat CNS: anatomical and functional implications. Trends Neurosci, 1995,18:22-29.
6 Johnson SM, Smith JC, Feldman JL. Modulation of respiratory rhythm in vitro: role of Ci/0 protein-mediated mechanisms. J Appl Physiol, 1996,80:2120-2133.
7 Zadina JE, Hackler L, Ge LJ, et al. A potent and selective endogenous agonist for the μ-opiate receptor. Nature, 1997,386:449-501.
收稿:1999-04-16 修回:1999-06-17, http://www.100md.com
单位:200433 上海,第二军医大学附属长海医院呼吸内科(许欣现在解放军第一○七医院呼吸内科264002),神经生物教研室(孙学军、王成海)
关键词:β内啡肽;缺氧症;大鼠;呼吸
New Page 2 【摘要】 目的 探讨β内啡肽(β-EP)在慢性缺氧大鼠呼吸调控中的作用。方法 采用放射免疫法测定慢性缺氧大鼠模型血浆及延髓、桥脑、下丘脑、中央灰质等神经核团中β-EP的含量变化,以及不同给药途径给予外源性β-EP对慢性缺氧大鼠呼吸功能的影响。正常大鼠侧脑室注射β-EP后,观察记录呼吸频率(RR);102只慢性缺氧大鼠随机分为:(1)静脉组36只,分别给予阿片受体拮抗剂纳洛酮(NLX)和不同剂量β-EP,记录RR和潮气量(VT);(2)侧脑室组48只,微量注射NLX、β-EP,测定RR、VT及血气指标;(3)孤束核组18只,分别注射β-EP和人工脑脊液(ACSF),测定RR和VT。结果慢性缺氧模型延髓、桥脑、下丘脑、中央灰质和血浆β-EP的含量较对照组均显著升高(P<0.01)。给正常大鼠侧脑室注射β-EP后,RR显著下降(P<0.05)。慢性缺氧大鼠静脉给予不同剂量β-EP和NLX后,RR和VT变化差异无显著性(P>0.05)。侧脑室注射NLX后,RR显著增高(P<0.05)。侧脑室及孤束核注射β-EP后显著降低RR、VT。侧脑室注射NLX 30分钟时MV/PaCO2较对照组显著升高(t=2.76,P<0.05),侧脑室注射β-EP 30分钟时MV/PaCO2较对照组显著降低(t=4.01,P<0.01)。结论 慢性缺氧可造成机体中枢及外周血β-EP含量显著升高,通过中枢途径给予β-EP后显著抑制慢性缺氧模型的呼吸功能。
, http://www.100md.com
Respiratory effects of beta-endorphin in chronic hypoxic rats
XU Xin, LI Qiang, SUN Xuejun, et al.
Department of Respiratory Diseases, Changhai Hospital, Shanghai 200433
【Abstract】 Objective To assess the role of β-EP in the physiological and pathophysiological process of respiratory regulation in chronic hypoxic rats. Methods The chronic hypoxic rat model was established by intravenous injections of papain 6 times, once a week. The concentration of β-endorphin in medulla, pons, hypothalamus, central gray and plasma of chronic hypoxic rats were measured by radioimmunoassay. All animals were pretreated with sodium pentobartital (35 mg/kg) before experiment. 102 rats were randomly divided into three groups. Group 1 (n=36). The respiratory rate (RR) and tidal volume (VT) were measured after intravenous injection of naloxone (NLX, 2 mg/kg), β-EP (40 μg/kg, 160 μg/kg) or normal saline, Group 2 (n=48) By the intracerebroventricular administration of NLX and β-EP to the models, RR, VT and PaCO2 were observed after microinjection 5, 15, 30, 45, 60 min. Group 3 (n=18). The respiratory effects of β-EP after directly into the nucleus tractus solitari of the anaesthetised rats were investigated. Results The β-EP contents in medulla, pons, hypothalamus, central gray and plasma of chronic hypoxic rats were significantly increased compared with control subjects (P<0.01). It suggested that the pathophysiology of chronic hypoxic process infleuced the contents of β-EP in the CNS and plasma in rats. Intracerebroventricular microinjection of β-EP in normal rats, resulted in a significant decrease in RR (P<0.05). No significant difference in RR and VT was observved after intravenous injection of naloxone (2 mg/kg) and β-EP (40 μg/kg, 160 μg/kg) in treatment group compared with the control group (P>0.05), Intracerebroventricular microinjection of NLX in chronic hypoxic rats, resulted in a marked increase in RR (P<0.05) and central hypercapnic-sensitivity (t=2.76, P<0.05), Intracerebroventriculalr microinjection of β-EP in chronic hypoxic models, resulted in severe respiratory depression after injection 15, 30, 45, 60 min (RR t=3.41, 6.54, 6.97, 7.87, P<0.01; VT t=3.07, 7.27, 6.14, 6.08). Conclusions These results indicate the β-endorphin may be involved in central respiratory control of chronic hypoxic rats.
, 百拇医药
【Key words】 beta-Endorphin Anoxia Rats Respiration
β内啡肽(β-EP)是一种由31个氨基酸组成的内源性阿片肽,广泛存在于机体的中枢及外周组织,作为激素或神经介质,参与机体系统功能的调节,并与多种疾病和应激反应的病理生理过程密切相关。有关β-EP的呼吸调控作用得出的结论不尽一致。采用静脉注射、侧脑室及神经核团微量注射β-EP的方法,观察慢性缺氧模型呼吸参数的变化,以探讨其中β-EP的作用及其机制。
材料与方法
一、实验动物
健康雄性SD大鼠,体重220~260 g,饲养条件:室温(20±2)℃,每日光照12小时,随意饮水和进食。由上海计划生育研究所动物饲养批发中心提供。
二、主要试剂和药品
, http://www.100md.com
β-EP(美国Peninsula Lab),抑肽酶(德国Bayer公司),Na I125(英国Amersham公司),戊巴比妥钠(Serva公司),纳洛酮(NLX)(北京四环制药厂),木瓜蛋白酶(Serva公司),牙托粉、牙托水、磷酸锌粘固粉、粘固液(均为上海齿科材料厂)。
三、实验仪器
江湾Ⅰ型C立体定向仪(第二军医大学),0.5 μl及10 μl微量进样器(上海医用激光仪器厂),侧脑室套管(第二军医大学),AVL995血气分析仪(瑞士AVL公司),冷冻离心机(德国Hermale公司),SN-682型放射免疫γ计数器(上海日环仪器厂),MPA-Ⅳ型多道生物信号分析系统(第二军医大学)。
四、实验方法
1.慢性缺氧模型的制备:参照Snider等[1]方法,由模型组大鼠尾静脉注入0.5 ml生理盐水,内含木瓜蛋白酶5 mg,每周1次,共6周。对照组从尾静脉注入生理盐水0.5 mg,每周1次,共6周。第6周时将大鼠仰卧固定,用经1%肝素冲洗的注射器,于左胸壁心搏最强处刺入左心室,采血1 ml送检作血气分析。模型组动脉血氧分压(PaO2)为(69±9) mm Hg(1 mm Hg=0.133 kPa),较对照组(104±12) mm Hg显著降低(t=2.965,P<0.01)。
, 百拇医药
2.慢性缺氧大鼠中枢及血浆β-EP水平的测定:具体操作参见文献[2,3]。
3.静脉、侧脑室和神经核团的给药方法:(1)动物经戊巴比妥钠(35 mg/kg)腹腔麻醉后,从尾静脉分别注入剂量为40 μg/kg、160 μg/kg的β-EP及NLX 2 mg/kg,分别以生理盐水为对照,测定记录给药后5、15、30、45、60分钟时呼吸频率(RR)及潮气量(VT)。(2)将经戊巴比妥钠麻醉的动物置于江湾I型C立体定向仪上,依照包新民等[4]所著图谱定位(A:1 mm R:1.6 mm H:3.5 mm),钻开颅骨,将侧脑室套管置埋其中,套管末端离颅骨表面3.6 mm,并用牙科水泥、磷酸锌凝固剂及502强力胶将套管固定。1周后即可实验,给药时,用10 μl微量进样器通过软导管(由头皮针管制成)沿套管插入针头,使末端稍长于套管下端,将药液缓慢注入侧脑室(5分钟内完成),注射管留置2分钟后撤出,以防药液外溢。实验结束后,注入少量染料,以核对套管位置是否准确,定位不准者均弃用。(3)动物经麻醉后,参照Pellegrino鼠脑定向图谱,在江湾I型C立体定向仪引导下将注射针头插入,用0.5 μl微量进样器在2分钟内将0.4 μg/kg β-EP注入大鼠孤束核,留针2分钟,对照组则注入相同体积的人工脑脊液(ACSF)。
, http://www.100md.com
4.呼吸功能指标的测定:将经麻醉及相应处理后的大鼠仰卧于手术台上,手术分离右颈总动脉,结扎远心端,近心端插入充满含肝素的生理盐水的三通开关导管。作气管插管,通过换能器将信号放大后由采样器输入MPA-Ⅳ型多道生物信号分析系统,在注药后相应时刻记录RR和VT值,同时由颈总动脉导管抽取动脉血作血气分析。
5.统计学处理:实验数据以
结果
一、慢性缺氧大鼠中枢及血浆β-EP的含量变化
慢性缺氧大鼠延髓、桥脑、下丘脑、中央灰质和血浆的β-EP含量显著增加(P<0.01),见表1。
, http://www.100md.com
二、侧脑室注射β-EP对正常大鼠RR的影响
侧脑室注射β-EP后正常大鼠RR在注药后15、30、45、60分钟时显著下降(P均<0.05),结果见图1。
表1 慢性缺氧大鼠中枢及血浆β-EP水平变化(
组别
鼠数
延髓(pg/mg△)
桥脑(pg/mg△)
下丘脑(pg/mg△)
, http://www.100md.com
中央灰质(pg/mg△)
血浆(pg/ml)
对照组
10
3.6±0.3
3.4±0.3
18.5±1.7
172±14
124±10
模型组
10
38.2±3.5*
, 百拇医药
34.7±2.7*
77.1±3.9
338±19*
212±8*
注:△指毫克组织,*与对照组比较P<0.01

图1 正常大鼠侧脑室注射β-EP后RR的变化
三、静脉注射NLX和β-EP对慢性缺氧模型呼吸指标的影响
, http://www.100md.com
静脉分别注射NLX(2 mg/kg)、β-EP(40 μg/kg、160 μg/kg)及生理盐水后,在注药后5、15、30、45、60分钟时,观察记录RR及VT的变化,结果表明差异无显著性(P>0.05),见表2。
表2 静脉注射NLX和β-EP后RR及VT的变化(
组别
鼠数
注药后时间(min)
5
15
, 百拇医药
30
45
60
生理盐水组RR
9
58±6
60±3
60±4
62±5
64±4
VT
(0.82±0.14)
(0.78±0.18)
, 百拇医药
(0.89±0.12)
(0.92±0.09)
(1.02±0.23)
NLX组RR
9
58±7
60±7
61±5
61±3
63±5
VT
(0.88±0.09)
, 百拇医药
(0.84±0.15)
(0.97±0.29)
(0.96±0.13)
(0.98±0.20)
β-ET(40 μg/kg)组RR
9
61±4
59±4
58±6
58±4
59±5
VT
, 百拇医药
(0.91±0.18)
(0.89±0.20)
(0.90±0.12)
(0.92±0.07)
(0.87±0.35)
β-ET(160 μg/kg)组RR
9
61±5
58±4
60±4
61±5
62±5
, http://www.100md.com
VT
(0.85±0.17)
(0.83±0.10)
(0.85±0.21)
(0.90±0.18)
(1.06±0.12)
注:RR单位为次/分,括号内为VT值(单位:ml)

图2 慢性缺氧模型侧脑室注射NLX后RR的变化

, 百拇医药
图3 慢性缺氧模型侧脑室注射β-EP后RR的变化

图4 慢性缺氧模型侧脑室注射β-EP后VT的变化

图5 慢性缺氧模型侧脑室注射β-EP后动脉血pH值的变化
四、侧脑室注射NLX及β-EP后对慢性缺氧大鼠呼吸的影响
侧脑室注射NLX后,RR显著增高。侧脑室注射β-EP(1 μg/kg)后在15、30、45、60分钟时RR、VT较对照组显著降低(RRt=3.41、6.54、6.97、7.87次/分,P<0.01;VT t=3.07、7.27、6.14、6.08 ml,P<0.01)。将β-EP组与对照组在侧脑室注药后30分钟时每只动物的MV/PaCO2值进行t检验,结果表明差异有非常显著性(t=4.01,P<0.01)。侧脑室注射NLX后30分钟时MV/PaCO2与对照组比较差异有显著性(t=2.76,P<0.05)。见图2~5。
, http://www.100md.com
五、孤束核微量注射β-EP对慢性缺氧模型呼吸指标的影响
孤束核注射0.4 μg/kg β-EP后,RR及VT在注射后15、30、45、60分钟时与对照组降低非常显著(RR t=3.17、8.19、6.91、5.09 次/分,P<0.01;VT t=3.42、6.41、6.36、7.59 ml,P<0.01),VT在注药5分钟后与对照组比较有显著下降(t=2.45,P<0.05)见图6,7。

图6 慢性缺氧模型孤束核注射β-EP后RR的变化

, http://www.100md.com
图7 慢性缺氧模型孤束核注射β-EP后VT的变化
讨论
自从1975年Hughs发现脑腓肽以来,有关内源性阿片肽(EOP)的生理作用受到普遍关注。作为激素或神经介质,EOP的作用极为广泛,几乎参与机体各系统功能的调节。在各种应激状态下(如疼痛、休克、缺氧等),EOP系统被动员,导致合成与释放增加,并且其增高程度与应激强度之间存在某种相关性。在应激状态下,EOP的合成与分泌增加是机体通过神经内分泌环路调节机体以适应环境改变,减轻应激因素对机体产生不利影响的一种保护性反应,其作用具体反映在EOP对机体心血管、消化、呼吸、神经、内分泌及免疫系统进行一系列调节。
为了复制出更接近人类慢性阻塞性肺气肿的模型,我们从大鼠尾静脉注射木瓜蛋白酶破坏肺的正常组织结构以造成机体内缺氧状态,并曾报道[2]慢性缺氧大鼠脑内及血浆β-EP水平除垂体外普遍显著升高。其中相当于呼吸中枢部位的神经核团β-EP含量增幅最为显著。国外研究表明EOP可直接或间接影响呼吸调节,其中以β-EP的作用最强。为了探讨β-EP的呼吸调节作用及其可能的途径,进一步阐明慢性缺氧所造成的中枢及外周β-EP含量变化的意义,本组实验首先采用静脉给予阿片受体拮抗剂NLX和不同剂量的β-EP,观察其对于RR和VT的影响,结果实验组与对照组比较差异无显著性,(P>0.05),表明β-EP在外周对呼吸调节无显著作用。侧脑室注射NLX后,显著增高RR,并可提高呼吸中枢对CO2的敏感度。侧脑室及孤束核微量注射β-EP后显著抑制动物的RR、VT,同时显著降低中枢对CO2的敏感度,表明β-EP具有显著的中枢性呼吸抑制作用。有学者提出,缺氧时机体β-EP合成与分泌增加以抑制呼吸可能有益于呼吸肌的保护,防止其因过度舒缩而迅速进入疲劳状态。
, 百拇医药
β-EP抑制呼吸的详尽机制尚不十分明确,一般认为[5],β-EP通过作用于中枢内某些部位的阿片受体μ受体及δ受体而对呼吸产生抑制作用。这些部位包括孤束核、疑核和下丘脑前区等。现已证实延髓腹侧表面、桥脑、孤束核和疑核等位点存在密度很高的阿片受体和β-EP能神经元及其末梢。β-EP通过选择性作用于相应的受体而发挥其呼吸抑制作用。当运用μ受体及δ受体激动剂均可减少鼠的延髓呼吸神经元的放电频率,提示μ受体和δ受体均参与呼吸调控过程。其中μ受体在呼吸控制中起重要作用,进一步研究发现它又可分成μ1和μ2两种亚型,其中μ2受体介导呼吸抑制。有研究表明[6],μ受体通过G蛋白介导,作用于延髓中与控制节律有关的神经元对呼吸节律的调控产生影响。我们认为机体因慢性缺氧造成外周中枢β-EP合成与分泌增加,脑内β-EP神经元自分泌或旁分泌的β-EP和通过全身循环而来的外周β-EP均与呼吸中枢上的阿片受体结合而产生呼吸抑制效应。我们在临床测定了慢性阻塞性肺疾病(COPD)患者血浆β-EP含量,同时行血气分析和通气功能测定,结果表明COPD患者体内β-EP释放增多,且与患者的通气功能、动脉血PaO2和PaCO2及病情具有良好的相关性,应用NLX后,对患者通气功能、血气指标及临床症状均有不同程度的改善,这表明应用阿片受体拮抗剂对于提高COPD及呼吸衰竭的防治水平具有潜在价值。
, 百拇医药
β-EP内啡肽影响呼吸所涉及的病理生理过程十分复杂,但随着阿片受体分子结构的确定,μ型阿片受体内源性配体内吗啡肽的发现[7]以及各种合成的阿片肽类似物的应用,有关β-EP影响呼吸调控的内在机制将会不断得到揭示。
本课题受国家自然科学基金资助(基金编号:39300060)
参考文献
1 Snider GL, Lucey EC, Stone PJ. Animal models of emphysema. Am Rev Respir Dis, 1986,133:149-169.
2 许欣,李强,孙学军,等.慢性缺氧大鼠中枢及血浆β-内啡肽水平的变化.中华结核和呼吸杂志,1998,6:375.
3 祝元祥,管小滨,崔瑞耀,等. β内啡肽的抗血清制备及其放射免疫测定.第二军医大学学报,1986,7:332-336.
, 百拇医药
4 包新民,主编.大鼠脑立体定位图谱.北京:人民卫生出版社,1991.32.
5 Mansour A, Fox CA, Akil H, et al. Opioid-receptor mRNA expression in rat CNS: anatomical and functional implications. Trends Neurosci, 1995,18:22-29.
6 Johnson SM, Smith JC, Feldman JL. Modulation of respiratory rhythm in vitro: role of Ci/0 protein-mediated mechanisms. J Appl Physiol, 1996,80:2120-2133.
7 Zadina JE, Hackler L, Ge LJ, et al. A potent and selective endogenous agonist for the μ-opiate receptor. Nature, 1997,386:449-501.
收稿:1999-04-16 修回:1999-06-17, http://www.100md.com