纤维粘连蛋白和粘附分子CD29在上皮性卵巢癌的表达及其临床意义
作者:张文颖 王维华 潘颖 柏文田 张建中 陆野燕 李丽华
单位:张文颖(100101 北京,中国人民解放军第306医院妇产科)‘;王维华(100101 北京,中国人民解放军第306医院妇产科);陆野燕(100101 北京,中国人民解放军第306医院妇产科);李丽华(100101 北京,中国人民解放军第306医院妇产科);柏文田(病理科);张建中(病理科);潘颖(白求恩医大第三临床学院妇产科)
关键词:
中华医学杂志000416 上皮性卵巢癌具有肿瘤细胞脱落并种植于腹膜而导致广泛性腹腔内转移的特性。已有多项研究证实细胞外基质中纤维粘连蛋白(FN)与整合素受体在肿瘤细胞粘附、侵袭和转移中起着重要的作用。我们采用分子生物学和免疫学技术,检测了不同分化的卵巢浆液性囊腺癌组织FN及整合素B1亚单位CD29的表达,并探讨在腹腔种植中的意义。
, http://www.100md.com
一、对象与方法
1.对象:卵巢癌患者来源于我院和白求恩医科大学第三临床学院,均为浆液性囊腺癌,共67例。年龄36~54岁。组织学分级为高分化23例,中分化15例,低分化29例。临床分期为Ⅰ期25例,Ⅱ期32例,Ⅲ期10例。对照组为取自子宫肌瘤手术的8例正常卵巢组织。同时留取卵巢癌腹水和子宫肌瘤手术患者的腹腔液。
2.试剂:主要试剂有RNA提取试剂盒,DNA标记试剂盒,FN纯品,鼠抗人FN单抗,兔抗人FN多抗,SP免疫组织化学试剂盒、辣根酶标记羊抗兔IgG,鼠抗CD29单抗。
3.Northern杂交分析:提取组织总RNA,采用随机引物法α-32P22-d ATP标记FN cDNA探针,RNA甲醛变性电泳、吸印、预杂交、杂交、放射自显影。经吸光度扫描将各杂交带与相对应的B-actin内参照面积积分值校正。
4.免疫组织化学:采用SP法。石蜡切片脱蜡至水,3% H2O2消除内源性过氧化物酶,0.001 kg/L胰酶消化37℃,40 min,羊血清封闭,一抗分别用鼠抗人FN和CD29单抗,DAB显色。设阴性及阳性对照。结果判断:FN阳性表达为胞浆、胞膜、细胞外基质内棕黄色沉淀。CD29阳性表达为胞浆、胞膜棕黄着色。用计算机HPIA-1000图文分析系统对结果进行定量分析,每张切片于400倍下取4周和中间5个视野,测量肿瘤实质区吸光度值(A),以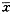 ±s表示。
±s表示。
, 百拇医药
5.酶联免疫(ELISA):用鼠抗人FN单抗(1∶1 000)包被聚苯乙烯板,0.01 kg/L牛血清白蛋白封闭,加入待测标本(卵巢癌腹水和正常腹腔液),温浴、洗涤。加兔抗人FN多抗,温浴洗涤后加入羊抗兔IgG-HRP(1∶800),底物显色,酶标仪450 nm测A值。用递减浓度FN纯品做出标准曲线。
6.统计学处理:计量资料两组间差异用t检验分析。
二、结果
1.卵巢癌组织中FN mRNA表达:正常卵巢组织FN mRNA于7.6 kb处有明显杂交带,高分化肿瘤中17例表达下降,中、低分化肿瘤则全部表达下降。肿瘤分化越差,其表达越低(图1,表1)。
2.免疫组织化学结果:FN、CD29于正常卵巢组织呈阳性表达,卵巢癌组织FN棕黄染色明显减弱,与细胞分化有关。甚至在低分化肿瘤的癌巢内FN表达完全缺如(图2~4)。CD29在中、低分化卵巢癌细胞中表达较正常增强,差异有显著意义。高分化者与正常比较差异不明显(图5,6)。卵巢癌组织FN和CD29表达与临床分期无关。
, http://www.100md.com
3.腹水中FN含量:由表1可见FN在卵巢癌患者腹水
A:正常卵巢组织;B:高分化卵巢癌;C:中分化卵巢癌;D:低分化卵巢癌
图1 卵巢癌FN mRNA表达
表1 两组对象卵巢组织FN mRNA、FN及CD29
表达和腹水中FN含量(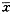 ±s) 组别
±s) 组别
例数
FN mRNA
(灰度比值)
, 百拇医药
FN
(A值)
CD29
(A值)
腹水FN
(μg/ml)
正常对照
8
1.43±
0.18
4.70±
0.30
4.9±
, 百拇医药
0.9
87±
54
卵巢癌
高分化
23
1.09±
0.13*
2.27±
0.17*
4.6±
1.3△
, http://www.100md.com
172±
80*
中分化
15
0.48±
0.15**▲
0.92±
0.31**
5.5±
0.9*
279±
48*
, http://www.100md.com
低分化
29
0.13±
0.11**
0.16±
0.27**
6.9±
0.5*
231±
57*
注:与正常组比较*P<0.05;**P<0.01,△P>0.05;与高、低分化组比较▲P<0.05中明显增高,与组织分级和临床分期无关。
, http://www.100md.com
4.统计学处理:组间差异显著性检验采用t检验。
三、讨论
转移的卵巢癌细胞粘附于腹膜表面的机制还不十分清楚。已证明肿瘤细胞粘附于细胞外基质和基底膜成分由特殊的细胞表面受体所介导,该受体与细胞外粘附蛋白相互作用。在恶性细胞中,细胞外基质成分FN的表达明显减少,致使细胞连接和细胞骨架发生改变,某些恶性表型如游走、侵袭等行为得以加强,细胞易于脱离原瘤灶而播散。我们在试验中发现,卵巢癌组织FN表达与细胞分化程度有关,分化越差的癌细胞其表达越低,甚至在癌巢中表达缺失,尽管如此,癌巢周围的纤维结缔组织中仍是免疫染色阳性。从而使得一方面细胞易于脱落进入腹腔,另一方面结缔组织中FN对低分化肿瘤细胞的较强趋化作用,使其不断向基底膜或癌巢周围结缔组织中侵袭蔓延。另外,腹水中高含量的FN对肿瘤细胞的趋化作用,使之易于游走并与腹膜表面接触[1]。
, http://www.100md.com
图2 正常卵巢组织FN阳性表达 DAB染色(图3~6同) ×200(图3~6同)
图3 高分化卵巢癌FN阳性颗粒减少
图4 低分化卵巢癌FN阳性物质明显减少,癌巢周围结缔组织仍为FN阳性表达
图5 CD29在高分化卵巢癌阳性表达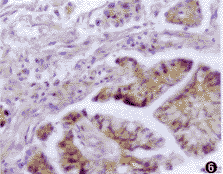
图6 CD29在低分化卵巢中的表达
, http://www.100md.com 整合素(Integrins)是一组细胞表面跨膜受体,由α链和β链以非共价键形成异构二聚体,在识别细胞外基质成分中起着重要的作用。多项研究表明,整合素介导肿瘤细胞的转移。随着肿瘤转移机制研究的深入发展,注意到FN与整合素受体相互作用在肿瘤进展中的重要意义。CD29是整合素β1链,β1类整合素是多种细胞外基质蛋白的受体。能结合FN的β1类整合素包括α3β1、α4β1、α5β1、αVβ1;细胞结合于Ⅰ型胶原由α1β1、α2β1、α3β1介导,结合于层粘连蛋白由α1β1、α2β1、α6β1介导[2]。体外实验表明CD29表达与肿瘤细胞迁移和侵袭的能力成正比。尽管如此,癌基因的表达在体内、体外或不同肿瘤的试验中对CD29的影响有不同的结果[3]。我们的试验表明,与正常卵巢和高分化的卵巢浆液性囊腺癌相比,低分化卵巢癌细胞在FN表达明显降低的同时,CD29表达增多,与临床分期无关。推测这种改变在卵巢癌腹腔种植过程中起作用,CD29类整合素可能介导脱落的肿瘤细胞与腹膜表面的细胞外基质蛋白连接,通过诱导信号转导引发侵袭种植。我们认为,在卵巢浆液性囊腺癌转移过程中,癌细胞FN减少与CD29即整合素β1链表达增多以及腹水FN的增加可能具有有机的联系,是肿瘤转移的潜在促进因素。动物实验表明,CD29抗体抑制胚胎血管形成步骤中管腔的形成[4]。因此,低分化卵巢癌细胞过表达CD29的意义还可能有利于转移灶血管的形成。
, 百拇医药
早期多项体外实验证实了CD29在肿瘤转移侵袭中的重要作用[5]。Moser等[6]用CD29抗体抑制了体外卵巢癌细胞与Ⅰ型胶原粘附,支持CD29介导卵巢癌细胞腹膜内播散的观点。而 Cannistra SA在体外实验中发现CD29抗体不明显抑制卵巢癌细胞与单层生长的间皮细胞的结合,因此认为,在卵巢癌腹腔种植中,整合素不起重要作用[7]。恶性肿瘤是多元化实体,由多克隆的子体组成,很多特性在子体中是不同的,同一肿瘤细胞在体内和体外可表达不同的整合素、也可表现出不同的生物学行为[4]。本组资料中低分化卵巢癌过表达CD29,提示这种分子在肿瘤细胞侵袭到腹膜间皮下细胞外基质的过程中起着重要的作用。关于卵巢癌腹腔转移机制中整合素的作用还应深入研究,旨在从抗粘附的角度寻找有效的治疗方法。
基金项目:中国人民解放军总装备部卫生部医药卫生科研基金资助项目
参考文献
, 百拇医药
1,Murata J,Saiki I,Yoneda J,et al.Dffernces in Chemotaxis to Fibronectin in Weakly and Highly Metastatic Tumor Cells.Jpn J Cancer Res,1992,83:1327-1333.
2,Akiyama SK,Olden K,Yamada KM.Fibronectin and integrins in invasion and metastasis. Cancer metastasis Rev, 1995,14:173-198.
3,Beauvais A,Erickson CA,Goins T,et al.Chengs in the fibronectin-specific integrin expression patten modify the migratory behavior of sarcoma S180 cells in vitro and in the embryonic environment.J Ceel Biol,1995,128:699-713.
, http://www.100md.com
4,Darke CJ,Davis LA,Little CD et al.Antibodies to β1-integrins cause alterations of aortic vasculogenesis in vivo.Dev Dynamics,1992,193:83-91.
5,Yamada KM,Kennedy DW,Yamada SS,et al.Monoclonal antibody and synthetic peptide inhibitors of human tumor cell migration.Cancer Res,1990,50:4485-4496.
6,Moser TL,Pizzo SV,Bafetti LM,et al.Evidence for preferential adhesion of ovarian epithelial carcinoma ceels to type I collagen mediated by the alpha2beta1 integrin.Int J Cancer,1996,67:695-701.
7,Cannistra SA, Ottensmeier C, Niloff J, et al.Expression and function of β1 and αVβ3 integrins in ovarian cancer. Gynecol Oncol,1995,58:216-225.
(收稿日期:1999-06-02), 百拇医药
单位:张文颖(100101 北京,中国人民解放军第306医院妇产科)‘;王维华(100101 北京,中国人民解放军第306医院妇产科);陆野燕(100101 北京,中国人民解放军第306医院妇产科);李丽华(100101 北京,中国人民解放军第306医院妇产科);柏文田(病理科);张建中(病理科);潘颖(白求恩医大第三临床学院妇产科)
关键词:
中华医学杂志000416 上皮性卵巢癌具有肿瘤细胞脱落并种植于腹膜而导致广泛性腹腔内转移的特性。已有多项研究证实细胞外基质中纤维粘连蛋白(FN)与整合素受体在肿瘤细胞粘附、侵袭和转移中起着重要的作用。我们采用分子生物学和免疫学技术,检测了不同分化的卵巢浆液性囊腺癌组织FN及整合素B1亚单位CD29的表达,并探讨在腹腔种植中的意义。
, http://www.100md.com
一、对象与方法
1.对象:卵巢癌患者来源于我院和白求恩医科大学第三临床学院,均为浆液性囊腺癌,共67例。年龄36~54岁。组织学分级为高分化23例,中分化15例,低分化29例。临床分期为Ⅰ期25例,Ⅱ期32例,Ⅲ期10例。对照组为取自子宫肌瘤手术的8例正常卵巢组织。同时留取卵巢癌腹水和子宫肌瘤手术患者的腹腔液。
2.试剂:主要试剂有RNA提取试剂盒,DNA标记试剂盒,FN纯品,鼠抗人FN单抗,兔抗人FN多抗,SP免疫组织化学试剂盒、辣根酶标记羊抗兔IgG,鼠抗CD29单抗。
3.Northern杂交分析:提取组织总RNA,采用随机引物法α-32P22-d ATP标记FN cDNA探针,RNA甲醛变性电泳、吸印、预杂交、杂交、放射自显影。经吸光度扫描将各杂交带与相对应的B-actin内参照面积积分值校正。
4.免疫组织化学:采用SP法。石蜡切片脱蜡至水,3% H2O2消除内源性过氧化物酶,0.001 kg/L胰酶消化37℃,40 min,羊血清封闭,一抗分别用鼠抗人FN和CD29单抗,DAB显色。设阴性及阳性对照。结果判断:FN阳性表达为胞浆、胞膜、细胞外基质内棕黄色沉淀。CD29阳性表达为胞浆、胞膜棕黄着色。用计算机HPIA-1000图文分析系统对结果进行定量分析,每张切片于400倍下取4周和中间5个视野,测量肿瘤实质区吸光度值(A),以
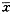 ±s表示。
±s表示。, 百拇医药
5.酶联免疫(ELISA):用鼠抗人FN单抗(1∶1 000)包被聚苯乙烯板,0.01 kg/L牛血清白蛋白封闭,加入待测标本(卵巢癌腹水和正常腹腔液),温浴、洗涤。加兔抗人FN多抗,温浴洗涤后加入羊抗兔IgG-HRP(1∶800),底物显色,酶标仪450 nm测A值。用递减浓度FN纯品做出标准曲线。
6.统计学处理:计量资料两组间差异用t检验分析。
二、结果
1.卵巢癌组织中FN mRNA表达:正常卵巢组织FN mRNA于7.6 kb处有明显杂交带,高分化肿瘤中17例表达下降,中、低分化肿瘤则全部表达下降。肿瘤分化越差,其表达越低(图1,表1)。
2.免疫组织化学结果:FN、CD29于正常卵巢组织呈阳性表达,卵巢癌组织FN棕黄染色明显减弱,与细胞分化有关。甚至在低分化肿瘤的癌巢内FN表达完全缺如(图2~4)。CD29在中、低分化卵巢癌细胞中表达较正常增强,差异有显著意义。高分化者与正常比较差异不明显(图5,6)。卵巢癌组织FN和CD29表达与临床分期无关。
, http://www.100md.com
3.腹水中FN含量:由表1可见FN在卵巢癌患者腹水

A:正常卵巢组织;B:高分化卵巢癌;C:中分化卵巢癌;D:低分化卵巢癌
图1 卵巢癌FN mRNA表达
表1 两组对象卵巢组织FN mRNA、FN及CD29
表达和腹水中FN含量(
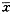 ±s) 组别
±s) 组别例数
FN mRNA
(灰度比值)
, 百拇医药
FN
(A值)
CD29
(A值)
腹水FN
(μg/ml)
正常对照
8
1.43±
0.18
4.70±
0.30
4.9±
, 百拇医药
0.9
87±
54
卵巢癌
高分化
23
1.09±
0.13*
2.27±
0.17*
4.6±
1.3△
, http://www.100md.com
172±
80*
中分化
15
0.48±
0.15**▲
0.92±
0.31**
5.5±
0.9*
279±
48*
, http://www.100md.com
低分化
29
0.13±
0.11**
0.16±
0.27**
6.9±
0.5*
231±
57*
注:与正常组比较*P<0.05;**P<0.01,△P>0.05;与高、低分化组比较▲P<0.05中明显增高,与组织分级和临床分期无关。
, http://www.100md.com
4.统计学处理:组间差异显著性检验采用t检验。
三、讨论
转移的卵巢癌细胞粘附于腹膜表面的机制还不十分清楚。已证明肿瘤细胞粘附于细胞外基质和基底膜成分由特殊的细胞表面受体所介导,该受体与细胞外粘附蛋白相互作用。在恶性细胞中,细胞外基质成分FN的表达明显减少,致使细胞连接和细胞骨架发生改变,某些恶性表型如游走、侵袭等行为得以加强,细胞易于脱离原瘤灶而播散。我们在试验中发现,卵巢癌组织FN表达与细胞分化程度有关,分化越差的癌细胞其表达越低,甚至在癌巢中表达缺失,尽管如此,癌巢周围的纤维结缔组织中仍是免疫染色阳性。从而使得一方面细胞易于脱落进入腹腔,另一方面结缔组织中FN对低分化肿瘤细胞的较强趋化作用,使其不断向基底膜或癌巢周围结缔组织中侵袭蔓延。另外,腹水中高含量的FN对肿瘤细胞的趋化作用,使之易于游走并与腹膜表面接触[1]。

, http://www.100md.com
图2 正常卵巢组织FN阳性表达 DAB染色(图3~6同) ×200(图3~6同)

图3 高分化卵巢癌FN阳性颗粒减少

图4 低分化卵巢癌FN阳性物质明显减少,癌巢周围结缔组织仍为FN阳性表达

图5 CD29在高分化卵巢癌阳性表达

图6 CD29在低分化卵巢中的表达
, http://www.100md.com 整合素(Integrins)是一组细胞表面跨膜受体,由α链和β链以非共价键形成异构二聚体,在识别细胞外基质成分中起着重要的作用。多项研究表明,整合素介导肿瘤细胞的转移。随着肿瘤转移机制研究的深入发展,注意到FN与整合素受体相互作用在肿瘤进展中的重要意义。CD29是整合素β1链,β1类整合素是多种细胞外基质蛋白的受体。能结合FN的β1类整合素包括α3β1、α4β1、α5β1、αVβ1;细胞结合于Ⅰ型胶原由α1β1、α2β1、α3β1介导,结合于层粘连蛋白由α1β1、α2β1、α6β1介导[2]。体外实验表明CD29表达与肿瘤细胞迁移和侵袭的能力成正比。尽管如此,癌基因的表达在体内、体外或不同肿瘤的试验中对CD29的影响有不同的结果[3]。我们的试验表明,与正常卵巢和高分化的卵巢浆液性囊腺癌相比,低分化卵巢癌细胞在FN表达明显降低的同时,CD29表达增多,与临床分期无关。推测这种改变在卵巢癌腹腔种植过程中起作用,CD29类整合素可能介导脱落的肿瘤细胞与腹膜表面的细胞外基质蛋白连接,通过诱导信号转导引发侵袭种植。我们认为,在卵巢浆液性囊腺癌转移过程中,癌细胞FN减少与CD29即整合素β1链表达增多以及腹水FN的增加可能具有有机的联系,是肿瘤转移的潜在促进因素。动物实验表明,CD29抗体抑制胚胎血管形成步骤中管腔的形成[4]。因此,低分化卵巢癌细胞过表达CD29的意义还可能有利于转移灶血管的形成。
, 百拇医药
早期多项体外实验证实了CD29在肿瘤转移侵袭中的重要作用[5]。Moser等[6]用CD29抗体抑制了体外卵巢癌细胞与Ⅰ型胶原粘附,支持CD29介导卵巢癌细胞腹膜内播散的观点。而 Cannistra SA在体外实验中发现CD29抗体不明显抑制卵巢癌细胞与单层生长的间皮细胞的结合,因此认为,在卵巢癌腹腔种植中,整合素不起重要作用[7]。恶性肿瘤是多元化实体,由多克隆的子体组成,很多特性在子体中是不同的,同一肿瘤细胞在体内和体外可表达不同的整合素、也可表现出不同的生物学行为[4]。本组资料中低分化卵巢癌过表达CD29,提示这种分子在肿瘤细胞侵袭到腹膜间皮下细胞外基质的过程中起着重要的作用。关于卵巢癌腹腔转移机制中整合素的作用还应深入研究,旨在从抗粘附的角度寻找有效的治疗方法。
基金项目:中国人民解放军总装备部卫生部医药卫生科研基金资助项目
参考文献
, 百拇医药
1,Murata J,Saiki I,Yoneda J,et al.Dffernces in Chemotaxis to Fibronectin in Weakly and Highly Metastatic Tumor Cells.Jpn J Cancer Res,1992,83:1327-1333.
2,Akiyama SK,Olden K,Yamada KM.Fibronectin and integrins in invasion and metastasis. Cancer metastasis Rev, 1995,14:173-198.
3,Beauvais A,Erickson CA,Goins T,et al.Chengs in the fibronectin-specific integrin expression patten modify the migratory behavior of sarcoma S180 cells in vitro and in the embryonic environment.J Ceel Biol,1995,128:699-713.
, http://www.100md.com
4,Darke CJ,Davis LA,Little CD et al.Antibodies to β1-integrins cause alterations of aortic vasculogenesis in vivo.Dev Dynamics,1992,193:83-91.
5,Yamada KM,Kennedy DW,Yamada SS,et al.Monoclonal antibody and synthetic peptide inhibitors of human tumor cell migration.Cancer Res,1990,50:4485-4496.
6,Moser TL,Pizzo SV,Bafetti LM,et al.Evidence for preferential adhesion of ovarian epithelial carcinoma ceels to type I collagen mediated by the alpha2beta1 integrin.Int J Cancer,1996,67:695-701.
7,Cannistra SA, Ottensmeier C, Niloff J, et al.Expression and function of β1 and αVβ3 integrins in ovarian cancer. Gynecol Oncol,1995,58:216-225.
(收稿日期:1999-06-02), 百拇医药