人重组P53蛋白的制备
作者:李卓炜 吴逸明 陈琛 贾定武 许东
单位:李卓炜(河南省卫生防疫站环境卫生科 郑州 450003);吴逸明 陈琛 贾定武 许东(河南医科大学劳动卫生学与卫生毒理学教研室 郑州 450052)
关键词:重组质粒;免疫印迹;技术
河南医科大学学报000310 摘要 目的:制备人重组P53蛋白。方法:使用含人p53基因的重组质粒pT7Hup53转化大肠杆菌BL21(DE3),于培养过程中加入异丙基-β-D硫代半乳糖苷诱导转化菌表达目的蛋白P53,然后采用溶菌、盐酸胍抽提等方法提取纯化目的蛋白。结果:最终提取物经蛋白电泳(SDS-PAGE)和免疫印记(Western blot)鉴定,确为P53蛋白,含量约0.373 g/L。
分类号 Q503
The preparation of human P53 protein
, 百拇医药
LI Zhuowei, JIA Dingwu,(Department of Environment, Henan Provincial Prevention and Antiepidemic Station,Zhengzhou,450003)
WU Yiming, CHEN Chen, XU Dong
(Department of Occupational Health and Health Toxicology, Henan Medical University, Zhengzhou 450052)
Abstract Aim:To prepare human recombination P53 protien.Method:Use the recombinant plasmid pT7-7 Hup53 with human p53 cDNA to transform E coli BL21(DE3). During the culture, add into IPTG to induce the transform bacterium to express destination protein P53. And then, with these methods of lysing bacterium and extracted by guanidine hydrochloride extract and purify the destination protein. Result: It was confirmed by protein electrophoresis (SDS-PAGE) and immunoblot (Western blot) that the final extract was human P53 protein, and the content was about 0.373 g/L.
, 百拇医药
Key words recombinant plasmid; immunoblot; technology
p53抑癌基因是迄今为止所发现的人类肿瘤相关性最高的抑癌基因。人的p53抑癌基因位于17p13,它含有11个外显子和10个内含子。p53抑癌基因编码的P53蛋白由393个氨基酸组成,相对分子质量为53 000,属核蛋白类。作者利用由大肠杆菌BL21(DE3)和Midgley等构建的重组质粒pT 7-7Hup53原核表达系统制备了人重组P53蛋白[1],制备方法报道如下。
1 材料与方法
1. 1 主要试剂 核酸相对分子质量参照物λDNA/ EcoR I+Hind III、溶菌酶和限制性内切酶PVU II、EcoR I,购自华美生物工程公司;盐酸胍,酶级超纯,BRL产品;异丙基-β-D-硫代半乳糖苷(IPTG),Promaga产品;DNAase I,Sigma产品;G-100,Pharmacia产品;鼠抗人p53单克隆抗体DO-1,Santa Cruz产品;兔抗人p53多克隆抗体CM-1、大肠杆菌BL21(DE3)、重组质粒pT 7-7 Hup53,由英国Dundee大学医学科学院研究所生物化学部Midgley教授惠赠。
, 百拇医药
1.2 方法
1.2.1 人p53 cDNA重组质粒pT7-7Hup53的转化:大肠杆菌菌株BL 21(DE 3)穿刺培养保存于半固体培养基。无菌条件下,于LB琼脂平板上划线培养过夜。从平板上挑取4~5个分散良好的菌落转移到2 ml LB液体培养基,37 ℃水浴振摇培养过夜,摇速250 r/min。 取过夜培养物20 ml转移至含2 ml LB的小试管中,37 ℃剧烈振摇培养约2 h,测A600约0.5左右时,取1.5 ml菌液于Eppendorf管中,以4 000 r/min离心10 min,弃去上清。加800 μl冰预冷的转化缓冲液(100 mmol/L CaCl2,70 mmol/L,MgCl2,40 mmol/L NaAc,100 mmol/L KCl),吹打重悬细胞,置0~4 ℃冰浴15 min,再以同样速度离心10 min,弃尽上清。加入50 μl转化缓冲液,轻轻吹打重悬细胞。然后取质粒pT 7-7 Hup53 2 μl转移至菌悬液中,混匀,置0~4 ℃冰浴30 min。将离心管转至42 ℃恒温水浴箱,热休克100 s,使 DNA进入宿主菌,迅速将管转至0~4 ℃冰浴,使细胞冷却2 min。 加入LB 600 μl,于37 ℃水浴中速振摇复性1 h(摇速,200 r/min)后。将400 μl培养物倒在含氨苄青霉素(Amp,100 mg/L)的LB琼脂上,并用涂布棒将菌液均匀涂布于整个平板表面。待表面水分吸收后,倒置放入37 ℃恒温培养箱培养12 h。
, 百拇医药
1.2.2 质粒pT 7-7 Hup53的提取及鉴定:参照《分子克隆实验指南》,采取碱裂解法小量制备质粒DNA[2]。各取质粒pT 7-7 Hup53 10 μl放于微量离心管中,编号为1,2,3,于1和2号管加入2 μl缓冲液B(pH 7.5,6 mmol/L Tris.Cl,6 mmol/L MgCl2,50 mmol/L NaCl),3号管内加2 μl 缓冲液H(pH 7.5,90 mmol/L Tris.Cl,10 mmol/L MgCl2,50 mmol/L NaCl)。再于1号管加限制性内切酶PVUⅡ及EcoR I各1个单位,2号管只加入PVUⅡ 1个单位,3号管仅加入EcoR I 1个单位。加水8 μl,混匀,37 ℃水浴酶切过夜。10 g/L琼脂糖凝胶电泳,以DNA相对分子质量标准(λDNA/Hind Ⅲ+EcoR I)作参照。电泳条件:以TAE作为电泳缓冲液,电压75 V。电泳1~2 h后,取出凝胶,放入0.5 mg/L EB染液中避光染色30 min,然后用紫外透射仪观察荧光条带。
, 百拇医药
1.2.3 人P53蛋白在原核细胞中的表达、制备及鉴定:将10 ml BL 21(DE 3)(pT 7-7 Hup53)过夜培养物倒入1 L LB中(含Amp 50 ml/L),37 ℃强烈振荡培养(300 r/min)至A600约为0.4时,加入IPTG继续培养2 h 。将培养物倒入离心管内,4 ℃,1 000 r/min离心10 min。再用冰预冷的50 mmol/L Tris.Cl pH 8.0洗涤沉淀2次。按0.66 ml/g加裂解液(100 g/L蔗糖,50 mmol/L Tris.Cl pH 8.0),混匀后可贮于-70 ℃备用。用时取出,25 ℃水浴融解后,放于0 ℃水浴。按每ml菌液加入15 μl 10g/L溶菌酶,20 μl 5 mol/L NaCl,轻轻吹打混匀。0 ℃静置45 min,然后转至37 ℃水浴1 min,再放回0 ℃,重复该过程,直至管内混合物非常粘稠。按每g大肠杆菌加入20 μl 2 g/L DNAase I,室温放置至菌液不再粘稠。以12 000 r/min 4 ℃离心15 min,弃去上清。加洗涤缓冲液(100 mmol/L NaCl,2 mmol/L EDTA,5 g/L Triton X-100,1 mmol/L PMSF,50 mmol/L Tris.Cl pH 8.0)重悬沉淀,以同样条件离心20 min ,重复洗涤过程2~3次,以确保沉淀大部分为含有目的蛋白的包涵体。加入10 ml 5 mol/L盐酸胍提取缓冲液(5 mol/L盐酸胍,50 mmol/L Tris.Cl pH 8.0,0.05 g/L Tween-80)于4 ℃放置4 h,并不断轻轻摇动,以12 000 r/min离心15 min,吸取上清转移至另一离心管中,迅速加入4倍体积的谷胱甘肽复性液,溶液各成分终浓度为1 mol/L盐酸胍,50 mmol/L Tris.Cl pH 8.0,0.05 g/L Tween-80,2 mmol/L还原型谷胱甘肽。将提取物放于4 ℃,轻轻摇动混合12~18 h,经梯度透析后除去盐酸胍。透析液成分:50 mmol/L Tris.Cl pH 8.0,150 mmol/L NaCl,0.05 g/L Tween-80;透析梯度:300~150 mmol/L NaCl。以12 000 r/min 4 ℃离心10 min,吸取上清。以葡聚糖凝胶G-100作为填料,将抽提物用饱和硫酸胺浓缩后上样洗脱。洗脱液成分:50 mmol/L Tris.Cl pH 8.0,1 mmol/L EDTA,0.1 g/L巯基乙醇,10 g/L甘油,500 mmol/L NaCl。采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测各管蛋白成分,将含目的蛋白的管内液体合并,透析除盐并浓缩(透析液:50 mmol/L Tris.Cl pH 8.0,500 g/L甘油,0.01 g/L巯基乙醇,1 mmol/L EDTA)。
, 百拇医药
1.2.4 P53蛋白的定性和定量:用50~200 g/L的SDS-PAGE梯度凝胶电泳分离蛋白以鉴定蛋白纯度,以标准蛋白,BL 21(pT 7-7 Hup53)菌的IPTG诱导及未诱导培养物做对照。电泳条件:电流25 mA,电泳时间持续约3 h。考马斯亮兰染色,脱色过夜后即可观察各条亮蓝色蛋白带;用免疫印迹法对提取的P53蛋白定性。取不同稀释度的人P53蛋白提取物上样电泳。电泳结束后,经电转移将凝胶上的大部分蛋白质转移至硝酸纤维素膜(硝膜)上。取出硝膜,丽春红S染色2 min,即显出各条蛋白带。将硝膜浸入封闭液(200 g/L胎牛血清+800 g/L 0.1 mol TBS+1 g/L Triston X-100),4 ℃浸泡过夜后铺于玻璃板上,分别以兔抗人p53多克隆抗体CM-1(体积比1∶500稀释)和鼠抗人p53单克隆抗体DO-1(0.1 mg/L)作一抗,室温1 h。用PBS缓冲液清洗4次,5 min/次。然后用封闭液按体积比1:50稀释辣根过氧化物酶标记的羊抗兔IgG,以DO-1为一抗,则二抗为羊抗鼠IgG-HRP。将酶标二抗以上述同样方法与硝膜作用后,重复洗涤过程。最后将硝膜浸泡于新鲜配制的DAB显色液中,约2 min出现明显的特异性反应带后,立即取出硝膜,用蒸馏水冲洗以终止反应。
, 百拇医药
2 结果
2.1 重组质粒pT 7-7 Hup53的鉴定 10 g/L琼脂糖凝胶上样电泳,EB染色后,于紫外分析仪下观察可见:λDNA/EcoR I+Hind Ⅲ参照物电泳后可分出十几条光带。以其为对照,经EcoR I及PVU Ⅱ双酶切后的样品在大约3.7 kb及1 kb处出现2条带。只用一种酶切割的样品仅在3.7 kb处出现1条带。质粒pT 7-7 Hup53的电泳位置与3.6 kb的质粒PBV 220基本接近。鉴定结果与文献提供的有关基础资料相符合,可确定质粒pT 7-7 Hup53重组有人p53 cDNA。
2.2 质粒pT 7-7 Hup53转化大肠杆菌BL 21(DE 3)及目的蛋白的诱导表达 含质粒pT 7-7 Hup53的大肠杆菌BL 21(DE 3)可在含氨苄青霉素的选择培养基上生长。菌落直径1~2 mm,圆形,表面光滑,湿润。在IPTG诱导下,克隆基因人p53 cDNA诱导表达相应的蛋白质人P53蛋白。取未加诱导的细菌培养物作为对照进行蛋白质电泳,在相对分子质量53 000处,出现明显的对照所没有的蛋白质,而其余部分的蛋白条带与对照完全相同(图1,见封三)。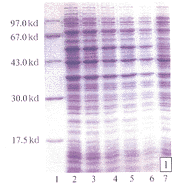
, 百拇医药
图1 IPTG诱导人P53表达
1 标准蛋白;2 2~6加IPTG后3h,2.5h,1.5h,1h的BL21(pT7 7Hup53);7h未加
IPTG的BL21(p T7 7Hup53)过夜培养物
2.3 提取过程中P53蛋白的存在形式分析 在P53蛋白提取的不同阶段取样进行SDS-PAGE,电泳结果见封三图2。由图可见,提取过程中,经IPTG诱导表达的目的蛋白大部分存在于包涵体内,上清液中仅含极少量P53蛋白。
图2 目的蛋白人P53的提取1.2离心后沉淀的不可溶性蛋白部分;3.4上清液中的可溶性蛋白部分;5IPTG诱导的BL21(PT7 7Hup53);6未被诱导的BL21(PT7 7Hup53)
, 百拇医药
2.4 定量 P53蛋白经纯化、浓缩后测A280=0.437 2,A260=0.401 3
按下式计算P53含量得:
Protein=1.55A280-0.76A260=
1.55×0.437 2-0.76×0.401 3=
0.373(g/L)
2.5 定性
2.5.1 SDS-PAGE 以蛋白质相对分子质量标准为参照,在相对分子质量53 000处,有一明显的蓝色蛋白带,其余电泳带不明显。电泳表明本实验所得提取物的主要成分为P53蛋白。
, http://www.100md.com
2.5.2 Western blot:为进一步确定提取物的成分,分别以CM-1及DO-1作为一抗与转至硝酸纤维素膜上的蛋白质进行免疫印迹反应。无论是CM-1还是DO-1均在53 000处出现明显增宽的免疫反应带。使用CM-1为一抗,非特异性显带较多,但非特异性带随样品稀释度增加而明显减少。检测灵敏度为5.595 ng。DO-1特异性较好。Western blot实验结果证明,提取物的主要成分确为人P53蛋白。
3 讨论
本研究所用的原核表达系统由宿主菌BL 21(DE 3)和质粒pT 7-7 Hup53组成。宿主菌BL 21(DE 3)是一溶源菌,其结构特点为:在BL 21大肠杆菌的DNA中整合了入噬菌体的遗传物质。后者的DE 3区携带有编码T 7噬菌体RNA聚合酶的基因,而这一基因的表达受IPTG诱导的启动子LacUV 5的控制。BL 21(DE 3)菌受适宜浓度的IPTG诱导后编码合成T 7 RNA聚合酶,识别T 7启动子,从而启动下游重组DNA的表达。这一表达系统使克隆化基因单独表达,并可以有效地高水平地表达一些在其他表达系统不能有效表达的基因[3,4]。由Midgley等构建的带有人p53 cDNA的重组质粒pT 7-7 Hup53,将质粒pT 7-7 Hup53转化大肠杆菌BL 21(DE3),IPTG诱导p53 cDNA高效表达。表达产物重组人P53蛋白以不可溶无活性的包涵体形式存在于大肠杆菌内。经5 mol/L盐酸胍抽提,梯度透析复性及分子筛层析等步骤获得较纯的P53蛋白。经免疫印迹确定后,即可用于免疫动物及P53蛋白分析。人重组P53蛋白的制备具有重要的应用价值。用纯化的P53蛋白免疫动物可获得相应的多克隆及单克隆抗p53抗体。这些抗体被广泛用于肿瘤组织抑癌基因P53表达的免疫组织化学研究,体液或组织提取液P53蛋白的检测。但由于P53抗体目前均为国外进口试剂,价格昂贵,大大限制了检测的样本量。因此, 利用P53蛋白自行研制抗p53抗体将是降低实
, 百拇医药
*河南省自然科学基金资助项目 991170215
验费用、扩大样本量、增进国内抑癌基因p53研究深度和广度的根本途径。
基金项目:河南省科委自然科学基金资助项目 984020300
研究方向:肺癌的病因学、预防、早期诊断和综合治疗,E-mail:ymwu @ 37.1 net
作者简介:吴逸明,男,55岁,教授,博士生导师,参考文献
[1]Midgley CA, Fisher CJ, Bartek J, et al.Analysis of p53 expression in human tumors:an antibody raised against human p53 &127;expressed in scherichia Coli. J Cell Sci, 1992,101:183
, 百拇医药
[2]J.萨姆布鲁克,E.F.弗里奇,T.曼尼阿蒂斯,著.分子克隆实验指南.金冬雁,黎孟枫译. 第2版.北京:科学出版社, 1992.19
[3]Studier FW,Rosenberg AH,Dunn JJ, et al.Use of T7 RNA polymerase to direct expression of cloned genes. Meth Enzym,1990,185:60
[4]Tabor S,Richardson CC. A bacterialphage T 7 polymerase/promoter system for controlled exclusive expression of spicific genes.Proc Natl Acad Sic USA,1985,82:1074
2000-01-05收稿, 百拇医药
单位:李卓炜(河南省卫生防疫站环境卫生科 郑州 450003);吴逸明 陈琛 贾定武 许东(河南医科大学劳动卫生学与卫生毒理学教研室 郑州 450052)
关键词:重组质粒;免疫印迹;技术
河南医科大学学报000310 摘要 目的:制备人重组P53蛋白。方法:使用含人p53基因的重组质粒pT7Hup53转化大肠杆菌BL21(DE3),于培养过程中加入异丙基-β-D硫代半乳糖苷诱导转化菌表达目的蛋白P53,然后采用溶菌、盐酸胍抽提等方法提取纯化目的蛋白。结果:最终提取物经蛋白电泳(SDS-PAGE)和免疫印记(Western blot)鉴定,确为P53蛋白,含量约0.373 g/L。
分类号 Q503
The preparation of human P53 protein
, 百拇医药
LI Zhuowei, JIA Dingwu,(Department of Environment, Henan Provincial Prevention and Antiepidemic Station,Zhengzhou,450003)
WU Yiming, CHEN Chen, XU Dong
(Department of Occupational Health and Health Toxicology, Henan Medical University, Zhengzhou 450052)
Abstract Aim:To prepare human recombination P53 protien.Method:Use the recombinant plasmid pT7-7 Hup53 with human p53 cDNA to transform E coli BL21(DE3). During the culture, add into IPTG to induce the transform bacterium to express destination protein P53. And then, with these methods of lysing bacterium and extracted by guanidine hydrochloride extract and purify the destination protein. Result: It was confirmed by protein electrophoresis (SDS-PAGE) and immunoblot (Western blot) that the final extract was human P53 protein, and the content was about 0.373 g/L.
, 百拇医药
Key words recombinant plasmid; immunoblot; technology
p53抑癌基因是迄今为止所发现的人类肿瘤相关性最高的抑癌基因。人的p53抑癌基因位于17p13,它含有11个外显子和10个内含子。p53抑癌基因编码的P53蛋白由393个氨基酸组成,相对分子质量为53 000,属核蛋白类。作者利用由大肠杆菌BL21(DE3)和Midgley等构建的重组质粒pT 7-7Hup53原核表达系统制备了人重组P53蛋白[1],制备方法报道如下。
1 材料与方法
1. 1 主要试剂 核酸相对分子质量参照物λDNA/ EcoR I+Hind III、溶菌酶和限制性内切酶PVU II、EcoR I,购自华美生物工程公司;盐酸胍,酶级超纯,BRL产品;异丙基-β-D-硫代半乳糖苷(IPTG),Promaga产品;DNAase I,Sigma产品;G-100,Pharmacia产品;鼠抗人p53单克隆抗体DO-1,Santa Cruz产品;兔抗人p53多克隆抗体CM-1、大肠杆菌BL21(DE3)、重组质粒pT 7-7 Hup53,由英国Dundee大学医学科学院研究所生物化学部Midgley教授惠赠。
, 百拇医药
1.2 方法
1.2.1 人p53 cDNA重组质粒pT7-7Hup53的转化:大肠杆菌菌株BL 21(DE 3)穿刺培养保存于半固体培养基。无菌条件下,于LB琼脂平板上划线培养过夜。从平板上挑取4~5个分散良好的菌落转移到2 ml LB液体培养基,37 ℃水浴振摇培养过夜,摇速250 r/min。 取过夜培养物20 ml转移至含2 ml LB的小试管中,37 ℃剧烈振摇培养约2 h,测A600约0.5左右时,取1.5 ml菌液于Eppendorf管中,以4 000 r/min离心10 min,弃去上清。加800 μl冰预冷的转化缓冲液(100 mmol/L CaCl2,70 mmol/L,MgCl2,40 mmol/L NaAc,100 mmol/L KCl),吹打重悬细胞,置0~4 ℃冰浴15 min,再以同样速度离心10 min,弃尽上清。加入50 μl转化缓冲液,轻轻吹打重悬细胞。然后取质粒pT 7-7 Hup53 2 μl转移至菌悬液中,混匀,置0~4 ℃冰浴30 min。将离心管转至42 ℃恒温水浴箱,热休克100 s,使 DNA进入宿主菌,迅速将管转至0~4 ℃冰浴,使细胞冷却2 min。 加入LB 600 μl,于37 ℃水浴中速振摇复性1 h(摇速,200 r/min)后。将400 μl培养物倒在含氨苄青霉素(Amp,100 mg/L)的LB琼脂上,并用涂布棒将菌液均匀涂布于整个平板表面。待表面水分吸收后,倒置放入37 ℃恒温培养箱培养12 h。
, 百拇医药
1.2.2 质粒pT 7-7 Hup53的提取及鉴定:参照《分子克隆实验指南》,采取碱裂解法小量制备质粒DNA[2]。各取质粒pT 7-7 Hup53 10 μl放于微量离心管中,编号为1,2,3,于1和2号管加入2 μl缓冲液B(pH 7.5,6 mmol/L Tris.Cl,6 mmol/L MgCl2,50 mmol/L NaCl),3号管内加2 μl 缓冲液H(pH 7.5,90 mmol/L Tris.Cl,10 mmol/L MgCl2,50 mmol/L NaCl)。再于1号管加限制性内切酶PVUⅡ及EcoR I各1个单位,2号管只加入PVUⅡ 1个单位,3号管仅加入EcoR I 1个单位。加水8 μl,混匀,37 ℃水浴酶切过夜。10 g/L琼脂糖凝胶电泳,以DNA相对分子质量标准(λDNA/Hind Ⅲ+EcoR I)作参照。电泳条件:以TAE作为电泳缓冲液,电压75 V。电泳1~2 h后,取出凝胶,放入0.5 mg/L EB染液中避光染色30 min,然后用紫外透射仪观察荧光条带。
, 百拇医药
1.2.3 人P53蛋白在原核细胞中的表达、制备及鉴定:将10 ml BL 21(DE 3)(pT 7-7 Hup53)过夜培养物倒入1 L LB中(含Amp 50 ml/L),37 ℃强烈振荡培养(300 r/min)至A600约为0.4时,加入IPTG继续培养2 h 。将培养物倒入离心管内,4 ℃,1 000 r/min离心10 min。再用冰预冷的50 mmol/L Tris.Cl pH 8.0洗涤沉淀2次。按0.66 ml/g加裂解液(100 g/L蔗糖,50 mmol/L Tris.Cl pH 8.0),混匀后可贮于-70 ℃备用。用时取出,25 ℃水浴融解后,放于0 ℃水浴。按每ml菌液加入15 μl 10g/L溶菌酶,20 μl 5 mol/L NaCl,轻轻吹打混匀。0 ℃静置45 min,然后转至37 ℃水浴1 min,再放回0 ℃,重复该过程,直至管内混合物非常粘稠。按每g大肠杆菌加入20 μl 2 g/L DNAase I,室温放置至菌液不再粘稠。以12 000 r/min 4 ℃离心15 min,弃去上清。加洗涤缓冲液(100 mmol/L NaCl,2 mmol/L EDTA,5 g/L Triton X-100,1 mmol/L PMSF,50 mmol/L Tris.Cl pH 8.0)重悬沉淀,以同样条件离心20 min ,重复洗涤过程2~3次,以确保沉淀大部分为含有目的蛋白的包涵体。加入10 ml 5 mol/L盐酸胍提取缓冲液(5 mol/L盐酸胍,50 mmol/L Tris.Cl pH 8.0,0.05 g/L Tween-80)于4 ℃放置4 h,并不断轻轻摇动,以12 000 r/min离心15 min,吸取上清转移至另一离心管中,迅速加入4倍体积的谷胱甘肽复性液,溶液各成分终浓度为1 mol/L盐酸胍,50 mmol/L Tris.Cl pH 8.0,0.05 g/L Tween-80,2 mmol/L还原型谷胱甘肽。将提取物放于4 ℃,轻轻摇动混合12~18 h,经梯度透析后除去盐酸胍。透析液成分:50 mmol/L Tris.Cl pH 8.0,150 mmol/L NaCl,0.05 g/L Tween-80;透析梯度:300~150 mmol/L NaCl。以12 000 r/min 4 ℃离心10 min,吸取上清。以葡聚糖凝胶G-100作为填料,将抽提物用饱和硫酸胺浓缩后上样洗脱。洗脱液成分:50 mmol/L Tris.Cl pH 8.0,1 mmol/L EDTA,0.1 g/L巯基乙醇,10 g/L甘油,500 mmol/L NaCl。采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测各管蛋白成分,将含目的蛋白的管内液体合并,透析除盐并浓缩(透析液:50 mmol/L Tris.Cl pH 8.0,500 g/L甘油,0.01 g/L巯基乙醇,1 mmol/L EDTA)。
, 百拇医药
1.2.4 P53蛋白的定性和定量:用50~200 g/L的SDS-PAGE梯度凝胶电泳分离蛋白以鉴定蛋白纯度,以标准蛋白,BL 21(pT 7-7 Hup53)菌的IPTG诱导及未诱导培养物做对照。电泳条件:电流25 mA,电泳时间持续约3 h。考马斯亮兰染色,脱色过夜后即可观察各条亮蓝色蛋白带;用免疫印迹法对提取的P53蛋白定性。取不同稀释度的人P53蛋白提取物上样电泳。电泳结束后,经电转移将凝胶上的大部分蛋白质转移至硝酸纤维素膜(硝膜)上。取出硝膜,丽春红S染色2 min,即显出各条蛋白带。将硝膜浸入封闭液(200 g/L胎牛血清+800 g/L 0.1 mol TBS+1 g/L Triston X-100),4 ℃浸泡过夜后铺于玻璃板上,分别以兔抗人p53多克隆抗体CM-1(体积比1∶500稀释)和鼠抗人p53单克隆抗体DO-1(0.1 mg/L)作一抗,室温1 h。用PBS缓冲液清洗4次,5 min/次。然后用封闭液按体积比1:50稀释辣根过氧化物酶标记的羊抗兔IgG,以DO-1为一抗,则二抗为羊抗鼠IgG-HRP。将酶标二抗以上述同样方法与硝膜作用后,重复洗涤过程。最后将硝膜浸泡于新鲜配制的DAB显色液中,约2 min出现明显的特异性反应带后,立即取出硝膜,用蒸馏水冲洗以终止反应。
, 百拇医药
2 结果
2.1 重组质粒pT 7-7 Hup53的鉴定 10 g/L琼脂糖凝胶上样电泳,EB染色后,于紫外分析仪下观察可见:λDNA/EcoR I+Hind Ⅲ参照物电泳后可分出十几条光带。以其为对照,经EcoR I及PVU Ⅱ双酶切后的样品在大约3.7 kb及1 kb处出现2条带。只用一种酶切割的样品仅在3.7 kb处出现1条带。质粒pT 7-7 Hup53的电泳位置与3.6 kb的质粒PBV 220基本接近。鉴定结果与文献提供的有关基础资料相符合,可确定质粒pT 7-7 Hup53重组有人p53 cDNA。
2.2 质粒pT 7-7 Hup53转化大肠杆菌BL 21(DE 3)及目的蛋白的诱导表达 含质粒pT 7-7 Hup53的大肠杆菌BL 21(DE 3)可在含氨苄青霉素的选择培养基上生长。菌落直径1~2 mm,圆形,表面光滑,湿润。在IPTG诱导下,克隆基因人p53 cDNA诱导表达相应的蛋白质人P53蛋白。取未加诱导的细菌培养物作为对照进行蛋白质电泳,在相对分子质量53 000处,出现明显的对照所没有的蛋白质,而其余部分的蛋白条带与对照完全相同(图1,见封三)。

, 百拇医药
图1 IPTG诱导人P53表达
1 标准蛋白;2 2~6加IPTG后3h,2.5h,1.5h,1h的BL21(pT7 7Hup53);7h未加
IPTG的BL21(p T7 7Hup53)过夜培养物
2.3 提取过程中P53蛋白的存在形式分析 在P53蛋白提取的不同阶段取样进行SDS-PAGE,电泳结果见封三图2。由图可见,提取过程中,经IPTG诱导表达的目的蛋白大部分存在于包涵体内,上清液中仅含极少量P53蛋白。

图2 目的蛋白人P53的提取1.2离心后沉淀的不可溶性蛋白部分;3.4上清液中的可溶性蛋白部分;5IPTG诱导的BL21(PT7 7Hup53);6未被诱导的BL21(PT7 7Hup53)
, 百拇医药
2.4 定量 P53蛋白经纯化、浓缩后测A280=0.437 2,A260=0.401 3
按下式计算P53含量得:
Protein=1.55A280-0.76A260=
1.55×0.437 2-0.76×0.401 3=
0.373(g/L)
2.5 定性
2.5.1 SDS-PAGE 以蛋白质相对分子质量标准为参照,在相对分子质量53 000处,有一明显的蓝色蛋白带,其余电泳带不明显。电泳表明本实验所得提取物的主要成分为P53蛋白。
, http://www.100md.com
2.5.2 Western blot:为进一步确定提取物的成分,分别以CM-1及DO-1作为一抗与转至硝酸纤维素膜上的蛋白质进行免疫印迹反应。无论是CM-1还是DO-1均在53 000处出现明显增宽的免疫反应带。使用CM-1为一抗,非特异性显带较多,但非特异性带随样品稀释度增加而明显减少。检测灵敏度为5.595 ng。DO-1特异性较好。Western blot实验结果证明,提取物的主要成分确为人P53蛋白。
3 讨论
本研究所用的原核表达系统由宿主菌BL 21(DE 3)和质粒pT 7-7 Hup53组成。宿主菌BL 21(DE 3)是一溶源菌,其结构特点为:在BL 21大肠杆菌的DNA中整合了入噬菌体的遗传物质。后者的DE 3区携带有编码T 7噬菌体RNA聚合酶的基因,而这一基因的表达受IPTG诱导的启动子LacUV 5的控制。BL 21(DE 3)菌受适宜浓度的IPTG诱导后编码合成T 7 RNA聚合酶,识别T 7启动子,从而启动下游重组DNA的表达。这一表达系统使克隆化基因单独表达,并可以有效地高水平地表达一些在其他表达系统不能有效表达的基因[3,4]。由Midgley等构建的带有人p53 cDNA的重组质粒pT 7-7 Hup53,将质粒pT 7-7 Hup53转化大肠杆菌BL 21(DE3),IPTG诱导p53 cDNA高效表达。表达产物重组人P53蛋白以不可溶无活性的包涵体形式存在于大肠杆菌内。经5 mol/L盐酸胍抽提,梯度透析复性及分子筛层析等步骤获得较纯的P53蛋白。经免疫印迹确定后,即可用于免疫动物及P53蛋白分析。人重组P53蛋白的制备具有重要的应用价值。用纯化的P53蛋白免疫动物可获得相应的多克隆及单克隆抗p53抗体。这些抗体被广泛用于肿瘤组织抑癌基因P53表达的免疫组织化学研究,体液或组织提取液P53蛋白的检测。但由于P53抗体目前均为国外进口试剂,价格昂贵,大大限制了检测的样本量。因此, 利用P53蛋白自行研制抗p53抗体将是降低实
, 百拇医药
*河南省自然科学基金资助项目 991170215
验费用、扩大样本量、增进国内抑癌基因p53研究深度和广度的根本途径。
基金项目:河南省科委自然科学基金资助项目 984020300
研究方向:肺癌的病因学、预防、早期诊断和综合治疗,E-mail:ymwu @ 37.1 net
作者简介:吴逸明,男,55岁,教授,博士生导师,参考文献
[1]Midgley CA, Fisher CJ, Bartek J, et al.Analysis of p53 expression in human tumors:an antibody raised against human p53 &127;expressed in scherichia Coli. J Cell Sci, 1992,101:183
, 百拇医药
[2]J.萨姆布鲁克,E.F.弗里奇,T.曼尼阿蒂斯,著.分子克隆实验指南.金冬雁,黎孟枫译. 第2版.北京:科学出版社, 1992.19
[3]Studier FW,Rosenberg AH,Dunn JJ, et al.Use of T7 RNA polymerase to direct expression of cloned genes. Meth Enzym,1990,185:60
[4]Tabor S,Richardson CC. A bacterialphage T 7 polymerase/promoter system for controlled exclusive expression of spicific genes.Proc Natl Acad Sic USA,1985,82:1074
2000-01-05收稿, 百拇医药