反义金属蛋白酶组织抑制因子-1表达质粒对实验性大鼠肝纤维化的影响
作者:杨长青 胡国龄 谭德明 张铮
单位:410008 长沙,湖南医科大学湘雅医院传染病研究所
关键词:肝硬化,实验性;胶原;反义金属蛋白酶组织抑制因子-1
中华内科杂志000612 【摘要】 目的 观察反义金属蛋白酶组织抑制因子-1(TIMP-1)表达质粒对实验性大鼠肝纤维化的影响。方法 运用逆转录巢式(RT-PCR)和重组DNA技术,构建大鼠反义TIMP-1真核细胞表达质粒,经脂质体包埋后,利用腹腔注射将其导入免疫性大鼠肝纤维化模型体内;通过RT-PCR,Ⅰ、Ⅲ型胶原的免疫组化以及Masson胶原染色观察反义TIMP-1表达质粒对大鼠肝纤维化的影响。结果 反义TIMP-1表达质粒可以促进肝脏中Ⅰ、Ⅲ型胶原的降解(P<0.01),且作用较秋水仙碱为强(P<0.05);在病理形态学的观察方面,反义TIMP-1表达质粒对肝纤维化有一定的逆转作用(P<0.05),其作用亦较秋水仙碱为强(P<0.05)。结论 反义TIMP-1表达质粒对肝纤维化有一定的逆转作用。
, http://www.100md.com
Effects of antisense-tissue inhibitor of metalloproteinase-1 expressing plasmid on rat liver fibrosis
YANG Changqing, HU Guoling, TAN Deming, et al.
Institute of Infectious Disease, Xiangya Hospital, Hunan Medical University, Changsha 410008,China
【Abstract】 Objective To observe the effects of antisense-tissue inhibitor of metalloproteinase-1(TIMP-1) expressing plasmid on rat liver fibrosis. Methods We construct the rat antisense-TIMP-1 recombinant plasmid which can be expressed in eucaryotic cells by RT-Nest-PCR and the technique of recombinant DNA. After being encapsulated by lipofectin the antisense-TIMP-1 recombinant plasmid was transferred to the fibrotic liver of rats intraperitoneally, then we observed the effects of the antisense-TIMP-1 plasmid on the fibrotic liver of rats by RT-PCR, immunohistochemistry of type I and type Ⅲ collagen, and Masson staining for pathological study. Results The recombinant plasmid of antisense-TIMP-1 could increase the degradation of type I and type Ⅲ collagen in the rat′s fibrotic liver according to immunohistochemistry as compared with a fibrotic model group(P<0.01) or compared with a colchicine group(P<0.05). According to the pathological study , recombinant plasmid of antisense-TIMP-1have some reverse effects on rat liver fibrosis. Conclusion The recombinant plasmid of antisense-TIMP-1 has a certain extent reverse effects on liver fibrosis.
, 百拇医药
【Key words】 Liver cirrhosis; Collagen; Antisense-tissue inhibitor of metalloproteinase-1
肝纤维化是多种慢性肝病病情发展的共同病理基础,是肝脏细胞外基质(ECM)的合成与降解失衡、导致其过度沉积的结果[1],在ECM 的降解过程中起主要作用的是基质金属蛋白酶(MMPs),其中间质胶原酶(即MMP-1) 在降解纤维化肝脏ECM的主要成分——Ⅰ、Ⅲ型胶原的过程中起主要作用[2]。而对MMP-1活性起主要抑制作用的是金属蛋白酶组织抑制因子-1(TIMP-1),在肝纤维化过程中TIMP-1通过对MMPs(主要是MMP-1)活性的抑制,抑制了Ⅰ、Ⅲ型胶原等ECM的降解,从而导致ECM在肝脏内的过度沉积,促进了肝纤维化的形成和发展[3]。我们运用重组DNA技术构建可表达大鼠反义TIMP-1序列的真核细胞表达质粒,并利用脂染体包埋处理,将其导入免疫性大鼠肝纤维化模型体内,观察其对实验性肝纤维化的影响。
, http://www.100md.com
材料与方法
一、构建重组质粒
1. 引物的设计与合成: 根据TIMP-1的全基因cDNA序列[4]设计PCR扩增用套式引物,T1、T2为1对外引物,T3、T4为1对内引物。引物设计后,由中科院上海细胞生物所赛尔(Cell)公司合成。
T1(F): 5′ TAGAGGAGATACCAC 3′; T2(R): 5′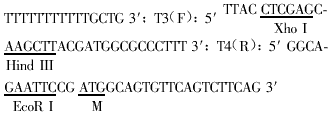
2. 肝脏RNA的提取和RT-PCR扩增TIMP-1 : 运用TRIZOL RNA分离液(GIBCO,USA)提取正常Wistar大鼠肝脏总RNA;以此RNA为模板,经逆转录药盒(GIBCO,USA)合成TIMP-1的cDNA 第一链;再以此cDNA为模板,运用巢式PCR扩增TIMP-1,片段长度为695bp,循环温度和时间均为: 94℃、7 min,94℃、 1 min,55℃、 1 min,72℃、1 min,共32个循环;72℃、5 min,4℃保存。
, 百拇医药
3. 反义TIMP-1表达质粒的构建:将TIMP-1 PCR产物分别经2%琼脂糖电泳分离,用PCR-DNA纯化药盒(Promega,USA)回收和纯化。将纯化后的产物与T载体(Promega,USA)连接,转染JM-109大肠杆菌,经IPTG/X-gal(Promega,USA)蓝白筛选后构建T载体克隆pT/TIMP-1。再从pT/TIMP-1中切下目的片段,反向插入真核细胞表达质粒pcDNA3(湖南医科大学肿瘤研究所李桂源教授馈赠)中,即构建真核细胞表达质粒pcDNA3/反义TIMP-1,再转染大肠杆菌JM-109。
4. 结果鉴定:克隆结果分别经酶切(Xho I + EcoR I)和DNA测序进行鉴定(全自动测序仪377型,PE公司产品,USA)。结果均证实克隆构建成功。
二、动物实验
1. 模型制备: 雌性Wistar大鼠55只,体重120~150 g,湖南医科大学实验动物部提供,清洁饲养。除6只用作正常对照外,其余参照王宝恩等[5]用人血白蛋白免疫攻击的方法制备大鼠免疫性肝纤维化模型,抗大鼠IgG单抗为法国库尔特公司产品。
, 百拇医药
2. 动物分组: 实验动物经过2次静脉免疫攻击后,按随机分组法对存活动物进行分组。C(-)组为模型组,按计划静脉注射白蛋白免疫攻击制作模型,不给予其他任何干预因素。C(+)组为秋水仙碱治疗组,自静脉攻击2周后给予秋水仙碱灌胃治疗,按0.28 mg/kg体重给药,6次/周。T1 组为反义TIMP-1预防组,自静脉攻击2周后给予反义TIMP-1重组质粒50 μg,每2周1次至第8周。T2组为反义TIMP-1治疗组,自静脉攻击4周后给予反义TIMP-1重组质粒50μg,每2周1次至第8周。正常对照组 (N组)每次静脉攻击时只注射等量生理盐水。除正常对照组外,其余各组实验动物白蛋白静脉攻击按计划进行。
3. 重组DNA导入活体动物体内: 提取、纯化重组质粒pcDNA3/反义TIMP-1(Plasmid-DNA回收纯化药盒,Promega,USA)。运用一定量的质粒DNA与不同量的脂质体lipofectin(GIBCO,USA)混合后电泳的方法确定lipofectin与重组质粒pcDNA3/反义TIMP-1的最佳配比关系为1 μg质粒DNA :5 μl lipofectin。每次治疗时每只动物给予50μg重组质粒DNA与相应的脂质体包裹后,腹腔注射。
, http://www.100md.com
三、结果观察
实验动物在静脉攻击第8周结束后,2%戊巴比妥钠腹腔麻醉、取肝组织后断颈处死。部分肝组织作抽提RNA用,部分肝组织置于Carnoy组织固定液中,待作病理学检测和免疫组化。
1. RT-PCR检测TIMP-1的表达:每样本取Total RNA 0.4 μg作逆转录摸板,设计套式引物,外引物:T1: 5′ TAGAGGAGATACCAC 3′; T2 5′ GAAAG-AAAGATGGAGG 3′;内引物:T3: 5′ GCCTGTGGCAT-CCTCTTG3′;T4:5′ GTGTTCGCTCTGGTA-GCC 3′,预计扩增片段长度为536 bp;引物设计后,由中科院上海细胞生物所赛尔公司合成。内对照引物(扩增β-actin):β1 5′ AACCGCGAGAAGATGAACCAGA-TCATGTTT 3′,β2 5′ AGCAGCCGTGGCCATCTCTT-GCTCGAAGTC 3′,套式扩增时,内外引物使用相同;内对照引物由湖南医科大学神经病学研究所肖波教授馈赠,预计扩增片段长度为335bp。逆转录试剂盒为华美公司产品,方法参照说明。利用T载体克隆pT/TIMP-1制备探针并采用地高辛标记,方法参照《分子生物学常用实验方法》[6],用Southern blot对RT-PCR产物进行鉴定。RT-PCR反应结束后,2%琼脂糖凝胶电泳, 再将凝胶置于图像分析仪(Eagle Eye Ⅱ型,USA)下,对反应产物进行综合吸光度值(IDV)量化处理。
, 百拇医药
2. 病理形态学观察:对组织切片用Masson胶原染色法观察。肝纤维化病理学分级参照王宝恩等[7]的标准。
3. Ⅰ、Ⅲ型胶原的免疫组化:Ⅰ、Ⅲ型胶原免疫组化试剂盒(SABC)为武汉博士德生物制品公司产品,方法参照说明。实验结果用图像分析仪(Eagle Eye Ⅱ型,USA)作积分吸光度值(ILD)量化处理。
4. 统计学处理: TIMP-1的表达及Ⅰ、Ⅲ型胶原免疫组化的量化结果使用SPSS 7.0 软件作方差分析(多样本均数内的两两比较),病理形态学的观察结果使用EPI 5.0 软件作趋势分析卡方检验。
结果
1. TIMP-1的表达:由表1可见:(1)各实验组TIMP-1的表达均较N组显著增高(P<0.05~P<0.01)。(2) 使用反义TIMP-1治疗组(T1、T2组), 其TIMP-1的表达较C(-)组和C(+)组为低(P<0.05)。(3)T1、 T2组之间TIMP-1的表达值差异无显著性 (P>0.05)。(4)C(+)组与C(-)组相比,其TIMP-1的表达较低(P<0.05)。
, http://www.100md.com
表1 反义TIMP-1表达质粒对实验动物肝
组织中TIMP-1和Ⅰ、Ⅲ型胶原的影响 组
别
样本
量
TIMP-1 (IDV)
胶原 Ⅰ (ILD)
胶原 Ⅲ (ILD)
N
6
2.06±0.14
62±18
, 百拇医药
100±19
C(-)
6
5.62±0.55##
403±78###
699±102###
C(+)
7
4.01±0.42#*
311±66##*
516±71###*
, 百拇医药
T1
8
3.28±0.74#**+
165±45#**+
339±46##**+
T2
8
3.73±1.05**#+
182±41#**+
353±52##**+
, 百拇医药
注:各实验组与N组相比,# P<0.05,##P<0.01,###P<0.001;各治疗组与C(-)组相比,*P<0.05,**P<0.01;基因治疗组与C(+)组相比,+ P<0.05,++P<0.01 2.病理形态学观察:由表2可见:(1)N组与各实验组(包括基因治疗组)之间的病理学分级差异有显著性 (P<0.05~P<0.01)。(2)T1、T2组与C(-)组相比其病理学分级差异均有显著性(P<0.05~P<0.01)。(3)T1、T2组与C(+)组相比其病理学分级差异均有显著性(P<0.05)。(4)C(+)组与 C(-)组之间的差异无显著性(P>0.05)。 ⑤T1、T2组之间差异亦无显著性 (P>0.05)。
表2 实验动物肝纤维化的级别分布 组别
肝纤维化分级
, http://www.100md.com
合 计
0
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
Ⅵ
N
6
0
0
0
0
, 百拇医药
0
0
6
C(-)##
0
0
0
0
0
3
3
6
C(+)##
, 百拇医药
0
0
0
1
2
2
2
7
T1#**
0
2
2
3
1
, 百拇医药
0
0
8
T2#*
0
1
2
3
1
1
0
8
注:各实验组动物与正常对照组的差异性比较,#P<0.05,## P<0.01;治疗组动物与模型组的差异性比较,*P<0.05,**P<0.01 3.Ⅰ、Ⅲ型胶原的免疫组化:由表1可见:(1)所有实验组动物肝组织切片中Ⅰ、Ⅲ型胶原含量均显著高于N组(P<0.05~P<0.001)。(2)T1、T2组与C(-)组相比其Ⅰ、Ⅲ型胶原的含量显著降低(P<0.05~P<0.01)。(3)T1、T2组Ⅰ、Ⅲ型胶原含量与C(+)组相比有所降低(P<0.05)。(4)C(+)组与 C(-)组相比差异亦有显著性(P<0.05)。(5)T1、T2组之间未见显著差异(P>0.05)。
, 百拇医药
讨论
有人发现在病损肝脏中TIMP-1的表达明显增高,出现时间较早,幅度较大[8]。因此,有越来越多的研究人员把它看作是肝纤维化发生过程中的一个非常重要的促发因素[8,9]。从表1可以看出,在我们的实验中,模型组TIMP-1的表达值较正常对照组增高272%以上。通过给予pcDNA3/反义TIMP-1后(T1、T2组),发现其TIMP-1的表达量均较其他实验组显著降低。这说明pcDNA3/反义TIMP-1经脂质体导入后在活体内能确切的表达,其表达产物在mRNA的水平上封闭了实验动物TIMP-1的表达。我们也发现,秋水仙碱治疗组中TIMP-1的表达较模型组有所减少,可能为秋水仙碱抗肝纤维化作用的机制之一。至于T1、T2组之间未见明显差异,可能与我们的统计样本数较少有关。
在正常人肝脏中,Ⅰ、Ⅲ型胶原占约肝脏总胶原80%左右,在肝脏纤维化变时,Ⅰ、Ⅲ型胶原可占肝脏总胶原的95%以上[10]。TIMP-1抑制的主要蛋白酶即是MMP-1[3,4],而MMP-1作用的主要对象就是Ⅰ、Ⅲ型胶原[2],且对Ⅰ、Ⅲ型胶原的降解能力相近,所以我们把Ⅰ、Ⅲ型胶原的含量变化作为观察的主要指标之一。 在我们的研究中发现同一实验动物经过相同因素的处理,其Ⅰ、Ⅲ型胶原含量的变化表现出高度的一致性(r=0.904,P<0.01)。从Ⅰ、Ⅲ 型胶原含量的变化还发现,一方面,反义TIMP-1基因治疗组和秋水仙碱治疗组的Ⅰ、Ⅲ 型胶原含量均低于模型组,提示治疗因素对肝纤维化的逆转是有一定效果;另一方面,所有实验组动物肝组织切片中Ⅰ、Ⅲ 型胶原的含量均显著高于正常对照组,提示干预因素在一定的时期内,均未能使纤维化肝脏恢复正常。
, 百拇医药
与正常对照组相比,所有实验组(包括基因治疗组)的肝组织病理学分级均有显著差异,这说明使用pcDNA3/反义TIMP-1或秋水仙碱进行治疗,一定时间内均不能使病变肝脏完全恢复至正常。但基因治疗组与肝纤维化模型组之间存在差异,提示pcDNA3/反义TIMP-1对肝纤维化仍有一定的逆转作用。尽管我们发现秋水仙碱对TIMP-1的表达有一定的抑制作用,但在病理形态学的分级方面并未发现秋水仙碱治疗组与肝纤维化模型组之间存在有显著差异,这表明秋水仙碱在肝纤维化治疗中的作用是有限的。
志谢 承蒙湖南医科大学湘雅医院病理科程瑞雪教授、冯德云讲师在病理学观察中给予大力帮助
参考文献
1,Friedman SL. Seminars in medicine of the Beth Israel Hospital, Boston. The cellular basis of hepatic fibrosis: mechanisms and treatment strategies. N Engl J Med, 1993, 328:1828-1835.
, 百拇医药
2,Matrisian LM .The matrix-degrading metalloproteinases. Bioessays, 1992, 14: 455-463.
3,Murphy G, Docherty AJ. The matrix metalloproteinases and their inhibitors. Am J Respir Cell Molec Biot, 1992, 7:120-125.
4,Okada A, Garnier JM, Vicaire S, et al. Cloning of the cDNA encoding rat tissue inhibitor of metnttoproteinase1(TIMP-1), a mino acid comparison with other TIMPs and gene expression in rat tissue. Gene, 1994, 147:301-302.
, 百拇医药
5,王宝恩, 王志富, 殷蔚荑, 等. 实验性免疫肝纤维化模型的研究. 中华医学杂志, 1989, 69:503-505.
6,姜泊, 张亚历, 周殿元,主编.分子生物学常用实验方法.北京:人民军医出版社,1996.54-79.
7,王宝恩, 王惠吉, 朱家璇, 等. 中药复方丹参不同剂型治疗肝纤维化实验研究与临床观察. 肝脏病杂志,1993, 1: 69-72.
8,Herbst H, Wege T, Milani S, et al .Tissue inhibitor of metalloproteinase-1 and -2 RNA expression in rat and human liver fibrosis. Am J Pathol, 1997, 150: 1647-1659.
9,Iredale JP, Benyon RC, Arthur MJ, et al. Tissue inhibitor of metalloproteinase-1 messenger RNA expression is enhanced relative to interstitial collagenase messenger RNA in experimental liver injury and fibrosis. Hepatology, 1996, 24: 176-184.
10,吴裕祈. 细胞因子与肝脏. 中华消化杂志,1998, 18: 166-170.
(收稿日期:1999-11-26), 百拇医药
单位:410008 长沙,湖南医科大学湘雅医院传染病研究所
关键词:肝硬化,实验性;胶原;反义金属蛋白酶组织抑制因子-1
中华内科杂志000612 【摘要】 目的 观察反义金属蛋白酶组织抑制因子-1(TIMP-1)表达质粒对实验性大鼠肝纤维化的影响。方法 运用逆转录巢式(RT-PCR)和重组DNA技术,构建大鼠反义TIMP-1真核细胞表达质粒,经脂质体包埋后,利用腹腔注射将其导入免疫性大鼠肝纤维化模型体内;通过RT-PCR,Ⅰ、Ⅲ型胶原的免疫组化以及Masson胶原染色观察反义TIMP-1表达质粒对大鼠肝纤维化的影响。结果 反义TIMP-1表达质粒可以促进肝脏中Ⅰ、Ⅲ型胶原的降解(P<0.01),且作用较秋水仙碱为强(P<0.05);在病理形态学的观察方面,反义TIMP-1表达质粒对肝纤维化有一定的逆转作用(P<0.05),其作用亦较秋水仙碱为强(P<0.05)。结论 反义TIMP-1表达质粒对肝纤维化有一定的逆转作用。
, http://www.100md.com
Effects of antisense-tissue inhibitor of metalloproteinase-1 expressing plasmid on rat liver fibrosis
YANG Changqing, HU Guoling, TAN Deming, et al.
Institute of Infectious Disease, Xiangya Hospital, Hunan Medical University, Changsha 410008,China
【Abstract】 Objective To observe the effects of antisense-tissue inhibitor of metalloproteinase-1(TIMP-1) expressing plasmid on rat liver fibrosis. Methods We construct the rat antisense-TIMP-1 recombinant plasmid which can be expressed in eucaryotic cells by RT-Nest-PCR and the technique of recombinant DNA. After being encapsulated by lipofectin the antisense-TIMP-1 recombinant plasmid was transferred to the fibrotic liver of rats intraperitoneally, then we observed the effects of the antisense-TIMP-1 plasmid on the fibrotic liver of rats by RT-PCR, immunohistochemistry of type I and type Ⅲ collagen, and Masson staining for pathological study. Results The recombinant plasmid of antisense-TIMP-1 could increase the degradation of type I and type Ⅲ collagen in the rat′s fibrotic liver according to immunohistochemistry as compared with a fibrotic model group(P<0.01) or compared with a colchicine group(P<0.05). According to the pathological study , recombinant plasmid of antisense-TIMP-1have some reverse effects on rat liver fibrosis. Conclusion The recombinant plasmid of antisense-TIMP-1 has a certain extent reverse effects on liver fibrosis.
, 百拇医药
【Key words】 Liver cirrhosis; Collagen; Antisense-tissue inhibitor of metalloproteinase-1
肝纤维化是多种慢性肝病病情发展的共同病理基础,是肝脏细胞外基质(ECM)的合成与降解失衡、导致其过度沉积的结果[1],在ECM 的降解过程中起主要作用的是基质金属蛋白酶(MMPs),其中间质胶原酶(即MMP-1) 在降解纤维化肝脏ECM的主要成分——Ⅰ、Ⅲ型胶原的过程中起主要作用[2]。而对MMP-1活性起主要抑制作用的是金属蛋白酶组织抑制因子-1(TIMP-1),在肝纤维化过程中TIMP-1通过对MMPs(主要是MMP-1)活性的抑制,抑制了Ⅰ、Ⅲ型胶原等ECM的降解,从而导致ECM在肝脏内的过度沉积,促进了肝纤维化的形成和发展[3]。我们运用重组DNA技术构建可表达大鼠反义TIMP-1序列的真核细胞表达质粒,并利用脂染体包埋处理,将其导入免疫性大鼠肝纤维化模型体内,观察其对实验性肝纤维化的影响。
, http://www.100md.com
材料与方法
一、构建重组质粒
1. 引物的设计与合成: 根据TIMP-1的全基因cDNA序列[4]设计PCR扩增用套式引物,T1、T2为1对外引物,T3、T4为1对内引物。引物设计后,由中科院上海细胞生物所赛尔(Cell)公司合成。
T1(F): 5′ TAGAGGAGATACCAC 3′; T2(R): 5′
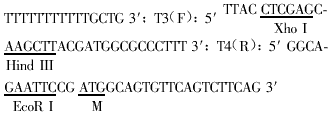
2. 肝脏RNA的提取和RT-PCR扩增TIMP-1 : 运用TRIZOL RNA分离液(GIBCO,USA)提取正常Wistar大鼠肝脏总RNA;以此RNA为模板,经逆转录药盒(GIBCO,USA)合成TIMP-1的cDNA 第一链;再以此cDNA为模板,运用巢式PCR扩增TIMP-1,片段长度为695bp,循环温度和时间均为: 94℃、7 min,94℃、 1 min,55℃、 1 min,72℃、1 min,共32个循环;72℃、5 min,4℃保存。
, 百拇医药
3. 反义TIMP-1表达质粒的构建:将TIMP-1 PCR产物分别经2%琼脂糖电泳分离,用PCR-DNA纯化药盒(Promega,USA)回收和纯化。将纯化后的产物与T载体(Promega,USA)连接,转染JM-109大肠杆菌,经IPTG/X-gal(Promega,USA)蓝白筛选后构建T载体克隆pT/TIMP-1。再从pT/TIMP-1中切下目的片段,反向插入真核细胞表达质粒pcDNA3(湖南医科大学肿瘤研究所李桂源教授馈赠)中,即构建真核细胞表达质粒pcDNA3/反义TIMP-1,再转染大肠杆菌JM-109。
4. 结果鉴定:克隆结果分别经酶切(Xho I + EcoR I)和DNA测序进行鉴定(全自动测序仪377型,PE公司产品,USA)。结果均证实克隆构建成功。
二、动物实验
1. 模型制备: 雌性Wistar大鼠55只,体重120~150 g,湖南医科大学实验动物部提供,清洁饲养。除6只用作正常对照外,其余参照王宝恩等[5]用人血白蛋白免疫攻击的方法制备大鼠免疫性肝纤维化模型,抗大鼠IgG单抗为法国库尔特公司产品。
, 百拇医药
2. 动物分组: 实验动物经过2次静脉免疫攻击后,按随机分组法对存活动物进行分组。C(-)组为模型组,按计划静脉注射白蛋白免疫攻击制作模型,不给予其他任何干预因素。C(+)组为秋水仙碱治疗组,自静脉攻击2周后给予秋水仙碱灌胃治疗,按0.28 mg/kg体重给药,6次/周。T1 组为反义TIMP-1预防组,自静脉攻击2周后给予反义TIMP-1重组质粒50 μg,每2周1次至第8周。T2组为反义TIMP-1治疗组,自静脉攻击4周后给予反义TIMP-1重组质粒50μg,每2周1次至第8周。正常对照组 (N组)每次静脉攻击时只注射等量生理盐水。除正常对照组外,其余各组实验动物白蛋白静脉攻击按计划进行。
3. 重组DNA导入活体动物体内: 提取、纯化重组质粒pcDNA3/反义TIMP-1(Plasmid-DNA回收纯化药盒,Promega,USA)。运用一定量的质粒DNA与不同量的脂质体lipofectin(GIBCO,USA)混合后电泳的方法确定lipofectin与重组质粒pcDNA3/反义TIMP-1的最佳配比关系为1 μg质粒DNA :5 μl lipofectin。每次治疗时每只动物给予50μg重组质粒DNA与相应的脂质体包裹后,腹腔注射。
, http://www.100md.com
三、结果观察
实验动物在静脉攻击第8周结束后,2%戊巴比妥钠腹腔麻醉、取肝组织后断颈处死。部分肝组织作抽提RNA用,部分肝组织置于Carnoy组织固定液中,待作病理学检测和免疫组化。
1. RT-PCR检测TIMP-1的表达:每样本取Total RNA 0.4 μg作逆转录摸板,设计套式引物,外引物:T1: 5′ TAGAGGAGATACCAC 3′; T2 5′ GAAAG-AAAGATGGAGG 3′;内引物:T3: 5′ GCCTGTGGCAT-CCTCTTG3′;T4:5′ GTGTTCGCTCTGGTA-GCC 3′,预计扩增片段长度为536 bp;引物设计后,由中科院上海细胞生物所赛尔公司合成。内对照引物(扩增β-actin):β1 5′ AACCGCGAGAAGATGAACCAGA-TCATGTTT 3′,β2 5′ AGCAGCCGTGGCCATCTCTT-GCTCGAAGTC 3′,套式扩增时,内外引物使用相同;内对照引物由湖南医科大学神经病学研究所肖波教授馈赠,预计扩增片段长度为335bp。逆转录试剂盒为华美公司产品,方法参照说明。利用T载体克隆pT/TIMP-1制备探针并采用地高辛标记,方法参照《分子生物学常用实验方法》[6],用Southern blot对RT-PCR产物进行鉴定。RT-PCR反应结束后,2%琼脂糖凝胶电泳, 再将凝胶置于图像分析仪(Eagle Eye Ⅱ型,USA)下,对反应产物进行综合吸光度值(IDV)量化处理。
, 百拇医药
2. 病理形态学观察:对组织切片用Masson胶原染色法观察。肝纤维化病理学分级参照王宝恩等[7]的标准。
3. Ⅰ、Ⅲ型胶原的免疫组化:Ⅰ、Ⅲ型胶原免疫组化试剂盒(SABC)为武汉博士德生物制品公司产品,方法参照说明。实验结果用图像分析仪(Eagle Eye Ⅱ型,USA)作积分吸光度值(ILD)量化处理。
4. 统计学处理: TIMP-1的表达及Ⅰ、Ⅲ型胶原免疫组化的量化结果使用SPSS 7.0 软件作方差分析(多样本均数内的两两比较),病理形态学的观察结果使用EPI 5.0 软件作趋势分析卡方检验。
结果
1. TIMP-1的表达:由表1可见:(1)各实验组TIMP-1的表达均较N组显著增高(P<0.05~P<0.01)。(2) 使用反义TIMP-1治疗组(T1、T2组), 其TIMP-1的表达较C(-)组和C(+)组为低(P<0.05)。(3)T1、 T2组之间TIMP-1的表达值差异无显著性 (P>0.05)。(4)C(+)组与C(-)组相比,其TIMP-1的表达较低(P<0.05)。
, http://www.100md.com
表1 反义TIMP-1表达质粒对实验动物肝
组织中TIMP-1和Ⅰ、Ⅲ型胶原的影响 组
别
样本
量
TIMP-1 (IDV)
胶原 Ⅰ (ILD)
胶原 Ⅲ (ILD)
N
6
2.06±0.14
62±18
, 百拇医药
100±19
C(-)
6
5.62±0.55##
403±78###
699±102###
C(+)
7
4.01±0.42#*
311±66##*
516±71###*
, 百拇医药
T1
8
3.28±0.74#**+
165±45#**+
339±46##**+
T2
8
3.73±1.05**#+
182±41#**+
353±52##**+
, 百拇医药
注:各实验组与N组相比,# P<0.05,##P<0.01,###P<0.001;各治疗组与C(-)组相比,*P<0.05,**P<0.01;基因治疗组与C(+)组相比,+ P<0.05,++P<0.01 2.病理形态学观察:由表2可见:(1)N组与各实验组(包括基因治疗组)之间的病理学分级差异有显著性 (P<0.05~P<0.01)。(2)T1、T2组与C(-)组相比其病理学分级差异均有显著性(P<0.05~P<0.01)。(3)T1、T2组与C(+)组相比其病理学分级差异均有显著性(P<0.05)。(4)C(+)组与 C(-)组之间的差异无显著性(P>0.05)。 ⑤T1、T2组之间差异亦无显著性 (P>0.05)。
表2 实验动物肝纤维化的级别分布 组别
肝纤维化分级
, http://www.100md.com
合 计
0
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
Ⅵ
N
6
0
0
0
0
, 百拇医药
0
0
6
C(-)##
0
0
0
0
0
3
3
6
C(+)##
, 百拇医药
0
0
0
1
2
2
2
7
T1#**
0
2
2
3
1
, 百拇医药
0
0
8
T2#*
0
1
2
3
1
1
0
8
注:各实验组动物与正常对照组的差异性比较,#P<0.05,## P<0.01;治疗组动物与模型组的差异性比较,*P<0.05,**P<0.01 3.Ⅰ、Ⅲ型胶原的免疫组化:由表1可见:(1)所有实验组动物肝组织切片中Ⅰ、Ⅲ型胶原含量均显著高于N组(P<0.05~P<0.001)。(2)T1、T2组与C(-)组相比其Ⅰ、Ⅲ型胶原的含量显著降低(P<0.05~P<0.01)。(3)T1、T2组Ⅰ、Ⅲ型胶原含量与C(+)组相比有所降低(P<0.05)。(4)C(+)组与 C(-)组相比差异亦有显著性(P<0.05)。(5)T1、T2组之间未见显著差异(P>0.05)。
, 百拇医药
讨论
有人发现在病损肝脏中TIMP-1的表达明显增高,出现时间较早,幅度较大[8]。因此,有越来越多的研究人员把它看作是肝纤维化发生过程中的一个非常重要的促发因素[8,9]。从表1可以看出,在我们的实验中,模型组TIMP-1的表达值较正常对照组增高272%以上。通过给予pcDNA3/反义TIMP-1后(T1、T2组),发现其TIMP-1的表达量均较其他实验组显著降低。这说明pcDNA3/反义TIMP-1经脂质体导入后在活体内能确切的表达,其表达产物在mRNA的水平上封闭了实验动物TIMP-1的表达。我们也发现,秋水仙碱治疗组中TIMP-1的表达较模型组有所减少,可能为秋水仙碱抗肝纤维化作用的机制之一。至于T1、T2组之间未见明显差异,可能与我们的统计样本数较少有关。
在正常人肝脏中,Ⅰ、Ⅲ型胶原占约肝脏总胶原80%左右,在肝脏纤维化变时,Ⅰ、Ⅲ型胶原可占肝脏总胶原的95%以上[10]。TIMP-1抑制的主要蛋白酶即是MMP-1[3,4],而MMP-1作用的主要对象就是Ⅰ、Ⅲ型胶原[2],且对Ⅰ、Ⅲ型胶原的降解能力相近,所以我们把Ⅰ、Ⅲ型胶原的含量变化作为观察的主要指标之一。 在我们的研究中发现同一实验动物经过相同因素的处理,其Ⅰ、Ⅲ型胶原含量的变化表现出高度的一致性(r=0.904,P<0.01)。从Ⅰ、Ⅲ 型胶原含量的变化还发现,一方面,反义TIMP-1基因治疗组和秋水仙碱治疗组的Ⅰ、Ⅲ 型胶原含量均低于模型组,提示治疗因素对肝纤维化的逆转是有一定效果;另一方面,所有实验组动物肝组织切片中Ⅰ、Ⅲ 型胶原的含量均显著高于正常对照组,提示干预因素在一定的时期内,均未能使纤维化肝脏恢复正常。
, 百拇医药
与正常对照组相比,所有实验组(包括基因治疗组)的肝组织病理学分级均有显著差异,这说明使用pcDNA3/反义TIMP-1或秋水仙碱进行治疗,一定时间内均不能使病变肝脏完全恢复至正常。但基因治疗组与肝纤维化模型组之间存在差异,提示pcDNA3/反义TIMP-1对肝纤维化仍有一定的逆转作用。尽管我们发现秋水仙碱对TIMP-1的表达有一定的抑制作用,但在病理形态学的分级方面并未发现秋水仙碱治疗组与肝纤维化模型组之间存在有显著差异,这表明秋水仙碱在肝纤维化治疗中的作用是有限的。
志谢 承蒙湖南医科大学湘雅医院病理科程瑞雪教授、冯德云讲师在病理学观察中给予大力帮助
参考文献
1,Friedman SL. Seminars in medicine of the Beth Israel Hospital, Boston. The cellular basis of hepatic fibrosis: mechanisms and treatment strategies. N Engl J Med, 1993, 328:1828-1835.
, 百拇医药
2,Matrisian LM .The matrix-degrading metalloproteinases. Bioessays, 1992, 14: 455-463.
3,Murphy G, Docherty AJ. The matrix metalloproteinases and their inhibitors. Am J Respir Cell Molec Biot, 1992, 7:120-125.
4,Okada A, Garnier JM, Vicaire S, et al. Cloning of the cDNA encoding rat tissue inhibitor of metnttoproteinase1(TIMP-1), a mino acid comparison with other TIMPs and gene expression in rat tissue. Gene, 1994, 147:301-302.
, 百拇医药
5,王宝恩, 王志富, 殷蔚荑, 等. 实验性免疫肝纤维化模型的研究. 中华医学杂志, 1989, 69:503-505.
6,姜泊, 张亚历, 周殿元,主编.分子生物学常用实验方法.北京:人民军医出版社,1996.54-79.
7,王宝恩, 王惠吉, 朱家璇, 等. 中药复方丹参不同剂型治疗肝纤维化实验研究与临床观察. 肝脏病杂志,1993, 1: 69-72.
8,Herbst H, Wege T, Milani S, et al .Tissue inhibitor of metalloproteinase-1 and -2 RNA expression in rat and human liver fibrosis. Am J Pathol, 1997, 150: 1647-1659.
9,Iredale JP, Benyon RC, Arthur MJ, et al. Tissue inhibitor of metalloproteinase-1 messenger RNA expression is enhanced relative to interstitial collagenase messenger RNA in experimental liver injury and fibrosis. Hepatology, 1996, 24: 176-184.
10,吴裕祈. 细胞因子与肝脏. 中华消化杂志,1998, 18: 166-170.
(收稿日期:1999-11-26), 百拇医药