Smad4基因在人牙乳头细胞内的表达及其意义的探讨*
作者:何文喜 牛忠英 药立波 陈健 季少平
单位:何文喜(第四军医大学:口腔医学院);牛忠英(第四军医大学:口腔医学院);药立波(全军分子生物学重点实验室;陕西 西安 710032);陈健(第四军医大学:口腔医学院);季少平(全军分子生物学重点实验室;陕西 西安 710032)
关键词:人牙乳头细胞;Smad4;转化生长因子-β1;骨形成蛋白-2
牙体牙髓牙周病学杂志000102 摘 要:目的:观察转化生长因子-β超家族特异的细胞内信号转导基因Smad4在人牙乳头细胞内的表达,及其在转化生长因子-β1(TGF-β1)和骨形成蛋白-2(BMP-2)作用下的变化,从细胞内信号转导水平探讨牙齿发育过程中成牙本质细胞的分化机制。方法:原代培养人牙乳头细胞,用TGF-β1和BMP-2刺激培养的细胞,分别从刺激前后的细胞中提取总RNA和总蛋白,采用Northern和Western印迹杂交方法,从mRNA和蛋白水平观察Smad4基因的表达及变化。结果:从mRNA和蛋白水平观察到Smad4基因在人牙乳头细胞内的表达。但在TGF-β1和BMP-2作用下表达无变化。结论:研究证实Smad4基因在人牙乳头细胞内的表达,Smad4基因在信号转导过程中无量的变化,其活化可能是通过蛋白磷酸化途径实现的。
, http://www.100md.com
分类号:R780.2 文献标识码:A
文章编号:1005-2593(2000)01-0004-04
[牙体牙髓牙周病学杂志,2000;10(1):4]
Expression and significance of Smad4 gene
in human dental papilla cell
HE Wen-xi,NIU Zhong-ying, CHEN Jian, et al
School of Stomatology, The Fourth Military Medical University,Xi'an 710032
, 百拇医药
Abstract:AIM:To investigate the expression of Smad4 gene in human dental papilla cells and the variation of mRNA and protein of Smad4 gene on stimulation from human transforming growth factor-β1 (TGF-β1) or human bone morphogenetic protein-2 (BMP-2). METHODS:Total RNA and protein were isolated from primary cultured human dental papilla cells on stimulation from TGF-β1 or BMP-2 in different time. The expression of mRNA and protein of Smad4 gene were detected by Northern blot and Western blot. RESULTS: The expression of mRNA and protein of Smad4 gene were found in human dental papilla cells,but no quantitive change on stimulation from TGF-β1 or BMP-2. CONCLUSION:The expression of mRNA and protein of Smad4 gene in human dental papilla cells were detected. Smad4 gene in TGF-β1 superfamily signaling transduction may be not mediated by quantitive change,possibly mediated by phosphorylation.
, http://www.100md.com
Key Words:human dental papilla cells; Smad4; transforming growth factors-β1,bone morphogenetic protein
[Chinese Journal of Conservative Dentistry, 2000,10(1):4]▲
转化生长因子-β1(TGF-β1)和骨形成蛋白-2(BMP-2)作为转化生长因子-β超家族的成员,在牙齿发育,特别是成牙本质细胞终末分化中发挥重要的,甚至是关键的调控作用[1~4]。目前国内外研究认为,牙齿发育过程中成牙本质细胞终末分化,是由许多生长因子组成的分子网络共同调控发生的,其中TGF-β1和 BMP-2起关键的调控作用[2~5]。但TGF-β1和 BMP-2在成牙本质细胞和牙乳头细胞内的信号转导途径及其调控基因表达方式仍然未能阐明。1996年以后,Smads基因家族的发现,是TGF-β1和 BMP-2信号转导研究的一个突破性的进展。
, 百拇医药
目前,有关TGF-βs和 BMPs人牙乳头间充质细胞内信号转导途径研究,TGF-βs和BMPs在人牙乳头间充质细胞内信号转导是否通过Smad4信号转导途径转导至核内,报道较少。本文目的是观察培养的人牙乳头间充质细胞是否存在Smad4的表达,及在TGF-β1和BMP-2不同时间的刺激条件下其mRNA和蛋白的表达变化,阐明TGF-βs和BMPs在人牙乳头间充质细胞内的信号转导途径。
1 材料和方法
1.1 人牙乳头细胞原代培养和实验分组
选择合法引产的4~5月胎儿,取其牙乳头,组织块法[1]原代培养人牙乳头细胞。培养液为含150ml/L胎牛血清(fetal calf serum,FCS)的DMEM培养液(Gibco,USA)。取生长良好的第5代牙乳头细胞,以浓度3×105/L接种于新的75ml培养瓶,每瓶1ml,加4ml含100ml/L FCS的DMEM的培养液,3d后用含2ml/L FCS的DMEM培养液清洗并培养3h。用含100pmol/L TGF-β1(Promega)和10nmol/L BMP-2(Promega)的2ml/L FCS的DMEM培养液分别刺激并培养6、12、24和48h。对照组继续用含2ml/L FCS的DMEM的培养液培养,不加任何刺激。弃去培养液,用冰冷的1mol/L PBS终止并清洗细胞后,用于以下实验。
, http://www.100md.com
1.2 Smad4 mRNA表达
1.2.1 总RNA的提取
刺激组和对照组细胞用TRIZOL试剂盒提取(LIFE TECHOLOG?ES)总RNA,溶于40μl的1g/L焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水中。取5μl电泳鉴定提取总RNA有无明显的降解。取3μl RNA,用1g/L DEPC水稀释到600μl,分光光度计测定其A260和A280,以确定RNA的纯度和含量。用1g/L DEPC水稀释每组RNA样品至相同的浓度,保证上样量一致。
1.2.2 探针的制备
PDH105/Smad4重组质粒(Dr. Malcolm Whitman, Department of Cell Biology, Harvard Medical School,惠赠)转化大肠杆菌DH5α,挑取阳性克隆,大量培养,用质粒提取试剂盒(上海华舜公司)提取质粒,BamHI酶切消化,10g/L低熔点胶琼脂糖凝胶电泳,用胶回收试剂盒(上海华舜公司)回收目的片段。用缺口平移试剂盒(华美公司)同位素(α-32P)dATP(11.1×109Bq/mol,购自北京亚辉公司)标记Smad4 cDNA探针。
, http://www.100md.com
1.2.3 Northern 印迹杂交
从人牙乳头细胞提取的RNA经甲醛变性后,10g/L琼脂糖变性胶电泳,每孔30μg,以毛细管转移方法将RNA转至硝酸纤维素膜,将硝酸纤维素膜置入聚乙烯杂交袋中,加入预杂交液:500ml/L去离子甲酰胺,5mol/L SSPE(含氯化钠、磷酸二氢钠和乙二胺四乙酸钠二钠盐),2mol/L Denhart试剂(含多聚蔗糖,聚乙烯吡咯烷酮,牛血清白蛋白第五组份),10g/L SDS(十二烷基硫酸钠),鲑鱼精DNA,弃去气泡,封住袋口,置42℃水浴4h,在预杂交液中加入以煮沸变性的α-32P标记的Smad4探针。42℃水浴杂交24h。洗膜:倾出杂交液,2mol/L SSC(含氯化钠,枸橼酸钠),1g/L SDS, 室温洗膜20min;1mol/L SSC, 5g/L SDS, 42℃洗膜30min;100mmol/L SSC, 5g/L SDS,56℃洗膜30min。X线片-70℃放射自显影7~10d,暗室显影5min,定影7min,观察结果。
, http://www.100md.com
1.3 Smad4蛋白的表达
1.3.1 总蛋白的提取
取生长良好的第5代牙乳头细胞,细胞传代和细胞分组、刺激同总RNA的提取。用冰冷的PB终止并清洗细胞后,培养皿置于冰块上,加200μl NP-40 细胞裂解液(10ml/L NP-40,20mmol/L Tris-Cl, pH7.8, 150mmol/L NaCl, 200mg/L NaN3, 1mmol/L EDTA, 用前加入1.7mg/L aprotinin, 1.0mmol/L PMSF),冰上静置20min,橡皮刮收集细胞,离心(12?000g, 4℃,10min),取上清于4℃存放备用。
1.3.2 蛋白定量
蛋白定量按BIO-RAD的蛋白定量试剂盒的标准定量方法进行:用NP-40 细胞裂解液稀释牛血清白蛋白(BSA)至4个不同浓度,分别为0.05、0.1、0.5、1g/L。12.5μl的BSA和待测蛋白到1.5ml管中,加62.5ml试剂A和500μl试剂B, 混匀,15min后,紫外分光光度计测定750nm吸收值。以BSA浓度-吸收值绘制标准曲线。依据标准曲线得出待测蛋白浓度。用NP-40 细胞裂解液稀释各组蛋白,以保证样品上样量一致。
, http://www.100md.com
1.3.3 Western 印迹杂交
将已知浓度的各样品加入5×蛋白上样缓冲液,煮沸10min,离心(10?000g, 4℃,10min), 取上清常规方法做SDS-PAGE。取下聚丙稀酰胺凝胶。用甲醇浸泡固定PVDF膜(polyvinylidene difluoride membrane,Millipore Biotechnology Company),于冰浴条件下电转移(100V电压,3h)。以PBST(含1ml/L Triton的1mol/L PBS)洗去PVDF膜上残留的转移缓冲液,用含50g/L明胶的PBST浸泡PVDF膜,37℃,轻摇1h,封闭非特异性位点。取PVDF膜及1μg 兔抗羊Smad4抗体(SantaCruz)溶于1.5ml PBS中,封入聚乙烯杂交袋中,4℃过夜。用20ml PBST漂洗PVDF膜(37℃,轻轻摇动),共3次(1×15min,2×5min)。再将PVDF膜及1μg羊抗兔抗体(SantaCruz)溶于1.5ml PBS,封入聚乙烯杂交袋中,37℃,轻摇1.5h。同上以PBST 20ml漂洗PVDF膜,共5次(1×15min,4×5min)。用滤纸吸干多余的PBST。取Western 印迹杂交检测试剂盒 ECL(为Amersham公司的化学发光试剂)中1号液及2号液各1ml, 混匀,立即投入PVDF膜,反应1min后,滤纸吸干多余反应液,于暗室条件下压上X线片,感光10min。
, 百拇医药
2 结果
2.1 总RNA
实验组和对照组,总RNA含量在50~65μg之间,A260/A280比值约1.8~2.1,电泳可见28S、18S二条带(图1),其中28S的带最亮,约为18S的2倍,表明所获的总RNA纯度较高,且无明显降解。
图1 人牙乳头细胞总RNA琼脂糖凝胶电泳
2.2 Smad4 cDNA探针的鉴定
Smad4质粒,经BamHI酶切消化,10g/L低熔点胶琼脂糖凝胶电泳可得到长为1196bp的目的片段和载体质粒PDH105(4.10kb)(图2)。
, http://www.100md.com
图2 重组质粒PDH105/Smad4酶切图谱琼脂糖凝胶电泳
1. γDNA/HindⅢ 2、3. PDH105/Smad4经BamHI酶切
2.3 Northern 印迹杂交
Northern 印迹杂交分析表明,不加任何刺激的牙乳头细胞内有Smad4 mRNA的表达,但对照组和实验各组之间mRNA表达量无太大的变化(图3)。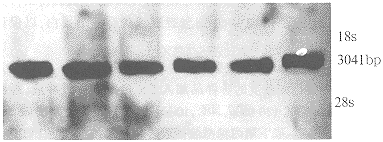
图3 人牙乳头细胞Smad4 mRNA的表达
1. 对照组; 2. TGF-β1刺激6h; 3. TGF-β1刺激12h
4. TGF-β1刺激24h; 5. BMP-2刺激12h; 6. BMP-2刺激24h
, http://www.100md.com
2.4 总蛋白
提取的各组总蛋白经定量后,蛋白含量在0.1~0.3g/L之间。稀释到蛋白浓度为0.2g/L。
2.5 Western印迹杂交
Western印迹杂交结果表明,实验组和对照组人牙乳头细胞内均有Smad4蛋白的表达,但无表达量的变化(图4)。
图4 人牙乳头细胞Smad4蛋白的表达
1.对照组; 2.TGF-β1刺激12h; 3.TGF-β1刺激24h;
4.TGF-β1刺激48h;5.BMP-2刺激24h;6.BMP-2刺激48h;
, 百拇医药
3 讨论
在牙胚发育过程中,上皮与间充质之间的相互作用,通过牙上皮诱导间充质聚集区的细胞因子表达,调控其形态的发生和细胞的分化,其中TGF-βs和BMPs是主要的信号分子[2~6]。免疫组化和分子杂交研究发现,TGF-βs和BMPs 在牙齿发育过程中表现出时间和空间上特殊的表达特征[3],表明TGF-βs和BMPs 参与上皮-间充质之间信号传递,并在细胞分化中参与调节胞外基质的分泌和沉积。BMPs可激活MSX-1、MSX-2、MSX-3和自身在间充质的表达,启动间充质凝聚区的形成[7]。体外培养含有前体细胞的牙乳头,在肝素或FN存在时,TGF-β可诱导细胞极化,发生成牙本质细胞样功能样分化。若用抗TGF-β的单克隆抗体预先使TGF-β失去活性,则这种诱导作用消失,表明TGF-β可诱导成牙本质细胞分化[8]。
牙乳头间充质细胞具有分化形成成牙本质细胞和牙髓细胞的能力,阐明TGF-βs和BMPs在牙乳头间充质细胞内信号转导途径,有利于了解TGF-βs和BMPs在牙胚发育和第三期牙本质形成中的分子机制。本组从新近发现的TGF-βs和BMPs 的细胞内共同的信号分子Smad4入手,旨在弄清TGF-βs和BMPs在牙乳头间充质细胞内信号转导途径,为进一步探索TGF-βs和BMPs下游目的基因打下基础。
, 百拇医药
Smad4首先被命名为DPC4,最初发现在膀胱癌和直肠癌细胞中Smad4突变或缺失,体外转移Smad4 mRNA进入癌细胞,可抑制癌细胞恶性变。因而认为Smad4为一种肿瘤抑制基因,定位于人染色体18q21.1[9]。Smad4为Smads基因家族中的共同中介分子,即转化生长因子β超家族的所有因子的细胞内信号转导都必须通过Smad4介导转位至核内,与转录因子结合共同作用于靶基因,促进其转录或表达[10]。
牙乳头在牙齿发育中具有重要作用,是决定牙齿的形态和结构的重要因素,牙乳头细胞作为牙胚发育过程中唯一具有分化成牙本质细胞能力的间充质细胞群,是研究牙齿发育特别是牙本质形成的重要模型。通过对牙乳头细胞的研究,不仅对揭示成牙本质细胞的分化和牙本质形成有着重要意义,而且使人们对外、中胚层的相互作用有更加深入的认识。本实验组成功培养的牙乳头细胞将有利于研究TGF-βs和 BMPs在促进牙乳头细胞分化的分子机制。
, 百拇医药 TGF-βs和 BMPs在牙乳头间充质细胞的分化过程中扮演重要的作用,但是TGF-βs和 BMPs在牙乳头间充质细胞的信号途径仍不清楚。了解其信号途径,有利于进一步寻找TGF-βs和 BMPs在牙乳头间充质细胞内的目的基因。本研究采用Northern和Western印迹杂交方法,观察到人牙乳头间充质细胞表达Smad4,表明人牙乳头细胞存在Smad4信号转导途径,TGF-βs和BMPs对牙乳头间充质细胞的分化调节很可能是通过Smad4信号途径实现的。同时本实验结果还显示TGF-β1和BMP2刺激不引起Smad4量的变化。推测Smad4在信号转导过程中可能无量的变化,其变化可能是通过蛋白磷酸化途径实现的。
成牙本质细胞终末分化除了TGF-β超家族成员的作用外,其它的细胞因子也参与调节其发生。它们组成一复杂的分子网络共同调控成牙本质细胞终末分化,要了解细胞因子如何协同作用,现代研究已逐步深入细胞内信号转导水平,观察信号在细胞内的转导过程和如何调控目的基因的表达。本实验证实TGF-β超家族的信号转导共同基因Smad4在人牙乳头细胞的表达,将有助于从细胞内信号转导水平揭示成牙本质细胞分化机制,也有助于了解TGF-β超家族成员如TGF-βs和BMPs在牙髓细胞分化和第三期牙本质形成的分子学机制。■
, 百拇医药
*国家自然科学基金资助项目(39870789)
参考文献:
[1] 吴军正,司徒镇强,陈建元,等. 体外培养的人牙龈牙周牙髓成纤维细胞生长曲线及形态特点. 实用口腔医学杂志,1993,9(4):227
[2] Ruch JV, Lesot H, Begue-kirn C. Odontoblast differentiation. Int J Dev Biol,1995,39:51
[3] Thesleff I, Vaahtokari A, Kettunen P, et al. Epithelial-mesenchymal signaling during tooth development. Connect Tissue Res, 1995,32:9
, 百拇医药
[4] Thesleff I, Vaantokari A. The role of growth factors in determination and differentiation of the odontoblastic cell lineage. Proc Finn Dent Soc, 1992,88 (suppl 1):357
[5] Begue-Kirn C, Smith AJ, Ruch JV, et al. Effect of dentin proteins, Transforming growth factor-β, and bone morphogenetic protein-2 on the differentiation of odontoblasts in vitro. Int J Dev Biol, 1992,36:491
[6] Begue-Kirn C, Smith A, Loriot M, et al. Comparative analysis of TGF-βs, BMPs, IGF, msxs,fibronectin, osteonectin and bone sialoprotein gene expressions during normal and in vitro induced odontoblast differentiation. Int J Dev Biol, 1994,38:405
, http://www.100md.com
[7] Bondemark L, Kurol J, Wennberg A. Orthodontic rare earth magnets--in vitro assessment of cytotoxicity. Br J Orthod. 1994, 21(4): 335
[8] Tziafas D. Basic mechanism of cytodifferentiation and dentinogenesis during dental pulp repair. Int J Dev Biol, 1995, 39:281
[9] Hahn S.A,Schutte M,Hoque AT, et al.DPC4,a candidate tumor suppressor gene at human chromosome 18q21.1. Science,1996,271,350
[10]Heldin C.H,Miyazono K,Dijke PT. TGF-β signalling from cell membrane to nucleus through Smad proteins.Nature,1997,390(4):465
收稿日期:1999-10-27, http://www.100md.com
单位:何文喜(第四军医大学:口腔医学院);牛忠英(第四军医大学:口腔医学院);药立波(全军分子生物学重点实验室;陕西 西安 710032);陈健(第四军医大学:口腔医学院);季少平(全军分子生物学重点实验室;陕西 西安 710032)
关键词:人牙乳头细胞;Smad4;转化生长因子-β1;骨形成蛋白-2
牙体牙髓牙周病学杂志000102 摘 要:目的:观察转化生长因子-β超家族特异的细胞内信号转导基因Smad4在人牙乳头细胞内的表达,及其在转化生长因子-β1(TGF-β1)和骨形成蛋白-2(BMP-2)作用下的变化,从细胞内信号转导水平探讨牙齿发育过程中成牙本质细胞的分化机制。方法:原代培养人牙乳头细胞,用TGF-β1和BMP-2刺激培养的细胞,分别从刺激前后的细胞中提取总RNA和总蛋白,采用Northern和Western印迹杂交方法,从mRNA和蛋白水平观察Smad4基因的表达及变化。结果:从mRNA和蛋白水平观察到Smad4基因在人牙乳头细胞内的表达。但在TGF-β1和BMP-2作用下表达无变化。结论:研究证实Smad4基因在人牙乳头细胞内的表达,Smad4基因在信号转导过程中无量的变化,其活化可能是通过蛋白磷酸化途径实现的。
, http://www.100md.com
分类号:R780.2 文献标识码:A
文章编号:1005-2593(2000)01-0004-04
[牙体牙髓牙周病学杂志,2000;10(1):4]
Expression and significance of Smad4 gene
in human dental papilla cell
HE Wen-xi,NIU Zhong-ying, CHEN Jian, et al
School of Stomatology, The Fourth Military Medical University,Xi'an 710032
, 百拇医药
Abstract:AIM:To investigate the expression of Smad4 gene in human dental papilla cells and the variation of mRNA and protein of Smad4 gene on stimulation from human transforming growth factor-β1 (TGF-β1) or human bone morphogenetic protein-2 (BMP-2). METHODS:Total RNA and protein were isolated from primary cultured human dental papilla cells on stimulation from TGF-β1 or BMP-2 in different time. The expression of mRNA and protein of Smad4 gene were detected by Northern blot and Western blot. RESULTS: The expression of mRNA and protein of Smad4 gene were found in human dental papilla cells,but no quantitive change on stimulation from TGF-β1 or BMP-2. CONCLUSION:The expression of mRNA and protein of Smad4 gene in human dental papilla cells were detected. Smad4 gene in TGF-β1 superfamily signaling transduction may be not mediated by quantitive change,possibly mediated by phosphorylation.
, http://www.100md.com
Key Words:human dental papilla cells; Smad4; transforming growth factors-β1,bone morphogenetic protein
[Chinese Journal of Conservative Dentistry, 2000,10(1):4]▲
转化生长因子-β1(TGF-β1)和骨形成蛋白-2(BMP-2)作为转化生长因子-β超家族的成员,在牙齿发育,特别是成牙本质细胞终末分化中发挥重要的,甚至是关键的调控作用[1~4]。目前国内外研究认为,牙齿发育过程中成牙本质细胞终末分化,是由许多生长因子组成的分子网络共同调控发生的,其中TGF-β1和 BMP-2起关键的调控作用[2~5]。但TGF-β1和 BMP-2在成牙本质细胞和牙乳头细胞内的信号转导途径及其调控基因表达方式仍然未能阐明。1996年以后,Smads基因家族的发现,是TGF-β1和 BMP-2信号转导研究的一个突破性的进展。
, 百拇医药
目前,有关TGF-βs和 BMPs人牙乳头间充质细胞内信号转导途径研究,TGF-βs和BMPs在人牙乳头间充质细胞内信号转导是否通过Smad4信号转导途径转导至核内,报道较少。本文目的是观察培养的人牙乳头间充质细胞是否存在Smad4的表达,及在TGF-β1和BMP-2不同时间的刺激条件下其mRNA和蛋白的表达变化,阐明TGF-βs和BMPs在人牙乳头间充质细胞内的信号转导途径。
1 材料和方法
1.1 人牙乳头细胞原代培养和实验分组
选择合法引产的4~5月胎儿,取其牙乳头,组织块法[1]原代培养人牙乳头细胞。培养液为含150ml/L胎牛血清(fetal calf serum,FCS)的DMEM培养液(Gibco,USA)。取生长良好的第5代牙乳头细胞,以浓度3×105/L接种于新的75ml培养瓶,每瓶1ml,加4ml含100ml/L FCS的DMEM的培养液,3d后用含2ml/L FCS的DMEM培养液清洗并培养3h。用含100pmol/L TGF-β1(Promega)和10nmol/L BMP-2(Promega)的2ml/L FCS的DMEM培养液分别刺激并培养6、12、24和48h。对照组继续用含2ml/L FCS的DMEM的培养液培养,不加任何刺激。弃去培养液,用冰冷的1mol/L PBS终止并清洗细胞后,用于以下实验。
, http://www.100md.com
1.2 Smad4 mRNA表达
1.2.1 总RNA的提取
刺激组和对照组细胞用TRIZOL试剂盒提取(LIFE TECHOLOG?ES)总RNA,溶于40μl的1g/L焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水中。取5μl电泳鉴定提取总RNA有无明显的降解。取3μl RNA,用1g/L DEPC水稀释到600μl,分光光度计测定其A260和A280,以确定RNA的纯度和含量。用1g/L DEPC水稀释每组RNA样品至相同的浓度,保证上样量一致。
1.2.2 探针的制备
PDH105/Smad4重组质粒(Dr. Malcolm Whitman, Department of Cell Biology, Harvard Medical School,惠赠)转化大肠杆菌DH5α,挑取阳性克隆,大量培养,用质粒提取试剂盒(上海华舜公司)提取质粒,BamHI酶切消化,10g/L低熔点胶琼脂糖凝胶电泳,用胶回收试剂盒(上海华舜公司)回收目的片段。用缺口平移试剂盒(华美公司)同位素(α-32P)dATP(11.1×109Bq/mol,购自北京亚辉公司)标记Smad4 cDNA探针。
, http://www.100md.com
1.2.3 Northern 印迹杂交
从人牙乳头细胞提取的RNA经甲醛变性后,10g/L琼脂糖变性胶电泳,每孔30μg,以毛细管转移方法将RNA转至硝酸纤维素膜,将硝酸纤维素膜置入聚乙烯杂交袋中,加入预杂交液:500ml/L去离子甲酰胺,5mol/L SSPE(含氯化钠、磷酸二氢钠和乙二胺四乙酸钠二钠盐),2mol/L Denhart试剂(含多聚蔗糖,聚乙烯吡咯烷酮,牛血清白蛋白第五组份),10g/L SDS(十二烷基硫酸钠),鲑鱼精DNA,弃去气泡,封住袋口,置42℃水浴4h,在预杂交液中加入以煮沸变性的α-32P标记的Smad4探针。42℃水浴杂交24h。洗膜:倾出杂交液,2mol/L SSC(含氯化钠,枸橼酸钠),1g/L SDS, 室温洗膜20min;1mol/L SSC, 5g/L SDS, 42℃洗膜30min;100mmol/L SSC, 5g/L SDS,56℃洗膜30min。X线片-70℃放射自显影7~10d,暗室显影5min,定影7min,观察结果。
, http://www.100md.com
1.3 Smad4蛋白的表达
1.3.1 总蛋白的提取
取生长良好的第5代牙乳头细胞,细胞传代和细胞分组、刺激同总RNA的提取。用冰冷的PB终止并清洗细胞后,培养皿置于冰块上,加200μl NP-40 细胞裂解液(10ml/L NP-40,20mmol/L Tris-Cl, pH7.8, 150mmol/L NaCl, 200mg/L NaN3, 1mmol/L EDTA, 用前加入1.7mg/L aprotinin, 1.0mmol/L PMSF),冰上静置20min,橡皮刮收集细胞,离心(12?000g, 4℃,10min),取上清于4℃存放备用。
1.3.2 蛋白定量
蛋白定量按BIO-RAD的蛋白定量试剂盒的标准定量方法进行:用NP-40 细胞裂解液稀释牛血清白蛋白(BSA)至4个不同浓度,分别为0.05、0.1、0.5、1g/L。12.5μl的BSA和待测蛋白到1.5ml管中,加62.5ml试剂A和500μl试剂B, 混匀,15min后,紫外分光光度计测定750nm吸收值。以BSA浓度-吸收值绘制标准曲线。依据标准曲线得出待测蛋白浓度。用NP-40 细胞裂解液稀释各组蛋白,以保证样品上样量一致。
, http://www.100md.com
1.3.3 Western 印迹杂交
将已知浓度的各样品加入5×蛋白上样缓冲液,煮沸10min,离心(10?000g, 4℃,10min), 取上清常规方法做SDS-PAGE。取下聚丙稀酰胺凝胶。用甲醇浸泡固定PVDF膜(polyvinylidene difluoride membrane,Millipore Biotechnology Company),于冰浴条件下电转移(100V电压,3h)。以PBST(含1ml/L Triton的1mol/L PBS)洗去PVDF膜上残留的转移缓冲液,用含50g/L明胶的PBST浸泡PVDF膜,37℃,轻摇1h,封闭非特异性位点。取PVDF膜及1μg 兔抗羊Smad4抗体(SantaCruz)溶于1.5ml PBS中,封入聚乙烯杂交袋中,4℃过夜。用20ml PBST漂洗PVDF膜(37℃,轻轻摇动),共3次(1×15min,2×5min)。再将PVDF膜及1μg羊抗兔抗体(SantaCruz)溶于1.5ml PBS,封入聚乙烯杂交袋中,37℃,轻摇1.5h。同上以PBST 20ml漂洗PVDF膜,共5次(1×15min,4×5min)。用滤纸吸干多余的PBST。取Western 印迹杂交检测试剂盒 ECL(为Amersham公司的化学发光试剂)中1号液及2号液各1ml, 混匀,立即投入PVDF膜,反应1min后,滤纸吸干多余反应液,于暗室条件下压上X线片,感光10min。
, 百拇医药
2 结果
2.1 总RNA
实验组和对照组,总RNA含量在50~65μg之间,A260/A280比值约1.8~2.1,电泳可见28S、18S二条带(图1),其中28S的带最亮,约为18S的2倍,表明所获的总RNA纯度较高,且无明显降解。

图1 人牙乳头细胞总RNA琼脂糖凝胶电泳
2.2 Smad4 cDNA探针的鉴定
Smad4质粒,经BamHI酶切消化,10g/L低熔点胶琼脂糖凝胶电泳可得到长为1196bp的目的片段和载体质粒PDH105(4.10kb)(图2)。

, http://www.100md.com
图2 重组质粒PDH105/Smad4酶切图谱琼脂糖凝胶电泳
1. γDNA/HindⅢ 2、3. PDH105/Smad4经BamHI酶切
2.3 Northern 印迹杂交
Northern 印迹杂交分析表明,不加任何刺激的牙乳头细胞内有Smad4 mRNA的表达,但对照组和实验各组之间mRNA表达量无太大的变化(图3)。

图3 人牙乳头细胞Smad4 mRNA的表达
1. 对照组; 2. TGF-β1刺激6h; 3. TGF-β1刺激12h
4. TGF-β1刺激24h; 5. BMP-2刺激12h; 6. BMP-2刺激24h
, http://www.100md.com
2.4 总蛋白
提取的各组总蛋白经定量后,蛋白含量在0.1~0.3g/L之间。稀释到蛋白浓度为0.2g/L。
2.5 Western印迹杂交
Western印迹杂交结果表明,实验组和对照组人牙乳头细胞内均有Smad4蛋白的表达,但无表达量的变化(图4)。

图4 人牙乳头细胞Smad4蛋白的表达
1.对照组; 2.TGF-β1刺激12h; 3.TGF-β1刺激24h;
4.TGF-β1刺激48h;5.BMP-2刺激24h;6.BMP-2刺激48h;
, 百拇医药
3 讨论
在牙胚发育过程中,上皮与间充质之间的相互作用,通过牙上皮诱导间充质聚集区的细胞因子表达,调控其形态的发生和细胞的分化,其中TGF-βs和BMPs是主要的信号分子[2~6]。免疫组化和分子杂交研究发现,TGF-βs和BMPs 在牙齿发育过程中表现出时间和空间上特殊的表达特征[3],表明TGF-βs和BMPs 参与上皮-间充质之间信号传递,并在细胞分化中参与调节胞外基质的分泌和沉积。BMPs可激活MSX-1、MSX-2、MSX-3和自身在间充质的表达,启动间充质凝聚区的形成[7]。体外培养含有前体细胞的牙乳头,在肝素或FN存在时,TGF-β可诱导细胞极化,发生成牙本质细胞样功能样分化。若用抗TGF-β的单克隆抗体预先使TGF-β失去活性,则这种诱导作用消失,表明TGF-β可诱导成牙本质细胞分化[8]。
牙乳头间充质细胞具有分化形成成牙本质细胞和牙髓细胞的能力,阐明TGF-βs和BMPs在牙乳头间充质细胞内信号转导途径,有利于了解TGF-βs和BMPs在牙胚发育和第三期牙本质形成中的分子机制。本组从新近发现的TGF-βs和BMPs 的细胞内共同的信号分子Smad4入手,旨在弄清TGF-βs和BMPs在牙乳头间充质细胞内信号转导途径,为进一步探索TGF-βs和BMPs下游目的基因打下基础。
, 百拇医药
Smad4首先被命名为DPC4,最初发现在膀胱癌和直肠癌细胞中Smad4突变或缺失,体外转移Smad4 mRNA进入癌细胞,可抑制癌细胞恶性变。因而认为Smad4为一种肿瘤抑制基因,定位于人染色体18q21.1[9]。Smad4为Smads基因家族中的共同中介分子,即转化生长因子β超家族的所有因子的细胞内信号转导都必须通过Smad4介导转位至核内,与转录因子结合共同作用于靶基因,促进其转录或表达[10]。
牙乳头在牙齿发育中具有重要作用,是决定牙齿的形态和结构的重要因素,牙乳头细胞作为牙胚发育过程中唯一具有分化成牙本质细胞能力的间充质细胞群,是研究牙齿发育特别是牙本质形成的重要模型。通过对牙乳头细胞的研究,不仅对揭示成牙本质细胞的分化和牙本质形成有着重要意义,而且使人们对外、中胚层的相互作用有更加深入的认识。本实验组成功培养的牙乳头细胞将有利于研究TGF-βs和 BMPs在促进牙乳头细胞分化的分子机制。
, 百拇医药 TGF-βs和 BMPs在牙乳头间充质细胞的分化过程中扮演重要的作用,但是TGF-βs和 BMPs在牙乳头间充质细胞的信号途径仍不清楚。了解其信号途径,有利于进一步寻找TGF-βs和 BMPs在牙乳头间充质细胞内的目的基因。本研究采用Northern和Western印迹杂交方法,观察到人牙乳头间充质细胞表达Smad4,表明人牙乳头细胞存在Smad4信号转导途径,TGF-βs和BMPs对牙乳头间充质细胞的分化调节很可能是通过Smad4信号途径实现的。同时本实验结果还显示TGF-β1和BMP2刺激不引起Smad4量的变化。推测Smad4在信号转导过程中可能无量的变化,其变化可能是通过蛋白磷酸化途径实现的。
成牙本质细胞终末分化除了TGF-β超家族成员的作用外,其它的细胞因子也参与调节其发生。它们组成一复杂的分子网络共同调控成牙本质细胞终末分化,要了解细胞因子如何协同作用,现代研究已逐步深入细胞内信号转导水平,观察信号在细胞内的转导过程和如何调控目的基因的表达。本实验证实TGF-β超家族的信号转导共同基因Smad4在人牙乳头细胞的表达,将有助于从细胞内信号转导水平揭示成牙本质细胞分化机制,也有助于了解TGF-β超家族成员如TGF-βs和BMPs在牙髓细胞分化和第三期牙本质形成的分子学机制。■
, 百拇医药
*国家自然科学基金资助项目(39870789)
参考文献:
[1] 吴军正,司徒镇强,陈建元,等. 体外培养的人牙龈牙周牙髓成纤维细胞生长曲线及形态特点. 实用口腔医学杂志,1993,9(4):227
[2] Ruch JV, Lesot H, Begue-kirn C. Odontoblast differentiation. Int J Dev Biol,1995,39:51
[3] Thesleff I, Vaahtokari A, Kettunen P, et al. Epithelial-mesenchymal signaling during tooth development. Connect Tissue Res, 1995,32:9
, 百拇医药
[4] Thesleff I, Vaantokari A. The role of growth factors in determination and differentiation of the odontoblastic cell lineage. Proc Finn Dent Soc, 1992,88 (suppl 1):357
[5] Begue-Kirn C, Smith AJ, Ruch JV, et al. Effect of dentin proteins, Transforming growth factor-β, and bone morphogenetic protein-2 on the differentiation of odontoblasts in vitro. Int J Dev Biol, 1992,36:491
[6] Begue-Kirn C, Smith A, Loriot M, et al. Comparative analysis of TGF-βs, BMPs, IGF, msxs,fibronectin, osteonectin and bone sialoprotein gene expressions during normal and in vitro induced odontoblast differentiation. Int J Dev Biol, 1994,38:405
, http://www.100md.com
[7] Bondemark L, Kurol J, Wennberg A. Orthodontic rare earth magnets--in vitro assessment of cytotoxicity. Br J Orthod. 1994, 21(4): 335
[8] Tziafas D. Basic mechanism of cytodifferentiation and dentinogenesis during dental pulp repair. Int J Dev Biol, 1995, 39:281
[9] Hahn S.A,Schutte M,Hoque AT, et al.DPC4,a candidate tumor suppressor gene at human chromosome 18q21.1. Science,1996,271,350
[10]Heldin C.H,Miyazono K,Dijke PT. TGF-β signalling from cell membrane to nucleus through Smad proteins.Nature,1997,390(4):465
收稿日期:1999-10-27, http://www.100md.com