稳定表达的人GDNF基因对PC12细胞的分化作用研究
作者:焦建伟 田竟生 祁亚慧 赫翠珍 商永磊 林嘉友
单位:焦建伟(中国医学科学院 中国协和医科大学基础医学研究所免疫室,北京 100005);田竟生(首都医科大学北京神经科学研究所,北京 100054);祁亚慧(首都医科大学北京神经科学研究所,北京 100054);赫翠珍(首都医科大学北京神经科学研究所,北京 100054);商永磊(首都医科大学北京神经科学研究所,北京 100054)
关键词:胶质细胞源性神经营养因子;基因工程细胞;细胞分化
解剖学报000313 【摘要】 目的 利用自行构建的BHK-hGDNF基因工程细胞,研究GDNF是否具有促进大鼠嗜铬细胞瘤细胞系PC12细胞分化的作用。 方法 从人胎儿脑组织中提取总RNA,用RT-PCR的方法克隆人GDNF基因;利用Lipofecamine将构建的真核表达载体pTARGET/hGDNF(±)转染BHK-21细胞,在含有G418的选择培养基中筛选出稳定表达人GDNF的BHK-hGDNF基因工程细胞。用免疫组织化学的方法检测BHK-hGDNF基因工程细胞中人GDNF的表达。并且用BHK-hGDNF基因工程细胞培养的上清液培养PC12细胞,观察GDNF是否具有促进大鼠嗜铬细胞瘤细胞系PC12细胞分化作用。 结果 构建的正向和反向真核表达载体pTARGET/hGDNF(±)的酶解消化和测序结果正确;用正向真核表达载体pTARGET/hGDNF(+)转染BHK-21细胞后免疫组织化学的结果证明BHK-hGDNF细胞能够表达人GDNF;BHK-hGDNF基因工程细胞培养上清液可以促进PC12细胞分化。 结论 构建的BHK-hGDNF基因工程细胞中表达的人GDNF可以促进PC12细胞分化。
, http://www.100md.com
【中图分类号】 Q593.2;R329.2+8;R329.2+1 【文献标识码】 A 【文章编号】 0529-1356(2000)03-246
THE HUMAN GDNF STABLE EXPRESSION IN ENGINEERED
CELLS INDUCED DIFFERENTIATION OF PC12 CELLS
JIAO Jian-wei TIAN Jing-sheng QI Ya-hui HE Cui-zhen SHANG Yong-Lei LIN Jia-you
(Department of Immunology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences,Beijing 100005,China)
, 百拇医药
(Beijing Institute of Neuroscience, Capital University of Medical Sciences, Beijing 100054,China)
【Abstract】 Objective To explore differentiation of PC12 cells by using stable expression engineered BHK-hGDNF cells. Methods We obtained GDNF DNA from human fetal brain tissues by RT-PCR and two mammalian expression vectors were constructed. The two mammalian expression vectors pTARGET/hGDNF (±) were transfected into BHK-21 cells mediated by lipofecamine. The GDNF stable expression in BHK-GDNF cells was detected by immunohistochemical staining method. To detect if GDNF can induce differentiation of PC12 cells, the PC12 cells were cultured in the supernatant of BHK-GDNF cells culture medium. Results Identifications of pTARGET/hGDNF(±) were confirmed by digestion of endonuclease and sequence analysis; The immunohistochemical staining positive cells were observed in BHK-21 cells that were transfected with pTARGET/hGDNF(+). The PC12 cell can be induced to differentiate to neuronal cell with culture supernatant of BHK-GDNF cells. Conclusions The human GDNF can be expressed by constructed BHK-GDNF engineered cells, and human GDNF is able to induce the differentiation of PC12 cells to neuronal cells.
, 百拇医药
【Key words】 Glial cell line-derived neurotrophic factor; Genetic engineered cells; Cells differentiation
神经营养因子是一类能够促进神经细胞存活、生长和分化的蛋白质或多肽,在神经系统的发育、生长、损伤和修复等过程中发挥重要作用。胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)是1993年Lin等[1]首先在鼠胶质细胞系B49中发现的一种具有特异地促进中脑多巴胺能神经元生存的神经营养因子。人和鼠GDNF分子有93%~95%的同源性。由于GDNF含有的7个保守的半胱氨酸残基与转化生长因子-β(TGF-β)的半胱氨酸残基位置一致,因此GDNF属于TGF-β超家族成员之一。人GDNF基因定位于染色体5p12-p13.1[2],其成熟蛋白含有134个氨基酸残基。体内、外实验表明:GDNF具有很强的促进中脑多巴胺能神经元、中枢胆碱能神经元、脊髓运动神经元交感、副交感感觉神经元的存活作用[3~7]。目前,国外应用GDNF治疗帕金森病已经进入了临床Ⅲ期阶段[8]。在本研究中,我们从人胎儿脑组织中提取总RNA利用RT-PCR的方法克隆了人GDNF的基因,构建了真核表达载体;并且用构建pTARGET/hGDNF(±)真核表达载体分别转染BHK-21细胞,筛选出稳定表达人GDNF的BHK-hGDNF基因工程细胞;探讨GDNF对大鼠嗜铬细胞瘤细胞系PC12的分化作用。
, 百拇医药
图1 pTARGET/hGDNF(±)表达载体的构建
Fig.1 Construction of pTARGET/hGDNF(±) expression vector
材料和方法
1.人GDNF基因的克隆、真核表达载体的构建与鉴定
脑组织来源于因故终止妊娠的胎儿(5个月)(宣武医院妇产科)。取100mg胎脑组织采用异硫氰酸胍一步法提取脑组织总RNA[9]。RNA进行琼脂糖甲醛变性电泳,如果28s和18s清晰无降解则进行反转录反应。在反转录反应中以OligdT15-18(Promega)为引物合成cDNA第1链。然后用cDNA为模板,以GDNF上游、下游引物(合成于上海生物工程公司)进行PCR反应(上游引物:5’gctcgag atg aag tta tgg gat gtc gt 3',下游引物:5’cggatcct cag ata cat cca cac ctt 3')。 PCR扩增条件为:94℃预变性5min,94℃ 45s,58℃ 1min,72℃ 1.5min,35个循环,72℃延伸5min。PCR产物在1.8%琼脂糖凝胶电泳中分析结果。用玻璃奶(博大公司)回收DNA片段约为560bp,克隆入pTARGET(Promega)真核表达载体中,经IPTG诱导蓝白菌落筛选后获得正向和反向pTARGET/hGDNF(±)两种克隆(图1)。用酶切和测序方法对克隆的基因进行鉴定。
, http://www.100md.com
2.用pTARGET/hGDNF(±)转染BHK-21细胞
将BHK-21细胞株(由中国预防科学院病毒所吴小兵博士惠赠)在RPMI1640(Gibco/BRL),10%马血清和5%胎牛血清,37℃、5%的CO2的条件下传代培养,以2×105细胞密度接种于35mm培养皿中。将pTARGET/hGDNF(+)和pTARGET/hGDNF(-)各2μg与10μl lipofecamine(Gibco/BRL)分别用无血清RPMI1640培养液稀释至100μl,混匀后室温放置30min,将形成的DNA-liposome复合物加入0.8ml的无血清RPMI1640培养液,然后加入60%汇片的BHK-21细胞中培养5h,弃掉含有lipofecamine的原培养液,再加入完全培养液继续培养。第3d将细胞以1∶10传代并用含400mg/L G418(Gibco/BRL)的选择培养液培养1个月,挑选阳性细胞克隆。
3.用免疫组织化学法检测GDNF在BHK-21细胞中的表达
, http://www.100md.com
从pTARGET/hGDNF(±)转染的BHK-21细胞中,挑选出阳性细胞克隆分别在35mm培养皿中培养,待细胞长满后用D-PBS(pH7.4)漂洗2次,4%的多聚甲醛室温固定15min;然后用新配置含1%H2O2的D-PBS中室温孵育15min,再用D-PBS漂洗3次,用5%的山羊血清和含0.1% Triton X-100的D-PBS缓冲液在室温下孵育30min,加入1∶100的兔抗人GDNF多克隆抗体(Santa Cruz),4℃孵育24h,D-PBS漂洗3次,加入生物素标记的羊抗兔二抗(北京中山公司)再室温孵育30min,用D-PBS漂洗3次,加入ABC复合物(北京中山公司)置室温孵育1h,再经0.05mol/L Tris-HCl(pH7.4)漂洗3次。最后用含0.5g/L二氨基联苯胺(DAB)的0.05mol/L Tris-HCl缓冲液(含0.0 003% H2O2)倒置显微镜下观察细胞显色。
4.BHK-hGDNF基因工程细胞对PC12细胞的分化作用
, 百拇医药
将转染pTARGET/hGDNF(±)的BHK-21细胞,在无G418培养液中培养48h后,收集上清待用。大鼠嗜铬细胞瘤细胞系PC12细胞(由首都医科大学神经生物室惠赠)在RPMI1640,10%马血清,5%胎牛血清中传代培养。将新传代PC12细胞分成2组:1组加入稳定转染pTARGET/hGDNF(+)质粒的BHK-21细胞培养上清;另1组加入稳定转染pTARGET/hGDNF(-)质粒的BHK-21细胞培养上清。隔天换液1次,连续培养1周,倒置显微镜下观察细胞形态变化。
结 果
1.真核表达载体pTARGET/hGDNF(±)的酶切与测序结果
将回收的PCR产物与pTARGET真核表达载体连接。转化至JM109大肠杆菌感受态细胞中。随机挑取在LB固体培养基(含IPTG/X-gal)上的生长白色克隆。小提质粒后用EcoRI和XhoI/BamHI酶切鉴定。由于在载体多克隆位点的两侧有2个EcoRI酶切位点,人GDNF基因片段中有1个EcoRI酶切位点,因此用EcoRI酶切可以切出两条片段。另外上游引物中含有1个XhoI酶切位点,下游引物中含有1个BamHI酶切位点,因此用XhoI/BamHI酶切可以切出人GDNF基因片段(图2)。并且可以用PstI酶切鉴定插入片段的方向(图片未附),序列测定结果与Genbank报道的序列一致。
, http://www.100md.com
2.真核表达载体pTARGET/hGDNF在BHK21细胞中的表达
将转染pTARGET/hGDNF(±)的BHK-21细胞在含G418的培养液中筛选培养1个月。挑选阳性细胞克隆用ABC免疫组织化学法检测GDNF的表达。结果发现:仅pTARGET/hGDNF(+)转染的BHK-21细胞染成黄褐色,而且细胞核周围染色较深(图3);而pTARGET/hGDNF(-)转染的BHK-21细胞未见染色。因此,结果可以证明成功地转染了pTARGET/hGDNF(+)的BHK-21细胞中有人GDNF的表达。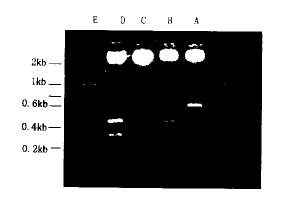
图2 pTAGET/hGDNF(±)的酶解反应鉴定图
A:pTARGET/hGDNF(+)质粒载体的XhoI和BamHI双酶解反应;B:pTARGET/hGDNF(+)质粒载体的EcoRI酶解反应;C:pTARGET/hGDNF(-)质粒载体的BamHI酶解反应;D:pTARGET/hGDNF(-)质粒载体的EcoRI酶解反应;E:200bp DNA Marker
, 百拇医药
Fig.2 Restrictive digestion and identification of recombination vector pTARGET/hGDNF(±)
A,pTARGET/hGDNF(+)/XhoI and BamHI;B,pTARGET/hGDNF(+)/EcoRI;C,pTARGET/hGDNF(-)/BamHI;D,pTARGET/hGDNF(-)/EcoRIE,200bp ladder marker
3.GDNF基因工程细胞培养上清对PC12细胞的分化作用
本实验分为2组:1组在PC12细胞中加入已转染pTARGET/hGDNF(+)的BHK-21细胞培养上清;另1组加入转染pTARGET/hGDNF(-)的BHK-21细胞的培养上清;隔天换液,连续培养1周。由于成功转染pTARGET/hGDNF(+)的BHK-21细胞用免疫组织化学的方法已经证明可以表达人GDNF,因此其培养上清中就有人GDNF的存在,而转染pTARGET/hGDNF(-)的BHK-21细胞,由于真核表达载体中插入的是反向GDNF基因片段,因此没有人GDNF的表达。PC12细胞在上述的细胞上清培养,1周后发现:在含有GDNF上清中培养的PC12细胞具有明显的向神经细胞分化的特性,胞体呈多边形、突起变长,细胞形态类似于神经元,增殖速度与对照组比明显减慢(图4,5)。
, http://www.100md.com
讨 论
目前发现很多神经系统疾病以神经细胞发生退行性病变和死亡为主要的病理表现。有学者认为在神经退性行疾病中大部分神经细胞的死亡是由两种关键因素诱发的神经细胞凋亡,一种因素是缺乏神经营养因子支持,另外一种因素是氧化自由基损伤[10]。神经营养因子是在神经系统的发育、生长和维持过程中发挥重要生理作用的一类活性多肽,它们都是通过与其受体或受体复合物结合后进行信号传导,发挥其生物学效应。近年来发现神经营养因子可以促进很多类型的神经细胞生长和分化,抑制神经细胞的死亡。到目前为止已经发现了至少30种神经营养因子或相关的蛋白。1993年发现的胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)在神经系统中具有很强的促进发育过程中或已经成熟的中枢或外周神经细胞存活和分化作用,并且具有抑制神经细胞损伤后发生的凋亡。
已有的研究发现,大鼠嗜铬细胞瘤细胞系PC12是理想的研究神经细胞分化、生长和凋亡的细胞模型。例如有人发现在有NGF存在的条件下,PC12细胞表现型会转变成为一种不能分裂、具有兴奋性和长出突起的细胞,类似于交感神经元[11]。还有人发现NGF可以抑制无血清条件培养诱导的PC12细胞凋亡[12]。在本研究中我们成功地从人的胎脑组织中克隆了人的GDNF基因,并且将构建真核表达载体pTARGET-hGDNF(±)转染BHK-21细胞,筛选出稳定表达人GDNF的细胞克隆。研究发现:用成功地转染pTARGET-hGDNF(+)的BHK-21细胞的培养上清培养PC12细胞,1周后PC12细胞突起明显增多、增长,形态类似于神经元,而且细胞基本处于不增殖的状态。然而,用pTARGET-hGDNF(-)转染BHK-21细胞组,PC12细胞的形态没有发生改变,并且与未转染的细胞一样增殖速度很快。虽然我们用RT-PCR的方法检测到了BHK-21细胞本身有GDNF mRNA的表达(结果未附),但是在免疫组织化学的结果中却发现,未经pTARGET-hGDNF(+)转染的BHK-21细胞,没有检测到GDNF阳性的细胞。原因可能是由于正常的BHK-21细胞中GDNF的表达水平很低,而且是一种分泌型蛋白,未达到免疫组织化学的检测灵敏度范围。这一点也可以间接地证明我们构建的BHK-hGDNF基因工程细胞可以高效表达人GDNF。
, 百拇医药
目前,基因治疗的方法很多,其中选择合适的基因转移系统是基因治疗能否达到预期目的的关键一步。已有的实验研究发现,用基因工程细胞携带合适的目的基因进行基因治疗,已经取得了很好的实验疗效[13]。因此,在此实验基础上,我们要进一步将BHK-hGDNF基因工程细胞应用于神经系统退性行疾病实验性治疗的研究中。


图3 免疫组织化学法检测PTAGET/hGDNF(+)在BHK-21细胞中的表达×200
图4,5BHK-hGDNF基因工程细胞培养上清液对PC12 细胞的分作用
图4加PTAGET/hGDNF(-)转染的BHK-21细胞培养上清×400
, 百拇医药
图5 加PTAGET/hGDNF(+)转染的BHK-21细胞培养上清×400
Fig.3 Detection of pTaget/hGDNF (+)expression in BHK-21cells by immunohistochemical stain×200
Fig.4 ,5 Differentiation of PC 12 cells induced by culture suoernatant of BHK-GDNF cells
Fig.4 Add supernatant of BHK-21 cells transfected by pTaget/hGDNF (-)×400
Fig.5.Add supernatant of BHK-21cells transfected by pTaget/hGDNF (+)×400
, 百拇医药
【作者简介】 焦建伟(1971—),男,黑龙江省齐齐哈尔市人,微生物药学硕士,在读博士生
通讯作者(To whom correspondence should be addressed)
作者单位:林嘉友(中国医学科学院 中国协和医科大学基础医学研究所免疫室,北京 100005)
参考文献
[1]Lin LF, Doherty DH, Lile JD, et al. GDNF:a glial cell line-derived neurotrophic factor for midbrain dopaminergic neurons[J]. Science,1993,260(5111):1130-1132.
[2]Nessan BE, Renate HI, Fraser GI, et al. Human glial cell line-derived neurotrophic factor(GDNF) maps to chromosome 5[J]. Hum Genet, 1995,96:671-673.
, 百拇医药
[3]Hou JG, Lin LF, Mytilineou C, et al. Glial cell line-derived neurotrophic factor exerts neurotrophic effects on dopaminergic neurons in vitro and promotes their survival and regrowth after damage by 1-methy1-4-phenylpyridinium[J]. J Neurochem, 1996,66(1):74.
[4]Oorschot DE, McLennan IS. The trophic requirements of mature motoneurons[J]. Brain Res,1998,789(2):315-321.
[5]Oppenheim RW, Houenou LJ, Johnson JE, et al. Developing motor neurons rescued from programmed and axotomy-induced cell death by GDNF[J]. Nature,1995,373(6512):344.
, 百拇医药
[6]Buj-Bello A, Buchman VL, Horton A, et al. GDNF is an age-specific survival factor for sensory and autonomic neurons[J]. Neuron,1995,15(4):821-828.
[7]Ebendal T, Tomac A, Hoffer BJ, et al. Glial cell line-derived neurotrophic factor stim ulates fiber formation and survival in cultured neurons from peripheral autonomic ganglia[J]. J Neurosci Res,1995,40(2):276-284.
[8]Lapchak PA. A preclinical development strategy designed to optimize the use of glial cell-line derived neurotrophic factor in the treatment of Parkinson disease[J]. Mov Disord, 1998,13,(suppl 1):49-54.
, 百拇医药
[9]Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning:A Laboratory Manual[M]. 2ed. New York:Cold Spring Harbor Laboratory Press,1989,352-355.
[10]Coyle JT, Puttfarcken P. Oxidatative stress, glutamate, and neurodegenerative disorders[J].Science,1993,262(5134):689-695.
[11]Carol MT, Leonidas ST, Lioyd AG, et al. Mechanism of neuronal degeneration A final common pathway? Advanced in Neurology[M].Philadelphia,New York:Litpincott-Raven,1997,72:103-101.
, 百拇医药
[12]Greene LA, Nerve growth factor prevents the death and stimulates the neuronal differentiation of clonal PC12 pheochromocytoma cells in serum-free medium[J]. J Cell Biol, 1978,78(3):747-755.
[13]Sagot Y, Tan SA, Hammang JP, et al. GDNF slows loss of motoneurons but not axonal degeneration or premature death of pmn/pmn mice[J]. J Neurosci,1996,16(7):2335-2341.
【收稿日期】1999-10-10 【修稿日期】1999-11-30, 百拇医药
单位:焦建伟(中国医学科学院 中国协和医科大学基础医学研究所免疫室,北京 100005);田竟生(首都医科大学北京神经科学研究所,北京 100054);祁亚慧(首都医科大学北京神经科学研究所,北京 100054);赫翠珍(首都医科大学北京神经科学研究所,北京 100054);商永磊(首都医科大学北京神经科学研究所,北京 100054)
关键词:胶质细胞源性神经营养因子;基因工程细胞;细胞分化
解剖学报000313 【摘要】 目的 利用自行构建的BHK-hGDNF基因工程细胞,研究GDNF是否具有促进大鼠嗜铬细胞瘤细胞系PC12细胞分化的作用。 方法 从人胎儿脑组织中提取总RNA,用RT-PCR的方法克隆人GDNF基因;利用Lipofecamine将构建的真核表达载体pTARGET/hGDNF(±)转染BHK-21细胞,在含有G418的选择培养基中筛选出稳定表达人GDNF的BHK-hGDNF基因工程细胞。用免疫组织化学的方法检测BHK-hGDNF基因工程细胞中人GDNF的表达。并且用BHK-hGDNF基因工程细胞培养的上清液培养PC12细胞,观察GDNF是否具有促进大鼠嗜铬细胞瘤细胞系PC12细胞分化作用。 结果 构建的正向和反向真核表达载体pTARGET/hGDNF(±)的酶解消化和测序结果正确;用正向真核表达载体pTARGET/hGDNF(+)转染BHK-21细胞后免疫组织化学的结果证明BHK-hGDNF细胞能够表达人GDNF;BHK-hGDNF基因工程细胞培养上清液可以促进PC12细胞分化。 结论 构建的BHK-hGDNF基因工程细胞中表达的人GDNF可以促进PC12细胞分化。
, http://www.100md.com
【中图分类号】 Q593.2;R329.2+8;R329.2+1 【文献标识码】 A 【文章编号】 0529-1356(2000)03-246
THE HUMAN GDNF STABLE EXPRESSION IN ENGINEERED
CELLS INDUCED DIFFERENTIATION OF PC12 CELLS
JIAO Jian-wei TIAN Jing-sheng QI Ya-hui HE Cui-zhen SHANG Yong-Lei LIN Jia-you
(Department of Immunology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences,Beijing 100005,China)
, 百拇医药
(Beijing Institute of Neuroscience, Capital University of Medical Sciences, Beijing 100054,China)
【Abstract】 Objective To explore differentiation of PC12 cells by using stable expression engineered BHK-hGDNF cells. Methods We obtained GDNF DNA from human fetal brain tissues by RT-PCR and two mammalian expression vectors were constructed. The two mammalian expression vectors pTARGET/hGDNF (±) were transfected into BHK-21 cells mediated by lipofecamine. The GDNF stable expression in BHK-GDNF cells was detected by immunohistochemical staining method. To detect if GDNF can induce differentiation of PC12 cells, the PC12 cells were cultured in the supernatant of BHK-GDNF cells culture medium. Results Identifications of pTARGET/hGDNF(±) were confirmed by digestion of endonuclease and sequence analysis; The immunohistochemical staining positive cells were observed in BHK-21 cells that were transfected with pTARGET/hGDNF(+). The PC12 cell can be induced to differentiate to neuronal cell with culture supernatant of BHK-GDNF cells. Conclusions The human GDNF can be expressed by constructed BHK-GDNF engineered cells, and human GDNF is able to induce the differentiation of PC12 cells to neuronal cells.
, 百拇医药
【Key words】 Glial cell line-derived neurotrophic factor; Genetic engineered cells; Cells differentiation
神经营养因子是一类能够促进神经细胞存活、生长和分化的蛋白质或多肽,在神经系统的发育、生长、损伤和修复等过程中发挥重要作用。胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)是1993年Lin等[1]首先在鼠胶质细胞系B49中发现的一种具有特异地促进中脑多巴胺能神经元生存的神经营养因子。人和鼠GDNF分子有93%~95%的同源性。由于GDNF含有的7个保守的半胱氨酸残基与转化生长因子-β(TGF-β)的半胱氨酸残基位置一致,因此GDNF属于TGF-β超家族成员之一。人GDNF基因定位于染色体5p12-p13.1[2],其成熟蛋白含有134个氨基酸残基。体内、外实验表明:GDNF具有很强的促进中脑多巴胺能神经元、中枢胆碱能神经元、脊髓运动神经元交感、副交感感觉神经元的存活作用[3~7]。目前,国外应用GDNF治疗帕金森病已经进入了临床Ⅲ期阶段[8]。在本研究中,我们从人胎儿脑组织中提取总RNA利用RT-PCR的方法克隆了人GDNF的基因,构建了真核表达载体;并且用构建pTARGET/hGDNF(±)真核表达载体分别转染BHK-21细胞,筛选出稳定表达人GDNF的BHK-hGDNF基因工程细胞;探讨GDNF对大鼠嗜铬细胞瘤细胞系PC12的分化作用。

, 百拇医药
图1 pTARGET/hGDNF(±)表达载体的构建
Fig.1 Construction of pTARGET/hGDNF(±) expression vector
材料和方法
1.人GDNF基因的克隆、真核表达载体的构建与鉴定
脑组织来源于因故终止妊娠的胎儿(5个月)(宣武医院妇产科)。取100mg胎脑组织采用异硫氰酸胍一步法提取脑组织总RNA[9]。RNA进行琼脂糖甲醛变性电泳,如果28s和18s清晰无降解则进行反转录反应。在反转录反应中以OligdT15-18(Promega)为引物合成cDNA第1链。然后用cDNA为模板,以GDNF上游、下游引物(合成于上海生物工程公司)进行PCR反应(上游引物:5’gctcgag atg aag tta tgg gat gtc gt 3',下游引物:5’cggatcct cag ata cat cca cac ctt 3')。 PCR扩增条件为:94℃预变性5min,94℃ 45s,58℃ 1min,72℃ 1.5min,35个循环,72℃延伸5min。PCR产物在1.8%琼脂糖凝胶电泳中分析结果。用玻璃奶(博大公司)回收DNA片段约为560bp,克隆入pTARGET(Promega)真核表达载体中,经IPTG诱导蓝白菌落筛选后获得正向和反向pTARGET/hGDNF(±)两种克隆(图1)。用酶切和测序方法对克隆的基因进行鉴定。
, http://www.100md.com
2.用pTARGET/hGDNF(±)转染BHK-21细胞
将BHK-21细胞株(由中国预防科学院病毒所吴小兵博士惠赠)在RPMI1640(Gibco/BRL),10%马血清和5%胎牛血清,37℃、5%的CO2的条件下传代培养,以2×105细胞密度接种于35mm培养皿中。将pTARGET/hGDNF(+)和pTARGET/hGDNF(-)各2μg与10μl lipofecamine(Gibco/BRL)分别用无血清RPMI1640培养液稀释至100μl,混匀后室温放置30min,将形成的DNA-liposome复合物加入0.8ml的无血清RPMI1640培养液,然后加入60%汇片的BHK-21细胞中培养5h,弃掉含有lipofecamine的原培养液,再加入完全培养液继续培养。第3d将细胞以1∶10传代并用含400mg/L G418(Gibco/BRL)的选择培养液培养1个月,挑选阳性细胞克隆。
3.用免疫组织化学法检测GDNF在BHK-21细胞中的表达
, http://www.100md.com
从pTARGET/hGDNF(±)转染的BHK-21细胞中,挑选出阳性细胞克隆分别在35mm培养皿中培养,待细胞长满后用D-PBS(pH7.4)漂洗2次,4%的多聚甲醛室温固定15min;然后用新配置含1%H2O2的D-PBS中室温孵育15min,再用D-PBS漂洗3次,用5%的山羊血清和含0.1% Triton X-100的D-PBS缓冲液在室温下孵育30min,加入1∶100的兔抗人GDNF多克隆抗体(Santa Cruz),4℃孵育24h,D-PBS漂洗3次,加入生物素标记的羊抗兔二抗(北京中山公司)再室温孵育30min,用D-PBS漂洗3次,加入ABC复合物(北京中山公司)置室温孵育1h,再经0.05mol/L Tris-HCl(pH7.4)漂洗3次。最后用含0.5g/L二氨基联苯胺(DAB)的0.05mol/L Tris-HCl缓冲液(含0.0 003% H2O2)倒置显微镜下观察细胞显色。
4.BHK-hGDNF基因工程细胞对PC12细胞的分化作用
, 百拇医药
将转染pTARGET/hGDNF(±)的BHK-21细胞,在无G418培养液中培养48h后,收集上清待用。大鼠嗜铬细胞瘤细胞系PC12细胞(由首都医科大学神经生物室惠赠)在RPMI1640,10%马血清,5%胎牛血清中传代培养。将新传代PC12细胞分成2组:1组加入稳定转染pTARGET/hGDNF(+)质粒的BHK-21细胞培养上清;另1组加入稳定转染pTARGET/hGDNF(-)质粒的BHK-21细胞培养上清。隔天换液1次,连续培养1周,倒置显微镜下观察细胞形态变化。
结 果
1.真核表达载体pTARGET/hGDNF(±)的酶切与测序结果
将回收的PCR产物与pTARGET真核表达载体连接。转化至JM109大肠杆菌感受态细胞中。随机挑取在LB固体培养基(含IPTG/X-gal)上的生长白色克隆。小提质粒后用EcoRI和XhoI/BamHI酶切鉴定。由于在载体多克隆位点的两侧有2个EcoRI酶切位点,人GDNF基因片段中有1个EcoRI酶切位点,因此用EcoRI酶切可以切出两条片段。另外上游引物中含有1个XhoI酶切位点,下游引物中含有1个BamHI酶切位点,因此用XhoI/BamHI酶切可以切出人GDNF基因片段(图2)。并且可以用PstI酶切鉴定插入片段的方向(图片未附),序列测定结果与Genbank报道的序列一致。
, http://www.100md.com
2.真核表达载体pTARGET/hGDNF在BHK21细胞中的表达
将转染pTARGET/hGDNF(±)的BHK-21细胞在含G418的培养液中筛选培养1个月。挑选阳性细胞克隆用ABC免疫组织化学法检测GDNF的表达。结果发现:仅pTARGET/hGDNF(+)转染的BHK-21细胞染成黄褐色,而且细胞核周围染色较深(图3);而pTARGET/hGDNF(-)转染的BHK-21细胞未见染色。因此,结果可以证明成功地转染了pTARGET/hGDNF(+)的BHK-21细胞中有人GDNF的表达。

图2 pTAGET/hGDNF(±)的酶解反应鉴定图
A:pTARGET/hGDNF(+)质粒载体的XhoI和BamHI双酶解反应;B:pTARGET/hGDNF(+)质粒载体的EcoRI酶解反应;C:pTARGET/hGDNF(-)质粒载体的BamHI酶解反应;D:pTARGET/hGDNF(-)质粒载体的EcoRI酶解反应;E:200bp DNA Marker
, 百拇医药
Fig.2 Restrictive digestion and identification of recombination vector pTARGET/hGDNF(±)
A,pTARGET/hGDNF(+)/XhoI and BamHI;B,pTARGET/hGDNF(+)/EcoRI;C,pTARGET/hGDNF(-)/BamHI;D,pTARGET/hGDNF(-)/EcoRIE,200bp ladder marker
3.GDNF基因工程细胞培养上清对PC12细胞的分化作用
本实验分为2组:1组在PC12细胞中加入已转染pTARGET/hGDNF(+)的BHK-21细胞培养上清;另1组加入转染pTARGET/hGDNF(-)的BHK-21细胞的培养上清;隔天换液,连续培养1周。由于成功转染pTARGET/hGDNF(+)的BHK-21细胞用免疫组织化学的方法已经证明可以表达人GDNF,因此其培养上清中就有人GDNF的存在,而转染pTARGET/hGDNF(-)的BHK-21细胞,由于真核表达载体中插入的是反向GDNF基因片段,因此没有人GDNF的表达。PC12细胞在上述的细胞上清培养,1周后发现:在含有GDNF上清中培养的PC12细胞具有明显的向神经细胞分化的特性,胞体呈多边形、突起变长,细胞形态类似于神经元,增殖速度与对照组比明显减慢(图4,5)。
, http://www.100md.com
讨 论
目前发现很多神经系统疾病以神经细胞发生退行性病变和死亡为主要的病理表现。有学者认为在神经退性行疾病中大部分神经细胞的死亡是由两种关键因素诱发的神经细胞凋亡,一种因素是缺乏神经营养因子支持,另外一种因素是氧化自由基损伤[10]。神经营养因子是在神经系统的发育、生长和维持过程中发挥重要生理作用的一类活性多肽,它们都是通过与其受体或受体复合物结合后进行信号传导,发挥其生物学效应。近年来发现神经营养因子可以促进很多类型的神经细胞生长和分化,抑制神经细胞的死亡。到目前为止已经发现了至少30种神经营养因子或相关的蛋白。1993年发现的胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)在神经系统中具有很强的促进发育过程中或已经成熟的中枢或外周神经细胞存活和分化作用,并且具有抑制神经细胞损伤后发生的凋亡。
已有的研究发现,大鼠嗜铬细胞瘤细胞系PC12是理想的研究神经细胞分化、生长和凋亡的细胞模型。例如有人发现在有NGF存在的条件下,PC12细胞表现型会转变成为一种不能分裂、具有兴奋性和长出突起的细胞,类似于交感神经元[11]。还有人发现NGF可以抑制无血清条件培养诱导的PC12细胞凋亡[12]。在本研究中我们成功地从人的胎脑组织中克隆了人的GDNF基因,并且将构建真核表达载体pTARGET-hGDNF(±)转染BHK-21细胞,筛选出稳定表达人GDNF的细胞克隆。研究发现:用成功地转染pTARGET-hGDNF(+)的BHK-21细胞的培养上清培养PC12细胞,1周后PC12细胞突起明显增多、增长,形态类似于神经元,而且细胞基本处于不增殖的状态。然而,用pTARGET-hGDNF(-)转染BHK-21细胞组,PC12细胞的形态没有发生改变,并且与未转染的细胞一样增殖速度很快。虽然我们用RT-PCR的方法检测到了BHK-21细胞本身有GDNF mRNA的表达(结果未附),但是在免疫组织化学的结果中却发现,未经pTARGET-hGDNF(+)转染的BHK-21细胞,没有检测到GDNF阳性的细胞。原因可能是由于正常的BHK-21细胞中GDNF的表达水平很低,而且是一种分泌型蛋白,未达到免疫组织化学的检测灵敏度范围。这一点也可以间接地证明我们构建的BHK-hGDNF基因工程细胞可以高效表达人GDNF。
, 百拇医药
目前,基因治疗的方法很多,其中选择合适的基因转移系统是基因治疗能否达到预期目的的关键一步。已有的实验研究发现,用基因工程细胞携带合适的目的基因进行基因治疗,已经取得了很好的实验疗效[13]。因此,在此实验基础上,我们要进一步将BHK-hGDNF基因工程细胞应用于神经系统退性行疾病实验性治疗的研究中。



图3 免疫组织化学法检测PTAGET/hGDNF(+)在BHK-21细胞中的表达×200
图4,5BHK-hGDNF基因工程细胞培养上清液对PC12 细胞的分作用
图4加PTAGET/hGDNF(-)转染的BHK-21细胞培养上清×400
, 百拇医药
图5 加PTAGET/hGDNF(+)转染的BHK-21细胞培养上清×400
Fig.3 Detection of pTaget/hGDNF (+)expression in BHK-21cells by immunohistochemical stain×200
Fig.4 ,5 Differentiation of PC 12 cells induced by culture suoernatant of BHK-GDNF cells
Fig.4 Add supernatant of BHK-21 cells transfected by pTaget/hGDNF (-)×400
Fig.5.Add supernatant of BHK-21cells transfected by pTaget/hGDNF (+)×400
, 百拇医药
【作者简介】 焦建伟(1971—),男,黑龙江省齐齐哈尔市人,微生物药学硕士,在读博士生
通讯作者(To whom correspondence should be addressed)
作者单位:林嘉友(中国医学科学院 中国协和医科大学基础医学研究所免疫室,北京 100005)
参考文献
[1]Lin LF, Doherty DH, Lile JD, et al. GDNF:a glial cell line-derived neurotrophic factor for midbrain dopaminergic neurons[J]. Science,1993,260(5111):1130-1132.
[2]Nessan BE, Renate HI, Fraser GI, et al. Human glial cell line-derived neurotrophic factor(GDNF) maps to chromosome 5[J]. Hum Genet, 1995,96:671-673.
, 百拇医药
[3]Hou JG, Lin LF, Mytilineou C, et al. Glial cell line-derived neurotrophic factor exerts neurotrophic effects on dopaminergic neurons in vitro and promotes their survival and regrowth after damage by 1-methy1-4-phenylpyridinium[J]. J Neurochem, 1996,66(1):74.
[4]Oorschot DE, McLennan IS. The trophic requirements of mature motoneurons[J]. Brain Res,1998,789(2):315-321.
[5]Oppenheim RW, Houenou LJ, Johnson JE, et al. Developing motor neurons rescued from programmed and axotomy-induced cell death by GDNF[J]. Nature,1995,373(6512):344.
, 百拇医药
[6]Buj-Bello A, Buchman VL, Horton A, et al. GDNF is an age-specific survival factor for sensory and autonomic neurons[J]. Neuron,1995,15(4):821-828.
[7]Ebendal T, Tomac A, Hoffer BJ, et al. Glial cell line-derived neurotrophic factor stim ulates fiber formation and survival in cultured neurons from peripheral autonomic ganglia[J]. J Neurosci Res,1995,40(2):276-284.
[8]Lapchak PA. A preclinical development strategy designed to optimize the use of glial cell-line derived neurotrophic factor in the treatment of Parkinson disease[J]. Mov Disord, 1998,13,(suppl 1):49-54.
, 百拇医药
[9]Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning:A Laboratory Manual[M]. 2ed. New York:Cold Spring Harbor Laboratory Press,1989,352-355.
[10]Coyle JT, Puttfarcken P. Oxidatative stress, glutamate, and neurodegenerative disorders[J].Science,1993,262(5134):689-695.
[11]Carol MT, Leonidas ST, Lioyd AG, et al. Mechanism of neuronal degeneration A final common pathway? Advanced in Neurology[M].Philadelphia,New York:Litpincott-Raven,1997,72:103-101.
, 百拇医药
[12]Greene LA, Nerve growth factor prevents the death and stimulates the neuronal differentiation of clonal PC12 pheochromocytoma cells in serum-free medium[J]. J Cell Biol, 1978,78(3):747-755.
[13]Sagot Y, Tan SA, Hammang JP, et al. GDNF slows loss of motoneurons but not axonal degeneration or premature death of pmn/pmn mice[J]. J Neurosci,1996,16(7):2335-2341.
【收稿日期】1999-10-10 【修稿日期】1999-11-30, 百拇医药