GST融合蛋白在杆状病毒系统中表达的可溶性研究
作者:杨林 李国清 黄葆英 王全忠 龙綮新 王珣章
单位:杨林(中山大学生物防治国家重点实验室、生物医药中心,广州 510275);李国清(华南农业大学动物医学系,广州 510640)黄葆英 王全忠 龙綮新 王珣章(中山大学生物防治国家重点实验室、生物医药中心,广州 510275)
关键词:GST融合蛋白;杆状病毒表达系统;可溶性分析
中国病毒学000208 摘要:将构建好的可表达GST融合蛋白的重组病毒AcMNPV-OCC--GST-6xHis-Etp28感染Sf9细胞,一定时间后取感染了病毒的细胞裂解物上清液进行SDS-PAGE分析,结果显示53kDa的融合蛋白(GST-6xHis-Etp28)呈不溶状态。在原有裂解液的基础上,加固体十二烷基肌氨酸钠至终浓度1.5%,并将Triton X-100的比例由1%提高到2%。SDS-PAGE结果显示至少有1/3的GST-6xHis-Etp28处于溶解状态,可溶性GST-6xHis-Etp28经亲合层析,53kDa的目标蛋白得到纯化。
, http://www.100md.com
中图分类号:Q939.4,Q786 文献标识码:A
文章编号:1003-5125(2000)02-0143-06
Solubilization Analysis of GST Fusion Protein Expressed in Baculovirus System
YANG Lin,HUANG Bao-ying,WANG Quan-zhong,LONG Qing-xin,WANG Xun-zhang
(State key Lab for Biological Control,Biopharmaceutical Center,Zhongshan University,Guangzhou 510275,China)
LI Guo-qing
, http://www.100md.com
(Department of Animal Medicine,South China Agricultural University,Guangzhou,510640,China)
Abstract:Insect Sf9 cells were infected with constructed recombinant virus AcMNPV-OCC--GST-6xHis-Etp28,which could produce GST fusion protein and the supernatant of 72 h pi cell lysate was examined by SDS-PAGE.The results showed that GST-6xHis-Etp28 fusion protein of 53 kDa was expressed in insoluble status.After the sodium salt of the alkylanionic detergent sarkosyl was added to insect cell lysis buffer to a final concentration of 1.5%,and the final concentration of TritonX-100 was increased from 1% to 2%,at least 1/3 of GST-6xHis-Etp28 appeared to be soluble,which was examined by SDS-PAGE.Then soluble GST-6xHis-Etp28 was purified by affinity chromatography using glutathione agarose.
, http://www.100md.com
Key words:GST fusion protein; Baculovirus expression system; Solubilization analysis
自从1983年Smith和Summers首次利用苜蓿丫纹夜蛾核型多角体病毒(AcMNPV)表达人β-干扰素以来,至今已有数百种外源基因在杆状病毒载体系统中得到表达。由于杆状病毒载体表达系统具有较完备的翻译后加工修饰系统,如糖基化、磷酸化、蛋白酶特异性水解(如切除信号肽)和酰胺化等,还具有高效表达外源基因的能力,因此杆状病毒载体系统已成为最有应用前景的真核基因高效表达载体之一。
在应用杆状病毒系统进行外源基因的表达时,一个常用的转移载体是GST融合载体,这类载体将表达出GST融合蛋白。GST与还原型谷胱苷肽具有高度亲合性,因此可通过简便、高效的亲合纯化进行外源蛋白的分离纯化;此外,抗GST抗体可以对融合蛋白中的GST进行检测,从而使那些无法获得抗体的外源蛋白的检测成为可能。
, http://www.100md.com
应用原核系统表达GST融合蛋白时,往往会得到不可溶的表达产物[1],这就给表达产物的纯化、活性保证等带来了困难。本研究探讨了GST融合蛋白在杆状病毒系统中表达的可溶性状况,并进行了解决可溶性问题的研究。
1 材料和方法
1.1 材料
1.1.1 重组病毒 重组病毒AcMNPV-OCC--GST-6xHis-Etp28[2]由本室构建。
1.1.2 昆虫细胞、病毒和病毒基因组DNA 含合成启动子和β-半乳糖苷酶基因的无包涵体粉纹夜蛾重组株(TnNPV-SVI-G)由本室构建[3],草地夜蛾(Spodoptera frugiperda 9,Sf9)昆虫细胞引自英国自然环境研究会病毒研究所。
, 百拇医药
1.1.3 其它生化试剂 Glutathione Agarose Beads、Glutathione Powder、昆虫细胞裂解缓冲液(1×)、蛋白酶抑制剂混合物(50×)购自PharMingen公司。Acrylamide、Bis-acrylamide购自Sigma公司。
1.2 方法
1.2.1 病毒扩增
大量培养Sf9细胞,待细胞长成单层处于对数生长期时用于病毒感染。具体操作包括:吸弃培养基,接种病毒,使病毒感染复数(MOI)小于1。室温吸附1h后除去病毒接种物,换以新鲜培养基,27℃培养48~72h,收集上清待用。
1.2.2 表达产物的检测
1.2.2.1 病毒定量感染和样品制备 接种2×106个处于对数生长期的Sf9细胞至25cm2细胞培养瓶中,使用高滴度病毒原液,病毒滴度(PFU/mL)至少为1×108有效病毒粒子/mL,且病毒感染复数(MOI)控制在5~10之间。病毒接种细胞吸附1h后,弃病毒液,换以新鲜的培养基27℃培养72h后,移弃培养基,预冷的PBS(pH7.4)缓冲液洗涤细胞数次。除尽残留液体,再加入500μL预冷的细胞裂解液(含有1×Protease inhibitor cocktail),用橡皮刮刮下细胞收集至eppendorf管内,置冰浴裂解45min,每50μL细胞裂解物分装至一个eppendorf管中,置于-20℃或者-80℃贮存备用或直接用于表达情况分析。
, 百拇医药
1.2.2.2 SDS-PAGE分析 将制备好的病毒感染的Sf9细胞裂解液上清取50μL,加入等量的蛋白质样品上样缓冲液(2×),水浴煮沸5min,4℃、12000r/min离心5min,移取上清,在BioRad小型蛋白电泳装置上进行恒流电泳(SDS-PAGE电泳浓缩胶浓度为5%,电泳电流强度为18mA;分离胶浓度10%,电泳电流强度为34mA)。电泳结束后,考马斯亮蓝染色,观察蛋白质带型。
1.2.3 GST-6xHis-Etp28的纯化
取适量Glutathione Agarose Beads,500g离心3~5min,弃上清并用5~10倍体积的PBS洗两次;加入细胞裂解上清液,于4℃轻摇摆30min,500g离心3~5min,弃上清,用5倍体积的PBS洗两次;加入1倍体积的GST Elution Buffer,室温放置2min,500g离心3~5min,收集洗脱液,内含纯化的GST融合蛋白。
, 百拇医药
2 结果与分析
2.1 重组病毒AcMNPV-OCC--GST-6xHis-Etp28
重组病毒AcMNPV-OCC--GST-6xHis-Etp28,系通过含有Etp28基因的重组转移载体质粒pAcGHLT-A-Etp28与线性化致死缺失型苜蓿丫纹夜蛾核型多角体病毒(AcMNPV-OCC-)共转染Sf9细胞后构建而成[2]。
2.2 GST-6xHis-Etp28融合基因在Sf9细胞中的表达
将MOI约为3~10的重组毒株AcMNPV-OCC--GST-6xHis-Etp28感染处于生长对数期的Sf9细胞,27℃培养72h后,用适量的细胞裂解液裂解贴壁的细胞单层,取适量的裂解液上清进行SDS-PAGE分析,可观察到感染重组病毒的细胞裂解液上清蛋白质样品比感染了TnNPV-OCC-的细胞样品多了一条53kDa蛋白带(图1)。该蛋白带与预期的表达产物大小一致,表明融合的Etp28基因得到了表达。
, http://www.100md.com
2.3 GST-6xHis-Etp28融合蛋白的表达特性
为了探讨GST-6xHis-Etp28融合蛋白的溶解状态,在按常规方法裂解完细胞后,将裂解液以12000r/min离心15min,裂解上清液加等体积蛋白质样品上样缓冲液(2×),煮沸5min后待用;裂解沉淀物则用1×PBS洗涤两次,加与Lysis buffer同样体积的1×PBS,于冰浴中进行超声波粉碎,加等体积蛋白质样品上样缓冲液(2×),煮沸10min后待用。
图1 感染了重组毒株AcMNPV-OCC--GST-6xHis-Etp28的Sf9细胞裂解物SDS-PAGE分析
Fig.1 SDS-PAGE analysis of the Sf9 cell lysate
, 百拇医药
1.Mid-range protein molecular weight marker;
2.The Sf9 cell lysate infected with TnNPV-SVIG;
3~4.The Sf9 cell infected with different recombinant virus clonies of AcMNPV-OCC--GST-6xHis-Etp28
(图中箭头所指示表达产物GST-6xHis-Etp28,以下图均同此标注)
SDS-PAGE结果显示,GST-6xHis-Etp28主要存在于裂解沉淀物中,即GST-6xHis-Etp28呈不可溶状态,在裂解上清中基本看不到GST-6xHis-Etp28(图2)。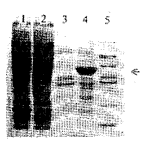
, http://www.100md.com
图2 GST-6xHis-Etp28溶解性质的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of GST-6xHis-Etp28 solubility
1.Supernatant of Sf9 cell lysate infected with TnNPV-SVIG;
2.Supernatant of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
3.Insoluble pellet of Sf9 cell lysate infected with TnNPV-SVIG;
4.Insoluble pellet of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
, http://www.100md.com
5.Mid-range protein molecular weight marker
从表达、样品制备等方面对GST-6xHis-Etp28不可溶的原因进行了探讨:(1)首先通过向Lysis buffer中直接加固体Tris的办法将Lysis buffer的pH值由7.5提高到8.5。Etp28的等电点(pI)为6.71,GST的pI为6.90。Lysis buffer的pH值与pI差别越大则越有助于GST-6xHis-Etp28的可溶性。但SDS-PAGE结果显示GST-6xHis-Etp28仍处于不可溶状态(图略)。(2)在细胞感染早期收获样品,即在24pi、36pi和48pi就收获细胞,但SDS-PAGE结果显示GST-6xHis-Etp28仍处于不可溶状态(图略)。(3)较低的MOI可能会有助于改善外源蛋白的溶解性。我们用MOI<1进行细胞感染,结果发现除表达量降低外,GST-6xHis-Etp28仍处于不可溶状态(图3)。(4)用MOI<3进行细胞感染,然后于48pi就收获细胞,结果约有1/3的GST-6xHis-Etp28处于溶解状态,但该实验结果重复性较差(图略)。(5)对裂解液成份进行调整,即将非离子去垢剂Triton X-100的比例由1%提高到2%,并加入终浓度为1.5%的固体Sarkosyl,结果发现约有20%~30%的GST-6xHis-Etp28呈可溶状态,且实验重复性好(图4)。
, 百拇医药
2.4 GST-6xHis-Etp28的纯化
将可溶性GST-6xHis-Etp28进行亲合纯化,SDS-PAGE和Western-blot(图略)结果显示53kDa的目标蛋白得到了纯化。SDS-PAGE显示的另一条约26kDa蛋白带为细胞内天然GST(图5)。
图3 MOI<1时GST-6xHis-Etp28溶解性质的SDS-PAGE分析
Fig.3 SDS-PAGE analysis of GST-6xHis-Etp28 solubility when MOI<1
1.Mid-range protein molecular weight marker;
, http://www.100md.com 2.Insoluble pellet of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
3.Insoluble pellet of Sf9 cell lysate infected with TnNPV-SVIG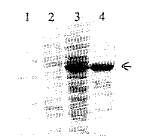
图4 Sarkosyl对GST-6xHis-Etp28溶解性质影响的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of the effect of sarkosyl on GST-6xHis-Etp28 solubility
1.Mid-range protein molecular weight marker;
, http://www.100md.com
2.Sf9 cell lysate infected with TnNPV-SVIG;
3.Supernatant of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
4.Insoluble pellet of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28
图5 GST-6xHis-Etp28亲和纯化效果的SDS-PAGE分析
Fig.5 SDS-PAGE of affinity purification of GST-6xHis-Etp28
, 百拇医药
1.Eluted PBS wash buffer after washing the glutathione agarose bound with GST-6xHis-Etp28;
2.Eluted supernatant fractions of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28 added to the glutathione agarose;
3.Supernatant of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
4.Insoluble pellet of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
, 百拇医药
5.Purified GST-6xHis-Etp28;
6.Mid-range protein molecular weight marker;
7.Affinity purification of supernatant of Sf9 cell lysate infected with TnNPV-SVIG
3 讨论
对杆状病毒表达系统,表达外源蛋白的可溶性被认为是该系统的优点之一,实际情况也大多如此。获得可溶性的外源蛋白,不仅有利于亲合纯化得到GST融合蛋白,而且在大部分情况下是外源蛋白保证其生物学功能的重要前提,例如蛋白质的正确折叠、糖基化磷酸化以及信号肽的正确切割等都有赖于外源蛋白的可溶性。但本研究中发现,GST-6xHis-Etp28融合蛋白基本处于不可溶状态。本实验室应用杆状病毒系统表达过其它GST融合蛋白(例如鸡传染性支气管炎病毒S1-GST融合蛋白、猪生殖和呼吸综合症病毒M-GST融合蛋白等)以及单纯GST蛋白,发现基本上都呈不可溶状态(未发表)。通常,造成GST融合蛋白不可溶的原因可能是:(1)过迟收获被感染外源蛋白本身的性质所决定。(2)重组病毒的MOI过高,例如远大于10。(3)昆虫细胞系选择不当。(4)由外源蛋白本身的性质所决定。(5)外源蛋白表达量过高也可能造成一定程度的不溶。(6)细胞裂解液所致。
, http://www.100md.com
我们在感染后24、36和48h收获细胞,然后降低MOI至1以下(表达量同时得到减少)以及更换不同的细胞系(如Sf9和Hi5),除偶然几次可得到部分可溶性GST-6xHis-Etp28外,大部分实验得到的GST-6xHis-Etp28均呈不可溶状态,且获得可溶性GST-6xHis-Etp28的实验重复性较差。
还有一个因素应考虑,即裂解液的pH值。Etp28的等电点(pI)为6.71,裂解液的pH值距Etp28的pI越远,则越有助于GST-6xHis-Etp28的溶解。所用的昆虫细胞裂解液的pH值为7.5,理论上已足以让Etp28可溶,但我们还向昆虫细胞裂解液中直接加固体Tris,提高pH值至8.5,SDS-PAGE分析表明GST-6xHis-Etp28依旧处于不可溶状态。
在GST融合蛋白的原核表达系统中(例如pGEX系列),虽然表达产物被商家描写为可溶性蛋白,但就实际情况而言GST融合蛋白经常处于不可溶状态。一般来讲,标准分离GST融合蛋白的方法是采用非离子去垢剂,例如Triton X-100。但据报道,通过这种方法获得的GST融合蛋白的不可溶性是一个普遍现象。J.V.Frangioni和B.G.Neel(1993)[1]利用十二烷基肌氨酸钠(Sarkosyl)可溶解肌动蛋白这一特性,在E.coli细胞裂解液中加入适量Sarkosyl,从而获得了部分甚至完全可溶的GST融合蛋白。Sarkosyl是一种人工合成的烷基阴离子去垢剂,最初是为了用来筛选抗龋剂的,它能够在体外吸附到Casein上,并抑制唾液中具有龋活性的酸的形成。
, 百拇医药
本研究将非离子去垢剂Triton-X-100的比例由1%提高到2%,并加入终浓度为1.5%的固体Sarkosyl,结果发现约有20%~30%的GST-6xHis-Etp28呈可溶状态。去垢剂和蛋白的比例、即Sarkosyl的绝对浓度直接影响蛋白的可溶性,因此对于每一种GST融合蛋白来说,有必要优化Sarkosyl的使用量。我们获得的可溶性GST-6xHis-Etp28仍只占整个融合蛋白的小部分,因此有必要进一步摸索条件提高可溶部分的比例。采用Sarkosyl裂解细胞,虽然可得到可溶的融合蛋白,但有可能影响其与Glutathione Agarose Beads的结合,从而降低纯化效率。从实际结果看,只有约50%的可溶性GST-6xHis-Etp28能够结合到Glutathione Agarose Beads上。不过J.V.Frangioni和B.G.Neel发表的结果显示:调整好Sarkosyl与Triton X-100的比例,将会极大改进GST融合蛋白与Glutathione Agarose Beads的结合效率。通常,1.5% Sarkosyl∶2% Triton X-100已经足够,但在一些极端情况下,可将Triton X-100的比例提高至4%。
, 百拇医药
国家自然科学研究基金资助项目(39800108).
杨林(1964年-),男,云南建水人,助研,博士.
参考文献
[1]Frangioni J V,Neel B G.Solubilization and purification of enzymatically active glutathione S-transferase fusion proteins [J].Analytical Biochemistry,1993,210:179~187
[2] 杨林,朱维,王珣章,等.鸡球虫Etp28基因的克隆及其在杆状病毒系统中的表达[J].生物化学与生物物理学报,1998,3:293~298
[3] 王珣章,谢伟东,龙綮新,等.形成多角体的杆状病毒载体系统的建立[J].病毒学报,1991,7:252~261
[4] O'Reilly D R,Miller L K,Luckow V A.Baculovirus expression vectors—a laboratory manual,New York:WH Freeman,1992.
1999-01-04
1999-03-31, http://www.100md.com
单位:杨林(中山大学生物防治国家重点实验室、生物医药中心,广州 510275);李国清(华南农业大学动物医学系,广州 510640)黄葆英 王全忠 龙綮新 王珣章(中山大学生物防治国家重点实验室、生物医药中心,广州 510275)
关键词:GST融合蛋白;杆状病毒表达系统;可溶性分析
中国病毒学000208 摘要:将构建好的可表达GST融合蛋白的重组病毒AcMNPV-OCC--GST-6xHis-Etp28感染Sf9细胞,一定时间后取感染了病毒的细胞裂解物上清液进行SDS-PAGE分析,结果显示53kDa的融合蛋白(GST-6xHis-Etp28)呈不溶状态。在原有裂解液的基础上,加固体十二烷基肌氨酸钠至终浓度1.5%,并将Triton X-100的比例由1%提高到2%。SDS-PAGE结果显示至少有1/3的GST-6xHis-Etp28处于溶解状态,可溶性GST-6xHis-Etp28经亲合层析,53kDa的目标蛋白得到纯化。
, http://www.100md.com
中图分类号:Q939.4,Q786 文献标识码:A
文章编号:1003-5125(2000)02-0143-06
Solubilization Analysis of GST Fusion Protein Expressed in Baculovirus System
YANG Lin,HUANG Bao-ying,WANG Quan-zhong,LONG Qing-xin,WANG Xun-zhang
(State key Lab for Biological Control,Biopharmaceutical Center,Zhongshan University,Guangzhou 510275,China)
LI Guo-qing
, http://www.100md.com
(Department of Animal Medicine,South China Agricultural University,Guangzhou,510640,China)
Abstract:Insect Sf9 cells were infected with constructed recombinant virus AcMNPV-OCC--GST-6xHis-Etp28,which could produce GST fusion protein and the supernatant of 72 h pi cell lysate was examined by SDS-PAGE.The results showed that GST-6xHis-Etp28 fusion protein of 53 kDa was expressed in insoluble status.After the sodium salt of the alkylanionic detergent sarkosyl was added to insect cell lysis buffer to a final concentration of 1.5%,and the final concentration of TritonX-100 was increased from 1% to 2%,at least 1/3 of GST-6xHis-Etp28 appeared to be soluble,which was examined by SDS-PAGE.Then soluble GST-6xHis-Etp28 was purified by affinity chromatography using glutathione agarose.
, http://www.100md.com
Key words:GST fusion protein; Baculovirus expression system; Solubilization analysis
自从1983年Smith和Summers首次利用苜蓿丫纹夜蛾核型多角体病毒(AcMNPV)表达人β-干扰素以来,至今已有数百种外源基因在杆状病毒载体系统中得到表达。由于杆状病毒载体表达系统具有较完备的翻译后加工修饰系统,如糖基化、磷酸化、蛋白酶特异性水解(如切除信号肽)和酰胺化等,还具有高效表达外源基因的能力,因此杆状病毒载体系统已成为最有应用前景的真核基因高效表达载体之一。
在应用杆状病毒系统进行外源基因的表达时,一个常用的转移载体是GST融合载体,这类载体将表达出GST融合蛋白。GST与还原型谷胱苷肽具有高度亲合性,因此可通过简便、高效的亲合纯化进行外源蛋白的分离纯化;此外,抗GST抗体可以对融合蛋白中的GST进行检测,从而使那些无法获得抗体的外源蛋白的检测成为可能。
, http://www.100md.com
应用原核系统表达GST融合蛋白时,往往会得到不可溶的表达产物[1],这就给表达产物的纯化、活性保证等带来了困难。本研究探讨了GST融合蛋白在杆状病毒系统中表达的可溶性状况,并进行了解决可溶性问题的研究。
1 材料和方法
1.1 材料
1.1.1 重组病毒 重组病毒AcMNPV-OCC--GST-6xHis-Etp28[2]由本室构建。
1.1.2 昆虫细胞、病毒和病毒基因组DNA 含合成启动子和β-半乳糖苷酶基因的无包涵体粉纹夜蛾重组株(TnNPV-SVI-G)由本室构建[3],草地夜蛾(Spodoptera frugiperda 9,Sf9)昆虫细胞引自英国自然环境研究会病毒研究所。
, 百拇医药
1.1.3 其它生化试剂 Glutathione Agarose Beads、Glutathione Powder、昆虫细胞裂解缓冲液(1×)、蛋白酶抑制剂混合物(50×)购自PharMingen公司。Acrylamide、Bis-acrylamide购自Sigma公司。
1.2 方法
1.2.1 病毒扩增
大量培养Sf9细胞,待细胞长成单层处于对数生长期时用于病毒感染。具体操作包括:吸弃培养基,接种病毒,使病毒感染复数(MOI)小于1。室温吸附1h后除去病毒接种物,换以新鲜培养基,27℃培养48~72h,收集上清待用。
1.2.2 表达产物的检测
1.2.2.1 病毒定量感染和样品制备 接种2×106个处于对数生长期的Sf9细胞至25cm2细胞培养瓶中,使用高滴度病毒原液,病毒滴度(PFU/mL)至少为1×108有效病毒粒子/mL,且病毒感染复数(MOI)控制在5~10之间。病毒接种细胞吸附1h后,弃病毒液,换以新鲜的培养基27℃培养72h后,移弃培养基,预冷的PBS(pH7.4)缓冲液洗涤细胞数次。除尽残留液体,再加入500μL预冷的细胞裂解液(含有1×Protease inhibitor cocktail),用橡皮刮刮下细胞收集至eppendorf管内,置冰浴裂解45min,每50μL细胞裂解物分装至一个eppendorf管中,置于-20℃或者-80℃贮存备用或直接用于表达情况分析。
, 百拇医药
1.2.2.2 SDS-PAGE分析 将制备好的病毒感染的Sf9细胞裂解液上清取50μL,加入等量的蛋白质样品上样缓冲液(2×),水浴煮沸5min,4℃、12000r/min离心5min,移取上清,在BioRad小型蛋白电泳装置上进行恒流电泳(SDS-PAGE电泳浓缩胶浓度为5%,电泳电流强度为18mA;分离胶浓度10%,电泳电流强度为34mA)。电泳结束后,考马斯亮蓝染色,观察蛋白质带型。
1.2.3 GST-6xHis-Etp28的纯化
取适量Glutathione Agarose Beads,500g离心3~5min,弃上清并用5~10倍体积的PBS洗两次;加入细胞裂解上清液,于4℃轻摇摆30min,500g离心3~5min,弃上清,用5倍体积的PBS洗两次;加入1倍体积的GST Elution Buffer,室温放置2min,500g离心3~5min,收集洗脱液,内含纯化的GST融合蛋白。
, 百拇医药
2 结果与分析
2.1 重组病毒AcMNPV-OCC--GST-6xHis-Etp28
重组病毒AcMNPV-OCC--GST-6xHis-Etp28,系通过含有Etp28基因的重组转移载体质粒pAcGHLT-A-Etp28与线性化致死缺失型苜蓿丫纹夜蛾核型多角体病毒(AcMNPV-OCC-)共转染Sf9细胞后构建而成[2]。
2.2 GST-6xHis-Etp28融合基因在Sf9细胞中的表达
将MOI约为3~10的重组毒株AcMNPV-OCC--GST-6xHis-Etp28感染处于生长对数期的Sf9细胞,27℃培养72h后,用适量的细胞裂解液裂解贴壁的细胞单层,取适量的裂解液上清进行SDS-PAGE分析,可观察到感染重组病毒的细胞裂解液上清蛋白质样品比感染了TnNPV-OCC-的细胞样品多了一条53kDa蛋白带(图1)。该蛋白带与预期的表达产物大小一致,表明融合的Etp28基因得到了表达。
, http://www.100md.com
2.3 GST-6xHis-Etp28融合蛋白的表达特性
为了探讨GST-6xHis-Etp28融合蛋白的溶解状态,在按常规方法裂解完细胞后,将裂解液以12000r/min离心15min,裂解上清液加等体积蛋白质样品上样缓冲液(2×),煮沸5min后待用;裂解沉淀物则用1×PBS洗涤两次,加与Lysis buffer同样体积的1×PBS,于冰浴中进行超声波粉碎,加等体积蛋白质样品上样缓冲液(2×),煮沸10min后待用。

图1 感染了重组毒株AcMNPV-OCC--GST-6xHis-Etp28的Sf9细胞裂解物SDS-PAGE分析
Fig.1 SDS-PAGE analysis of the Sf9 cell lysate
, 百拇医药
1.Mid-range protein molecular weight marker;
2.The Sf9 cell lysate infected with TnNPV-SVIG;
3~4.The Sf9 cell infected with different recombinant virus clonies of AcMNPV-OCC--GST-6xHis-Etp28
(图中箭头所指示表达产物GST-6xHis-Etp28,以下图均同此标注)
SDS-PAGE结果显示,GST-6xHis-Etp28主要存在于裂解沉淀物中,即GST-6xHis-Etp28呈不可溶状态,在裂解上清中基本看不到GST-6xHis-Etp28(图2)。

, http://www.100md.com
图2 GST-6xHis-Etp28溶解性质的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of GST-6xHis-Etp28 solubility
1.Supernatant of Sf9 cell lysate infected with TnNPV-SVIG;
2.Supernatant of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
3.Insoluble pellet of Sf9 cell lysate infected with TnNPV-SVIG;
4.Insoluble pellet of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
, http://www.100md.com
5.Mid-range protein molecular weight marker
从表达、样品制备等方面对GST-6xHis-Etp28不可溶的原因进行了探讨:(1)首先通过向Lysis buffer中直接加固体Tris的办法将Lysis buffer的pH值由7.5提高到8.5。Etp28的等电点(pI)为6.71,GST的pI为6.90。Lysis buffer的pH值与pI差别越大则越有助于GST-6xHis-Etp28的可溶性。但SDS-PAGE结果显示GST-6xHis-Etp28仍处于不可溶状态(图略)。(2)在细胞感染早期收获样品,即在24pi、36pi和48pi就收获细胞,但SDS-PAGE结果显示GST-6xHis-Etp28仍处于不可溶状态(图略)。(3)较低的MOI可能会有助于改善外源蛋白的溶解性。我们用MOI<1进行细胞感染,结果发现除表达量降低外,GST-6xHis-Etp28仍处于不可溶状态(图3)。(4)用MOI<3进行细胞感染,然后于48pi就收获细胞,结果约有1/3的GST-6xHis-Etp28处于溶解状态,但该实验结果重复性较差(图略)。(5)对裂解液成份进行调整,即将非离子去垢剂Triton X-100的比例由1%提高到2%,并加入终浓度为1.5%的固体Sarkosyl,结果发现约有20%~30%的GST-6xHis-Etp28呈可溶状态,且实验重复性好(图4)。
, 百拇医药
2.4 GST-6xHis-Etp28的纯化
将可溶性GST-6xHis-Etp28进行亲合纯化,SDS-PAGE和Western-blot(图略)结果显示53kDa的目标蛋白得到了纯化。SDS-PAGE显示的另一条约26kDa蛋白带为细胞内天然GST(图5)。

图3 MOI<1时GST-6xHis-Etp28溶解性质的SDS-PAGE分析
Fig.3 SDS-PAGE analysis of GST-6xHis-Etp28 solubility when MOI<1
1.Mid-range protein molecular weight marker;
, http://www.100md.com 2.Insoluble pellet of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
3.Insoluble pellet of Sf9 cell lysate infected with TnNPV-SVIG

图4 Sarkosyl对GST-6xHis-Etp28溶解性质影响的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of the effect of sarkosyl on GST-6xHis-Etp28 solubility
1.Mid-range protein molecular weight marker;
, http://www.100md.com
2.Sf9 cell lysate infected with TnNPV-SVIG;
3.Supernatant of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
4.Insoluble pellet of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28

图5 GST-6xHis-Etp28亲和纯化效果的SDS-PAGE分析
Fig.5 SDS-PAGE of affinity purification of GST-6xHis-Etp28
, 百拇医药
1.Eluted PBS wash buffer after washing the glutathione agarose bound with GST-6xHis-Etp28;
2.Eluted supernatant fractions of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28 added to the glutathione agarose;
3.Supernatant of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
4.Insoluble pellet of Sf9 cell lysate infected with AcMNPV-OCC--GST-6xHis-Etp28;
, 百拇医药
5.Purified GST-6xHis-Etp28;
6.Mid-range protein molecular weight marker;
7.Affinity purification of supernatant of Sf9 cell lysate infected with TnNPV-SVIG
3 讨论
对杆状病毒表达系统,表达外源蛋白的可溶性被认为是该系统的优点之一,实际情况也大多如此。获得可溶性的外源蛋白,不仅有利于亲合纯化得到GST融合蛋白,而且在大部分情况下是外源蛋白保证其生物学功能的重要前提,例如蛋白质的正确折叠、糖基化磷酸化以及信号肽的正确切割等都有赖于外源蛋白的可溶性。但本研究中发现,GST-6xHis-Etp28融合蛋白基本处于不可溶状态。本实验室应用杆状病毒系统表达过其它GST融合蛋白(例如鸡传染性支气管炎病毒S1-GST融合蛋白、猪生殖和呼吸综合症病毒M-GST融合蛋白等)以及单纯GST蛋白,发现基本上都呈不可溶状态(未发表)。通常,造成GST融合蛋白不可溶的原因可能是:(1)过迟收获被感染外源蛋白本身的性质所决定。(2)重组病毒的MOI过高,例如远大于10。(3)昆虫细胞系选择不当。(4)由外源蛋白本身的性质所决定。(5)外源蛋白表达量过高也可能造成一定程度的不溶。(6)细胞裂解液所致。
, http://www.100md.com
我们在感染后24、36和48h收获细胞,然后降低MOI至1以下(表达量同时得到减少)以及更换不同的细胞系(如Sf9和Hi5),除偶然几次可得到部分可溶性GST-6xHis-Etp28外,大部分实验得到的GST-6xHis-Etp28均呈不可溶状态,且获得可溶性GST-6xHis-Etp28的实验重复性较差。
还有一个因素应考虑,即裂解液的pH值。Etp28的等电点(pI)为6.71,裂解液的pH值距Etp28的pI越远,则越有助于GST-6xHis-Etp28的溶解。所用的昆虫细胞裂解液的pH值为7.5,理论上已足以让Etp28可溶,但我们还向昆虫细胞裂解液中直接加固体Tris,提高pH值至8.5,SDS-PAGE分析表明GST-6xHis-Etp28依旧处于不可溶状态。
在GST融合蛋白的原核表达系统中(例如pGEX系列),虽然表达产物被商家描写为可溶性蛋白,但就实际情况而言GST融合蛋白经常处于不可溶状态。一般来讲,标准分离GST融合蛋白的方法是采用非离子去垢剂,例如Triton X-100。但据报道,通过这种方法获得的GST融合蛋白的不可溶性是一个普遍现象。J.V.Frangioni和B.G.Neel(1993)[1]利用十二烷基肌氨酸钠(Sarkosyl)可溶解肌动蛋白这一特性,在E.coli细胞裂解液中加入适量Sarkosyl,从而获得了部分甚至完全可溶的GST融合蛋白。Sarkosyl是一种人工合成的烷基阴离子去垢剂,最初是为了用来筛选抗龋剂的,它能够在体外吸附到Casein上,并抑制唾液中具有龋活性的酸的形成。
, 百拇医药
本研究将非离子去垢剂Triton-X-100的比例由1%提高到2%,并加入终浓度为1.5%的固体Sarkosyl,结果发现约有20%~30%的GST-6xHis-Etp28呈可溶状态。去垢剂和蛋白的比例、即Sarkosyl的绝对浓度直接影响蛋白的可溶性,因此对于每一种GST融合蛋白来说,有必要优化Sarkosyl的使用量。我们获得的可溶性GST-6xHis-Etp28仍只占整个融合蛋白的小部分,因此有必要进一步摸索条件提高可溶部分的比例。采用Sarkosyl裂解细胞,虽然可得到可溶的融合蛋白,但有可能影响其与Glutathione Agarose Beads的结合,从而降低纯化效率。从实际结果看,只有约50%的可溶性GST-6xHis-Etp28能够结合到Glutathione Agarose Beads上。不过J.V.Frangioni和B.G.Neel发表的结果显示:调整好Sarkosyl与Triton X-100的比例,将会极大改进GST融合蛋白与Glutathione Agarose Beads的结合效率。通常,1.5% Sarkosyl∶2% Triton X-100已经足够,但在一些极端情况下,可将Triton X-100的比例提高至4%。
, 百拇医药
国家自然科学研究基金资助项目(39800108).
杨林(1964年-),男,云南建水人,助研,博士.
参考文献
[1]Frangioni J V,Neel B G.Solubilization and purification of enzymatically active glutathione S-transferase fusion proteins [J].Analytical Biochemistry,1993,210:179~187
[2] 杨林,朱维,王珣章,等.鸡球虫Etp28基因的克隆及其在杆状病毒系统中的表达[J].生物化学与生物物理学报,1998,3:293~298
[3] 王珣章,谢伟东,龙綮新,等.形成多角体的杆状病毒载体系统的建立[J].病毒学报,1991,7:252~261
[4] O'Reilly D R,Miller L K,Luckow V A.Baculovirus expression vectors—a laboratory manual,New York:WH Freeman,1992.
1999-01-04
1999-03-31, http://www.100md.com