草鱼呼肠孤病毒(GCRV)部分基因片段cDNA文库的构建
作者:方勤 田静
单位:方勤 田静(中国科学院武汉病毒研究所,武汉 430071)
关键词:草鱼呼肠孤病毒;双链RNA;cDNA文库
中国病毒学000113 摘 要:在随机六聚体引物浓度不变条件下,分别采用0.5、2、5μg 草鱼呼肠孤病毒(GCRV)单一片段RNA进行反转录cDNA合成及文库构建。结果表明,在GCRV-R NA模板浓度大于2μg时,第二链cDNA合成产物可直接通过EB染色的琼脂糖凝胶电泳进行定量及鉴定。选择cDNA与载体连接比率为5∶1,在高效电转化条件下,可获得106转化子/μg cDNA的转化效率。阳性克隆子经酶切及PCR鉴定,约45%以上的插入片段大于500bp。
分类号:Q78 文献标识码:A
文章编号:1003-5125(2000)01-0078-05
, 百拇医药
Construction of cDNA Libraries of GCRV Partial Genome Segments
FANG Qin, TIAN Jing
(Wuhan Institute of Virology, Academia Sinica, Wuhan 430071, China)
Abstract:Under the condition of constant concentration of random hex amers,the methods of cDNA synthesis and library construction were describ ed by using 0.5 μg, 2 μg and 5 μg individual RNA segment of GCRV as templates respectively. The result showed that when the template concentration of GCRV-RN A was equal to or more than 2 μg, the products of synthesized cDNA could be analysed directly through agarose gel electrophoresis stained by EB. When the ligation r atio of cDNA and vector was 5∶1, cloning efficiency could be as high as 106 transformants gene-rated per μg cDNA basing on highly efficient electropora tion transformation. Up to 45% inserts of the segments were larger than 500 bp by restriction analysis and PCR amplification.
, 百拇医药
Key words:Grass carp reovirus (GCRV); Double-stranded RNA, cDNA libr ary▲
草鱼出血病病毒为呼肠孤病毒科一新成员,其基因组由11条双链分段RNA组成[1] 。根据该病毒形态学及基因组等特性研究,1995年国际病毒分类命名委员会已正式将该病毒 命名为草鱼呼肠孤病毒(GCRV),并纳入呼肠孤病毒科新建水生呼肠孤病毒属正在研究的新种 [2],因此我们将过去一直沿用的草鱼出血病病毒(GCHV)正式更名为草鱼呼肠孤病 毒(GCRV),并根据该病毒基因组RNA在电泳图谱上的大小分布命名GCRV 11条分段双链RNA片 段分别为L1-3,M4-6,S7-11。目前,国际上已报道水生呼肠孤病毒有20多种,但对该属病 毒的研究内容主要局限于生物学范畴,未见有关水生呼肠孤病毒基因组cDNA文库构建及序列 分析的报道。为了解水生呼肠孤病毒基因组遗传信息、基因结构及复制特征,有必要进行GC RV基因组cDNA文库的构建。这一研究不仅有利于了解水生呼肠孤病毒属的分子生物学特征, 同时将揭示水生呼肠孤病毒与该科其它属的亲缘关系,以确定其进化历程。近期我们已报道 了GCRV基因组cDNA合成、克隆及部分序列分析结果[3],本研究侧重于其基因组cD NA文库的构建,现将结果报道如下。
, 百拇医药
1 材料和方法
1.1 材料
1.1.1 病毒毒株
草鱼呼肠孤病毒毒株为本实验室保存毒株GCRV873(原名GCHV873)[4] 。
1.1.2 试剂
cDNA合成、PCR扩增及pZEr2.0克隆试剂盒为美国BRL、Perkin Elmer及Invitrogen公司产品 ;PCR纯化试剂盒及限制性内切酶类分别购自上海华舜公司及华美生物工程公司。
1.2 方法
1.2.1 GCRV基因片段分离、纯化
, 百拇医药
从感染CIK细胞培养液中纯化的GCRV按实验室常规酚/氯仿抽提法提取病毒核酸,GCRV-RNA 单一片段的分离及纯化按文献[3]进行。
1.2.2 cDNA合成及克隆
cDNA合成采用随机引物法进行,反转录酶选用SuperScriptⅡ。设定每反应体积引物用量为1 00ng (25pmol/μL),分别采用不同的模板量进行反转录cDNA合成。具体反应条件及方 法为:溶于90%DMSO中的RNA样品,于70℃变性15min,置冰上加入100ng的随机六聚体 引 物,以形成模板/引物混合物。然后依次加入第一链cDNA buffer以及10mmol/L DTT, 0 .2u RNasin, 3μL SuperScriptⅡ (200u/μL),最后加入经DEPC处理的双蒸水至100 μL。37℃保温60min,以进行cDNA第一链的合成。cDNA第一链合成后,通过PCR纯化 小柱去除引物六聚体。采用0.5mol/L NaOH 37℃反应15min去除RNA模板,用HCl中和 后,乙醇沉淀反应产物。然后将沉淀溶于40mmol/L Tris-HCl(pH8.0),200mmol/L NaC l, 2mmol/L EDTA,50%甲酰胺溶液中,于94℃,5min变性反转录的两条cDNA链,50 ℃过夜使双链cDNA完全复性。复性的cDNA用DNA Polymerase Ⅰ 进行两端补齐,乙醇沉淀后 ,取 总量的1/5电泳鉴定及初步定量。定量后的cDNA按不同比例与EcoRV消化的pZErO 2.0载体进 行平头连接,电转化TOP 10感受态细胞。转化后的细胞涂布于含Kan(50μg/mL)的LB平板 上,过夜培养,次日计算克隆效率。重组质粒的小量培养及提取按文献[5]提供的方法进 行。
, http://www.100md.com
1.2.3 cDNA文库的筛选及鉴定
选择位于EcoRV插入两端的单一酶切位点BamHI和XhoI限制性内切酶对重组质粒进行双酶切, 经酶切分析后,挑选大于500bp的插入片段进行PCR扩增。引物位点在距EcoRV插入两端上 下各100bp左右的位置。正向引物为5′CAGGAAACAGCTATGACC 3′;反向引物为:5′ CGCC AGGGTTTTCCCAGTCACGAC 3′。扩增条件为:第一轮94℃变性3分钟,第二轮以后94℃变 性30sec, 50℃退火1min,70℃延伸2min,循环35次。在1%琼脂糖凝胶电泳条件 下对PCR产物进行鉴定及分析。
2 结果与讨论
2.1 cDNA合成条件及产率分析
在固定每反应体积随机引物量为100ng条件下,分别采用500ng、2μg、5μg的单一 片 段RNA进行了一系列GCRV-cDNA合成。反转录第二链cDNA合成结果见图1。从图1可以看出, 在RNA模板量大于或等于2μg时,第二链cDNA产物经常规EB染色琼脂糖凝胶电泳后,可直 接在紫外灯下进行鉴定及定量分析,但当模板用量为500ng时cDNA产物不能通过常规EB染 色的琼脂糖凝胶电泳进行分析。根据电泳图谱上的GCRV-cDNA荧光强度与标准Marker的比较 分析,推算第二链cDNA合成产率约为总模板量的25%。此外,从图中的cDNA条带可见, 小分 子第9片段(S9)的cDNA分子大小为300bp~1kb,大分子1、3片段(L1、L3)的cDNA为400 bp~4kb。由此可见所得cDNA产物分子量范围与其模板RNA大小基本吻合[1]。
, 百拇医药
图1 GCRV S9、L1、L3片段 的cDNA产物电泳分析
1. 1 kb DNA标准分子量
2. GCRV S9的cDNA产物(2 μg起始模板)
3. GCRV S9的cDNA产物(500 ng起始模板)
4. GCRV L1的cDNA产物(5 μg起始模板)
5. GCRV L3的cDNA产物(5 μg起始模板)
6. GCHV L3的cDNA产物(500 ng起始模板)
Fig.1 Synthesized cDNA of GCRV S9、L1、L3
, 百拇医药
1. 1 kb DNA ladder
2. cDNA of GCRV S9(2 μg template)
3. cDNA of GCRV S9(500 ng template)
4. cDNA of GCRV L1(5 μg template)
5. cDNA of GCRV L3(5 μg template)
6. cDNA of GCRV L3(500 ng template)
表1结果显示,在载体质粒DNA与cDNA连接比为1∶5时,可得到高达106转化子/μg cDNA的 转化效率。这一结果与标准Φ×174转化效率相差无几[6],而在其它几种比率条 件下,转化效率均未达到预期效果。根据上述所选择的最佳条件,我们进行了GCRV-cDNA的 克隆,并获得了理想的GCRV-cDNA文库,结果见表2。
, 百拇医药
表1 cDNA与载体平连比率对转化效率的影响
Table 1 Effect of the ratio of blunt-end ligation of
cDNA and vector on transformation efficiency Exp.
No.
Vector
(ng)
cDNA
(ng)
Plasmid/cDNA
approx. ratio
, http://www.100md.com
Efficiency
(transformants/μg cDNA)
1
50
-
-
0
2
50
50
1∶1
5.0×103
3
, http://www.100md.com
50
100
1∶2
8.9×104
4
50
250
1∶5
4.8×106
5
50
500
1∶10
, 百拇医药
4.5×104
表2 cDNA克隆及文库特性
Table 2 cDNA cloning and library properties Library construction
Library 1 (L1)
Librar y 6 (M6)
Library 10 (S10)
RNA template size(bp)
4800
1900
890
, 百拇医药
RNA template input(μg)
5
2
2
Library size (Nb clones)
4.9×106
5.2×106
4.1×106
Insert analysis
Number of analysed clones
, 百拇医药 100
Ration
100
Ration
100
Ration
Number of inserts>500 bp
62
62%
56
56%
45
45%
, 百拇医药
Background
3
3%
2
2%
2
2%
2.3 阳性克隆的鉴定
筛选的重组质粒首先用酶切法进行初步鉴定,然后根据质粒载体上的引物位点进行PCR扩增 ,所得扩增产物经凝胶电泳分析,其扩增片段的分子量大小与酶切结果相吻合(图2A,B)。 图2A为L1片段重组克隆的双酶切图谱;图2B为与2A(1-9)相对应的PCR扩增产物。其2B各扩 增片段的分子量均大于酶切片段200bp左右,正好与预期的分子量大小相一致。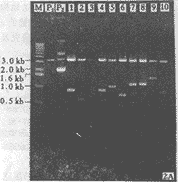
, http://www.100md.com
图2A 重组质粒的酶切分析
M. 1kb DNA标准分子量
P1.线性化的pZErO2.0质粒
P2.超螺旋和线性化的pZErO2.0质粒
1-10.BamHI和XholI消化的L1片段的重组质粒
Fig.2A Restriction analysis of GCRV L1
M. 1 kb DNA ladder
P1. Linearized pZErO2.0
P2. Supercoiled and linearized pZErO2.0
, http://www.100md.com
1-10. Digested recombinant plasmids of L1
by BamHI and XholI
图2B GCRV L1片段重组质粒的PCR扩增产物分析
M. 1 kb DNA标准分子量
N.阴性对照
1-9. L1片段的PCR扩增产物
Fig.2B PCR amplification of recombinant
plasmids of GCRV L1
, 百拇医药
M. 1 kb DNA ladder
N. Negative control
1-9. PCR amplification products of GCRV L1
3 讨论
自1983年首次分离GCRV,迄今已有十多年的历史。由于GCRV含11条双链分段RNA基因组以及 其3′端不含poly(A)尾的特性,使得其基因组文库的构建具有一定的难度及复杂性。早期呼 肠孤病毒cDNA文库的构建主要借助传统的cDNA合成及克隆方法,其主要技术基本路线为:通 过poly(A)加尾反应获得带poly(A)尾的双链RNA,继而采用olig (dT)引导cDNA第一链合成。 根据Cashdollar等人[7]的报道,在进行呼肠孤病毒Ⅲ型(strain Dearing) cDNA 克隆时,曾用150μg经同位素(3H尿嘧啶)标记的全基因组RNA进行poly(A)加尾反应 ,在cDNA合成时,仍用32P-dATP再次标记cDNA第一链合成。如此大的模板用量 及长时间的同位素操作,在一般实验条件下是难以进行和控制的。近年来的资料及文献显示 ,国外对呼肠孤病毒科原有六个属的分子生物学特性已研究得相当深入,不仅有文库构建及 基因组片段的全序列报道[8,9],而且对某些重要基因片段的结构与功能及转录 调控方面的研究也已起步[10,11]。虽然目前最为普遍的cDNA文库构建多采用 RT-PCR合成cDNA,但该方法均需借助计算机数据库进行相关种属序列的同源性及保守区域 的分析,以获得RT-PCR的引物序列,从而构建同类病毒新毒株的cDNA文库。由于GCRV为呼 肠孤病毒科新属新种,在无法进行同源序列比较的情况下,采用随机引物法引导cDNA合成不 失为一种简单、可行的策略。我们在原有随机引物法的基础上,通过进行一系列条件比较, 采用微克级模板,成功地构建了GCRV-RNA L1、L2、L3、M6、S7、S9、S10、S11的cDNA文库 。目前我们正利用所构建的cDNA文库进行GCRV各基因片段的序列分析,这将为该病毒以后的 同源性比较、进化研究及各基因片段所编码的蛋白质结构与功能研究奠定良好的基础。■
, 百拇医药
基金项目:国家自然科学基金资助课题 批准号:39570035
作者简介:方勤(1961-),女,湖北省人,副研究员。主要从事水生动物病毒的分子 生物学及其基因工程研究,承担过国家自然科学基因项目,发表论文20余篇。
参考文献:
[1]柯丽华,方勤,蔡宜权.一株新的草鱼出血病病毒分离物的特性[J].水生生物学报,1990,14(2):153~159
[2]Murphy F A, Fauquet C M, Bishop D H L et al. Virus Taxnomy [J]. Arc hives of Virology, 1995,(suppl):208~239
[3]田静,邹桂平,方勤.草鱼出血病病毒基因组的cDNA合成、克隆及序列分析[J].中国病毒学,1999,14:87~92
, http://www.100md.com
[4]方勤,柯丽华,蔡宜权.草鱼出血病病毒的生长特性及高滴价培养[J].病毒学杂志 , 1989,4(3):315~319
[5]Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning, A Laboratory Manu al [M], 2nd ed. USA, NY: Cold Spring Harbor, 1989.16~23
[6]方勤,田静.电转化法提高平连载体DNA转化效率的研究[J].生物技术,1999,9(4):5~8
[7]Cashdollar L W, Esparza, Hudson G R et al. Cloning the double-strand RNA genes of reovirus: Sequence of the cloned S2 gene [J]. Biochemistry, 1982 ,79:7644~7648
, 百拇医药
[8]Wiener J R, Joklik W K. The Sequences of the reovirus serotype 1, 2, and 3 L1 genome segments and analysis of the mode of divergence of the reovirus sero types [J]. Virology, 1989,169:194~203
[9]Patton J T, Salter-CID L Kalbach A et al. Nucleotide and amino acid sequence analysis of the rotavirus non-structural RNA-binding protein NS35 [ J]. Virology, 1993,192:438~446
[10]Lu G Y, Zhou Z H, Baker M L et al. Structure of double-shelle d rice dwarf virus [J].J Virol, 1998,72:8541~8549
[11]Schiff L A, Nibert M L, Co M S et al. Distinct binding sites for zinc and double-stranded RNA in the reovirus outer capsid protein δ3[J]. Mol Cell Biol, 1988,8:273~283
收稿日期:1999-05-21
修稿日期:1999-08-16, http://www.100md.com
单位:方勤 田静(中国科学院武汉病毒研究所,武汉 430071)
关键词:草鱼呼肠孤病毒;双链RNA;cDNA文库
中国病毒学000113 摘 要:在随机六聚体引物浓度不变条件下,分别采用0.5、2、5μg 草鱼呼肠孤病毒(GCRV)单一片段RNA进行反转录cDNA合成及文库构建。结果表明,在GCRV-R NA模板浓度大于2μg时,第二链cDNA合成产物可直接通过EB染色的琼脂糖凝胶电泳进行定量及鉴定。选择cDNA与载体连接比率为5∶1,在高效电转化条件下,可获得106转化子/μg cDNA的转化效率。阳性克隆子经酶切及PCR鉴定,约45%以上的插入片段大于500bp。
分类号:Q78 文献标识码:A
文章编号:1003-5125(2000)01-0078-05
, 百拇医药
Construction of cDNA Libraries of GCRV Partial Genome Segments
FANG Qin, TIAN Jing
(Wuhan Institute of Virology, Academia Sinica, Wuhan 430071, China)
Abstract:Under the condition of constant concentration of random hex amers,the methods of cDNA synthesis and library construction were describ ed by using 0.5 μg, 2 μg and 5 μg individual RNA segment of GCRV as templates respectively. The result showed that when the template concentration of GCRV-RN A was equal to or more than 2 μg, the products of synthesized cDNA could be analysed directly through agarose gel electrophoresis stained by EB. When the ligation r atio of cDNA and vector was 5∶1, cloning efficiency could be as high as 106 transformants gene-rated per μg cDNA basing on highly efficient electropora tion transformation. Up to 45% inserts of the segments were larger than 500 bp by restriction analysis and PCR amplification.
, 百拇医药
Key words:Grass carp reovirus (GCRV); Double-stranded RNA, cDNA libr ary▲
草鱼出血病病毒为呼肠孤病毒科一新成员,其基因组由11条双链分段RNA组成[1] 。根据该病毒形态学及基因组等特性研究,1995年国际病毒分类命名委员会已正式将该病毒 命名为草鱼呼肠孤病毒(GCRV),并纳入呼肠孤病毒科新建水生呼肠孤病毒属正在研究的新种 [2],因此我们将过去一直沿用的草鱼出血病病毒(GCHV)正式更名为草鱼呼肠孤病 毒(GCRV),并根据该病毒基因组RNA在电泳图谱上的大小分布命名GCRV 11条分段双链RNA片 段分别为L1-3,M4-6,S7-11。目前,国际上已报道水生呼肠孤病毒有20多种,但对该属病 毒的研究内容主要局限于生物学范畴,未见有关水生呼肠孤病毒基因组cDNA文库构建及序列 分析的报道。为了解水生呼肠孤病毒基因组遗传信息、基因结构及复制特征,有必要进行GC RV基因组cDNA文库的构建。这一研究不仅有利于了解水生呼肠孤病毒属的分子生物学特征, 同时将揭示水生呼肠孤病毒与该科其它属的亲缘关系,以确定其进化历程。近期我们已报道 了GCRV基因组cDNA合成、克隆及部分序列分析结果[3],本研究侧重于其基因组cD NA文库的构建,现将结果报道如下。
, 百拇医药
1 材料和方法
1.1 材料
1.1.1 病毒毒株
草鱼呼肠孤病毒毒株为本实验室保存毒株GCRV873(原名GCHV873)[4] 。
1.1.2 试剂
cDNA合成、PCR扩增及pZEr2.0克隆试剂盒为美国BRL、Perkin Elmer及Invitrogen公司产品 ;PCR纯化试剂盒及限制性内切酶类分别购自上海华舜公司及华美生物工程公司。
1.2 方法
1.2.1 GCRV基因片段分离、纯化
, 百拇医药
从感染CIK细胞培养液中纯化的GCRV按实验室常规酚/氯仿抽提法提取病毒核酸,GCRV-RNA 单一片段的分离及纯化按文献[3]进行。
1.2.2 cDNA合成及克隆
cDNA合成采用随机引物法进行,反转录酶选用SuperScriptⅡ。设定每反应体积引物用量为1 00ng (25pmol/μL),分别采用不同的模板量进行反转录cDNA合成。具体反应条件及方 法为:溶于90%DMSO中的RNA样品,于70℃变性15min,置冰上加入100ng的随机六聚体 引 物,以形成模板/引物混合物。然后依次加入第一链cDNA buffer以及10mmol/L DTT, 0 .2u RNasin, 3μL SuperScriptⅡ (200u/μL),最后加入经DEPC处理的双蒸水至100 μL。37℃保温60min,以进行cDNA第一链的合成。cDNA第一链合成后,通过PCR纯化 小柱去除引物六聚体。采用0.5mol/L NaOH 37℃反应15min去除RNA模板,用HCl中和 后,乙醇沉淀反应产物。然后将沉淀溶于40mmol/L Tris-HCl(pH8.0),200mmol/L NaC l, 2mmol/L EDTA,50%甲酰胺溶液中,于94℃,5min变性反转录的两条cDNA链,50 ℃过夜使双链cDNA完全复性。复性的cDNA用DNA Polymerase Ⅰ 进行两端补齐,乙醇沉淀后 ,取 总量的1/5电泳鉴定及初步定量。定量后的cDNA按不同比例与EcoRV消化的pZErO 2.0载体进 行平头连接,电转化TOP 10感受态细胞。转化后的细胞涂布于含Kan(50μg/mL)的LB平板 上,过夜培养,次日计算克隆效率。重组质粒的小量培养及提取按文献[5]提供的方法进 行。
, http://www.100md.com
1.2.3 cDNA文库的筛选及鉴定
选择位于EcoRV插入两端的单一酶切位点BamHI和XhoI限制性内切酶对重组质粒进行双酶切, 经酶切分析后,挑选大于500bp的插入片段进行PCR扩增。引物位点在距EcoRV插入两端上 下各100bp左右的位置。正向引物为5′CAGGAAACAGCTATGACC 3′;反向引物为:5′ CGCC AGGGTTTTCCCAGTCACGAC 3′。扩增条件为:第一轮94℃变性3分钟,第二轮以后94℃变 性30sec, 50℃退火1min,70℃延伸2min,循环35次。在1%琼脂糖凝胶电泳条件 下对PCR产物进行鉴定及分析。
2 结果与讨论
2.1 cDNA合成条件及产率分析
在固定每反应体积随机引物量为100ng条件下,分别采用500ng、2μg、5μg的单一 片 段RNA进行了一系列GCRV-cDNA合成。反转录第二链cDNA合成结果见图1。从图1可以看出, 在RNA模板量大于或等于2μg时,第二链cDNA产物经常规EB染色琼脂糖凝胶电泳后,可直 接在紫外灯下进行鉴定及定量分析,但当模板用量为500ng时cDNA产物不能通过常规EB染 色的琼脂糖凝胶电泳进行分析。根据电泳图谱上的GCRV-cDNA荧光强度与标准Marker的比较 分析,推算第二链cDNA合成产率约为总模板量的25%。此外,从图中的cDNA条带可见, 小分 子第9片段(S9)的cDNA分子大小为300bp~1kb,大分子1、3片段(L1、L3)的cDNA为400 bp~4kb。由此可见所得cDNA产物分子量范围与其模板RNA大小基本吻合[1]。

, 百拇医药
图1 GCRV S9、L1、L3片段 的cDNA产物电泳分析
1. 1 kb DNA标准分子量
2. GCRV S9的cDNA产物(2 μg起始模板)
3. GCRV S9的cDNA产物(500 ng起始模板)
4. GCRV L1的cDNA产物(5 μg起始模板)
5. GCRV L3的cDNA产物(5 μg起始模板)
6. GCHV L3的cDNA产物(500 ng起始模板)
Fig.1 Synthesized cDNA of GCRV S9、L1、L3
, 百拇医药
1. 1 kb DNA ladder
2. cDNA of GCRV S9(2 μg template)
3. cDNA of GCRV S9(500 ng template)
4. cDNA of GCRV L1(5 μg template)
5. cDNA of GCRV L3(5 μg template)
6. cDNA of GCRV L3(500 ng template)
表1结果显示,在载体质粒DNA与cDNA连接比为1∶5时,可得到高达106转化子/μg cDNA的 转化效率。这一结果与标准Φ×174转化效率相差无几[6],而在其它几种比率条 件下,转化效率均未达到预期效果。根据上述所选择的最佳条件,我们进行了GCRV-cDNA的 克隆,并获得了理想的GCRV-cDNA文库,结果见表2。
, 百拇医药
表1 cDNA与载体平连比率对转化效率的影响
Table 1 Effect of the ratio of blunt-end ligation of
cDNA and vector on transformation efficiency Exp.
No.
Vector
(ng)
cDNA
(ng)
Plasmid/cDNA
approx. ratio
, http://www.100md.com
Efficiency
(transformants/μg cDNA)
1
50
-
-
0
2
50
50
1∶1
5.0×103
3
, http://www.100md.com
50
100
1∶2
8.9×104
4
50
250
1∶5
4.8×106
5
50
500
1∶10
, 百拇医药
4.5×104
表2 cDNA克隆及文库特性
Table 2 cDNA cloning and library properties Library construction
Library 1 (L1)
Librar y 6 (M6)
Library 10 (S10)
RNA template size(bp)
4800
1900
890
, 百拇医药
RNA template input(μg)
5
2
2
Library size (Nb clones)
4.9×106
5.2×106
4.1×106
Insert analysis
Number of analysed clones
, 百拇医药 100
Ration
100
Ration
100
Ration
Number of inserts>500 bp
62
62%
56
56%
45
45%
, 百拇医药
Background
3
3%
2
2%
2
2%
2.3 阳性克隆的鉴定
筛选的重组质粒首先用酶切法进行初步鉴定,然后根据质粒载体上的引物位点进行PCR扩增 ,所得扩增产物经凝胶电泳分析,其扩增片段的分子量大小与酶切结果相吻合(图2A,B)。 图2A为L1片段重组克隆的双酶切图谱;图2B为与2A(1-9)相对应的PCR扩增产物。其2B各扩 增片段的分子量均大于酶切片段200bp左右,正好与预期的分子量大小相一致。

, http://www.100md.com
图2A 重组质粒的酶切分析
M. 1kb DNA标准分子量
P1.线性化的pZErO2.0质粒
P2.超螺旋和线性化的pZErO2.0质粒
1-10.BamHI和XholI消化的L1片段的重组质粒
Fig.2A Restriction analysis of GCRV L1
M. 1 kb DNA ladder
P1. Linearized pZErO2.0
P2. Supercoiled and linearized pZErO2.0
, http://www.100md.com
1-10. Digested recombinant plasmids of L1
by BamHI and XholI

图2B GCRV L1片段重组质粒的PCR扩增产物分析
M. 1 kb DNA标准分子量
N.阴性对照
1-9. L1片段的PCR扩增产物
Fig.2B PCR amplification of recombinant
plasmids of GCRV L1
, 百拇医药
M. 1 kb DNA ladder
N. Negative control
1-9. PCR amplification products of GCRV L1
3 讨论
自1983年首次分离GCRV,迄今已有十多年的历史。由于GCRV含11条双链分段RNA基因组以及 其3′端不含poly(A)尾的特性,使得其基因组文库的构建具有一定的难度及复杂性。早期呼 肠孤病毒cDNA文库的构建主要借助传统的cDNA合成及克隆方法,其主要技术基本路线为:通 过poly(A)加尾反应获得带poly(A)尾的双链RNA,继而采用olig (dT)引导cDNA第一链合成。 根据Cashdollar等人[7]的报道,在进行呼肠孤病毒Ⅲ型(strain Dearing) cDNA 克隆时,曾用150μg经同位素(3H尿嘧啶)标记的全基因组RNA进行poly(A)加尾反应 ,在cDNA合成时,仍用32P-dATP再次标记cDNA第一链合成。如此大的模板用量 及长时间的同位素操作,在一般实验条件下是难以进行和控制的。近年来的资料及文献显示 ,国外对呼肠孤病毒科原有六个属的分子生物学特性已研究得相当深入,不仅有文库构建及 基因组片段的全序列报道[8,9],而且对某些重要基因片段的结构与功能及转录 调控方面的研究也已起步[10,11]。虽然目前最为普遍的cDNA文库构建多采用 RT-PCR合成cDNA,但该方法均需借助计算机数据库进行相关种属序列的同源性及保守区域 的分析,以获得RT-PCR的引物序列,从而构建同类病毒新毒株的cDNA文库。由于GCRV为呼 肠孤病毒科新属新种,在无法进行同源序列比较的情况下,采用随机引物法引导cDNA合成不 失为一种简单、可行的策略。我们在原有随机引物法的基础上,通过进行一系列条件比较, 采用微克级模板,成功地构建了GCRV-RNA L1、L2、L3、M6、S7、S9、S10、S11的cDNA文库 。目前我们正利用所构建的cDNA文库进行GCRV各基因片段的序列分析,这将为该病毒以后的 同源性比较、进化研究及各基因片段所编码的蛋白质结构与功能研究奠定良好的基础。■
, 百拇医药
基金项目:国家自然科学基金资助课题 批准号:39570035
作者简介:方勤(1961-),女,湖北省人,副研究员。主要从事水生动物病毒的分子 生物学及其基因工程研究,承担过国家自然科学基因项目,发表论文20余篇。
参考文献:
[1]柯丽华,方勤,蔡宜权.一株新的草鱼出血病病毒分离物的特性[J].水生生物学报,1990,14(2):153~159
[2]Murphy F A, Fauquet C M, Bishop D H L et al. Virus Taxnomy [J]. Arc hives of Virology, 1995,(suppl):208~239
[3]田静,邹桂平,方勤.草鱼出血病病毒基因组的cDNA合成、克隆及序列分析[J].中国病毒学,1999,14:87~92
, http://www.100md.com
[4]方勤,柯丽华,蔡宜权.草鱼出血病病毒的生长特性及高滴价培养[J].病毒学杂志 , 1989,4(3):315~319
[5]Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning, A Laboratory Manu al [M], 2nd ed. USA, NY: Cold Spring Harbor, 1989.16~23
[6]方勤,田静.电转化法提高平连载体DNA转化效率的研究[J].生物技术,1999,9(4):5~8
[7]Cashdollar L W, Esparza, Hudson G R et al. Cloning the double-strand RNA genes of reovirus: Sequence of the cloned S2 gene [J]. Biochemistry, 1982 ,79:7644~7648
, 百拇医药
[8]Wiener J R, Joklik W K. The Sequences of the reovirus serotype 1, 2, and 3 L1 genome segments and analysis of the mode of divergence of the reovirus sero types [J]. Virology, 1989,169:194~203
[9]Patton J T, Salter-CID L Kalbach A et al. Nucleotide and amino acid sequence analysis of the rotavirus non-structural RNA-binding protein NS35 [ J]. Virology, 1993,192:438~446
[10]Lu G Y, Zhou Z H, Baker M L et al. Structure of double-shelle d rice dwarf virus [J].J Virol, 1998,72:8541~8549
[11]Schiff L A, Nibert M L, Co M S et al. Distinct binding sites for zinc and double-stranded RNA in the reovirus outer capsid protein δ3[J]. Mol Cell Biol, 1988,8:273~283
收稿日期:1999-05-21
修稿日期:1999-08-16, http://www.100md.com