WilliamsE无血清培养基中培养人头皮毛囊
作者:秦 俭 钟志红 杨淑霞 马圣清
单位:100034北京医科大学第一医院皮肤科
关键词:
中华皮肤科杂志990326
建立体外毛囊器官培养技术,有助于了解毛囊生物学特性,为探讨毛囊生长调节机制以及为脱发等相关疾病的治疗奠定基础。Philpott等[1]在1990年已建立了人头皮游离毛囊培养的模型,并对一些细胞因子、皮质类固醇及药物对毛囊生长的影响进行了探讨。我国也已逐渐开展了这方面的工作,建立了游离毛囊培养的方法[2]。本试验采用WilliamsE无血清培养基(含氢化可的松、牛胰岛素、转铁蛋白、亚硒酸钠、青霉素、链霉素)进行游离毛囊培养,对毛囊的形态变化、生长长度及生长时间进行了观察与检测。
一、材料和方法
, http://www.100md.com
1.标本来源:18~35岁新鲜尸体头皮。
2.培养基:WilliamsE培养基(Gibco)加谷氨酰胺2mmol/L,Hepes2mmol/L,氢化可的松10ng/mL,牛胰岛素(Sigma)10μg/mL,转铁蛋白(Sigma)10μg/mL,亚硒酸钠(北京朝阳中联化工试剂厂)10ng/mL,青霉素100U/mL,链霉素100μg/mL。
3.方法:参照Philpott[1]的方法,充分消毒皮肤,于真皮与皮下交界处切开,从皮下拔取毛囊,在解剖镜下选择完整的生长期毛囊移入24孔板,每孔一根,加1mL培养基,于31℃,5%CO2孵箱内培养。每天在倒置显微镜下观察毛囊形态并测量毛囊长度。选择部分培养的毛囊经Bouin液固定,用石蜡包埋进行组织学检查。
a.毛囊体外培养1d时的形态;
, 百拇医药
b.毛囊体外培养5d时的形态,毛干和内毛根鞘及外毛根鞘同步增长,真皮鞘无明显改变;
c.毛囊体外培养10d时的形态,毛干进一步延长,此时毛囊形态仍大致正常,毛球结构清晰,生长良好
图1倒置显微镜下培养的毛囊形成(×10)
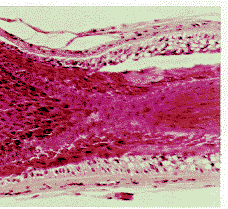
图2培养第30d的毛囊组织形态(×250)
二、结果
培养毛囊36根,分4批进行。
毛囊生长长度:毛囊生长以培养第1、2d最快,以后逐日降低。第1~3d每天分别生长0.305mm、0.184mm和0.136mm,平均0.208mm。最终生长长度1mm~3mm,平均1.402mm,总生长天数平均15d,最长生长天数为25d。
, http://www.100md.com
毛囊形态变化:倒置显微镜下观察,毛囊逐日延长,主要为内、外毛根鞘和毛干的延长,其真皮鞘基本不变(见图1)。在培养第1周毛囊形态无明显改变,以后毛球逐渐增大变圆,毛囊基部与毛根基部之间的距离变窄,毛干与内毛根鞘间的界限变得模糊不清。一般在停止生长后数天开始退行,毛球形态变得极不规则,毛囊基部与毛根基部之间的距离增加。
组织学观察:培养第1周内毛囊组织学无明显变化,毛囊各层清晰,毛乳头细胞大,发育好,毛母质细胞可见分裂相。个别毛囊培养至30d尚未退行,其各层次尚清晰,内毛根鞘增厚(见图2)。早期退行期改变的毛囊,毛乳头呈椭圆形,位置下移,紧贴毛囊基部,毛母质细胞数目减少,毛干基部钝圆呈杵状,外毛根鞘和真皮鞘结构尚清,但内毛根鞘均质化,结构不清。
三、讨论
本实验使用WilliamsE无血清培养基成功地建立了人头皮游离毛囊培养的方法。毛囊在培养前3d平均生长长度为每天0.208mm,最终平均生长长度为1.402mm,平均生长天数为15d,最长生长天数为25d。伍津津等[2]报道在含10%小牛血清的DMEM常规培养基,37℃培养时前3d平均每天生长0.14mm,仅生长5~6d便开始贴壁并停止生长。因此,我们认为培养基及培养条件的选择十分重要。我们预试验时曾使用了加1%小牛血清的DMEM培养基进行毛囊培养,毛囊生长较慢,生长天数也未能超过10d。可能是由于血清中含有TGFβ等抑制因子阻碍毛囊生长[3]。文献报道[4,5]胰岛素、氢化可的松具有明显的促进毛囊生长或维持毛囊形态的作用,亚硒酸钠和转铁蛋白对毛囊的生长或形态维持也有一定作用。此外,Imai等[6]研究表明,毛囊在31℃条件下生长较37℃时好。故经筛选,本试验选用WilliamsE无血清培养基(含有胰岛素、氢化可的松、亚硒酸钠、转铁蛋白),在31℃条件下培养。毛囊与毛干长度在培养的最初5d的增长基本相等,以后毛干生长大于毛囊生长,毛囊基部与毛根基部距离缩短。该结果与Harmon等[5]的研究结果相近。由于进入已分化细胞库细胞的减少,毛囊首先停止了生长,此时分化细胞尚未完全耗竭,故毛根继续缓慢生长,直至分化细胞库完全耗竭。Harmon等[5,6]用WilliamsE无血清培养基培养人毛囊,前3d每天的生长可达0.3mm,个别报道高达0.6mm/d。总生长长度为1~3mm,多数毛囊生长10~15d,个别毛囊生长更长达17d[1,3,7]。本实验结果与国外报道相似。前3d毛囊生长速度较国外文献报道的略慢,但生长天数略长,少数毛囊能够生长25d,个别毛囊在第30d时毛乳头形态仍很规整。
, 百拇医药
我们认为,毛囊器官培养中应注意以下几点:①标本的消毒要充分,②操作中毛囊的选取亦十分重要,应选取外毛根鞘完整、毛乳头形态圆润光滑的生长期毛囊,有些毛囊形态完整但生长缓慢,考虑仍存在内损伤,因此用体外毛囊培养作研究时,可选择培养第1d生长较快的毛囊,因根据培养第1d的生长情况可以推测以后的生长,③培养温度以31℃为好,培养箱内应保持一定湿度。
宝洁公司资助课题
参考文献
1 Philpott MP, Green MR, Kealey T. Human hair growth in vitro. J Cell Sci, 1990,97:463- 471.
2 伍津津,刘荣卿,叶庆佾,等.人头皮游离毛囊培养.中华皮肤科杂志,1996,29:246-248.
, 百拇医药
3 Westgate GE, Gibson WT, Kealey T, et al. Prolonged maintenance of human hair follicles in vitro in a serum free medium. Br J Dermatol, 1993,129:372- 379.
4 Bond JJ, Wynin PC, Brown GN, et al. Growth of wool follicles in culture. In Vitro Cell Dev Biol, 1994,30A:90- 98.
5 Harmon CS, Nevins TD. Hair fibre production by human hair follicles in whole organ culture. Br J Dermatol, 1994,130:415- 423.
6 Imai R, Miura Y, Mochida K, et al. Organ culture conditions of human hair follicles. J Dermatol Sci, 1992,3:163- 171.
7 Taylor M, Ashcroft AT, Messenger AG. Cyclosporin A prolongs human hair growth in vitro. J Invest Dermatol, 1993,100:237- 239.
(收稿:1998-06-06修回:1998-12-10), http://www.100md.com
单位:100034北京医科大学第一医院皮肤科
关键词:
中华皮肤科杂志990326
建立体外毛囊器官培养技术,有助于了解毛囊生物学特性,为探讨毛囊生长调节机制以及为脱发等相关疾病的治疗奠定基础。Philpott等[1]在1990年已建立了人头皮游离毛囊培养的模型,并对一些细胞因子、皮质类固醇及药物对毛囊生长的影响进行了探讨。我国也已逐渐开展了这方面的工作,建立了游离毛囊培养的方法[2]。本试验采用WilliamsE无血清培养基(含氢化可的松、牛胰岛素、转铁蛋白、亚硒酸钠、青霉素、链霉素)进行游离毛囊培养,对毛囊的形态变化、生长长度及生长时间进行了观察与检测。
一、材料和方法
, http://www.100md.com
1.标本来源:18~35岁新鲜尸体头皮。
2.培养基:WilliamsE培养基(Gibco)加谷氨酰胺2mmol/L,Hepes2mmol/L,氢化可的松10ng/mL,牛胰岛素(Sigma)10μg/mL,转铁蛋白(Sigma)10μg/mL,亚硒酸钠(北京朝阳中联化工试剂厂)10ng/mL,青霉素100U/mL,链霉素100μg/mL。
3.方法:参照Philpott[1]的方法,充分消毒皮肤,于真皮与皮下交界处切开,从皮下拔取毛囊,在解剖镜下选择完整的生长期毛囊移入24孔板,每孔一根,加1mL培养基,于31℃,5%CO2孵箱内培养。每天在倒置显微镜下观察毛囊形态并测量毛囊长度。选择部分培养的毛囊经Bouin液固定,用石蜡包埋进行组织学检查。

a.毛囊体外培养1d时的形态;
, 百拇医药
b.毛囊体外培养5d时的形态,毛干和内毛根鞘及外毛根鞘同步增长,真皮鞘无明显改变;
c.毛囊体外培养10d时的形态,毛干进一步延长,此时毛囊形态仍大致正常,毛球结构清晰,生长良好
图1倒置显微镜下培养的毛囊形成(×10)


图2培养第30d的毛囊组织形态(×250)
二、结果
培养毛囊36根,分4批进行。
毛囊生长长度:毛囊生长以培养第1、2d最快,以后逐日降低。第1~3d每天分别生长0.305mm、0.184mm和0.136mm,平均0.208mm。最终生长长度1mm~3mm,平均1.402mm,总生长天数平均15d,最长生长天数为25d。
, http://www.100md.com
毛囊形态变化:倒置显微镜下观察,毛囊逐日延长,主要为内、外毛根鞘和毛干的延长,其真皮鞘基本不变(见图1)。在培养第1周毛囊形态无明显改变,以后毛球逐渐增大变圆,毛囊基部与毛根基部之间的距离变窄,毛干与内毛根鞘间的界限变得模糊不清。一般在停止生长后数天开始退行,毛球形态变得极不规则,毛囊基部与毛根基部之间的距离增加。
组织学观察:培养第1周内毛囊组织学无明显变化,毛囊各层清晰,毛乳头细胞大,发育好,毛母质细胞可见分裂相。个别毛囊培养至30d尚未退行,其各层次尚清晰,内毛根鞘增厚(见图2)。早期退行期改变的毛囊,毛乳头呈椭圆形,位置下移,紧贴毛囊基部,毛母质细胞数目减少,毛干基部钝圆呈杵状,外毛根鞘和真皮鞘结构尚清,但内毛根鞘均质化,结构不清。
三、讨论
本实验使用WilliamsE无血清培养基成功地建立了人头皮游离毛囊培养的方法。毛囊在培养前3d平均生长长度为每天0.208mm,最终平均生长长度为1.402mm,平均生长天数为15d,最长生长天数为25d。伍津津等[2]报道在含10%小牛血清的DMEM常规培养基,37℃培养时前3d平均每天生长0.14mm,仅生长5~6d便开始贴壁并停止生长。因此,我们认为培养基及培养条件的选择十分重要。我们预试验时曾使用了加1%小牛血清的DMEM培养基进行毛囊培养,毛囊生长较慢,生长天数也未能超过10d。可能是由于血清中含有TGFβ等抑制因子阻碍毛囊生长[3]。文献报道[4,5]胰岛素、氢化可的松具有明显的促进毛囊生长或维持毛囊形态的作用,亚硒酸钠和转铁蛋白对毛囊的生长或形态维持也有一定作用。此外,Imai等[6]研究表明,毛囊在31℃条件下生长较37℃时好。故经筛选,本试验选用WilliamsE无血清培养基(含有胰岛素、氢化可的松、亚硒酸钠、转铁蛋白),在31℃条件下培养。毛囊与毛干长度在培养的最初5d的增长基本相等,以后毛干生长大于毛囊生长,毛囊基部与毛根基部距离缩短。该结果与Harmon等[5]的研究结果相近。由于进入已分化细胞库细胞的减少,毛囊首先停止了生长,此时分化细胞尚未完全耗竭,故毛根继续缓慢生长,直至分化细胞库完全耗竭。Harmon等[5,6]用WilliamsE无血清培养基培养人毛囊,前3d每天的生长可达0.3mm,个别报道高达0.6mm/d。总生长长度为1~3mm,多数毛囊生长10~15d,个别毛囊生长更长达17d[1,3,7]。本实验结果与国外报道相似。前3d毛囊生长速度较国外文献报道的略慢,但生长天数略长,少数毛囊能够生长25d,个别毛囊在第30d时毛乳头形态仍很规整。
, 百拇医药
我们认为,毛囊器官培养中应注意以下几点:①标本的消毒要充分,②操作中毛囊的选取亦十分重要,应选取外毛根鞘完整、毛乳头形态圆润光滑的生长期毛囊,有些毛囊形态完整但生长缓慢,考虑仍存在内损伤,因此用体外毛囊培养作研究时,可选择培养第1d生长较快的毛囊,因根据培养第1d的生长情况可以推测以后的生长,③培养温度以31℃为好,培养箱内应保持一定湿度。
宝洁公司资助课题
参考文献
1 Philpott MP, Green MR, Kealey T. Human hair growth in vitro. J Cell Sci, 1990,97:463- 471.
2 伍津津,刘荣卿,叶庆佾,等.人头皮游离毛囊培养.中华皮肤科杂志,1996,29:246-248.
, 百拇医药
3 Westgate GE, Gibson WT, Kealey T, et al. Prolonged maintenance of human hair follicles in vitro in a serum free medium. Br J Dermatol, 1993,129:372- 379.
4 Bond JJ, Wynin PC, Brown GN, et al. Growth of wool follicles in culture. In Vitro Cell Dev Biol, 1994,30A:90- 98.
5 Harmon CS, Nevins TD. Hair fibre production by human hair follicles in whole organ culture. Br J Dermatol, 1994,130:415- 423.
6 Imai R, Miura Y, Mochida K, et al. Organ culture conditions of human hair follicles. J Dermatol Sci, 1992,3:163- 171.
7 Taylor M, Ashcroft AT, Messenger AG. Cyclosporin A prolongs human hair growth in vitro. J Invest Dermatol, 1993,100:237- 239.
(收稿:1998-06-06修回:1998-12-10), http://www.100md.com