白细胞介素1、肿瘤坏死因子α和脂多糖对人脐静脉内皮细胞表达单核细胞趋化蛋白1的影响
作者:孟峰 邓仲端
单位:孟峰(同济医科大学病理学教研室,武汉 430030);邓仲端(同济医科大学病理学教研室,武汉 430030)
关键词:内皮;血管;单核细胞化学吸引蛋白质1;脂多糖类
中华病理学杂志000114 摘 要 目的 观察细胞因子白细胞介素1(IL-1)β、肿瘤坏死因子(TNF)α和脂多糖(LPS)是否诱导人脐静脉内皮细胞表达单核细胞趋化蛋白1(MCP-1) mRNA及蛋白。方法 选取生长汇合的人脐静脉内皮细胞,在其培养基中分别加入终浓度为2 ng/ml的IL-1β、20 ng/ml的TNFα和100 ng/ml的LPS,37℃共育4 h后,按照一步法提取其总RNA,用γ-32P标记的寡核苷酸探针进行dot blot分析,观察其MCP-1 mRNA表达,另一部分培养24 h,收集长满细胞的盖玻片,用免疫细胞化学法及图像分析系统检测细胞内的MCP-1蛋白质表达。结果 培养的人脐静脉内皮细胞能低水平地表达MCP-1 mRNA和蛋白质。IL-1β、TNFα及LPS均能增加MCP-1 mRNA的表达(分别是对照组的7.8倍、2.6倍及1.2倍)。免疫细胞化学显示,各组细胞对MCP-1多克隆抗体均显示阳性反应。图像扫描显示,LPS组、TNFα组及IL-1β组细胞的平均吸光度(A)值分别为0.078±0.113、0.102±0.005和0.117±0.010,均明显高于对照组(0.051±0.004), 差异有显著性(F=193.25,P<0.01)。结论 IL-1β和TNFα均能显著增强内皮细胞MCP-1 mRNA和蛋白的表达,提示它们通过诱导内皮细胞产生MCP-1,吸引单核细胞迁入动脉内膜而参与动脉粥样硬化的发生和发展。
, 百拇医药
Effects of IL-1β, TNF-α and lipopolysaccharide on the expression of MCP-1 in human umbilical vein endothelial cells
MENG Feng DENG Zhongduan
(Department of Pathology, Tonji Medical University, Wuhan 430030, China)
Abstract Objective To investigate whether the proinflammatory cytokines IL-1β, TNF-α and lipopolysaccharide (LPS) enable to induce the expression of MCP-1 mRNA and protein in human umbilical vein endothelial cells (HUVECs). Methods After a four-hour exposure to 2 ng/ml IL-1β, 20 ng/ml TNF-α or 100 ng/ml LPS, total RNA of HUVECs was extracted by single-step method. The expression of MCP-1 mRNA in HUVECs was examined by dot blot analysis using a probe of γ-32P-end-labelled 35 mer oligonucleotide. Meanwhile, MCP-1 protein in the cytoplasm was detected by SABC immunostaining. Results Dot blot analysis showed that cultured HUVECs were able to express MCP-1 mRNA at a low level. Exposure to IL-1β, TNF-α and LPS resulted in a 7.8-fold, 2.6-fold and 1.2-fold induction of MCP-1 mRNA expression in HUVECs, respectively. The cells on the coverglass in all groups revealed MCP-1 immunoreactivity. Densitometry scans showed that the mean absorbance (A) values of the cells in LPS, TNF-α and IL-1β groups were 0.078±0.113, 0.102±0.005 and 0.117±0.010, respectively; whereas the absorbance values of the control group was 0.051±0.004. There were significant differences between all the experimental groups and the control group (F=193.25, P<0.01). Conclusions IL-1β and TNF-α induce a strong expression of MCP-1 mRNA and protein in HUVECs. Both cytokines may be involved in the atherogenesis by inducing the liberation of MCP-1 by endothelial cells and increasing the recruitment of monocytes into the subendothelial space.
, 百拇医药
Key words Endothelium,vascular;Monocyte chemoattractant protein-1;Lipopolysaccharides
动脉粥样硬化发病过程中关键的早期事件是脂质沉积于动脉内膜和外周血液中单核细胞在动脉内皮下间隙的聚集。虽然单核细胞迁入内皮下间隙的机制尚未完全明了,但是近几年的研究表明,趋化因子在该过程中起着重要作用,其中以单核细胞趋化蛋白1(monocyte chemoattractant protein-1, MCP-1)作用最强。MCP-1是一种强有力的具有趋化和激活单核细胞的细胞因子[1]。单核细胞粘附并迁入动脉内皮下间隙受多个因素的调节,并需一系列协调信号的介导。动脉内皮细胞是单核细胞渗出的最初发生部位,内皮的损伤(内毒素、高脂血症、脂质过氧化损伤等)是动脉粥样硬化发病的早期事件之一。损伤或受刺激的内皮可快速表达白细胞介素1β(IL-1β)[1],而IL-1β又可促进血管壁平滑肌细胞产生和分泌肿瘤坏死因子α(TNFα)[2]。我们的研究表明,内皮的损伤(氧化脂蛋白、脂质过氧化、内毒素等)可诱导其表达高水平的MCP-1 mRNA和蛋白[3,4]。因此,研究MCP-1在动脉壁细胞中的表达及其影响因素,特别是细胞因子对其表达的影响,对阐明动脉粥样硬化的发生和发展具有重要意义。本实验旨在探讨细胞因子IL-1β、TNFα及脂多糖(LPS)是否诱导人脐静脉内皮细胞表达MCP-1 mRNA及蛋白。
, http://www.100md.com
材料和方法
1.内皮细胞的培养和鉴定:人脐静脉内皮细胞株购自武汉大学中国典型培养物保藏中心。用含10%小牛血清的DMEM培养液培养,以间接免疫荧光法测定Ⅷ因子相关抗原进行内皮细胞的鉴定。
2.Dot blot分析:当内皮细胞生长汇合后随机分为4组。N组 :正常对照组,在培养液中不加诱导剂。LPS组:在培养液中加入终浓度为100 ng/ml的脂多糖。IL-1β组:在培养液中加入终浓度2 ng/ml IL-1β(鼠类,重组型,Gibco公司产品)。TNFα组:在培养液中加入终浓度为20 ng/ml的TNFα(人类,重组型,Gibco公司产品)。 上述4组细胞不加或加入上述诱导剂后培养4 h收集细胞,用异硫氰酸胍法分别提取各组细胞的总RNA。每组取总RNA 20 μg,用多孔过滤加样器点到硝酸纤维素膜上。MCP-1探针是由35对碱基组成的寡核苷酸,它与MCP-1的cDNA的257~291核苷酸互补。探针的序列为5′-CGGATGTTGGGTTTGCTTGTCCAGGTGGTCCATGG-3′(探针由西安医科大学免疫病理学研究室协助合成)。将点有样品的硝酸纤维素膜置于预杂交液,57℃预杂交4 h,然后加入γ-32P标记的探针(2×106 cpm/ml),57℃杂交过夜。杂交完后用50 ml清洗液(0.2×SSC和0.1% SDS)57℃下洗膜4次。凉干后在-70℃下对感光胶片曝光72 h。常规显影定影后,用TJTY-300型医用图像处理系统检测各样本的积分吸光度值。
, http://www.100md.com
3.免疫细胞化学检测:待培养瓶中盖玻片上内皮细胞生长至半汇合状态时,弃去培养液,用D-Hanks液轻洗2次,分别加入含LPS 100 ng/ml、IL-1β 2 ng/ml和TNFα 20 ng/ml的培养液孵育24 h,对照组不加上述刺激物。弃去培养液,用D-Hanks液漂洗1次,4%多聚甲醛固定30 min后,收集盖玻片。用1% Triton 0.05 mol/L TBS浸泡长有内皮细胞盖玻片,4℃过夜。后按常规SABC法进行免疫细胞化学染色。用TJTY-300型全自动图像分析仪定量测定,在相同的放大倍数下,每组随机测4个视野,每个视野测5个细胞,即共测20个细胞的平均A值,以此代表内皮细胞内MCP-1含量,用SAS软件对各组数据进行方差分析。
结果
1.Dot blot分析: 培养的人脐静脉内皮细胞不暴露或分别暴露于IL-1β和 TNFα后,点在硝酸纤维素膜上的人脐静脉内皮细胞总RNA与MCP-1探针杂交后,放射自显影图像显示不同程度积分A值的斑点(图1)。图像处理系统检测结果,对照组、LPS组、TNFα组及IL-1β组斑点的积分A值分别为14.56、17.84、37.32和113.6。IL-1β组、TNFα组、LPS组分别为对照组的7.8倍、2.6倍和1.2倍(图2)。结果提示,培养的人脐静脉内皮细胞能低水平地表达MCP-1 mRNA,当其分别暴露于IL-1β和TNFα后,其MCP-1 mRNA的表达明显增强,而且前者的诱导作用强于后者。
, http://www.100md.com
图1 内皮细胞MCP-1的表达,图示斑点杂交后放射自显影的各组的斑点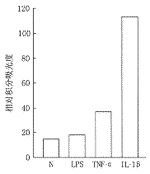
图2 内皮细胞MCP-1 mRNA斑点的积分吸光度扫描结果
2.各组人脐静脉内皮细胞的MCP-1蛋白表达:免疫细胞化学显示,对照组内皮细胞中MCP-1蛋白呈非常弱的表达。各实验组中,LPS组内细胞中MCP-1表达较弱,但与对照组比较有所增强,TNFα组细胞呈中等强度表达,而IL-1β组内皮细胞中MCP-1表达明显增加,呈强阳性反应。图像分析显示各组的平均A值见表1。经方差分析表明,各组间差异有极显著性(F=193.25,P<0.01)。LPS组、TNFα组及IL-1β组与对照组相比,差异均有显著性(P<0.01)。
表1 免疫细胞化学显示各组MCP-1蛋白的表达 组别
, 百拇医药
细胞数
平均A值(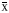 ±s)
±s)
对照
20
0.051±0.004
LPS
20
0.078±0.113*
TNFα
20
0.102±0.005*
, 百拇医药
IL-1β
20
0.117±0.010*
*与对照组比较,P<0.01讨论
众所周知,细胞因子网络不仅参与维护正常血管的功能而且参与涉及血管的各种病理过程。近年研究表明,动脉粥样硬化病变的形成是动脉壁细胞通过分泌生长因子、趋化因子及其他细胞因子而相互调控的结果。因此,研究细胞因子,特别是促炎性细胞因子在动脉粥样硬化发展中的作用十分重要。本结果表明,在正常培养条件下人脐静脉内皮细胞可低水平地表达MCP-1mRNA和蛋白。经细胞因子IL-1β、TNFα刺激后人脐静脉内皮细胞可较高水平地表达MCP-1 mRNA和蛋白质,而LPS仅轻度诱导人脐静脉内皮细胞表达MCP-1。证实和扩展了Strieter等[5]与Rollins等[6]的实验观察。Strieter等[5]实验证实IL-1β、TNFα、LPS可以诱导内皮细胞表达MCP-1 mRNA和蛋白;Rollins等[6]用IL-1β、TNFα及干扰素γ诱导人脐静脉内皮细胞,结果IL-1β与TNFα处理的内皮细胞3 h后就高水平地表达MCP-1 mRNA, 而干扰素γ刺激24 h后才轻度诱导MCP-1 mRNA表达。同时我们的实验表明,IL-1β诱导内皮细胞表达MCP-1 mRNA的作用最强而LPS作用最弱,这与Brown等[7]的研究结果较一致。Brown等[7]用IL-1β、TNFα、干扰素γ及LPS与人肺微血管内皮细胞共育以检验是否增强MCP-1 mRNA和蛋白的表达,结果表明,IL-1β是最强的诱导物,TNFα次之,LPS与干扰素γ作用最弱或相对无效,TNFα与IL-1β激活内皮细胞功能是与快速早期原癌基因c-fos和c-jun的表达相关。同时已有报道,细胞因子使内皮细胞表达MCP-1依赖核因子Kappa B(NF-κB)与转录因子活化蛋白-1(AP-1,c-jun和c-fos基因产物构成的异二聚体)协调下进行[8]。IL-1β和TNFα还可使内皮细胞发生一系列的改变,包括形态与细胞外基质的反应[9]。
, http://www.100md.com
总之,我们的资料表明IL-1β和TNFα均可促进内皮细胞表达MCP-1 mRNA和蛋白。因此,它们在动脉粥样硬化的发生及发展特别是外周血液单核细胞在动脉内膜中的聚集中起重要作用。
基金项目:国家自然科学基金资助项目(39470289)
通信作者:邓仲端
参考文献:
[1]Clinton SK, Fleet JC, Loppnow H, et al. Interleukin-1 gene expression in rabbit vascular tissue in vivo. Am J Pathol, 1991,138:1005-1014.
[2]Warner SJ, Friedman GB, Libby P. Regulation of major histocompatibility gene expression in human vascular smooth muscle cells. Arteriosclerosis,1989,9:279-288.
, 百拇医药
[3]于光耀,邓仲端,瞿智玲.氧化修饰脂蛋白对内皮细胞的单核细胞趋化蛋白-1表达的影响.中华病理学杂志,1998,27:174-176.
[4]夏春枝,邓仲端.脂质过氧化诱导培养的内皮细胞表达单核细胞趋化蛋白1.中国动脉硬化杂志,1997,5:291-294.
[5]Strieter RM, Wiggins R, Phan SH, et al. Monocyte chemotactic protein gene expression by cytokine-treated human fibroblasts and endothelial cells. Biochem Biophys Res Commun, 1989,162:694-700.
[6]Rollins BJ, Yoshimura T, Leonard EJ, et al. Cytokine-activated human endothelial cells synthesize and secrete a monocyte chemoattractant, MCP-1/JE. Am J Pathol, 1990,136:1229-1233.
, 百拇医药
[7]Brown Z, Gerritson ME, Carley WW, et al. Chemokine gene expression and secretion by cytokine-activated human microvascular endothelial cells. Am J Pathol, 1994,145:913-921.
[8]Martin T, Cardarelli PM, Parry GC, et al. Cytokine induction of monocyte chemoattractant protein-1 gene expression in human endothelial cells depends on the cooperative action of NF-κB and AP-1, Eur J Immunol ,1997,27:1091-1097.
[9]Mantovani A, Dejana E. Cytokines as communication signals between leukocytes and vascular endothelial cells. Immunol Today, 1989,10:370-375.
收稿日期:1999-03-10, 百拇医药
单位:孟峰(同济医科大学病理学教研室,武汉 430030);邓仲端(同济医科大学病理学教研室,武汉 430030)
关键词:内皮;血管;单核细胞化学吸引蛋白质1;脂多糖类
中华病理学杂志000114 摘 要 目的 观察细胞因子白细胞介素1(IL-1)β、肿瘤坏死因子(TNF)α和脂多糖(LPS)是否诱导人脐静脉内皮细胞表达单核细胞趋化蛋白1(MCP-1) mRNA及蛋白。方法 选取生长汇合的人脐静脉内皮细胞,在其培养基中分别加入终浓度为2 ng/ml的IL-1β、20 ng/ml的TNFα和100 ng/ml的LPS,37℃共育4 h后,按照一步法提取其总RNA,用γ-32P标记的寡核苷酸探针进行dot blot分析,观察其MCP-1 mRNA表达,另一部分培养24 h,收集长满细胞的盖玻片,用免疫细胞化学法及图像分析系统检测细胞内的MCP-1蛋白质表达。结果 培养的人脐静脉内皮细胞能低水平地表达MCP-1 mRNA和蛋白质。IL-1β、TNFα及LPS均能增加MCP-1 mRNA的表达(分别是对照组的7.8倍、2.6倍及1.2倍)。免疫细胞化学显示,各组细胞对MCP-1多克隆抗体均显示阳性反应。图像扫描显示,LPS组、TNFα组及IL-1β组细胞的平均吸光度(A)值分别为0.078±0.113、0.102±0.005和0.117±0.010,均明显高于对照组(0.051±0.004), 差异有显著性(F=193.25,P<0.01)。结论 IL-1β和TNFα均能显著增强内皮细胞MCP-1 mRNA和蛋白的表达,提示它们通过诱导内皮细胞产生MCP-1,吸引单核细胞迁入动脉内膜而参与动脉粥样硬化的发生和发展。
, 百拇医药
Effects of IL-1β, TNF-α and lipopolysaccharide on the expression of MCP-1 in human umbilical vein endothelial cells
MENG Feng DENG Zhongduan
(Department of Pathology, Tonji Medical University, Wuhan 430030, China)
Abstract Objective To investigate whether the proinflammatory cytokines IL-1β, TNF-α and lipopolysaccharide (LPS) enable to induce the expression of MCP-1 mRNA and protein in human umbilical vein endothelial cells (HUVECs). Methods After a four-hour exposure to 2 ng/ml IL-1β, 20 ng/ml TNF-α or 100 ng/ml LPS, total RNA of HUVECs was extracted by single-step method. The expression of MCP-1 mRNA in HUVECs was examined by dot blot analysis using a probe of γ-32P-end-labelled 35 mer oligonucleotide. Meanwhile, MCP-1 protein in the cytoplasm was detected by SABC immunostaining. Results Dot blot analysis showed that cultured HUVECs were able to express MCP-1 mRNA at a low level. Exposure to IL-1β, TNF-α and LPS resulted in a 7.8-fold, 2.6-fold and 1.2-fold induction of MCP-1 mRNA expression in HUVECs, respectively. The cells on the coverglass in all groups revealed MCP-1 immunoreactivity. Densitometry scans showed that the mean absorbance (A) values of the cells in LPS, TNF-α and IL-1β groups were 0.078±0.113, 0.102±0.005 and 0.117±0.010, respectively; whereas the absorbance values of the control group was 0.051±0.004. There were significant differences between all the experimental groups and the control group (F=193.25, P<0.01). Conclusions IL-1β and TNF-α induce a strong expression of MCP-1 mRNA and protein in HUVECs. Both cytokines may be involved in the atherogenesis by inducing the liberation of MCP-1 by endothelial cells and increasing the recruitment of monocytes into the subendothelial space.
, 百拇医药
Key words Endothelium,vascular;Monocyte chemoattractant protein-1;Lipopolysaccharides
动脉粥样硬化发病过程中关键的早期事件是脂质沉积于动脉内膜和外周血液中单核细胞在动脉内皮下间隙的聚集。虽然单核细胞迁入内皮下间隙的机制尚未完全明了,但是近几年的研究表明,趋化因子在该过程中起着重要作用,其中以单核细胞趋化蛋白1(monocyte chemoattractant protein-1, MCP-1)作用最强。MCP-1是一种强有力的具有趋化和激活单核细胞的细胞因子[1]。单核细胞粘附并迁入动脉内皮下间隙受多个因素的调节,并需一系列协调信号的介导。动脉内皮细胞是单核细胞渗出的最初发生部位,内皮的损伤(内毒素、高脂血症、脂质过氧化损伤等)是动脉粥样硬化发病的早期事件之一。损伤或受刺激的内皮可快速表达白细胞介素1β(IL-1β)[1],而IL-1β又可促进血管壁平滑肌细胞产生和分泌肿瘤坏死因子α(TNFα)[2]。我们的研究表明,内皮的损伤(氧化脂蛋白、脂质过氧化、内毒素等)可诱导其表达高水平的MCP-1 mRNA和蛋白[3,4]。因此,研究MCP-1在动脉壁细胞中的表达及其影响因素,特别是细胞因子对其表达的影响,对阐明动脉粥样硬化的发生和发展具有重要意义。本实验旨在探讨细胞因子IL-1β、TNFα及脂多糖(LPS)是否诱导人脐静脉内皮细胞表达MCP-1 mRNA及蛋白。
, http://www.100md.com
材料和方法
1.内皮细胞的培养和鉴定:人脐静脉内皮细胞株购自武汉大学中国典型培养物保藏中心。用含10%小牛血清的DMEM培养液培养,以间接免疫荧光法测定Ⅷ因子相关抗原进行内皮细胞的鉴定。
2.Dot blot分析:当内皮细胞生长汇合后随机分为4组。N组 :正常对照组,在培养液中不加诱导剂。LPS组:在培养液中加入终浓度为100 ng/ml的脂多糖。IL-1β组:在培养液中加入终浓度2 ng/ml IL-1β(鼠类,重组型,Gibco公司产品)。TNFα组:在培养液中加入终浓度为20 ng/ml的TNFα(人类,重组型,Gibco公司产品)。 上述4组细胞不加或加入上述诱导剂后培养4 h收集细胞,用异硫氰酸胍法分别提取各组细胞的总RNA。每组取总RNA 20 μg,用多孔过滤加样器点到硝酸纤维素膜上。MCP-1探针是由35对碱基组成的寡核苷酸,它与MCP-1的cDNA的257~291核苷酸互补。探针的序列为5′-CGGATGTTGGGTTTGCTTGTCCAGGTGGTCCATGG-3′(探针由西安医科大学免疫病理学研究室协助合成)。将点有样品的硝酸纤维素膜置于预杂交液,57℃预杂交4 h,然后加入γ-32P标记的探针(2×106 cpm/ml),57℃杂交过夜。杂交完后用50 ml清洗液(0.2×SSC和0.1% SDS)57℃下洗膜4次。凉干后在-70℃下对感光胶片曝光72 h。常规显影定影后,用TJTY-300型医用图像处理系统检测各样本的积分吸光度值。
, http://www.100md.com
3.免疫细胞化学检测:待培养瓶中盖玻片上内皮细胞生长至半汇合状态时,弃去培养液,用D-Hanks液轻洗2次,分别加入含LPS 100 ng/ml、IL-1β 2 ng/ml和TNFα 20 ng/ml的培养液孵育24 h,对照组不加上述刺激物。弃去培养液,用D-Hanks液漂洗1次,4%多聚甲醛固定30 min后,收集盖玻片。用1% Triton 0.05 mol/L TBS浸泡长有内皮细胞盖玻片,4℃过夜。后按常规SABC法进行免疫细胞化学染色。用TJTY-300型全自动图像分析仪定量测定,在相同的放大倍数下,每组随机测4个视野,每个视野测5个细胞,即共测20个细胞的平均A值,以此代表内皮细胞内MCP-1含量,用SAS软件对各组数据进行方差分析。
结果
1.Dot blot分析: 培养的人脐静脉内皮细胞不暴露或分别暴露于IL-1β和 TNFα后,点在硝酸纤维素膜上的人脐静脉内皮细胞总RNA与MCP-1探针杂交后,放射自显影图像显示不同程度积分A值的斑点(图1)。图像处理系统检测结果,对照组、LPS组、TNFα组及IL-1β组斑点的积分A值分别为14.56、17.84、37.32和113.6。IL-1β组、TNFα组、LPS组分别为对照组的7.8倍、2.6倍和1.2倍(图2)。结果提示,培养的人脐静脉内皮细胞能低水平地表达MCP-1 mRNA,当其分别暴露于IL-1β和TNFα后,其MCP-1 mRNA的表达明显增强,而且前者的诱导作用强于后者。

, http://www.100md.com
图1 内皮细胞MCP-1的表达,图示斑点杂交后放射自显影的各组的斑点

图2 内皮细胞MCP-1 mRNA斑点的积分吸光度扫描结果
2.各组人脐静脉内皮细胞的MCP-1蛋白表达:免疫细胞化学显示,对照组内皮细胞中MCP-1蛋白呈非常弱的表达。各实验组中,LPS组内细胞中MCP-1表达较弱,但与对照组比较有所增强,TNFα组细胞呈中等强度表达,而IL-1β组内皮细胞中MCP-1表达明显增加,呈强阳性反应。图像分析显示各组的平均A值见表1。经方差分析表明,各组间差异有极显著性(F=193.25,P<0.01)。LPS组、TNFα组及IL-1β组与对照组相比,差异均有显著性(P<0.01)。
表1 免疫细胞化学显示各组MCP-1蛋白的表达 组别
, 百拇医药
细胞数
平均A值(
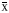 ±s)
±s)对照
20
0.051±0.004
LPS
20
0.078±0.113*
TNFα
20
0.102±0.005*
, 百拇医药
IL-1β
20
0.117±0.010*
*与对照组比较,P<0.01讨论
众所周知,细胞因子网络不仅参与维护正常血管的功能而且参与涉及血管的各种病理过程。近年研究表明,动脉粥样硬化病变的形成是动脉壁细胞通过分泌生长因子、趋化因子及其他细胞因子而相互调控的结果。因此,研究细胞因子,特别是促炎性细胞因子在动脉粥样硬化发展中的作用十分重要。本结果表明,在正常培养条件下人脐静脉内皮细胞可低水平地表达MCP-1mRNA和蛋白。经细胞因子IL-1β、TNFα刺激后人脐静脉内皮细胞可较高水平地表达MCP-1 mRNA和蛋白质,而LPS仅轻度诱导人脐静脉内皮细胞表达MCP-1。证实和扩展了Strieter等[5]与Rollins等[6]的实验观察。Strieter等[5]实验证实IL-1β、TNFα、LPS可以诱导内皮细胞表达MCP-1 mRNA和蛋白;Rollins等[6]用IL-1β、TNFα及干扰素γ诱导人脐静脉内皮细胞,结果IL-1β与TNFα处理的内皮细胞3 h后就高水平地表达MCP-1 mRNA, 而干扰素γ刺激24 h后才轻度诱导MCP-1 mRNA表达。同时我们的实验表明,IL-1β诱导内皮细胞表达MCP-1 mRNA的作用最强而LPS作用最弱,这与Brown等[7]的研究结果较一致。Brown等[7]用IL-1β、TNFα、干扰素γ及LPS与人肺微血管内皮细胞共育以检验是否增强MCP-1 mRNA和蛋白的表达,结果表明,IL-1β是最强的诱导物,TNFα次之,LPS与干扰素γ作用最弱或相对无效,TNFα与IL-1β激活内皮细胞功能是与快速早期原癌基因c-fos和c-jun的表达相关。同时已有报道,细胞因子使内皮细胞表达MCP-1依赖核因子Kappa B(NF-κB)与转录因子活化蛋白-1(AP-1,c-jun和c-fos基因产物构成的异二聚体)协调下进行[8]。IL-1β和TNFα还可使内皮细胞发生一系列的改变,包括形态与细胞外基质的反应[9]。
, http://www.100md.com
总之,我们的资料表明IL-1β和TNFα均可促进内皮细胞表达MCP-1 mRNA和蛋白。因此,它们在动脉粥样硬化的发生及发展特别是外周血液单核细胞在动脉内膜中的聚集中起重要作用。
基金项目:国家自然科学基金资助项目(39470289)
通信作者:邓仲端
参考文献:
[1]Clinton SK, Fleet JC, Loppnow H, et al. Interleukin-1 gene expression in rabbit vascular tissue in vivo. Am J Pathol, 1991,138:1005-1014.
[2]Warner SJ, Friedman GB, Libby P. Regulation of major histocompatibility gene expression in human vascular smooth muscle cells. Arteriosclerosis,1989,9:279-288.
, 百拇医药
[3]于光耀,邓仲端,瞿智玲.氧化修饰脂蛋白对内皮细胞的单核细胞趋化蛋白-1表达的影响.中华病理学杂志,1998,27:174-176.
[4]夏春枝,邓仲端.脂质过氧化诱导培养的内皮细胞表达单核细胞趋化蛋白1.中国动脉硬化杂志,1997,5:291-294.
[5]Strieter RM, Wiggins R, Phan SH, et al. Monocyte chemotactic protein gene expression by cytokine-treated human fibroblasts and endothelial cells. Biochem Biophys Res Commun, 1989,162:694-700.
[6]Rollins BJ, Yoshimura T, Leonard EJ, et al. Cytokine-activated human endothelial cells synthesize and secrete a monocyte chemoattractant, MCP-1/JE. Am J Pathol, 1990,136:1229-1233.
, 百拇医药
[7]Brown Z, Gerritson ME, Carley WW, et al. Chemokine gene expression and secretion by cytokine-activated human microvascular endothelial cells. Am J Pathol, 1994,145:913-921.
[8]Martin T, Cardarelli PM, Parry GC, et al. Cytokine induction of monocyte chemoattractant protein-1 gene expression in human endothelial cells depends on the cooperative action of NF-κB and AP-1, Eur J Immunol ,1997,27:1091-1097.
[9]Mantovani A, Dejana E. Cytokines as communication signals between leukocytes and vascular endothelial cells. Immunol Today, 1989,10:370-375.
收稿日期:1999-03-10, 百拇医药