不同培养条件对人脐静脉内皮细胞分泌t-PA及PAI-1抗原的影响
作者:黄春 陈晓春 蓝玉福
单位:福建医科大学附属协和医院干部病房,福建省老年医学研究所(福州 350001)
关键词:内皮细胞;纤溶酶原灭活剂-1
福建医科大学学报990203 目的 观察不同培养条件对内皮细胞(EC)纤溶活性的影响。方法 用ELISA法测定人脐静脉内皮细胞(HUVEC)培养上清液中的纤溶酶原激活物(t-PA)及I型纤溶酶原灭活剂(PAI-1)总抗原,观察不同代EC分泌t-PA,PAI-1抗原的变化,以及不同血清浓度对两种抗原含量的影响。结果 传代和血清均可刺激PAI-1抗原的合成分泌;HUVEC 在第3~4代分泌PAI-1抗原量相当;10%血清浓度时PAI-1抗原含量最高。结论 传代和不同浓度血清可影响HUVEC分泌PAI-1抗原,但不影响t-PA抗原的分泌。
The Effects of Different Culture Conditions on t-PA and PAI-1 Antigens of Cultured Human Umbilical Vein Endothelial Cells
, http://www.100md.com
Huang Chun Chen Xiaochun Lan Yufu
(Fujian Institute of Geriatrics,The Affiliated Union Hospital,Fujian Medical University, Fuzhou, 350001)
Objective To investigate the effects of different culture conditions on fibrinolytic activity of endothelial cells(EC).Methods To quantify total tissue-profibrinolytic activator(t-PA) and plasminogen activator inhibitor-1(PAI-1) antigens in human umbilical vein endothelial cell(HUVEC)-conditioned media by enzyme-linked immunosorbend assays(ELISA). To examine the effects of serial passing of HUVEC on t-PA and PAI-1 synthesis levels and the effects of various-dose serum on t-PA and PAI-1 antigens released from EC passage 3.Results Serial passing and serum can stimulate synthesis and secretion of PAI-1 antigens. EC passage 3~4 have relatively compared PAI-1 antigens. Conditioned media containing 10% fatal bovin serum(10% FBS) have the highest PAI-1 level.Conclusion Serial passing and various-dose serum have effects on synthesis and secretion of PAI-1 antigens,but have no effect on release of t-PA antigens from EC.
, 百拇医药
Key words endothelium cell; plasminogen activator inhibitor-1
近年来,血栓形成在缺血性心脏病发生发展的病理机制研究中已广为重视,特别是纤溶系统在体内平衡的紊乱已有许多研究。纤溶酶原激活物(t-PA)和I型纤溶酶原灭活剂(PAI-1)是纤溶系统的重要调节因子,PAI-1的合成和分泌受多种因素的影响。本研究观察传代和血清浓度对内皮细胞
(EC)合成、分泌t-PA,PAI-1抗原的影响,寻找较合适的培养条件,为体外研究纤溶系统的调节机制提供模型和摸索合适的条件。
1 材料和方法
1.1 人脐静脉内皮细胞(HUVEC)的分离培养与鉴定
参照Jaffe[1]的方法,无菌条件下取足月顺产新生儿脐带4~6条,长25~30cm,D-Hank's液冲洗净脐静脉管腔,0.25%胰蛋白酶37℃消化10~15min,收集消化液,离心弃上清,用IMDM培养基洗细胞1次,含20%胎牛血清(20%FBS)的IMDM培养液重新悬浮细胞,调整细胞密度为1×105/ml,接种于培养瓶或培养板中,37℃、5%CO2条件下静置培养,细胞长至融合后,用胰蛋白酶/EDTA混合消化液(终浓度分别为0.1%和0.01%)消化,以1∶2传代。同源的原代及传1~3代EC均用20%FBS培养,长至单层融合后用于实验。实验前单层融合细胞用无血清IMDM培养基洗2遍。原代及传代细胞均用抗第八因子相关抗原(factor Ⅷ related antigen,FⅧ R)血清( 购自福州迈新公司)进行免疫细胞化学染色鉴定。
, 百拇医药
1.2 实验分组
同源的原代、传代细胞按同数量分为两组:(1)无血清IMDM培养液组(SFM);(2)含5%胎牛血清的IMDM组(5%FBS);分别孵育24h,收集上清液待测抗原。
第三代(即传第二代)细胞按同源、同数量分为4组:(1)SFM;(2)5%FBS;(3)含10%胎牛血清的IMDM培养液(10%FBS);(4)含20%胎牛血清的IMDM培养液(20%FBS);共同孵育24h,收集上清液待测抗原。
第三代细胞分SFM和含5%FBS培养基两组,分别孵育3,6,12,24h,收集上清液待测抗原。
每组实验重复5次。
1.3 用ELISA法测定培养上清液中t-PA,PAI-1抗原含量
, 百拇医药
T-PA,PAI-1抗原测定试剂盒购自法国Stago公司(按说明书操作)。
1.4 统计处理
数值以均数±标准差表示,多组间均数比较采用SPSS 软件进行One-Way ANOVA分析,显著性水平为P<0.05。
2 结 果
2.1 EC形态与生长状态
在光学倒置显微镜下,原代培养细胞种植2h后贴壁生长,开始细胞呈圆形,渐变为多角形、长多角形镶嵌排列,核呈圆形或椭圆形,呈集落样生长;培养3~4天后长成连续的单层细胞,融合后呈铺路石样紧密排列。传代细胞种植0.5~1h后即贴壁生长,3~4天后融合,形态同原代EC(图1)。在实验过程中,含5%~20%FBS的培养液能使EC保持融合状态至少达48h之久;无血清的IMDM培养液在实验头24h仍能维持EC的融合状态,24h后则开始出现散在的EC收缩变圆,甚至脱落。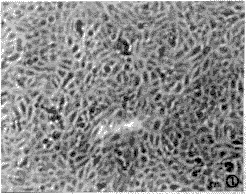
, 百拇医药
图1 传代培养的内皮细胞长成单层并呈镶嵌排列×100
2.2 ECⅧ因子SP染色鉴定
原代及传代培养的EC呈阳性反应(图2),即细胞浆内有棕褐色沉淀,以核周最为明显。对照呈阴性反应(图3)。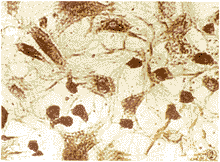
图2 传代培养的内皮细胞Ⅷ因子SP染色阳性反应 ×400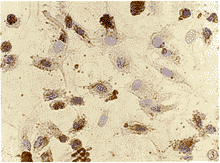
图3 传代培养的内皮细胞Ⅷ因子SP染色阴性对照 ×400
2.3 传代及血清浓度对EC纤溶活性影响
传代对EC培养上清液(CM)中t-PA,PAI-1抗原含量的影响见表1。不同浓度血清和孵育不同时间EC CM中t-PA,PAI-1抗原含量的变化见表2和表3。
, 百拇医药
表1 不同代EC培养上清液中t-PA,PAI-1抗原含量(ng/25万细胞/24h)
SFM
5%FBS
PAI-1
t-PA
PAI-1
t-PA
原代
402.60±7.47
1.35±0.09
730.40±48.63
1.31±0.03
, http://www.100md.com
第2代
206.00±10.61*
1.33±0.08
367.00±9.06*
1.30±0.01
第3代
415.20±13.97#
1.36±0.02
849.60±27.36#
1.32±0.01
第4代
, 百拇医药
417.20±12.87#
1.35±0.02
848.20±19.80#
1.30±0.02
SFM:无血清培养液;FBS:胎牛血清液.与原代比较,*:P<0.05;与第二代比较,#:P<0.05.
表2 不同浓度血清对EC培养上清液t-PA,PAI-1抗原(ng/25万细胞/24h)的影响
SFM
FBS
5%
10%
, http://www.100md.com
20%
PAI-1
415.20±13.97
849.60±27.36*
1196.40±0.74*#
828.00±10.30*▲
t-PA
1.38±0.01
1.35±0.09
1.35±0.02
1.33±0.08
, 百拇医药
与SFM组比较,*:P<0.05;与5%FBS组比较,#:P<0.05;与10%FBS组比较,▲:P<0.05.
表3 不同孵育时间培养上清t-PA,PAI-1抗原的含量(ng/25万细胞) 时间(h)
SFM
5%FBS
PAI-1
t-PA
PAI-1
t-PA
3
49.40±3.05
1.37±0.04
, http://www.100md.com
61.80±8.26
1.30±0.02
6
68.60±7.54*
1.31±0.05
174.88±19.11*
1.31±0.03
12
110.20±8.07*#
1.32±0.04
383.60±21.41*#
, 百拇医药
1.32±0.01
24
415.20±13.79*▲
1.31±0.02
849.60±27.36*▲
1.30±0.08
48
602.60±39.54*△
1.31±0.05
1261.60±43.62△
, 百拇医药 1.32±0.04
与3h比较,*:P<0.05;与6h比较,#:P<0.05;与12h比较,▲:P<0.05; 与24h比较,△:P<0.05.
3 讨 论
PAI-1是一种急性相反应物,其血浆中水平增加与血栓性疾病密切相关[2]。内皮细胞PAI-1有活性和潜在活性2种功能形式,体外培养细胞中分泌的活性PAI-1(a-PAI-1)会很快转变成为潜在活性型PAI-1(l-PAI-1)。因此,测定PAI-1总抗原较单纯测定其活性更能反映体外培养细胞PAI-1水平的变化。PAI-1的合成受多种物质的影响,糖皮质激素、内毒素、白细胞介素-1(IL-1)、肿瘤坏死因子(TNFα)和凝血酶都能刺激PAI-1分泌[3,4]。本研究发现,在一定浓度范围内,血清能刺激EC分泌PAI-1,以10%FBS的作用最大,5%FBS与20%FBS作用相近;在无血清条件下,培养上清中的PAI-1抗原也能随孵育时间的延长而增长,说明PAI-1抗原的合成并非血清依赖性。
, 百拇医药
原代培养人脐静脉内皮细胞中混有许多血细胞,其中单核、巨噬细胞能产生IL-1和TNF-α,激活EC,传1~2代后单核、巨噬细胞基本除去。本研究发现,第1代EC 培养上清中PAI-1抗原含量较第2代高,考虑是IL-1和TNFα刺激EC分泌PAI-1抗原所致,第3,4代EC培养上清中PAI-1抗原含量较第2代高,说明传代对PAI-1分泌有影响,传2~3代以后,PAI-1分泌趋于稳定。
笔者发现,EC融合后使用无血清培养基培养超过24h,有散在的细胞脱落,可能与长时间无血清培养导致EC营养不良有关,而FBS浓度在5%以上即可维持EC的融合状态达48h。因此,可以认为,用于研究纤溶调节机制的人脐静脉内皮细胞模型,以第3,4代较为稳定,施加处理因素过程中,用含低浓度血清的培养基进行培养,并以不含处理因素的同浓度血清为对照,既可保持细胞活力,又能尽量减少血清对实验结果的影响。
*:福建省卫生厅科研基金资助课题(97030)
, 百拇医药
参考文献
1 Jaffe EA,Nachman RL,Becker CG,et al.Culture of human endothelial cells derived from umbilical veins.Identification by morphologic and immunologic criteria.J Clin Invest,1973;52:2745
2 Sugao I,Toshiyasu T,Sigemoto N,et al.Postangioplasty restenosis:platelet activation and the coagulation-fibrinolysis system as possible factors in the pathogenesis of restenosis.Am Heart J,1997;133: 387
3 Yohko K,Yutaka M,Kiyoaki W,et al.hemodynamic force modulate the effects of cytokines on fibrinolytic activity of endothelial cells.Blood,1996;87:2314
4 David D,Thomas Q.Thrombin regulation of mRNA levels of tissue plasminogen activator and plasminogen activator inhibitor-1 in culture human umbilical vein endothelial cells.Blood,1989;74:222
(收稿:1999-02-05 修回:1999-04-19), 百拇医药
单位:福建医科大学附属协和医院干部病房,福建省老年医学研究所(福州 350001)
关键词:内皮细胞;纤溶酶原灭活剂-1
福建医科大学学报990203 目的 观察不同培养条件对内皮细胞(EC)纤溶活性的影响。方法 用ELISA法测定人脐静脉内皮细胞(HUVEC)培养上清液中的纤溶酶原激活物(t-PA)及I型纤溶酶原灭活剂(PAI-1)总抗原,观察不同代EC分泌t-PA,PAI-1抗原的变化,以及不同血清浓度对两种抗原含量的影响。结果 传代和血清均可刺激PAI-1抗原的合成分泌;HUVEC 在第3~4代分泌PAI-1抗原量相当;10%血清浓度时PAI-1抗原含量最高。结论 传代和不同浓度血清可影响HUVEC分泌PAI-1抗原,但不影响t-PA抗原的分泌。
The Effects of Different Culture Conditions on t-PA and PAI-1 Antigens of Cultured Human Umbilical Vein Endothelial Cells
, http://www.100md.com
Huang Chun Chen Xiaochun Lan Yufu
(Fujian Institute of Geriatrics,The Affiliated Union Hospital,Fujian Medical University, Fuzhou, 350001)
Objective To investigate the effects of different culture conditions on fibrinolytic activity of endothelial cells(EC).Methods To quantify total tissue-profibrinolytic activator(t-PA) and plasminogen activator inhibitor-1(PAI-1) antigens in human umbilical vein endothelial cell(HUVEC)-conditioned media by enzyme-linked immunosorbend assays(ELISA). To examine the effects of serial passing of HUVEC on t-PA and PAI-1 synthesis levels and the effects of various-dose serum on t-PA and PAI-1 antigens released from EC passage 3.Results Serial passing and serum can stimulate synthesis and secretion of PAI-1 antigens. EC passage 3~4 have relatively compared PAI-1 antigens. Conditioned media containing 10% fatal bovin serum(10% FBS) have the highest PAI-1 level.Conclusion Serial passing and various-dose serum have effects on synthesis and secretion of PAI-1 antigens,but have no effect on release of t-PA antigens from EC.
, 百拇医药
Key words endothelium cell; plasminogen activator inhibitor-1
近年来,血栓形成在缺血性心脏病发生发展的病理机制研究中已广为重视,特别是纤溶系统在体内平衡的紊乱已有许多研究。纤溶酶原激活物(t-PA)和I型纤溶酶原灭活剂(PAI-1)是纤溶系统的重要调节因子,PAI-1的合成和分泌受多种因素的影响。本研究观察传代和血清浓度对内皮细胞
(EC)合成、分泌t-PA,PAI-1抗原的影响,寻找较合适的培养条件,为体外研究纤溶系统的调节机制提供模型和摸索合适的条件。
1 材料和方法
1.1 人脐静脉内皮细胞(HUVEC)的分离培养与鉴定
参照Jaffe[1]的方法,无菌条件下取足月顺产新生儿脐带4~6条,长25~30cm,D-Hank's液冲洗净脐静脉管腔,0.25%胰蛋白酶37℃消化10~15min,收集消化液,离心弃上清,用IMDM培养基洗细胞1次,含20%胎牛血清(20%FBS)的IMDM培养液重新悬浮细胞,调整细胞密度为1×105/ml,接种于培养瓶或培养板中,37℃、5%CO2条件下静置培养,细胞长至融合后,用胰蛋白酶/EDTA混合消化液(终浓度分别为0.1%和0.01%)消化,以1∶2传代。同源的原代及传1~3代EC均用20%FBS培养,长至单层融合后用于实验。实验前单层融合细胞用无血清IMDM培养基洗2遍。原代及传代细胞均用抗第八因子相关抗原(factor Ⅷ related antigen,FⅧ R)血清( 购自福州迈新公司)进行免疫细胞化学染色鉴定。
, 百拇医药
1.2 实验分组
同源的原代、传代细胞按同数量分为两组:(1)无血清IMDM培养液组(SFM);(2)含5%胎牛血清的IMDM组(5%FBS);分别孵育24h,收集上清液待测抗原。
第三代(即传第二代)细胞按同源、同数量分为4组:(1)SFM;(2)5%FBS;(3)含10%胎牛血清的IMDM培养液(10%FBS);(4)含20%胎牛血清的IMDM培养液(20%FBS);共同孵育24h,收集上清液待测抗原。
第三代细胞分SFM和含5%FBS培养基两组,分别孵育3,6,12,24h,收集上清液待测抗原。
每组实验重复5次。
1.3 用ELISA法测定培养上清液中t-PA,PAI-1抗原含量
, 百拇医药
T-PA,PAI-1抗原测定试剂盒购自法国Stago公司(按说明书操作)。
1.4 统计处理
数值以均数±标准差表示,多组间均数比较采用SPSS 软件进行One-Way ANOVA分析,显著性水平为P<0.05。
2 结 果
2.1 EC形态与生长状态
在光学倒置显微镜下,原代培养细胞种植2h后贴壁生长,开始细胞呈圆形,渐变为多角形、长多角形镶嵌排列,核呈圆形或椭圆形,呈集落样生长;培养3~4天后长成连续的单层细胞,融合后呈铺路石样紧密排列。传代细胞种植0.5~1h后即贴壁生长,3~4天后融合,形态同原代EC(图1)。在实验过程中,含5%~20%FBS的培养液能使EC保持融合状态至少达48h之久;无血清的IMDM培养液在实验头24h仍能维持EC的融合状态,24h后则开始出现散在的EC收缩变圆,甚至脱落。

, 百拇医药
图1 传代培养的内皮细胞长成单层并呈镶嵌排列×100
2.2 ECⅧ因子SP染色鉴定
原代及传代培养的EC呈阳性反应(图2),即细胞浆内有棕褐色沉淀,以核周最为明显。对照呈阴性反应(图3)。

图2 传代培养的内皮细胞Ⅷ因子SP染色阳性反应 ×400

图3 传代培养的内皮细胞Ⅷ因子SP染色阴性对照 ×400
2.3 传代及血清浓度对EC纤溶活性影响
传代对EC培养上清液(CM)中t-PA,PAI-1抗原含量的影响见表1。不同浓度血清和孵育不同时间EC CM中t-PA,PAI-1抗原含量的变化见表2和表3。
, 百拇医药
表1 不同代EC培养上清液中t-PA,PAI-1抗原含量(ng/25万细胞/24h)
SFM
5%FBS
PAI-1
t-PA
PAI-1
t-PA
原代
402.60±7.47
1.35±0.09
730.40±48.63
1.31±0.03
, http://www.100md.com
第2代
206.00±10.61*
1.33±0.08
367.00±9.06*
1.30±0.01
第3代
415.20±13.97#
1.36±0.02
849.60±27.36#
1.32±0.01
第4代
, 百拇医药
417.20±12.87#
1.35±0.02
848.20±19.80#
1.30±0.02
SFM:无血清培养液;FBS:胎牛血清液.与原代比较,*:P<0.05;与第二代比较,#:P<0.05.
表2 不同浓度血清对EC培养上清液t-PA,PAI-1抗原(ng/25万细胞/24h)的影响
SFM
FBS
5%
10%
, http://www.100md.com
20%
PAI-1
415.20±13.97
849.60±27.36*
1196.40±0.74*#
828.00±10.30*▲
t-PA
1.38±0.01
1.35±0.09
1.35±0.02
1.33±0.08
, 百拇医药
与SFM组比较,*:P<0.05;与5%FBS组比较,#:P<0.05;与10%FBS组比较,▲:P<0.05.
表3 不同孵育时间培养上清t-PA,PAI-1抗原的含量(ng/25万细胞) 时间(h)
SFM
5%FBS
PAI-1
t-PA
PAI-1
t-PA
3
49.40±3.05
1.37±0.04
, http://www.100md.com
61.80±8.26
1.30±0.02
6
68.60±7.54*
1.31±0.05
174.88±19.11*
1.31±0.03
12
110.20±8.07*#
1.32±0.04
383.60±21.41*#
, 百拇医药
1.32±0.01
24
415.20±13.79*▲
1.31±0.02
849.60±27.36*▲
1.30±0.08
48
602.60±39.54*△
1.31±0.05
1261.60±43.62△
, 百拇医药 1.32±0.04
与3h比较,*:P<0.05;与6h比较,#:P<0.05;与12h比较,▲:P<0.05; 与24h比较,△:P<0.05.
3 讨 论
PAI-1是一种急性相反应物,其血浆中水平增加与血栓性疾病密切相关[2]。内皮细胞PAI-1有活性和潜在活性2种功能形式,体外培养细胞中分泌的活性PAI-1(a-PAI-1)会很快转变成为潜在活性型PAI-1(l-PAI-1)。因此,测定PAI-1总抗原较单纯测定其活性更能反映体外培养细胞PAI-1水平的变化。PAI-1的合成受多种物质的影响,糖皮质激素、内毒素、白细胞介素-1(IL-1)、肿瘤坏死因子(TNFα)和凝血酶都能刺激PAI-1分泌[3,4]。本研究发现,在一定浓度范围内,血清能刺激EC分泌PAI-1,以10%FBS的作用最大,5%FBS与20%FBS作用相近;在无血清条件下,培养上清中的PAI-1抗原也能随孵育时间的延长而增长,说明PAI-1抗原的合成并非血清依赖性。
, 百拇医药
原代培养人脐静脉内皮细胞中混有许多血细胞,其中单核、巨噬细胞能产生IL-1和TNF-α,激活EC,传1~2代后单核、巨噬细胞基本除去。本研究发现,第1代EC 培养上清中PAI-1抗原含量较第2代高,考虑是IL-1和TNFα刺激EC分泌PAI-1抗原所致,第3,4代EC培养上清中PAI-1抗原含量较第2代高,说明传代对PAI-1分泌有影响,传2~3代以后,PAI-1分泌趋于稳定。
笔者发现,EC融合后使用无血清培养基培养超过24h,有散在的细胞脱落,可能与长时间无血清培养导致EC营养不良有关,而FBS浓度在5%以上即可维持EC的融合状态达48h。因此,可以认为,用于研究纤溶调节机制的人脐静脉内皮细胞模型,以第3,4代较为稳定,施加处理因素过程中,用含低浓度血清的培养基进行培养,并以不含处理因素的同浓度血清为对照,既可保持细胞活力,又能尽量减少血清对实验结果的影响。
*:福建省卫生厅科研基金资助课题(97030)
, 百拇医药
参考文献
1 Jaffe EA,Nachman RL,Becker CG,et al.Culture of human endothelial cells derived from umbilical veins.Identification by morphologic and immunologic criteria.J Clin Invest,1973;52:2745
2 Sugao I,Toshiyasu T,Sigemoto N,et al.Postangioplasty restenosis:platelet activation and the coagulation-fibrinolysis system as possible factors in the pathogenesis of restenosis.Am Heart J,1997;133: 387
3 Yohko K,Yutaka M,Kiyoaki W,et al.hemodynamic force modulate the effects of cytokines on fibrinolytic activity of endothelial cells.Blood,1996;87:2314
4 David D,Thomas Q.Thrombin regulation of mRNA levels of tissue plasminogen activator and plasminogen activator inhibitor-1 in culture human umbilical vein endothelial cells.Blood,1989;74:222
(收稿:1999-02-05 修回:1999-04-19), 百拇医药