苯那普利对糖尿病大鼠肾组织细胞周期蛋白激酶抑制剂P21CIPI蛋白表达的影响*
作者:吴永贵 余 毅 林善锬
单位:上海医科大学华山医院肾内科 上海,200040
关键词:血管紧张素转换酶抑制剂;糖尿病肾病;P21CIPI蛋白
肾脏病与透析肾移植杂志990107 摘 要 目的:探讨苯那普利对糖尿病大鼠肾组织细胞周期蛋白激酶抑制剂P21CIP1蛋白表达的影响。 方法:大鼠随机分单侧肾切除对照组(C组)、糖尿病组(D组)及糖尿病苯那普利治疗组(DB组)。1周后,应用免疫印迹(Western杂交)分析各组肾皮质P21CIPI蛋白表达。血浆、肾皮、髓质血管紧张素转换酶(ACE)活性由荧光分光光度法测得。 结果:单侧肾切除糖尿病大鼠1周体重即明显下降(P<0.05),肾重/体重即肾脏肥大指数却明显增加(P<0.05),血浆ACE活性有所下降而肾皮质ACE活性却有所上升。Western杂交分析表明对照组肾皮质几乎没有P21CIP1蛋白表达,然而,糖尿病肾皮质P21CIP1蛋白表达明显增加;苯那普利治疗1周对肾脏肥大有明显的抑制作用,对血浆、肾皮、髓质ACE活性抑制分别达89.0%、70.0%、70.5%,对肾皮质P21CIPI蛋白表达抑制达60.0%。结论:苯那普利对糖尿病肾脏肥大的抑制作用至少部分与P21CIPI蛋白表达降低有关,其确切机制尚有待于进一步研究。
, http://www.100md.com
EFFECT OF BENAZEPRIL ON EXPRESSION OF CYCLIN KINASE INHIBITOR P21CIP1 PROTEIN IN RENAL TISSUE OF DIABETIC RATS
Wu Yonggui,Yu Yi,Lin Shanyan
Division of Nephrology,Hua Shan Hospital,Shanghai Medical University,Shanghai,200040
OBJECTIVE To investigate the effect of benazepril on expression of cyclin kinase inhibitor P21CIP1 protein in renal tissue of diabetic rats.
, 百拇医药
METHODOLOGY Uninephrectomized rats were randomly divided into three groups.Untreated uninephrectomized rats were set as the blank control group(Group C,n=6).Diabetic rats induced by streptozotocin(STZ)were divided into diabetic group(Group D,n=7)and benazepril treated diabetic group(Group DB,n=7)(10mg/kg*day-1by gavage).Angiotensin converting enzyme(ACE)activities were determined with fluorimetric assay in the plasma,renal cortex and medulla tissue.The expression of P21CIP1protein in renal cortex was determined with Western blot analysis.
, 百拇医药
RESULTS At the end of the first week of observation,loss of body weight,increase in renal hypertrophy index (kidney-weight/body-weight×100),decrease in plasma ACE activity and elevation of renal cortex ACE activity were observed in rats of Group D.The expression of P21CIP1 protein in renal cortex was hardly detected in rats of Group C,but was significantly enhanced in rats of Group D.Body weight loss and renal hypertrophy index increase were ameliorated in the rats of Group DB.As compared to Group D,ACE activities(in plasma,renal cortex and medulla)were decreased (by 89%,70%,and 70.5%respectively)and expression of P21CIP1protein in renal cortex was reduced (by 60%) in rats of Group DB.
, 百拇医药
CONCLUSION Benazepril′s suppression of early diabetic kidney hypertrophy might be associated,at least in part,with a decrease in the expression of P21CIP1protein in renal cortex.
Key words angiotesin converting enzyme inhibitor diabetic nephropathy P21CIP1 protein
近年来研究表明,高糖与局部肾素-血管紧张素系统(RAS)是糖尿病肾病(Diabetic nephropathy,DN)发生、发展的两大主要因素。其中,RAS依赖其活性物质血管紧张素Ⅱ(AngⅡ)不仅引起血流动力学紊乱,更重要的是与高糖协同诱导肾脏肥大。目前,研究证实AngⅡ诱导肾脏肥大涉及到细胞周期的变化,后者受一系列细胞周期调节蛋白(Cell-cycle regulatory protein,CRP)调控。CRP既包括正性调节蛋白如细胞周期蛋白(Cyclin)和cyclin依赖性激酶(Cyclin depentent kinase,CDK)又包括负性调节蛋白如Cyclin激酶抑制剂(Cyclin kinase inhibotor,CKI)[1]。P21CIP1蛋白是一种重要的CKI,研究表明AngⅡ的作用部分由P21CIP1蛋白介导。因而,甚有必要了解阻断RAS是否能下调P21CIP1蛋白表达。为此,我们选用一种血管紧张素转换酶抑制剂(Angiotensin converting enzyme inhibitor,ACEI)苯那普利从这个角度进行初步探讨。
, 百拇医药
1 材料和方法
1.1 糖尿病模型建立及动物分组 所有大鼠均接受右侧肾切除术,2周后腹腔注射单剂量链脲佐菌素(STZ)60 mg/kg(溶解在10 mmol/L枸椽酸缓冲液中,pH5.5),对照组仅注射等量枸椽酸缓冲液,48~72h后尾静脉采血用血糖仪[one TouchⅡ型,强生(中国)有限公司]测定全血血糖,血糖≥16.7 mmol/L,同时尿糖在3+~4+以上者确定为糖尿病模型。动物分三组:①对照组(C组,n=6);②糖尿病组(D组,n=7);③糖尿病+苯那普利治疗组(DB组,n=7)。苯那普利(北京-汽巴嘉基药品有限公司提供)10 mg/kg每日灌胃,C与D组仅给予等量生理盐水灌胃。观察1周后收集标本。
1.2 标本收集 1周末在大鼠空腹16h后于尾静脉采血待测血糖及血胰岛素水平。然后在3%水合氯醛麻醉下行右侧颈总动脉插管收集血标本,取血浆保存于-70℃冰箱中待测ACE活性,同时收集血清待测血肌酐(Scr)水平;在腹主动脉插管注入4℃预冷的生理盐水反复灌洗肾脏后,称重、分离皮、髓质,保存于-70℃冰箱中待测肾组织ACE活性及提取总蛋白。
, 百拇医药
1.3 一般指标测定 平均动脉压(MAP)由右侧颈总动脉插管接血压监测仪测得;血糖、SCr水平由日立7150型全自动生化分析仪检测;血胰岛素水平采用放射免疫法检测。
1.4 血浆及肾皮、髓质ACE活性测定 参考Unger等[2]方法略加改进,由日立F-4000荧光分光光度计检测(Ex 360nm、EW 486 nm)。所需底物马尿酰-组氨酰-亮氨酸(Hippury-L-histidyl-L-leucine,Hip-his-leu)、荧光激发物邻苯二醛(O-phthadialdehyde)及标准品组氨酰-亮氨酸(His-leu,HL)均购自Sigma公司。酶活性单位为nmol HL/(min.ml)(血浆)或nmol HL/(min.mg)(组织)。
1.5 免疫印迹(Western杂交)分析 肾皮质组织总蛋白提取在细胞裂解液(PBS,1% NP40,0.5% sodium deoxycholate,0.1% SDS,100mg/L aprotinin,100mg/L PMSF,100μmol/L sodium orthovanadate)中进行。肾皮质组织总蛋白含量采用改良lowry法。取总蛋白50μg,加等量样本处理液,100℃煮沸4min,15%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳后转移至硝酸纤维素膜上,在丽春红染液中染色观察蛋白转移情况并标出蛋白质分子量标准。然后用含5%脱脂牛奶的TBST封闭,4℃过液,洗膜后加兔抗P21CIP1多克隆抗体(工作浓度1∶100,Santa Cruz公司)进行杂交,再度洗膜后加辣根过氧化酶(HRP)标记的山羊抗兔IgG(工作浓度1∶100,华美生物工程公司)进行二抗杂交,洗膜后加入免疫印迹化学发光试剂(华美生物工程公司),最后进行放射自显影,所有杂交信号在IBAS-2000图像分析系统进行光密度(A值)扫描。
, http://www.100md.com
1.6 统计学处理 数据以均数±标准差(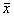 ±s)表示,组间差异性比较采用方差分析和q检验。
±s)表示,组间差异性比较采用方差分析和q检验。
2 结 果
2.1 各组血糖、血胰岛素及血肌酐水平的变化 与对照组相比,糖尿病大鼠血糖明显增加伴血胰岛素水平明显下降(P<0.01),提示糖尿病模型建立成功。苯那普利治疗一周对血糖、血胰岛素及血肌酐水平无明显影响。(表1)
表1 各组血糖、血胰岛素及血肌酐水平的变化(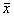 ±s) 组别
±s) 组别
鼠数
血糖(mmol/L)
, http://www.100md.com 血胰岛素(mU/L)
血肌酐(μmol/L)
C组
6
5.24±0.52
31.83±9.08
50.13±5.7
D组
7
31.02±2.44*
10.10±2.51*
55.77±2.2
, 百拇医药
DB组
7
27.96±3.76
14.09±2.42
59.84±5.2
与C组相比*P<0.01
2.2 各组MAP、体重及肾重/体重的变化 糖尿病大鼠MAP有所升高,但与对照组相比无明显统计学意义,苯那普利对MAP无明显降低作用;尽管糖尿病大鼠体重明显下降(P<0.01),但肾脏肥大指数(肾重/体重)有所增加,与对照组相比有统计学意义(P<0.05)。苯那普利治疗后对糖尿病大鼠体重下降有一定的延缓作用,并能抑制肾重/体重的增加(P<0.05)。(表2)
表2 各组MAP、体重及肾重/体重的变化(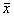 ±s) 组别
±s) 组别
, http://www.100md.com
鼠数
MAP(kPa)
体重(g)
肾重/体重×1000
C组
6
10.70±0.33
230.5±22.7
4.32±0.25
D组
7
11.33±0.58
, 百拇医药 180.7±25.6
5.52±0.37△
DB组
7
10.53±0.87
207.6±23.9#
4.71±0.28#
与C组相比*P<0.01,△P<0.05;与D组相比#P<0.05
2.3 各组血浆及肾皮、髓质ACE活性变化 与对照组相比,糖尿病大鼠血浆ACE活性有明显下降趋势;然而,肾皮质、髓质ACE活性却有所增加,苯那普利对血浆、肾皮、髓质ACE活性均有明显抑制作用,分别达到89.0%、70.0%和70.5%。(表3)
, 百拇医药
表3 各组血浆及肾皮、髓质ACE活性变化(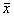 ±s) 组别
±s) 组别
鼠数
血浆
肾皮质
肾髓质
C组
6
230.0±32.5
1.79±0.12
9.15±0.84
D组
, 百拇医药
7
210.0±28.3
1.87±0.13
10.01±0.64
DB组
7
23.10±4.5*
0.56±0.10*
2.95±0.52*
ACE活性单位为nmol HL/(min.ml)(血浆)或nmol HL/(min.mg)(组织)。与C组相比*P<0.05。
, 百拇医药
2.4 Western杂交分析 组织标本经15%SDS-PAGE后转移至硝酸纤维素膜上,用抗P21CIP1蛋白一抗和相关二抗杂交后经化学发光放射自显影证实在P21CIP1蛋白相应分子量位置上可出现阳性杂交信号。其中,对照组肾皮质几乎无P21CIP1蛋白表达,糖尿病组表达则明显增加,苯那普利治疗后对此有明显的抑制作用,几乎达60.0%。
3 讨 论
本研究采用单侧肾切除后两周腹腔注射单剂量STZ制成胰岛素依赖性糖尿病模型,一周后大鼠体重明显下降,但肾脏肥大指数即肾重/体重却明显增加,说明本模型已出现DN早期肾脏肥大,与文献报道一致[3]。肾脏肥大是DN早期特征性病理表现之一,是晚期肾脏硬化的前驱。因此,目前众多学者研究兴趣多集中于探讨DN早期肾脏肥大的机制及如何延缓或逆转DN早期肾脏肥大。现在研究认为,DN早期肾脏肥大是以遗传为背景、以高血糖为启动因素所诱导的各种血管活性物质、生长因子、细胞介质、化学趋化因子、反应氧代谢产物等综合作用的结果,进一步研究则表明,这些损伤介质最终是通过调控细胞周期来诱导细胞肥大[4]。
, 百拇医药
由于G1期是细胞周期起始和限速阶段,因此,有关G1期CRP研究较多,G1期Cyclin包括Cyclin D和Cyclin E,CDK包括CDK2,4,6,其中Cyclin D和CDK4,6主要分布于G1期早期,而Cyclin E和CDK2则分布于G1期晚期。细胞周期从G1期过渡到S期必需要突破G1/S期之间检测点(Checkpoint),其关键是要使视网膜瘤蛋白(Retinoblastoma protein,pRb)磷酸化,释放转录因子E2F,解除DNA合成抑制,细胞得以进入增殖周期,否则G1期过度延长,细胞呈肥大状态[1]。在这过程中Cyclin与CDK结合复合物是使pRb磷酸化的关键。目前,有关糖尿病肾脏肥大过程中肾组织Cyclin与CDK表达的研究较少,Sankland等[5]报道,在STZ诱导的糖尿病模型中肾组织G1期Cyclin和CDK表达没有明显变化,其原因尚不清楚,最近Wolf等[6]研究则认为,糖尿病早期肾脏肥大与高糖诱导的细胞周期激酶抑制剂P27KIP1蛋白表达和活性增加有关。本研究则证实糖尿病状态下肾皮质另一种细胞周期激酶抑制剂P21CIP1蛋白表达明显增加,而对照组肾皮质几乎没有表达,尽管单侧肾切除亦可导致对侧肾脏肥大,但糖尿病状态下肾脏肥大要比单纯肾脏切除肾脏肥大复杂得多,可能P21CIP1蛋白不是介导单纯的肾脏切除肾脏肥大的主要因素之一。由于P21CIP1蛋白能与G1期不同的Cyclin/CDK复合物结合并抑制它们的表达或活性。因此,糖尿病早期肾脏肥大至少部分与肾皮质P21CIP1蛋白表达增加有关。
, 百拇医药
我们给予苯那普利治疗一周后即明显抑制糖尿病状态下肾脏肥大,其机制除了它能改善血流动力学紊乱外,我们以前的研究已表明,它能抑制糖尿病状态下肾皮质TGFβ1表达,现在进一步研究证实它尚能抑制肾皮质P21CIP1蛋白表达,由于DN早期病理上主要是肾组织固有细胞肥大,增生的成分极少,而本研究提示随着糖尿病肾皮质P21CIP1蛋白表达下降,肾脏肥大亦明显缓解,说明苯那普利对肾脏肥大的抑制至少部分与肾皮质P21CIP1蛋白表达下降有关,这与Morrissey等[7]在梗阻性肾病模型中观察的结果相类似。其机制可能与它抑制糖尿病状态下肾组织局部过度活跃RAS有关,因为本研究提示糖尿病状态下血浆ACE活性有所下降,但肾皮质ACE活性却有所增加,这与糖尿病状态下早期高血容量状态很不相适应,说明糖尿病状态下肾组织局部RAS相对过度活跃。由于众多研究表明大鼠肾组织RAS活性物质AngⅡ主要来源于经典途径即ACE途径,因此,随着糖尿病肾皮质ACE活性增加,肾皮质内AngⅡ水平必定有所增加,尽管我们没有直接检测肾皮质AngⅡ水平。现在认为AngⅡ是促进DN进展的一种极其重要的血管活性物质,它一方面能与高糖协同诱导肾组织TGFβ1表达,TGFβ1在肾组织不仅能促进细胞外基质积聚,而且能诱导肾组织P21CIP1蛋白和P15蛋白表达促进肾组织肥大[8];另一方面体外研究表明,AngⅡ能直接诱导P21CIP1蛋白基因表达,因为P21CIP1蛋白基因起动子部位含有AngⅡ转录位点[9]。因此,以上可以说明AngⅡ的作用至少部分直接或间接由P21CIP1蛋白介导。我们给予苯那普利一周后发现它不仅能抑制血浆ACE活性,对肾皮质ACE活性也有明显的抑制作用,几乎达70%,从而亦能明显降低肾皮质AngⅡ水平及作用。另外,最近研究尚表明AngⅡ可通过非TGFβ1依赖性—P27KIP1蛋白途径诱导肾小管细胞肥大[10],目前已报道糖尿病状态下肾组织P27KIP1蛋白表达明显增加,但苯那普利对其调节情况仍未清楚。因而,苯那普利对糖尿病早期肾脏肥大的抑制机制可能是多途径的,其确切的机制尚有待于进一步研究。
, 百拇医药
*美国中华医学基金会(NO.39470335)及国家自然科学基金(NO.39670349)课题
参考文献
1 Shankland SJ.Cell-cycle control and renal disease.Kidney Int,1997;52:294
2 Unger T,Scholl B,Rascher W et al.Selective activation of the converting enzyme inhibition MK 421 and comparison of its active diacid form with captopril in different tissues of the rat.Biochem Pharmacol,1982;31:3063
3 Anderson S,Rennke HG,Brenner BM et al.Nifedipine versus fosinopril in uninephrectomized diabetic rats.kidney Int,1992;41:891
, 百拇医药
4 Schoecklmann HO,Rupprecht HD,Zauner I et al.TGF-β1-induced cell cycle arrest in renal mesangial cells involves inhibition of cyclin E-cdk2 activation and retinoblastoma protein phosphorylation.kidney Int,1997;51:1228
5 Shankland SJ,Hamel PA,Scholey JW. Cyclin and cyclin dependent kinase expression in the glomeruli of normal,diabetic and renal-ablatedrats.(abstract) J Am Soc Nephrol,1994;5:701
6 Wolf G,Schroeder R,Thaiss F et al.Glomerular expression of P27KIP1 in diabetic db/db mouse:Role of hyperglycmia.Kidney Int,1998;53:869
, http://www.100md.com
7 Morrissey JJ,Ishidoya S,Mccracken R et al.The effect of ACE inhibitors on the expression of matrix genes and the role p53 and p21(WAF1)in experimentaln renal fibrosis.Kidney Int,1996;49(suppl 54):S83
8 Noble NA,Border WA.Angiotensin Ⅱ in renal fibrosis:should TGF-β rather than blood pressure be the therapeutic target.Semin Nephrol 1997;5:455
9 Terada Y,Yamada T,Nakshima O et al.Angiotensin Ⅱ induced P21CIP1 via JAK2-STAT1 pathway caused hypertrophy in proximal tubule cells(abstract) J Am socnephrol,1996;7:1661
10 Wolf G,Stahl RAK.Angiotensin Ⅱ-stimulated hypertrophy of LLC-PK1 cells depends on the induction of the cyclin-dependent kinase inhibitor P27KIP1.Kidney Int,1996;50:2112
收稿日期:1998-10-20,修回日期:1998-12-12, 百拇医药
单位:上海医科大学华山医院肾内科 上海,200040
关键词:血管紧张素转换酶抑制剂;糖尿病肾病;P21CIPI蛋白
肾脏病与透析肾移植杂志990107 摘 要 目的:探讨苯那普利对糖尿病大鼠肾组织细胞周期蛋白激酶抑制剂P21CIP1蛋白表达的影响。 方法:大鼠随机分单侧肾切除对照组(C组)、糖尿病组(D组)及糖尿病苯那普利治疗组(DB组)。1周后,应用免疫印迹(Western杂交)分析各组肾皮质P21CIPI蛋白表达。血浆、肾皮、髓质血管紧张素转换酶(ACE)活性由荧光分光光度法测得。 结果:单侧肾切除糖尿病大鼠1周体重即明显下降(P<0.05),肾重/体重即肾脏肥大指数却明显增加(P<0.05),血浆ACE活性有所下降而肾皮质ACE活性却有所上升。Western杂交分析表明对照组肾皮质几乎没有P21CIP1蛋白表达,然而,糖尿病肾皮质P21CIP1蛋白表达明显增加;苯那普利治疗1周对肾脏肥大有明显的抑制作用,对血浆、肾皮、髓质ACE活性抑制分别达89.0%、70.0%、70.5%,对肾皮质P21CIPI蛋白表达抑制达60.0%。结论:苯那普利对糖尿病肾脏肥大的抑制作用至少部分与P21CIPI蛋白表达降低有关,其确切机制尚有待于进一步研究。
, http://www.100md.com
EFFECT OF BENAZEPRIL ON EXPRESSION OF CYCLIN KINASE INHIBITOR P21CIP1 PROTEIN IN RENAL TISSUE OF DIABETIC RATS
Wu Yonggui,Yu Yi,Lin Shanyan
Division of Nephrology,Hua Shan Hospital,Shanghai Medical University,Shanghai,200040
OBJECTIVE To investigate the effect of benazepril on expression of cyclin kinase inhibitor P21CIP1 protein in renal tissue of diabetic rats.
, 百拇医药
METHODOLOGY Uninephrectomized rats were randomly divided into three groups.Untreated uninephrectomized rats were set as the blank control group(Group C,n=6).Diabetic rats induced by streptozotocin(STZ)were divided into diabetic group(Group D,n=7)and benazepril treated diabetic group(Group DB,n=7)(10mg/kg*day-1by gavage).Angiotensin converting enzyme(ACE)activities were determined with fluorimetric assay in the plasma,renal cortex and medulla tissue.The expression of P21CIP1protein in renal cortex was determined with Western blot analysis.
, 百拇医药
RESULTS At the end of the first week of observation,loss of body weight,increase in renal hypertrophy index (kidney-weight/body-weight×100),decrease in plasma ACE activity and elevation of renal cortex ACE activity were observed in rats of Group D.The expression of P21CIP1 protein in renal cortex was hardly detected in rats of Group C,but was significantly enhanced in rats of Group D.Body weight loss and renal hypertrophy index increase were ameliorated in the rats of Group DB.As compared to Group D,ACE activities(in plasma,renal cortex and medulla)were decreased (by 89%,70%,and 70.5%respectively)and expression of P21CIP1protein in renal cortex was reduced (by 60%) in rats of Group DB.
, 百拇医药
CONCLUSION Benazepril′s suppression of early diabetic kidney hypertrophy might be associated,at least in part,with a decrease in the expression of P21CIP1protein in renal cortex.
Key words angiotesin converting enzyme inhibitor diabetic nephropathy P21CIP1 protein
近年来研究表明,高糖与局部肾素-血管紧张素系统(RAS)是糖尿病肾病(Diabetic nephropathy,DN)发生、发展的两大主要因素。其中,RAS依赖其活性物质血管紧张素Ⅱ(AngⅡ)不仅引起血流动力学紊乱,更重要的是与高糖协同诱导肾脏肥大。目前,研究证实AngⅡ诱导肾脏肥大涉及到细胞周期的变化,后者受一系列细胞周期调节蛋白(Cell-cycle regulatory protein,CRP)调控。CRP既包括正性调节蛋白如细胞周期蛋白(Cyclin)和cyclin依赖性激酶(Cyclin depentent kinase,CDK)又包括负性调节蛋白如Cyclin激酶抑制剂(Cyclin kinase inhibotor,CKI)[1]。P21CIP1蛋白是一种重要的CKI,研究表明AngⅡ的作用部分由P21CIP1蛋白介导。因而,甚有必要了解阻断RAS是否能下调P21CIP1蛋白表达。为此,我们选用一种血管紧张素转换酶抑制剂(Angiotensin converting enzyme inhibitor,ACEI)苯那普利从这个角度进行初步探讨。
, 百拇医药
1 材料和方法
1.1 糖尿病模型建立及动物分组 所有大鼠均接受右侧肾切除术,2周后腹腔注射单剂量链脲佐菌素(STZ)60 mg/kg(溶解在10 mmol/L枸椽酸缓冲液中,pH5.5),对照组仅注射等量枸椽酸缓冲液,48~72h后尾静脉采血用血糖仪[one TouchⅡ型,强生(中国)有限公司]测定全血血糖,血糖≥16.7 mmol/L,同时尿糖在3+~4+以上者确定为糖尿病模型。动物分三组:①对照组(C组,n=6);②糖尿病组(D组,n=7);③糖尿病+苯那普利治疗组(DB组,n=7)。苯那普利(北京-汽巴嘉基药品有限公司提供)10 mg/kg每日灌胃,C与D组仅给予等量生理盐水灌胃。观察1周后收集标本。
1.2 标本收集 1周末在大鼠空腹16h后于尾静脉采血待测血糖及血胰岛素水平。然后在3%水合氯醛麻醉下行右侧颈总动脉插管收集血标本,取血浆保存于-70℃冰箱中待测ACE活性,同时收集血清待测血肌酐(Scr)水平;在腹主动脉插管注入4℃预冷的生理盐水反复灌洗肾脏后,称重、分离皮、髓质,保存于-70℃冰箱中待测肾组织ACE活性及提取总蛋白。
, 百拇医药
1.3 一般指标测定 平均动脉压(MAP)由右侧颈总动脉插管接血压监测仪测得;血糖、SCr水平由日立7150型全自动生化分析仪检测;血胰岛素水平采用放射免疫法检测。
1.4 血浆及肾皮、髓质ACE活性测定 参考Unger等[2]方法略加改进,由日立F-4000荧光分光光度计检测(Ex 360nm、EW 486 nm)。所需底物马尿酰-组氨酰-亮氨酸(Hippury-L-histidyl-L-leucine,Hip-his-leu)、荧光激发物邻苯二醛(O-phthadialdehyde)及标准品组氨酰-亮氨酸(His-leu,HL)均购自Sigma公司。酶活性单位为nmol HL/(min.ml)(血浆)或nmol HL/(min.mg)(组织)。
1.5 免疫印迹(Western杂交)分析 肾皮质组织总蛋白提取在细胞裂解液(PBS,1% NP40,0.5% sodium deoxycholate,0.1% SDS,100mg/L aprotinin,100mg/L PMSF,100μmol/L sodium orthovanadate)中进行。肾皮质组织总蛋白含量采用改良lowry法。取总蛋白50μg,加等量样本处理液,100℃煮沸4min,15%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳后转移至硝酸纤维素膜上,在丽春红染液中染色观察蛋白转移情况并标出蛋白质分子量标准。然后用含5%脱脂牛奶的TBST封闭,4℃过液,洗膜后加兔抗P21CIP1多克隆抗体(工作浓度1∶100,Santa Cruz公司)进行杂交,再度洗膜后加辣根过氧化酶(HRP)标记的山羊抗兔IgG(工作浓度1∶100,华美生物工程公司)进行二抗杂交,洗膜后加入免疫印迹化学发光试剂(华美生物工程公司),最后进行放射自显影,所有杂交信号在IBAS-2000图像分析系统进行光密度(A值)扫描。
, http://www.100md.com
1.6 统计学处理 数据以均数±标准差(
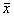 ±s)表示,组间差异性比较采用方差分析和q检验。
±s)表示,组间差异性比较采用方差分析和q检验。2 结 果
2.1 各组血糖、血胰岛素及血肌酐水平的变化 与对照组相比,糖尿病大鼠血糖明显增加伴血胰岛素水平明显下降(P<0.01),提示糖尿病模型建立成功。苯那普利治疗一周对血糖、血胰岛素及血肌酐水平无明显影响。(表1)
表1 各组血糖、血胰岛素及血肌酐水平的变化(
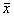 ±s) 组别
±s) 组别鼠数
血糖(mmol/L)
, http://www.100md.com 血胰岛素(mU/L)
血肌酐(μmol/L)
C组
6
5.24±0.52
31.83±9.08
50.13±5.7
D组
7
31.02±2.44*
10.10±2.51*
55.77±2.2
, 百拇医药
DB组
7
27.96±3.76
14.09±2.42
59.84±5.2
与C组相比*P<0.01
2.2 各组MAP、体重及肾重/体重的变化 糖尿病大鼠MAP有所升高,但与对照组相比无明显统计学意义,苯那普利对MAP无明显降低作用;尽管糖尿病大鼠体重明显下降(P<0.01),但肾脏肥大指数(肾重/体重)有所增加,与对照组相比有统计学意义(P<0.05)。苯那普利治疗后对糖尿病大鼠体重下降有一定的延缓作用,并能抑制肾重/体重的增加(P<0.05)。(表2)
表2 各组MAP、体重及肾重/体重的变化(
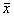 ±s) 组别
±s) 组别, http://www.100md.com
鼠数
MAP(kPa)
体重(g)
肾重/体重×1000
C组
6
10.70±0.33
230.5±22.7
4.32±0.25
D组
7
11.33±0.58
, 百拇医药 180.7±25.6
5.52±0.37△
DB组
7
10.53±0.87
207.6±23.9#
4.71±0.28#
与C组相比*P<0.01,△P<0.05;与D组相比#P<0.05
2.3 各组血浆及肾皮、髓质ACE活性变化 与对照组相比,糖尿病大鼠血浆ACE活性有明显下降趋势;然而,肾皮质、髓质ACE活性却有所增加,苯那普利对血浆、肾皮、髓质ACE活性均有明显抑制作用,分别达到89.0%、70.0%和70.5%。(表3)
, 百拇医药
表3 各组血浆及肾皮、髓质ACE活性变化(
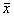 ±s) 组别
±s) 组别鼠数
血浆
肾皮质
肾髓质
C组
6
230.0±32.5
1.79±0.12
9.15±0.84
D组
, 百拇医药
7
210.0±28.3
1.87±0.13
10.01±0.64
DB组
7
23.10±4.5*
0.56±0.10*
2.95±0.52*
ACE活性单位为nmol HL/(min.ml)(血浆)或nmol HL/(min.mg)(组织)。与C组相比*P<0.05。
, 百拇医药
2.4 Western杂交分析 组织标本经15%SDS-PAGE后转移至硝酸纤维素膜上,用抗P21CIP1蛋白一抗和相关二抗杂交后经化学发光放射自显影证实在P21CIP1蛋白相应分子量位置上可出现阳性杂交信号。其中,对照组肾皮质几乎无P21CIP1蛋白表达,糖尿病组表达则明显增加,苯那普利治疗后对此有明显的抑制作用,几乎达60.0%。
3 讨 论
本研究采用单侧肾切除后两周腹腔注射单剂量STZ制成胰岛素依赖性糖尿病模型,一周后大鼠体重明显下降,但肾脏肥大指数即肾重/体重却明显增加,说明本模型已出现DN早期肾脏肥大,与文献报道一致[3]。肾脏肥大是DN早期特征性病理表现之一,是晚期肾脏硬化的前驱。因此,目前众多学者研究兴趣多集中于探讨DN早期肾脏肥大的机制及如何延缓或逆转DN早期肾脏肥大。现在研究认为,DN早期肾脏肥大是以遗传为背景、以高血糖为启动因素所诱导的各种血管活性物质、生长因子、细胞介质、化学趋化因子、反应氧代谢产物等综合作用的结果,进一步研究则表明,这些损伤介质最终是通过调控细胞周期来诱导细胞肥大[4]。
, 百拇医药
由于G1期是细胞周期起始和限速阶段,因此,有关G1期CRP研究较多,G1期Cyclin包括Cyclin D和Cyclin E,CDK包括CDK2,4,6,其中Cyclin D和CDK4,6主要分布于G1期早期,而Cyclin E和CDK2则分布于G1期晚期。细胞周期从G1期过渡到S期必需要突破G1/S期之间检测点(Checkpoint),其关键是要使视网膜瘤蛋白(Retinoblastoma protein,pRb)磷酸化,释放转录因子E2F,解除DNA合成抑制,细胞得以进入增殖周期,否则G1期过度延长,细胞呈肥大状态[1]。在这过程中Cyclin与CDK结合复合物是使pRb磷酸化的关键。目前,有关糖尿病肾脏肥大过程中肾组织Cyclin与CDK表达的研究较少,Sankland等[5]报道,在STZ诱导的糖尿病模型中肾组织G1期Cyclin和CDK表达没有明显变化,其原因尚不清楚,最近Wolf等[6]研究则认为,糖尿病早期肾脏肥大与高糖诱导的细胞周期激酶抑制剂P27KIP1蛋白表达和活性增加有关。本研究则证实糖尿病状态下肾皮质另一种细胞周期激酶抑制剂P21CIP1蛋白表达明显增加,而对照组肾皮质几乎没有表达,尽管单侧肾切除亦可导致对侧肾脏肥大,但糖尿病状态下肾脏肥大要比单纯肾脏切除肾脏肥大复杂得多,可能P21CIP1蛋白不是介导单纯的肾脏切除肾脏肥大的主要因素之一。由于P21CIP1蛋白能与G1期不同的Cyclin/CDK复合物结合并抑制它们的表达或活性。因此,糖尿病早期肾脏肥大至少部分与肾皮质P21CIP1蛋白表达增加有关。
, 百拇医药
我们给予苯那普利治疗一周后即明显抑制糖尿病状态下肾脏肥大,其机制除了它能改善血流动力学紊乱外,我们以前的研究已表明,它能抑制糖尿病状态下肾皮质TGFβ1表达,现在进一步研究证实它尚能抑制肾皮质P21CIP1蛋白表达,由于DN早期病理上主要是肾组织固有细胞肥大,增生的成分极少,而本研究提示随着糖尿病肾皮质P21CIP1蛋白表达下降,肾脏肥大亦明显缓解,说明苯那普利对肾脏肥大的抑制至少部分与肾皮质P21CIP1蛋白表达下降有关,这与Morrissey等[7]在梗阻性肾病模型中观察的结果相类似。其机制可能与它抑制糖尿病状态下肾组织局部过度活跃RAS有关,因为本研究提示糖尿病状态下血浆ACE活性有所下降,但肾皮质ACE活性却有所增加,这与糖尿病状态下早期高血容量状态很不相适应,说明糖尿病状态下肾组织局部RAS相对过度活跃。由于众多研究表明大鼠肾组织RAS活性物质AngⅡ主要来源于经典途径即ACE途径,因此,随着糖尿病肾皮质ACE活性增加,肾皮质内AngⅡ水平必定有所增加,尽管我们没有直接检测肾皮质AngⅡ水平。现在认为AngⅡ是促进DN进展的一种极其重要的血管活性物质,它一方面能与高糖协同诱导肾组织TGFβ1表达,TGFβ1在肾组织不仅能促进细胞外基质积聚,而且能诱导肾组织P21CIP1蛋白和P15蛋白表达促进肾组织肥大[8];另一方面体外研究表明,AngⅡ能直接诱导P21CIP1蛋白基因表达,因为P21CIP1蛋白基因起动子部位含有AngⅡ转录位点[9]。因此,以上可以说明AngⅡ的作用至少部分直接或间接由P21CIP1蛋白介导。我们给予苯那普利一周后发现它不仅能抑制血浆ACE活性,对肾皮质ACE活性也有明显的抑制作用,几乎达70%,从而亦能明显降低肾皮质AngⅡ水平及作用。另外,最近研究尚表明AngⅡ可通过非TGFβ1依赖性—P27KIP1蛋白途径诱导肾小管细胞肥大[10],目前已报道糖尿病状态下肾组织P27KIP1蛋白表达明显增加,但苯那普利对其调节情况仍未清楚。因而,苯那普利对糖尿病早期肾脏肥大的抑制机制可能是多途径的,其确切的机制尚有待于进一步研究。
, 百拇医药
*美国中华医学基金会(NO.39470335)及国家自然科学基金(NO.39670349)课题
参考文献
1 Shankland SJ.Cell-cycle control and renal disease.Kidney Int,1997;52:294
2 Unger T,Scholl B,Rascher W et al.Selective activation of the converting enzyme inhibition MK 421 and comparison of its active diacid form with captopril in different tissues of the rat.Biochem Pharmacol,1982;31:3063
3 Anderson S,Rennke HG,Brenner BM et al.Nifedipine versus fosinopril in uninephrectomized diabetic rats.kidney Int,1992;41:891
, 百拇医药
4 Schoecklmann HO,Rupprecht HD,Zauner I et al.TGF-β1-induced cell cycle arrest in renal mesangial cells involves inhibition of cyclin E-cdk2 activation and retinoblastoma protein phosphorylation.kidney Int,1997;51:1228
5 Shankland SJ,Hamel PA,Scholey JW. Cyclin and cyclin dependent kinase expression in the glomeruli of normal,diabetic and renal-ablatedrats.(abstract) J Am Soc Nephrol,1994;5:701
6 Wolf G,Schroeder R,Thaiss F et al.Glomerular expression of P27KIP1 in diabetic db/db mouse:Role of hyperglycmia.Kidney Int,1998;53:869
, http://www.100md.com
7 Morrissey JJ,Ishidoya S,Mccracken R et al.The effect of ACE inhibitors on the expression of matrix genes and the role p53 and p21(WAF1)in experimentaln renal fibrosis.Kidney Int,1996;49(suppl 54):S83
8 Noble NA,Border WA.Angiotensin Ⅱ in renal fibrosis:should TGF-β rather than blood pressure be the therapeutic target.Semin Nephrol 1997;5:455
9 Terada Y,Yamada T,Nakshima O et al.Angiotensin Ⅱ induced P21CIP1 via JAK2-STAT1 pathway caused hypertrophy in proximal tubule cells(abstract) J Am socnephrol,1996;7:1661
10 Wolf G,Stahl RAK.Angiotensin Ⅱ-stimulated hypertrophy of LLC-PK1 cells depends on the induction of the cyclin-dependent kinase inhibitor P27KIP1.Kidney Int,1996;50:2112
收稿日期:1998-10-20,修回日期:1998-12-12, 百拇医药