TNF-a 与IFN-g 诱导人绒毛膜滋养层细胞凋亡
作者:孔令红 刘忠 高云飞 邢福祺
单位:孔令红(第一军医大学附属南方医院妇产科,广东 广州 510515);刘忠(第一军医大学附属南方医院妇产科,广东 广州 510515);高云飞(第一军医大学附属南方医院妇产科,广东 广州 510515);邢福祺(第一军医大学附属南方医院妇产科,广东 广州 510515)
关键词:凋亡;程序化细胞死亡;滋养层细胞;TNF-a ;IFN -g
第一军医大学学报000104 摘要: 目的 探讨TNF-a 与IFN-g 诱导妊娠早期人绒毛膜滋养层细胞凋亡的作用。方法 建立人妊娠早期滋养层细胞体外培养体系;利用台盼蓝染色记数、光镜、透射电镜、DNA琼脂糖凝胶电泳观察和检测TNF-a 与IFN-g 处理后的细胞凋亡情况。结果 TNF-a 与IFN-g 可引起活细胞数减少;透射电镜观察到染色体边集、核固缩、凋亡小体;DNA琼脂糖凝胶电泳有“梯形条带”。结论 TNF-a 能够诱导人妊娠早期绒毛滋养层细胞凋亡,IFN-g 对TNF-a 具有协同作用。
, http://www.100md.com
中图分类号:R336 文献标识码:A 文章编号:1000-2588(2000)01-0012-03
Apoptosis of cultured human trophoblasts induced by tumor necrosis factor-a and interferon-g
KONG Ling-hong, LIU Zhong, GAO Yun-fei, XING Fu-qi
(Department of Gynaecology and Obsteric, Nanfang Hospital, First Military Medical University, Guangzhou 510515, China)
Abstract: Objective To investigate the possible bioactivity of TNF-αand IFN-g in the induction of human trophoblast apoptosis in early pregnancy . Methods Human trophoblast culture system of early gestation was established. The cells were observed and analyzed under light microscope, electron microscope and by means of agarose gel electrophoresis after being cultured in serum-free medium with TNF-a and IFN-g . Results TNF-a and IFN-g decreased the number of viable cells. Transmission electron microscopic examination showed chromatin aggregating beneath the nuclear envelope, nuclear contraction and apoptotic bodies. Sarose gel electophoresis of fragmented DNA showed a ladder-like pattern. Conclusion TNF-a can induce human trophoblast sapoptosis during early pregnancy, with the cooperation of IFN-g .
, 百拇医药
Key words: trophoblasts; apoptosis; TNF-a ; IFN-g
凋亡是指细胞由基因控制发生的自主的有序性死亡。凋亡在女性生殖系统也普遍存在,并发挥着重要的作用,如卵泡的闭锁及黄体的退化。最近的研究发现,正常胎盘绒毛组织有重发生的滋养层细胞生理性凋亡[1],而在某些病理产科过程如早产的胎盘剥离区见到大量的滋养层细胞凋亡[2]。TNF-α与IFN-γ及其受体在正常妊娠就可表达于人绒毛组织[3,4]。已有文献报道[5]TNF-α与IFN-γ可诱导人妊娠晚期滋养层细胞凋亡。但有关TNF-α与IFN-γ诱导人妊娠早期滋养层细胞凋亡的研究,国内外尚未见报道。本实验试图建立人妊娠早期滋养层细胞体外培养体系;观察和检测经TNF-α与IFN-γ处理后滋养层细胞的凋亡情况。
1 材料与方法
, 百拇医药
1.1 材料
TNF-α购自军事医学科学院;INF-γ由第一军医大学分子免疫所馈赠;DMEM、F12培养基购自美国生物技术有限公司;胰酶、RNase、蛋白酶K购自美国Sigma公司;琼脂糖购自上海东海公司。
1.2 方法
1.2.1 滋养层细胞的培养与纯化 取妊娠6~10周、发育正常、吸宫流产孕妇的绒毛,用D-Hanks液冲洗3次后剪碎。0.25%胰酶37℃消化两次各10 min,200目筛网过滤,150 g离心5 min后弃上清。细胞用含10%(V/V)的DMEM/ F12(1:1)培养基稀释为5×108/L左右,在37℃、5% CO2 孵育箱培养1 h,用吸管把未附壁的滋养层细胞吸到另一瓶培养。24 h后换液。以后每3天传代一次。
1.2.2 活细胞记数 细胞以5×105/孔传到培养板内,8 h后经D-Hanks液冲洗,换无血清的基础培养基。设立空白对照、IFN-γ(106 U/L)、TNF-α、TNF-α与IFN-γ(106 U/L)联合作用组。TNF-α的浓度梯度为2.5×105、5.0×105、1.0×106、2.0×106及4.0×106 U/L。处理36 h后收集细胞,台盼蓝染色记数活细胞。重复5次,所得结果以均数±标准差(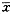 ±s)表示,多样本均数比较用方差分析。
±s)表示,多样本均数比较用方差分析。
, 百拇医药
1.2.3 光镜观察 细胞经IFN-γ与TNF-α联合处理36 h后,10%的中性缓冲甲醛固定,HE染色。
1.2.4 透射电镜观察 细胞经IFN-γ与TNF-α联合处理36 h后,胰酶消化、琼脂管离心、2%戊二醛固定、梯度丙酮脱水、环氧树脂渗透包埋、超薄切片及铀铅染色后,透射电镜观察。
1.2.5 DNA的琼脂糖凝胶电泳 细胞经TNF-α2.0×106 U/L、 IFN-γ1.0×106 U/L与TNF-α2.0×109 U/L处理48 h后收集细胞,常规提取DNA,1.5%琼脂糖凝胶电泳观察。
2 结果
2.1滋养层细胞的鉴定
绒毛滋养层细胞主要是与由间质分化来的成纤维细胞相鉴别。通过光镜观察细胞的大体形态、生长特性就可粗略鉴别:绒毛膜滋养层细胞形态为长多边形,而成纤维细胞为长梭形,纹理呈编织样生长。透射电镜下滋养层上皮细胞含有丰富的利于激素分泌的内质网、高尔基体和脂滴。
, http://www.100md.com
2.2 活细胞记数
在36时,单独的IFN-γ作用没有减少活细胞数;单独的TNF-α在2.0×106和4.0×106 U/L显著减少了活细胞数;而在与IFN-γ共同作用下,TNF-α5.0×105、1.0×106、2.0×106和4.0×109 U/L都显著减少了活细胞数(P<0.05)。
表1 TNF-α、TNF-α与IFN-γ联合作用对滋养层细胞生长的影响(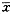 ±s)
±s)
Tab.1 Effect of TNF-αand TNF-αwith IFN-γon the growth of human trophoblast (M±SD) Concentration(U/L)
, http://www.100md.com
TNF-a
(1× 105μ/well)
TNF-a +IFN-g (1× 105μ/well)
Control
9.25±0.67
9.32±0.81
2.5×105
9.34±0.85
8.82±0.66
5.0×105
8.95±0.64
, 百拇医药
6.13±0.48 *
1.0×106
6.42±0.79 *
5.76±0.45 *
2.0×106
6.12±0.67 *
5.37±0.56 *
4.0×106
5.56±0.82 *
, http://www.100md.com
4.63±0.69 *
*P<0.05 vs the control group
2.3 光镜下凋亡细胞的形态学观察
光镜下正常的绒毛膜滋养层细胞体积大、胞浆及核染色浅;凋亡的滋养层细胞体积收缩变小、变圆,胞浆红染,核固缩呈蓝黑色,有核碎裂。凋亡细胞随TNF-α浓度的增高而增多,并出现凋亡细胞脱落遗留的空白区。
2.4 透射电镜下凋亡细胞的微观形态学观察2.4 透射电镜下凋亡细胞的微观形态学观察
正常的绒毛膜滋养层细胞电子密度低且均匀,有大量的脂滴分布;凋亡细胞电子密度加深,可见有细胞核固缩、染色质固缩凝集于核膜下、凋亡小体等。
, http://www.100md.com 2.5 DNA断裂片段的琼脂糖凝胶电泳
空白对照DNA双链完整,聚集于尾部;经TNF-α和IFN-γ联合处理的细胞DNA断裂成180 bp倍数的片段,呈“梯形条带”。单独TNF-α处理的凋亡细胞较少,其“梯形条带”不明显。
3 讨论
3.1 TNF-α在绒毛滋养层组织中的作用
TNF-α通常是由巨噬细胞和活化的T细胞产生的重要免疫调节因子,具有多种生物活性,比如抑制或杀伤肿瘤细胞。目前的研究发现TNF-α可诱导多种细胞凋亡。我们的研究结果也证实,高浓度TNF-α单独作用可引起妊妇早期人绒毛膜滋养层细胞凋亡。
有文献报道,TNF-α对DNA合成活跃的人绒毛膜癌滋养层细胞[6]及大鼠妊娠中期的滋养层细胞有杀伤作用[7,8],对小鼠处于静止期的滋养层细胞无任何效应[9]。但TNF-α能刺激大鼠的绒毛间质细胞增生[8]。推测TNF-α对胚泡分化来的细胞有多重作用,既抑制迅速增殖的滋养层细胞对母体子宫的过度侵蚀[10],又刺激间质细胞生长。在生理情况下绒毛细胞滋养层细胞分泌TNF-α,诱发绒毛轴心的间质细胞分泌GM-CSF和CSF-1,这些因子又调节滋养层细胞增殖、分化及凋亡。在感染及由母儿Rh血型不合、子癫前期引起的缺氧情况下,巨噬细胞可大量分泌IL-1、TNF-α;IL-1也能促进滋养层细胞分泌TNF-α[3]。胎盘内细胞自分泌及旁分泌的平衡被打乱,细胞凋亡、坏死增多,胎盘容易剥离导致流产或早产。
, 百拇医药
3.2 IFN-γ的协同作用机制3.2 IFN-γ的协同作用机制
我们的研究发现,109 U/L IFN-γ单独作用没有诱导绒毛膜滋养层细胞凋亡,但与TNF-α配伍应用可明显提高TNF-α诱导滋养层细胞凋亡的作用。目前的研究认为,IFN-γ的协同促凋亡作用与促进APO-1/FAS的表达有关。APO-1/FAS是一种跨膜蛋白,是程序化细胞死亡的重要信号传递系统。克隆的人APO-1/FAS抗原的cDNA与TNF-α受体的编码有高度同源性。免疫组化发现人绒毛膜滋养层细胞也有APO-1/FAS抗原表达[11]。这方面的机制有待进一步探讨。
总之,我们发现TNF-α能够诱导人妊娠早期绒毛膜滋养层细胞凋亡,IFN-γ对TNF-α有明显的协同作用。推测TNF-α及IFN-γ通过诱导滋养层细胞凋亡参与了生理状态下的绒毛组织改建及某些病理产科过程。
参考文献
, 百拇医药
[1]Szkaragi N, Ishikara H, Hareyama H. Apoptosis in human trophoblastic cells identified by in situ nick englabeling of fragmented DNA[J]. Acta Obstet Gunaecol JPN, 1994, 46(6):533~4.
[2]Kakinuma C, Kuwayama C, Kaga N. Trophoblastic apoptosis in mice with preterm delivery and its suppression by urinary trypsin inhibitor[J]. Obstet Gynecol, 1997, 90(1):117~24.
[3]Smith CA, Slayden D, Brenner M. A receptor for tumor necrosis factor defines an unusual family of cellular and viral proteins[J]. Science, 1990, 248:1019~23.
, 百拇医药
[4]Paulesu L, Fraser HM, Cowen GM. First trimester human trophoblasts expressing both interferon gamma and interferon gamma receptors[J]. J Reprod Immunol, 1994, 27:37~48.
[5]Yui J, Gaecia-lioret M, Wegmann TG. Cytotoxicity of tumor necrosis factor-a and interferon-g against primary human placental trophoblasts[J]. Placental, 1994, 15(8):819~35.
[6]Berkowitz RS, Simard J, Alan H. Effect of products of activated leukocytes (lymphokines and monokines) on the growth of malignant trophoblast cells in vitro[J]. Am J Obstet Gynecol, 1988, 158:199~203.
, http://www.100md.com
[7]Hunt JS, Soares mT, Lei MG. Products of activated macrophages (tumor necrosis factor-a , transforming growth factor-β) but not ipopoly-saccharide modify DNA synthesis by rat trophoblast cells exhibiting the 80 kDa lipopolysaccharide-binding protein[J]. J Immunol, 1989, 143: 1606~13.
[8]Hunt JS, Atherton RA, Pace JL. Differential responses of rat trophoblast cells and embryonic fibroblast cells to cytokines that regulate proliferation and class I MHC antigen expression[J]. J Immunol, 1990, 145:184~189.
, 百拇医药
[9]Drake BL, Jarry H, Parman M. Murine trophoblast cells are not killed by tumor necrosis factor-a [J]. J Reprod Immunol, 1990, 17:93~9.
[10]Hunt JS, Wuttke W, Pitzel L. Cytokine networks in the teroplacental unit: macrophages as pivotal regulatory cells[J]. J Reprod Immunol, 1989, 16:1~17.
[11]Bamberger AM, Schulte H, Thuneke I. Expression of the apoptosis-inducing Fas ligand (FASL) in human first and third trimester placenta and choriocarcinoma cells[J]. J Clin Endocrinol Metab, 1997, 82(9):3173~5.
1999-02-20, 百拇医药
单位:孔令红(第一军医大学附属南方医院妇产科,广东 广州 510515);刘忠(第一军医大学附属南方医院妇产科,广东 广州 510515);高云飞(第一军医大学附属南方医院妇产科,广东 广州 510515);邢福祺(第一军医大学附属南方医院妇产科,广东 广州 510515)
关键词:凋亡;程序化细胞死亡;滋养层细胞;TNF-a ;IFN -g
第一军医大学学报000104 摘要: 目的 探讨TNF-a 与IFN-g 诱导妊娠早期人绒毛膜滋养层细胞凋亡的作用。方法 建立人妊娠早期滋养层细胞体外培养体系;利用台盼蓝染色记数、光镜、透射电镜、DNA琼脂糖凝胶电泳观察和检测TNF-a 与IFN-g 处理后的细胞凋亡情况。结果 TNF-a 与IFN-g 可引起活细胞数减少;透射电镜观察到染色体边集、核固缩、凋亡小体;DNA琼脂糖凝胶电泳有“梯形条带”。结论 TNF-a 能够诱导人妊娠早期绒毛滋养层细胞凋亡,IFN-g 对TNF-a 具有协同作用。
, http://www.100md.com
中图分类号:R336 文献标识码:A 文章编号:1000-2588(2000)01-0012-03
Apoptosis of cultured human trophoblasts induced by tumor necrosis factor-a and interferon-g
KONG Ling-hong, LIU Zhong, GAO Yun-fei, XING Fu-qi
(Department of Gynaecology and Obsteric, Nanfang Hospital, First Military Medical University, Guangzhou 510515, China)
Abstract: Objective To investigate the possible bioactivity of TNF-αand IFN-g in the induction of human trophoblast apoptosis in early pregnancy . Methods Human trophoblast culture system of early gestation was established. The cells were observed and analyzed under light microscope, electron microscope and by means of agarose gel electrophoresis after being cultured in serum-free medium with TNF-a and IFN-g . Results TNF-a and IFN-g decreased the number of viable cells. Transmission electron microscopic examination showed chromatin aggregating beneath the nuclear envelope, nuclear contraction and apoptotic bodies. Sarose gel electophoresis of fragmented DNA showed a ladder-like pattern. Conclusion TNF-a can induce human trophoblast sapoptosis during early pregnancy, with the cooperation of IFN-g .
, 百拇医药
Key words: trophoblasts; apoptosis; TNF-a ; IFN-g
凋亡是指细胞由基因控制发生的自主的有序性死亡。凋亡在女性生殖系统也普遍存在,并发挥着重要的作用,如卵泡的闭锁及黄体的退化。最近的研究发现,正常胎盘绒毛组织有重发生的滋养层细胞生理性凋亡[1],而在某些病理产科过程如早产的胎盘剥离区见到大量的滋养层细胞凋亡[2]。TNF-α与IFN-γ及其受体在正常妊娠就可表达于人绒毛组织[3,4]。已有文献报道[5]TNF-α与IFN-γ可诱导人妊娠晚期滋养层细胞凋亡。但有关TNF-α与IFN-γ诱导人妊娠早期滋养层细胞凋亡的研究,国内外尚未见报道。本实验试图建立人妊娠早期滋养层细胞体外培养体系;观察和检测经TNF-α与IFN-γ处理后滋养层细胞的凋亡情况。
1 材料与方法
, 百拇医药
1.1 材料
TNF-α购自军事医学科学院;INF-γ由第一军医大学分子免疫所馈赠;DMEM、F12培养基购自美国生物技术有限公司;胰酶、RNase、蛋白酶K购自美国Sigma公司;琼脂糖购自上海东海公司。
1.2 方法
1.2.1 滋养层细胞的培养与纯化 取妊娠6~10周、发育正常、吸宫流产孕妇的绒毛,用D-Hanks液冲洗3次后剪碎。0.25%胰酶37℃消化两次各10 min,200目筛网过滤,150 g离心5 min后弃上清。细胞用含10%(V/V)的DMEM/ F12(1:1)培养基稀释为5×108/L左右,在37℃、5% CO2 孵育箱培养1 h,用吸管把未附壁的滋养层细胞吸到另一瓶培养。24 h后换液。以后每3天传代一次。
1.2.2 活细胞记数 细胞以5×105/孔传到培养板内,8 h后经D-Hanks液冲洗,换无血清的基础培养基。设立空白对照、IFN-γ(106 U/L)、TNF-α、TNF-α与IFN-γ(106 U/L)联合作用组。TNF-α的浓度梯度为2.5×105、5.0×105、1.0×106、2.0×106及4.0×106 U/L。处理36 h后收集细胞,台盼蓝染色记数活细胞。重复5次,所得结果以均数±标准差(
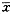 ±s)表示,多样本均数比较用方差分析。
±s)表示,多样本均数比较用方差分析。, 百拇医药
1.2.3 光镜观察 细胞经IFN-γ与TNF-α联合处理36 h后,10%的中性缓冲甲醛固定,HE染色。
1.2.4 透射电镜观察 细胞经IFN-γ与TNF-α联合处理36 h后,胰酶消化、琼脂管离心、2%戊二醛固定、梯度丙酮脱水、环氧树脂渗透包埋、超薄切片及铀铅染色后,透射电镜观察。
1.2.5 DNA的琼脂糖凝胶电泳 细胞经TNF-α2.0×106 U/L、 IFN-γ1.0×106 U/L与TNF-α2.0×109 U/L处理48 h后收集细胞,常规提取DNA,1.5%琼脂糖凝胶电泳观察。
2 结果
2.1滋养层细胞的鉴定
绒毛滋养层细胞主要是与由间质分化来的成纤维细胞相鉴别。通过光镜观察细胞的大体形态、生长特性就可粗略鉴别:绒毛膜滋养层细胞形态为长多边形,而成纤维细胞为长梭形,纹理呈编织样生长。透射电镜下滋养层上皮细胞含有丰富的利于激素分泌的内质网、高尔基体和脂滴。
, http://www.100md.com
2.2 活细胞记数
在36时,单独的IFN-γ作用没有减少活细胞数;单独的TNF-α在2.0×106和4.0×106 U/L显著减少了活细胞数;而在与IFN-γ共同作用下,TNF-α5.0×105、1.0×106、2.0×106和4.0×109 U/L都显著减少了活细胞数(P<0.05)。
表1 TNF-α、TNF-α与IFN-γ联合作用对滋养层细胞生长的影响(
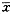 ±s)
±s)Tab.1 Effect of TNF-αand TNF-αwith IFN-γon the growth of human trophoblast (M±SD) Concentration(U/L)
, http://www.100md.com
TNF-a
(1× 105μ/well)
TNF-a +IFN-g (1× 105μ/well)
Control
9.25±0.67
9.32±0.81
2.5×105
9.34±0.85
8.82±0.66
5.0×105
8.95±0.64
, 百拇医药
6.13±0.48 *
1.0×106
6.42±0.79 *
5.76±0.45 *
2.0×106
6.12±0.67 *
5.37±0.56 *
4.0×106
5.56±0.82 *
, http://www.100md.com
4.63±0.69 *
*P<0.05 vs the control group
2.3 光镜下凋亡细胞的形态学观察
光镜下正常的绒毛膜滋养层细胞体积大、胞浆及核染色浅;凋亡的滋养层细胞体积收缩变小、变圆,胞浆红染,核固缩呈蓝黑色,有核碎裂。凋亡细胞随TNF-α浓度的增高而增多,并出现凋亡细胞脱落遗留的空白区。
2.4 透射电镜下凋亡细胞的微观形态学观察2.4 透射电镜下凋亡细胞的微观形态学观察
正常的绒毛膜滋养层细胞电子密度低且均匀,有大量的脂滴分布;凋亡细胞电子密度加深,可见有细胞核固缩、染色质固缩凝集于核膜下、凋亡小体等。
, http://www.100md.com 2.5 DNA断裂片段的琼脂糖凝胶电泳
空白对照DNA双链完整,聚集于尾部;经TNF-α和IFN-γ联合处理的细胞DNA断裂成180 bp倍数的片段,呈“梯形条带”。单独TNF-α处理的凋亡细胞较少,其“梯形条带”不明显。
3 讨论
3.1 TNF-α在绒毛滋养层组织中的作用
TNF-α通常是由巨噬细胞和活化的T细胞产生的重要免疫调节因子,具有多种生物活性,比如抑制或杀伤肿瘤细胞。目前的研究发现TNF-α可诱导多种细胞凋亡。我们的研究结果也证实,高浓度TNF-α单独作用可引起妊妇早期人绒毛膜滋养层细胞凋亡。
有文献报道,TNF-α对DNA合成活跃的人绒毛膜癌滋养层细胞[6]及大鼠妊娠中期的滋养层细胞有杀伤作用[7,8],对小鼠处于静止期的滋养层细胞无任何效应[9]。但TNF-α能刺激大鼠的绒毛间质细胞增生[8]。推测TNF-α对胚泡分化来的细胞有多重作用,既抑制迅速增殖的滋养层细胞对母体子宫的过度侵蚀[10],又刺激间质细胞生长。在生理情况下绒毛细胞滋养层细胞分泌TNF-α,诱发绒毛轴心的间质细胞分泌GM-CSF和CSF-1,这些因子又调节滋养层细胞增殖、分化及凋亡。在感染及由母儿Rh血型不合、子癫前期引起的缺氧情况下,巨噬细胞可大量分泌IL-1、TNF-α;IL-1也能促进滋养层细胞分泌TNF-α[3]。胎盘内细胞自分泌及旁分泌的平衡被打乱,细胞凋亡、坏死增多,胎盘容易剥离导致流产或早产。
, 百拇医药
3.2 IFN-γ的协同作用机制3.2 IFN-γ的协同作用机制
我们的研究发现,109 U/L IFN-γ单独作用没有诱导绒毛膜滋养层细胞凋亡,但与TNF-α配伍应用可明显提高TNF-α诱导滋养层细胞凋亡的作用。目前的研究认为,IFN-γ的协同促凋亡作用与促进APO-1/FAS的表达有关。APO-1/FAS是一种跨膜蛋白,是程序化细胞死亡的重要信号传递系统。克隆的人APO-1/FAS抗原的cDNA与TNF-α受体的编码有高度同源性。免疫组化发现人绒毛膜滋养层细胞也有APO-1/FAS抗原表达[11]。这方面的机制有待进一步探讨。
总之,我们发现TNF-α能够诱导人妊娠早期绒毛膜滋养层细胞凋亡,IFN-γ对TNF-α有明显的协同作用。推测TNF-α及IFN-γ通过诱导滋养层细胞凋亡参与了生理状态下的绒毛组织改建及某些病理产科过程。
参考文献
, 百拇医药
[1]Szkaragi N, Ishikara H, Hareyama H. Apoptosis in human trophoblastic cells identified by in situ nick englabeling of fragmented DNA[J]. Acta Obstet Gunaecol JPN, 1994, 46(6):533~4.
[2]Kakinuma C, Kuwayama C, Kaga N. Trophoblastic apoptosis in mice with preterm delivery and its suppression by urinary trypsin inhibitor[J]. Obstet Gynecol, 1997, 90(1):117~24.
[3]Smith CA, Slayden D, Brenner M. A receptor for tumor necrosis factor defines an unusual family of cellular and viral proteins[J]. Science, 1990, 248:1019~23.
, 百拇医药
[4]Paulesu L, Fraser HM, Cowen GM. First trimester human trophoblasts expressing both interferon gamma and interferon gamma receptors[J]. J Reprod Immunol, 1994, 27:37~48.
[5]Yui J, Gaecia-lioret M, Wegmann TG. Cytotoxicity of tumor necrosis factor-a and interferon-g against primary human placental trophoblasts[J]. Placental, 1994, 15(8):819~35.
[6]Berkowitz RS, Simard J, Alan H. Effect of products of activated leukocytes (lymphokines and monokines) on the growth of malignant trophoblast cells in vitro[J]. Am J Obstet Gynecol, 1988, 158:199~203.
, http://www.100md.com
[7]Hunt JS, Soares mT, Lei MG. Products of activated macrophages (tumor necrosis factor-a , transforming growth factor-β) but not ipopoly-saccharide modify DNA synthesis by rat trophoblast cells exhibiting the 80 kDa lipopolysaccharide-binding protein[J]. J Immunol, 1989, 143: 1606~13.
[8]Hunt JS, Atherton RA, Pace JL. Differential responses of rat trophoblast cells and embryonic fibroblast cells to cytokines that regulate proliferation and class I MHC antigen expression[J]. J Immunol, 1990, 145:184~189.
, 百拇医药
[9]Drake BL, Jarry H, Parman M. Murine trophoblast cells are not killed by tumor necrosis factor-a [J]. J Reprod Immunol, 1990, 17:93~9.
[10]Hunt JS, Wuttke W, Pitzel L. Cytokine networks in the teroplacental unit: macrophages as pivotal regulatory cells[J]. J Reprod Immunol, 1989, 16:1~17.
[11]Bamberger AM, Schulte H, Thuneke I. Expression of the apoptosis-inducing Fas ligand (FASL) in human first and third trimester placenta and choriocarcinoma cells[J]. J Clin Endocrinol Metab, 1997, 82(9):3173~5.
1999-02-20, 百拇医药