不同方案超排卵对金黄地鼠子宫内膜组织学和超微结构的影响
作者:黄荷凤 石一复 周馥贞 金帆 杨树标 何柏松
单位:310006 杭州,浙江大学附属妇产科医院(黄荷凤,石一复, 周馥贞,金帆);香港大学医学院妇产科系(杨树标,何柏松)
关键词:促性腺激素释放激素;子宫内膜;组织学;仓鼠;超排卵
中华妇产科杂志990612 【摘要】 目的 比较促性腺激素释放激素激动剂(GnRH-a)辅助超排卵和单纯促性腺激素(PMSG)超排卵对金黄地鼠子宫内膜的影响。方法 模仿人类长周期,对金黄地鼠进行GnRH-a 预处理后,用PMSG超排卵(10只,LA+PMSG组),并以10只单用PMSG超排卵(PMSG组)和10只自然周期金黄地鼠(对照组)为对照,对子宫内膜进行组织学和超微结构分析。 结果 组织学检查显示: LA+PMSG组子宫内膜成熟度与对照组相比,差异无显著性(P>0.05 ),而PMSG组子宫内膜明显发育延迟(P<0.01)。 超微结构分析显示:LA+PMSG组线粒体肿大,缺少线粒体脊,无网篮样结构;PMSG组线粒体明显减少。结论 GnRH-a辅助超排卵方案能促进生理性子宫内膜的形成,优于单独PMSG超排卵方案。但GnRH-a辅助超排卵仍存在对子宫内膜超微结构的不良影响。
, 百拇医药
Comparison of Endometrial Histology and Ultrastructure during
Different Ovarian Stimulation Protocols in Hamsters
HUANG Hefeng, SHI Yifu, ZHOU Fuzhen, et al. Obstetrics and Gynecology Hospital, Zhejiang University, Hangzhou 310006
【Abstract】 Objective To evaluate the influence of ovarian stimulation by pregnant mare's serum gonadotropin(PMSG) with or without gonadotropin releasing hormone agonist (GnRH-a) on endometrial histology and ultrastructure in hamsters. Methods Thirty hamsters were randomly allocated into 3 groups. (1) LA+PMSG group: Leuprolide acetate (LA) was given first for desensitizing the pituitary, then PMSG added for ovarian stimulation. (2) PMSG group was injected with PMSG only. (3) Control group was given with saline of same volume as groups LA+PMSG and PMSG on the same time schedule. Endometrial histology and ultrastructure were investigated by light microscope and electron microscope. Results Comparing to the controls, the changes of endometrial histology in group of LA+PMSG was not significantly different, but its ultrastructure had marked atterations: mitochondria swelling, undifferentiated crista and no basket-like structure. Delayed endometrial maturation was frequently found in group PMSG (P<0.01), and the ultrastructure showed poorly developed mitochondria. Conclusion The degree of endometrial maturation varied considerably with different ovarian stimulation protocols. Ovarian stimulation with GnRH-a was better than PMSG alone, because the protocol LA+PMSG, in hamsters, facilitated the formation of a physiologic endometrium. But the protocol with GnRH-a still had a negative effect on endometrial ultrastructure.
, 百拇医药
【Key words】 Gonadorelin Endometrium Histology Hamsters Superovulation
有研究表明,促性腺激素释放激素激动剂(GnRH-a)辅助超排卵能提高体外受精-胚胎移植(IVF-ET)的成功率[1]。Testart等[2]认为,该超排卵方案主要是促进了胚胎和子宫内膜的同步发育,尤其是改善了子宫内膜的接受性,但至今缺少实验依据。本实验以金黄地鼠为超排卵动物模型,模仿人类长周期GnRH-a给药方案,并以单纯促性腺激素超排卵方案和自然周期为对照,比较分析不同超排卵方案对子宫内膜组织学和超微结构方面的影响。
材料和方法
一、实验动物
雌性健康未孕金黄地鼠(上海生物制品所提供)30只,鼠龄8~12周,体重80~100g。自由饮食取水,维持光控时间为14∶10(光亮时间为1~15时,黑暗时间为15~24时)。每日上午9:00时行阴道分泌物和阴道涂片检查,确定其动情周期。阴道分泌物增加及阴道涂片中有大量卵圆形上皮,即为排卵日。连续2个动情周期均正常。随机分为3组,为PMSG、LA+PMSG和对照组,每组10只。
, 百拇医药
二、方法
1.超排卵程序:(1) LA+PMSG组:自动情周期第3天开始,每日腹腔注射GnRH-a[美国TAP药厂产品,商品名Louprolide Acetate(LA)] 40 μg/100g体重,第9天9时同时注射促性腺激素(PMSG,美国Intervet公司产品)40 IU/100g体重,第10天下午1时注射hCG(加拿大Ayerst实验室提供)100 IU/100g体重。(2) PMSG组:连续注射生理水9天,第9天9时同时注射PMSG 40 IU/100g体重,第10天下午1时注射hCG 100 IU/100g体重。(3) 对照组:每日注射等体积生理盐水,连续10天。
2.透射电镜和光镜下子宫内膜分析:LA+PMSG与PMSG组注射hCG 48小时、对照组排卵后(阴道涂片出现排卵征象)48小时,乙醚麻醉金黄地鼠,剖腹迅速取出子宫,刮下子宫内膜,分别用 25%戊二醛和10%甲醛溶液固定。戊二醛固定标本,经缓冲液冲洗过夜,再用1%锇酸固定,系列乙醇脱水,超薄包埋,LKB.NOVA.MT-2型超薄切片机切片,醋酸双氧油和柠檬酸铅双染,JEM-2000EX透射电镜下观察。10%甲醛溶液固定标本行半薄切片,HE染色后,光镜下观察。
, 百拇医药
三、统计方法
采用χ2检验。
结果
一、金黄地鼠的动情周期
动情周期为4天,排卵后表现为细胞阴道分泌物增加,阴道涂片中有大量卵圆形上皮。连续注射LA 4天后,典型的周期性排卵涂片象消失。
二、超排卵后子宫内膜组织学改变
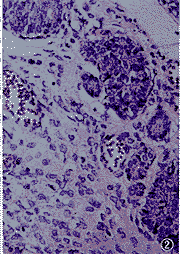
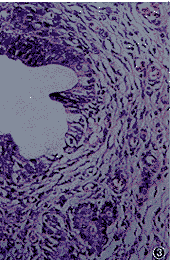
光镜下,发育成熟的子宫内膜较厚,间质疏松,血管丰富,腺体粗大 (图1)。发育不同步的子宫内膜表现为腺体狭小,上皮细胞有假复层现象,但部分间质细胞已发育为前蜕膜细胞(图2)。发育延迟的子宫内膜表现为子宫内膜薄,腺体发育差,腺腔狭小,间质致密,间质细胞核呈梭形,间质血管少(图3)。PMSG组子宫内膜发育明显延迟,其发生率高达60%,成熟的子宫内膜仅有20%,显著低于LA+PMSG组和对照组(P<0.01)。LA+PMSG组子宫内膜成熟有所改善,与对照组比较,差异无显著性(P>0.05)。但3组同时都有子宫内膜发育不同步现象,见表1。
, 百拇医药
图1 发育成熟的子宫内膜较厚,间质疏松,血管丰富,腺体粗大。HE×100
图2 发育不同步的子宫内膜表现为腺体狭小,上皮细胞有假复层现象,但部分间质细胞已发育为前蜕膜细胞。HE×100
图3发育延迟的子宫内膜薄,腺体发育差,腺腔狭小,间质致密,间质细胞核呈梭形,间质血管少。HE×100
表1 3组金黄地鼠子宫内膜成熟度比较 组别
总
只
数
成熟
发育延迟
发育不规则
, 百拇医药
只数
百分比
(%)
只数
百分比
(%)
只数
百分比
(%)
LA+PMSG组
10
6
60
, 百拇医药
3
30
1
10
PMSG组
10
2
20
6
60
2
20
对照组
10
, 百拇医药
8
80
2
20
0
0
三、超排卵后子宫内膜超微结构改变
对照组发育正常的子宫内膜腺细胞核呈不规则形状和卷折状,染色质呈块状,细胞浆内线粒体粗大,有明显的线粒体脊(图4),还有网篮样结构(图5)。 光镜下LA+PMSG组表现为成熟的子宫内膜,线粒体肿大,线粒体数目较多,缺少明显的线粒体脊,细胞核呈圆形(图6)。PMSG组的子宫内膜细胞核呈圆形,线粒体明显减少(图7)。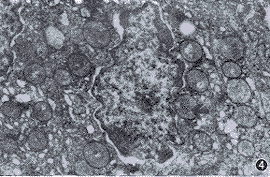



, 百拇医药
图4子宫内膜腺细胞核呈不规则形状和卷折状,染色质呈块状,细胞浆内线粒体粗大,有明显的线粒体嵴(↑).醋酸双氧油和柠檬酸铅双染。HE×7500
图5子宫内膜腺细胞呈不规则形状和卷折状,染色质呈块状,有网篮样结构(↑).醋酸双氧油和柠檬酸铅双染。HE×7500
图6成熟的子宫内膜线粒体肿大,线粒体数目较多,缺少明显的线粒体嵴,细胞核呈圆殂.醋酸双氧油和柠檬酸铅双染。HE×7500
图7子宫内膜细胞核呈圆形,线粒体明显减秒.醋酸双氧油和柠檬酸铅双染。HE×7500
讨论
一、GnRH-a对超排卵金黄地鼠子宫内膜的正面影响
IVF-ET实验显示,GnRH-a辅助超排卵长周期方案,能抑制体内自发性黄体生成素峰的形成,明显改进卵子和胚胎的质量[3]。我们以前的实验表明,GnRH-a辅助超排卵长周期方案,能促进子宫内膜蛋白分泌和合成的生理化[4]。子宫内膜成熟和胚胎发育同步,是建立妊娠的关键,子宫内膜在围着床期发育形态学的改变能直接反映胚胎着床的微环境[5]。本实验选用处于胚胎种植窗口期,排卵后2天或促排卵后2天的子宫内膜作形态学研究,是因为该期的子宫内膜处于着床期。结果表明,单用PMSG超排卵有60%的子宫内膜表现为发育延迟,超微结构改变也为亚细胞器结构和功能的异常。Can等[6]的实验发现,人类用绝经后促性腺激素(hMG)+hCG超排卵后,引起50%的子宫内膜在早分泌期呈光镜和电镜下的结构异常,多数表现为子宫内膜发育不良,与本实验结果相同。在人类原发不孕的患者中,也发现有近三分之一的分泌期子宫内膜呈发育延迟。可见,传统的单一促性腺激素超排卵后会使子宫内膜发育异常,使发育正常的胚胎不能如期种植。同时还发现,LA+PMSG组子宫内膜延迟发育比率明显低,而成熟度明显高于PMSG组,说明GnRH-a预处理金黄地鼠可明显改善子宫内膜的成熟度。表明,GnRH-a辅助超排卵优于PMSG超排卵。其机理可能是GnRH-a使内源性激素分泌相对正常,既提高了超排卵个体卵细胞的质量又改善了子宫内膜的成熟度。这可能是GnRH-a辅助促排卵提高IVF-ET成功又一重要因素。
, http://www.100md.com
二、GnRH-a对超排卵金黄地鼠子宫内膜的负面影响
虽然LA+PMSG组子宫内膜成熟度得到改善,但与对照组相比其成熟度仍存在一定的差异。另外,在LA+PMSG组,即使是光镜下正常的子宫内膜,与对照组相比在电镜下仍存在超微结构的不一致,表现为细胞核无卷折,线粒体肿大而无明显的脊,也无网篮样结构。而在人类,大的线粒体和核仁管系统(网篮样结构)是子宫内膜种植期的典型表现。有学者发现,GnRH-a+hMG超排卵后人子宫内膜核仁管系统消失,黄体期子宫内膜腺体间质发育不同步[7]。可见,GnRH-a辅助超排卵对子宫内膜仍存在负效应。
在辅助生育技术中既要获得多个优质卵细胞,而又不影响子宫内膜的生理发育成熟,这似乎是难以达到的和谐统一。子宫内膜组织结构的异常有时不能用常规的方法测出,却是低妊娠率最重要的原因之一。目前,各种超排卵方案都不能形成一个较理想的子宫内膜容受状态,进一步的研究工作将是寻找一个能使各细胞群之间的发育呈动态平衡,子宫内膜成熟更趋生理化的超排卵方法。
, 百拇医药
参考文献
1 Schmidt-saros C, Kaplan DR, Sarosi P, et al. Ovarian triggering in clomiphene citrate stimulated cycle: human chorionic gonadotropin releasing hormone agonist. J Assist Reprod Genet, 1995, 12: 167-174.
2 Testart J, Lefevre B, Gougeon A. Effects of gonadotropin-releasing hormone agonists (GnRH-a) on follicle and oocyte quality. Hum Reprod, 1993, 8:511-518.
3 Ben-Nun I, Shulman A. Induction of artificial endometrial cycles with S.C. estrogen implants and injectable progesterone in in-vitro fertilization treatment with donated oocytes: a preliminary report. Hum Reprod, 1997, 12:2267-2270.
, 百拇医药
4 黄荷凤,石一复,周馥贞,等. 醋酸亮丙瑞林辅助排卵对雌二醇和子宫内膜分泌功能的影响. 中华妇产科杂志, 1996,31:103-107.
5 Horne G, Critchlow JD, Newman MC. A perspective evaluation of cryopreservation strategies in a two-embryo transfer progromme. Hum Reprod, 1997, 12: 542-547.
6 Can A, Tekelioglu M, Biberoglu K. Structure of premenstrual endometrium in hMG+hCG induced anvulatory women. Eur J Obstet Gynecol, 1991, 50:119-129.
7 Bourgain C, Smitz J, Camus M, et al. Human endometrial maturation is markedly improved after luteal supplementation of gonadotropin-releasing hormone analogue/human menopausal gonadotropin stimulated cycles. Hum Reprod, 1994, 9:32-40.
收稿:1998-08-10
修回:1999-02-13, 百拇医药
单位:310006 杭州,浙江大学附属妇产科医院(黄荷凤,石一复, 周馥贞,金帆);香港大学医学院妇产科系(杨树标,何柏松)
关键词:促性腺激素释放激素;子宫内膜;组织学;仓鼠;超排卵
中华妇产科杂志990612 【摘要】 目的 比较促性腺激素释放激素激动剂(GnRH-a)辅助超排卵和单纯促性腺激素(PMSG)超排卵对金黄地鼠子宫内膜的影响。方法 模仿人类长周期,对金黄地鼠进行GnRH-a 预处理后,用PMSG超排卵(10只,LA+PMSG组),并以10只单用PMSG超排卵(PMSG组)和10只自然周期金黄地鼠(对照组)为对照,对子宫内膜进行组织学和超微结构分析。 结果 组织学检查显示: LA+PMSG组子宫内膜成熟度与对照组相比,差异无显著性(P>0.05 ),而PMSG组子宫内膜明显发育延迟(P<0.01)。 超微结构分析显示:LA+PMSG组线粒体肿大,缺少线粒体脊,无网篮样结构;PMSG组线粒体明显减少。结论 GnRH-a辅助超排卵方案能促进生理性子宫内膜的形成,优于单独PMSG超排卵方案。但GnRH-a辅助超排卵仍存在对子宫内膜超微结构的不良影响。
, 百拇医药
Comparison of Endometrial Histology and Ultrastructure during
Different Ovarian Stimulation Protocols in Hamsters
HUANG Hefeng, SHI Yifu, ZHOU Fuzhen, et al. Obstetrics and Gynecology Hospital, Zhejiang University, Hangzhou 310006
【Abstract】 Objective To evaluate the influence of ovarian stimulation by pregnant mare's serum gonadotropin(PMSG) with or without gonadotropin releasing hormone agonist (GnRH-a) on endometrial histology and ultrastructure in hamsters. Methods Thirty hamsters were randomly allocated into 3 groups. (1) LA+PMSG group: Leuprolide acetate (LA) was given first for desensitizing the pituitary, then PMSG added for ovarian stimulation. (2) PMSG group was injected with PMSG only. (3) Control group was given with saline of same volume as groups LA+PMSG and PMSG on the same time schedule. Endometrial histology and ultrastructure were investigated by light microscope and electron microscope. Results Comparing to the controls, the changes of endometrial histology in group of LA+PMSG was not significantly different, but its ultrastructure had marked atterations: mitochondria swelling, undifferentiated crista and no basket-like structure. Delayed endometrial maturation was frequently found in group PMSG (P<0.01), and the ultrastructure showed poorly developed mitochondria. Conclusion The degree of endometrial maturation varied considerably with different ovarian stimulation protocols. Ovarian stimulation with GnRH-a was better than PMSG alone, because the protocol LA+PMSG, in hamsters, facilitated the formation of a physiologic endometrium. But the protocol with GnRH-a still had a negative effect on endometrial ultrastructure.
, 百拇医药
【Key words】 Gonadorelin Endometrium Histology Hamsters Superovulation
有研究表明,促性腺激素释放激素激动剂(GnRH-a)辅助超排卵能提高体外受精-胚胎移植(IVF-ET)的成功率[1]。Testart等[2]认为,该超排卵方案主要是促进了胚胎和子宫内膜的同步发育,尤其是改善了子宫内膜的接受性,但至今缺少实验依据。本实验以金黄地鼠为超排卵动物模型,模仿人类长周期GnRH-a给药方案,并以单纯促性腺激素超排卵方案和自然周期为对照,比较分析不同超排卵方案对子宫内膜组织学和超微结构方面的影响。
材料和方法
一、实验动物
雌性健康未孕金黄地鼠(上海生物制品所提供)30只,鼠龄8~12周,体重80~100g。自由饮食取水,维持光控时间为14∶10(光亮时间为1~15时,黑暗时间为15~24时)。每日上午9:00时行阴道分泌物和阴道涂片检查,确定其动情周期。阴道分泌物增加及阴道涂片中有大量卵圆形上皮,即为排卵日。连续2个动情周期均正常。随机分为3组,为PMSG、LA+PMSG和对照组,每组10只。
, 百拇医药
二、方法
1.超排卵程序:(1) LA+PMSG组:自动情周期第3天开始,每日腹腔注射GnRH-a[美国TAP药厂产品,商品名Louprolide Acetate(LA)] 40 μg/100g体重,第9天9时同时注射促性腺激素(PMSG,美国Intervet公司产品)40 IU/100g体重,第10天下午1时注射hCG(加拿大Ayerst实验室提供)100 IU/100g体重。(2) PMSG组:连续注射生理水9天,第9天9时同时注射PMSG 40 IU/100g体重,第10天下午1时注射hCG 100 IU/100g体重。(3) 对照组:每日注射等体积生理盐水,连续10天。
2.透射电镜和光镜下子宫内膜分析:LA+PMSG与PMSG组注射hCG 48小时、对照组排卵后(阴道涂片出现排卵征象)48小时,乙醚麻醉金黄地鼠,剖腹迅速取出子宫,刮下子宫内膜,分别用 25%戊二醛和10%甲醛溶液固定。戊二醛固定标本,经缓冲液冲洗过夜,再用1%锇酸固定,系列乙醇脱水,超薄包埋,LKB.NOVA.MT-2型超薄切片机切片,醋酸双氧油和柠檬酸铅双染,JEM-2000EX透射电镜下观察。10%甲醛溶液固定标本行半薄切片,HE染色后,光镜下观察。
, 百拇医药
三、统计方法
采用χ2检验。
结果
一、金黄地鼠的动情周期
动情周期为4天,排卵后表现为细胞阴道分泌物增加,阴道涂片中有大量卵圆形上皮。连续注射LA 4天后,典型的周期性排卵涂片象消失。
二、超排卵后子宫内膜组织学改变
光镜下,发育成熟的子宫内膜较厚,间质疏松,血管丰富,腺体粗大 (图1)。发育不同步的子宫内膜表现为腺体狭小,上皮细胞有假复层现象,但部分间质细胞已发育为前蜕膜细胞(图2)。发育延迟的子宫内膜表现为子宫内膜薄,腺体发育差,腺腔狭小,间质致密,间质细胞核呈梭形,间质血管少(图3)。PMSG组子宫内膜发育明显延迟,其发生率高达60%,成熟的子宫内膜仅有20%,显著低于LA+PMSG组和对照组(P<0.01)。LA+PMSG组子宫内膜成熟有所改善,与对照组比较,差异无显著性(P>0.05)。但3组同时都有子宫内膜发育不同步现象,见表1。



, 百拇医药
图1 发育成熟的子宫内膜较厚,间质疏松,血管丰富,腺体粗大。HE×100
图2 发育不同步的子宫内膜表现为腺体狭小,上皮细胞有假复层现象,但部分间质细胞已发育为前蜕膜细胞。HE×100
图3发育延迟的子宫内膜薄,腺体发育差,腺腔狭小,间质致密,间质细胞核呈梭形,间质血管少。HE×100
表1 3组金黄地鼠子宫内膜成熟度比较 组别
总
只
数
成熟
发育延迟
发育不规则
, 百拇医药
只数
百分比
(%)
只数
百分比
(%)
只数
百分比
(%)
LA+PMSG组
10
6
60
, 百拇医药
3
30
1
10
PMSG组
10
2
20
6
60
2
20
对照组
10
, 百拇医药
8
80
2
20
0
0
三、超排卵后子宫内膜超微结构改变
对照组发育正常的子宫内膜腺细胞核呈不规则形状和卷折状,染色质呈块状,细胞浆内线粒体粗大,有明显的线粒体脊(图4),还有网篮样结构(图5)。 光镜下LA+PMSG组表现为成熟的子宫内膜,线粒体肿大,线粒体数目较多,缺少明显的线粒体脊,细胞核呈圆形(图6)。PMSG组的子宫内膜细胞核呈圆形,线粒体明显减少(图7)。




, 百拇医药
图4子宫内膜腺细胞核呈不规则形状和卷折状,染色质呈块状,细胞浆内线粒体粗大,有明显的线粒体嵴(↑).醋酸双氧油和柠檬酸铅双染。HE×7500
图5子宫内膜腺细胞呈不规则形状和卷折状,染色质呈块状,有网篮样结构(↑).醋酸双氧油和柠檬酸铅双染。HE×7500
图6成熟的子宫内膜线粒体肿大,线粒体数目较多,缺少明显的线粒体嵴,细胞核呈圆殂.醋酸双氧油和柠檬酸铅双染。HE×7500
图7子宫内膜细胞核呈圆形,线粒体明显减秒.醋酸双氧油和柠檬酸铅双染。HE×7500
讨论
一、GnRH-a对超排卵金黄地鼠子宫内膜的正面影响
IVF-ET实验显示,GnRH-a辅助超排卵长周期方案,能抑制体内自发性黄体生成素峰的形成,明显改进卵子和胚胎的质量[3]。我们以前的实验表明,GnRH-a辅助超排卵长周期方案,能促进子宫内膜蛋白分泌和合成的生理化[4]。子宫内膜成熟和胚胎发育同步,是建立妊娠的关键,子宫内膜在围着床期发育形态学的改变能直接反映胚胎着床的微环境[5]。本实验选用处于胚胎种植窗口期,排卵后2天或促排卵后2天的子宫内膜作形态学研究,是因为该期的子宫内膜处于着床期。结果表明,单用PMSG超排卵有60%的子宫内膜表现为发育延迟,超微结构改变也为亚细胞器结构和功能的异常。Can等[6]的实验发现,人类用绝经后促性腺激素(hMG)+hCG超排卵后,引起50%的子宫内膜在早分泌期呈光镜和电镜下的结构异常,多数表现为子宫内膜发育不良,与本实验结果相同。在人类原发不孕的患者中,也发现有近三分之一的分泌期子宫内膜呈发育延迟。可见,传统的单一促性腺激素超排卵后会使子宫内膜发育异常,使发育正常的胚胎不能如期种植。同时还发现,LA+PMSG组子宫内膜延迟发育比率明显低,而成熟度明显高于PMSG组,说明GnRH-a预处理金黄地鼠可明显改善子宫内膜的成熟度。表明,GnRH-a辅助超排卵优于PMSG超排卵。其机理可能是GnRH-a使内源性激素分泌相对正常,既提高了超排卵个体卵细胞的质量又改善了子宫内膜的成熟度。这可能是GnRH-a辅助促排卵提高IVF-ET成功又一重要因素。
, http://www.100md.com
二、GnRH-a对超排卵金黄地鼠子宫内膜的负面影响
虽然LA+PMSG组子宫内膜成熟度得到改善,但与对照组相比其成熟度仍存在一定的差异。另外,在LA+PMSG组,即使是光镜下正常的子宫内膜,与对照组相比在电镜下仍存在超微结构的不一致,表现为细胞核无卷折,线粒体肿大而无明显的脊,也无网篮样结构。而在人类,大的线粒体和核仁管系统(网篮样结构)是子宫内膜种植期的典型表现。有学者发现,GnRH-a+hMG超排卵后人子宫内膜核仁管系统消失,黄体期子宫内膜腺体间质发育不同步[7]。可见,GnRH-a辅助超排卵对子宫内膜仍存在负效应。
在辅助生育技术中既要获得多个优质卵细胞,而又不影响子宫内膜的生理发育成熟,这似乎是难以达到的和谐统一。子宫内膜组织结构的异常有时不能用常规的方法测出,却是低妊娠率最重要的原因之一。目前,各种超排卵方案都不能形成一个较理想的子宫内膜容受状态,进一步的研究工作将是寻找一个能使各细胞群之间的发育呈动态平衡,子宫内膜成熟更趋生理化的超排卵方法。
, 百拇医药
参考文献
1 Schmidt-saros C, Kaplan DR, Sarosi P, et al. Ovarian triggering in clomiphene citrate stimulated cycle: human chorionic gonadotropin releasing hormone agonist. J Assist Reprod Genet, 1995, 12: 167-174.
2 Testart J, Lefevre B, Gougeon A. Effects of gonadotropin-releasing hormone agonists (GnRH-a) on follicle and oocyte quality. Hum Reprod, 1993, 8:511-518.
3 Ben-Nun I, Shulman A. Induction of artificial endometrial cycles with S.C. estrogen implants and injectable progesterone in in-vitro fertilization treatment with donated oocytes: a preliminary report. Hum Reprod, 1997, 12:2267-2270.
, 百拇医药
4 黄荷凤,石一复,周馥贞,等. 醋酸亮丙瑞林辅助排卵对雌二醇和子宫内膜分泌功能的影响. 中华妇产科杂志, 1996,31:103-107.
5 Horne G, Critchlow JD, Newman MC. A perspective evaluation of cryopreservation strategies in a two-embryo transfer progromme. Hum Reprod, 1997, 12: 542-547.
6 Can A, Tekelioglu M, Biberoglu K. Structure of premenstrual endometrium in hMG+hCG induced anvulatory women. Eur J Obstet Gynecol, 1991, 50:119-129.
7 Bourgain C, Smitz J, Camus M, et al. Human endometrial maturation is markedly improved after luteal supplementation of gonadotropin-releasing hormone analogue/human menopausal gonadotropin stimulated cycles. Hum Reprod, 1994, 9:32-40.
收稿:1998-08-10
修回:1999-02-13, 百拇医药