补阳还五汤对沙鼠脑缺血损伤细胞凋亡的影响及机理研究
作者:刘志龙 宋含平 邓常青 韩绍娟
单位:赖新生 余瑾(广州中医药大学针灸推拿学院,广州 510405);庄礼兴(广州中医药大学第一附属医院,广州 510405)
关键词:脑缺血/病理生理学;脑缺血/病理学;脑缺血/中药疗法;脑/超微结构;补阳还五汤/治疗应用
广州中医药大学学报000411摘要:目的:研究补阳还五汤对沙鼠脑缺血损伤后神经细胞凋亡的作用及可能的作用机理。方法:采用沙土鼠双侧颈总动脉夹闭脑缺血再灌注模型,于再灌后120h取大脑半球,在解剖显微镜下切取海马,电镜观察神经细胞凋亡的情况;同样模型,于缺血再灌注后48h取脑组织测定Na+、K+-ATP酶、Ca2+-ATP酶、Mg2+-ATP酶活性、乳酸含量、NO含量、一氧化氮合酶(NOS)活性、氨基酸含量等。结果:补阳还五汤可使发生海马CA1区神经细胞凋亡的例数明显减少;可防止缺血再灌注后脑组织Na+、K+-ATP酶和Ca2+-ATP酶活性的降低;增加NO含量,提高NOS活性;可使缺血再灌注48h后脑内谷氨酸(Glu)含量降低。结论:补阳还五汤可对抗沙鼠脑缺血再灌注损伤后的神经细胞凋亡,其作用机理与改善脑能量代谢、调节NO的合成、拮抗兴奋性氨基酸毒性等方面有关。
, 百拇医药
中图分类号:R285.5 文献标识码:A
文章编号:1007-3213(2000)04-0318-05
Effect of Buyang Huanwu Decoction on Neural Cell Apoptosis
After Cerebral Ischemia in Gerbils and Its Mechanism
LIU Zhilong, SONG Hanping,HAN Shaojuan
(Dept. of TCM, Zhuhai People's Hospital of Guangdong Province, Zhuhai 519000, China)
DENG Changqing
, 百拇医药
(The First Affiliated Hospital, Guangzhou University of TCM, Guangzhou 510405, China)
Abstract: To study the effect of Buyang Huanwu Decoction (BHD) on neural cell apoptosis after cerebral ischemia in gerbils and its mechanism, gerbil model with cerebral ischemia was established by clamping of bilateral carotid arteries and then reperfusion. Neural cell apoptosis of hippocampal gyrus slides was observed under electron microscope 120 hours after reperfusion. The activities of Na+-K+ ATPase, Ca2+ ATPase, Mg2+ ATPase and NOS, and the contents of lactic acid, NO and amino acid in cerebral tissues were detected 120 hours after reperfusion. The results showed that BHD can reduce the incidence of neural cell apoptosis of hippocampal gyrus, prevent the decrease of Na+-K+ ATPase and Ca2+ ATPase activities, increase NO content and NOS activity, and reduce cerebral glucose content. It is indicated that BHD can counteract neural cell apoptosis after cerebral ischemia in gerbils and its mechanism may be related to the improvement of cerebral energy metabolism, regulation of NO synthesis and antagonism of toxic effect of excitatory amino acid.
, 百拇医药
Key words: CEREBRAL ISCHEMIA/pathophysiology; CEREBRAL ISCHEMIA /pathology;CEREBRAL ISCHEMIA/TCD therapy; BRAIN/ultrastructure;BUYANG HUANWU DECOCTION/ther. use
近年来的研究表明,脑缺血引起的神经元死亡与“凋亡”密切相关,在缺血性脑损伤的发生过程中,既存在神经细胞坏死,但在再灌注数天后,海马CA1区神经元的迟发性死亡则表现为细胞凋亡[1]。提示脑缺血的神经细胞损伤不完全是坏死,而有的是凋亡。补阳还五汤是治疗缺血性脑血管疾病的有效方剂,其作用机理研究国内已有许多报道,但尚未见从细胞凋亡角度研究的报道。本研究观察了补阳还五汤对沙土鼠脑缺血再灌注损伤后海马CA1区细胞凋亡的影响。并对其可能的作用机理从能量代谢、一氧化氮、兴奋性氨基酸毒性等方面进行了探讨,现将结果报道如下。
, http://www.100md.com
1 材料与方法
1.1 试验药物 补阳还五汤由黄芪60g、当归9g、川芎6g、赤芍9g、桃仁9g、红花9g、地龙9g组成。各药按以上比例由湖南中医学院药学分院制成注射剂,生药含量为2g/mL,用时以生理盐水稀释成0.2g/mL。
1.2 动物 体重为60~80g的蒙古沙土鼠,雌雄各半,清洁级,由卫生部上海生物制品研究所实验动物中心提供。
1.3 实验方法
1.3.1 细胞凋亡实验 沙鼠随机分为假手术对照组(假手术组)、模型对照组(模型组)、补阳还五汤组,每组6只沙鼠,雌雄各半。参照文献[2]方法,在实验前12h,补阳还五汤组腹腔注射(ip)补阳还五汤注射剂稀释液2g/kg(10 mL/kg),假手术组和模型组ip生理盐水10 mL/kg。次日于缺血前15min再同前ip药物1次。第二次给药15min后,ip盐酸氯氨酮60mg/kg(1.2mL/kg)麻醉,分离两侧颈总动脉。除假手术组外,其余2组以无创性小动脉夹夹闭双侧颈总动脉造成脑缺血。缺血15min后松开动脉夹行再灌流。假手术组不结扎双侧颈总动脉,其他操作与以上各组相同。缝合皮肤,继续饲养。再分别于再灌流后12、24、36、48、60、72、84、96、108h同前注药,共计注药11次(每天2次)。在再灌注后120h(第5天),再以盐酸氯氨酮麻醉,打开胸腔,于右心房心耳部剪一小口,从左心室插入导管至主动脉,向主动脉方向缓慢灌注预热的生理盐水(37℃)。直至右心房流出液变清亮;然后再灌注内固定液(0.2 mol/L pH7.4 PBS50mL,10%多聚甲醛20mL,25%戊二醛溶液10mL,加蒸馏水混合至100mL)约50mL进行内固定。然后立即取出大脑,正中剖开,置2.5%戊二醛溶液(0.2 mol/L pH7.4 PBS50mL,25%戊二醛10mL,加水至100mL)中固定待测。
, 百拇医药
1.3.2 机理探讨 实验动物分组同上。实验前12h补阳还五汤组ip补阳还五汤4g/kg(生药量),假手术组和模型组ip等量生理盐水。实验前15min再同前ip药物1次。于给药后15min,ip盐酸氯氨酮60mg/kg(1.2mL/kg)麻醉,分离两侧颈总动脉。除假手术组外,其余各组均以小动脉夹夹闭双侧颈总动脉造成脑缺血,缺血20min后松开动脉夹行再灌流。假手术组不夹闭双侧颈总动脉,其他操作与以上方法相同。缝合手术切口,继续饲养。再分别于再灌注后12、24、36h同前ip药物1次。于再灌注后48h将沙鼠颈椎脱臼致死,迅速取脑置冰台上,在冰台上迅速分离双侧前脑皮质,以冰生理盐水冲洗除去残余后称重,加冰生理盐水在冰溶下制成10%脑匀浆液,3500r/min于4℃离心15min,分离上清液供测试用。
1.4 观察指标与方法
1.4.1 海马CA1区细胞凋亡 取大脑半球,在解剖显微镜下定位海马,切取海马,取海马CA1区以3%戊二醛磷酸缓冲液(0.1 mol/LpH7.4 )再固定2h,1%锇酸后固定1h;梯度丙酮脱水,Epon-812环氧树脂包埋,在定位海马CA1区后,用LKBⅢ型(瑞典)超薄切片机切片,切片厚度为60nm。经醋酸双氧铀—柠檬酸铅电子染色后,以日立H-600型透射电镜观察神经细胞凋亡情况。凡观察到CA1区有暗细胞(系凋亡前细胞)、凋亡细胞和凋亡小体者,均属CA1区神经元发生凋亡。
, 百拇医药
1.4.2 能量代谢指标 脑匀浆钠、钾—三磷酸腺苷酶(Na+、K+-ATP酶)、钙—三磷酸腺苷酶(Ca2+-ATP酶)、镁—三磷酸腺苷酶(Mg2+-ATP酶)活性以定磷法测定。
1.4.3 NO和NOS活性 脑匀浆液一氧化氮(NO)含量按重氮反应法测定;一氧化氮合酶(NOS)活性以分光光度计法测定。
1.4.4 氨基酸含量 取冷藏备用的脑组织匀浆液,测试前标本复溶,再10 000r/min(4℃)离心10min,取上清液,按文献[3]方法,以高效液相色谱仪按内标法进行测定,进样量为100μL。
1.5 统计分析 计数资料以χ2检验;计量资料以 ±s表示,方差齐者以方差分析和q检验分析,方差不齐者以秩和检验分析。
±s表示,方差齐者以方差分析和q检验分析,方差不齐者以秩和检验分析。
, 百拇医药
2 结果
2.1 对神经细胞凋亡的影响 假手术组未发现凋亡细胞(见图1-a);模型组6例中有5例可以见到凋亡细胞或凋亡小体(见图1-b);补阳还五汤组6例均未见到凋亡细胞,神经元超微结构基本正常,仅可见到胶质细胞及神经元周围轻度水肿(见图1-c)。经χ2检验分析表明,模型组CA1区出现神经元凋亡的例数明显升高(χ2=15.11,χ2 0.01,3=11.345,P<0.01)。而补阳还五汤组CA1区出现神经元凋亡的例数明显低于模型组(P<0.01)。
2.2 对脑组织NO含量和NOS活性的影响 见表1。模型组脑组织NO含量明显低于假手术组;补阳还五汤组NO含量也低于假手术组,但显著高于模型组(P<0.01)。模型组NOS活性显著低于假手术组;补阳还五汤组NOS活性明显升高,与假手术组之间差异无显著性(P>0.05)。
, 百拇医药
表1 各组NO和NOS的比较# ( ±s) 组 别
±s) 组 别
N/只
bNO/(μmol.g-1)
bNOS/(μmol.g-1)
假手术组
8
2.60±2.02
16.71±2.21
, 百拇医药 模型组
8
0.79±0.40△△
11.61±1.64△△
补阳还五汤组
8
1.33±0.77△△
15.47±1.95
#:计算每g蛋白中物质的量
2.3 对能量代谢的影响 见表2。沙鼠脑缺血再灌注48h后,模型组脑组织Na+、K+-ATP酶活性较假手术组明显降低,补阳还五汤组该酶活性也明显低于假手术组,但明显高于模型组(P<0.05);模型组Ca2+-ATP酶活性较假手术组明显降低,补阳还五汤组该酶活性虽高于模型组,但差异无显著性(P>0.05)。
, 百拇医药
2.4 对脑组织氨基酸含量的影响 见表3。
模型组脑组织谷氨酸(Glu)含量高于假手表2 各组能量代谢指标比较#( ±s) 组 别
±s) 组 别
N/只
JNa+、K+-ATP酶/(nmol.s-1)
JCa2+-ATP酶/(nmol.s-1)
JMg2+-ATP酶/(nmol.s-1)
, http://www.100md.com
假手术组
8
0.97±0.13
0.81±0.10
0.82±0.06
模型组
8
0.20±0.16△△
0.26±0.25△△
0.24±0.24△△
补阳还五汤组
, http://www.100md.com 8
0.52±0.23△△*
0.35±0.11△△
0.31±0.08△△
*与模型组比P<0.05, P<0.01(下同);△与假手术组比P<0.05,△△P<0.01(下同);#均计算每s酶触反应将每mg蛋白转化有机磷的量表3 各组脑组织氨基酸含量比较# ( ±s) 组 别
±s) 组 别
N/只
bGlu/(μmol.g-1)
, 百拇医药
bAsp/(μmol.kg-1)
bGABA/(μmol.g-1)
bGly/(μmol.g-1)
假手术组
8
6.70±0.92
7.02±0.32
0.89±0.34
0.93±0.17
, 百拇医药
模型组
6
8.70±0.49△
1.41±0.31△
1.03±0.21
0.91±0.15
补阳还五汤组
6
7.62±1.55*
1.00±0.26
1.08±0.21
, 百拇医药
0.93±0.36
#:计算每g脑组织中物质的量
a.(×6000)假手术组:示海马CA1区神经元形态正常;b.模型组(×5000):示CA1区神经元和细胞核固缩变小,核染色质密集,核膜皱缩不平,胞质内细胞器密集,线粒体和粗面内质网均轻度肿胀,相邻可见暗细胞(凋亡细胞)、胶质细胞和毛细血管周围水肿空泡化;c.补阳还五汤组:示海马CA1区神经元形态基本正常,毛细血管周围胶质泡可见水肿术组(P<0.05),补阳还五汤组Glu含量低于模型组(P<0.05),但与假手术组相比差异无显著性(P>0.05)。模型组脑组织天冬氨酸(Asp)含量较假手术组明显降低(P<0.05),补阳还五汤组Asp含量较模型组降低,但差异无显著性(P>0.05)。脑组织γ-氨基丁酸(GABA)含量与甘氨酸(Gly)含量各组相比差异均无显著性(P>0.05)。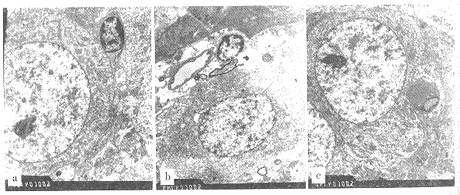
, 百拇医药
图1 各组沙鼠海马CA1区 电镜观察结果
3 讨论
细胞凋亡(apoptosis)又称细胞程序性死亡,是一种不同于细胞坏死的死亡方式,它是指细胞象秋天的树叶凋谢一样,在一定的生理或病理条件下,遵循自身的程序,自己结束其生命的过程,最后细胞脱落离体或裂解为若干凋亡小体(apoptotic bodies),而被其他细胞吞噬。在形态学上,细胞凋亡表现为神经细胞核染色质断裂、聚集;进而固缩,核膜崩解,细胞浆凝聚、固缩并空泡化,被细胞膜包裹形成凋亡小体而被巨噬细胞或小胶质细胞吞噬,没有炎症发生。细胞凋亡过程有其复杂的分子机制,受细胞自身基因调控。在脑卒中的病理过程中,存在细胞凋亡这一病理机制。沙鼠脑缺血再灌注后,海马CA1区出现迟发性神经细胞死亡,这种迟发性神经损伤与海马区神经元凋亡有关[4]。目前已有大量研究都证实缺血性脑损伤的神经元死亡与细胞凋亡关系密切,提示脑缺血的神经细胞损伤不只是坏死,而且与凋亡密切相关,特别是脑缺血后的迟发性神经元死亡,细胞凋亡为其主要的死亡方式[1]。本研究发现,模型组动物大多数海马CA1区神经元在电镜下可见到凋亡的发生,补阳还五汤可使海马CA1区神经元发生凋亡的例数减少,提示补阳还五汤可能具有对抗脑缺血再灌注后CA1区神经细胞凋亡的作用。由于本研究是采用电镜观察海马CA1区神经元,可能受观察范围和观察方法的局限,因此,本研究结果还有待于其他方法证实。至于凋亡发生的确切机制目前尚不清楚,有研究表明,体外小剂量的H2O2、NO及谷胱苷肽合成抑制剂均能诱导多种细胞发生凋亡,细胞内Ca2+浓度增加也可促进凋亡的发生[5],提示氧自由基和Ca2+在凋亡发生过程中起重要作用。补阳还五汤可对抗脑缺血后的氧自由基毒性,防止细胞内Ca2+超负荷,调节脑内花生烯代谢[6,7],由此推测补阳还五汤抗脑缺血后海马CA1区神经细胞凋亡与上述作用有关。为了深入阐明其具体作用机理,本文还进行了进一步的研究,推测其作用可能还与以下环节有关。
, 百拇医药
3.1 改善能量代谢 脑缺血后最早受影响的是能量代谢。脑内ATP的贮存是有限的,一旦血流供应中止,5~7min后ATP贮库耗竭,脑组织神经细胞不能进行主动过程(转运、合成等)[8]。补阳还五汤可防止缺血再灌注48h后脑组织Na+、K+-ATP酶的活性降低,对脑缺血损伤后脑组织的能量代谢有一定的改善作用。
3.2 提高NO的合成 脑组织存在丰富的NOS,可产生NO。研究表明,固有型NOS(cNOS)在基础条件下起作用,产生的NO对脑循环起重要的调节作用;而诱导型NOS(iNOS)在基础条件下不起作用,在缺血时表达并产生高浓度的NO,从而加速能量消耗,损伤DNA,导致神经细胞死亡。研究发现,iNOS的活化在原代神经细胞培养中引起的神经细胞死亡是以凋亡为特征的[9]。在大鼠局灶性脑缺血模型,脑缺血早期(阻断大脑中动脉后5~10min)NO持续增加,至30min达峰值,之后逐渐降至正常,再灌注数分钟到40min又轻度增加,之后又恢复至正常水平[10,11]。给予NOS抑制剂L-NANE或L-NNA等可明显减少大鼠局灶性脑缺血区血流量[12]。但也有研究表明,L-NANE等可使局部脑梗塞体积缩小,NOS抑制剂对脑缺血起保护作用[13]。可见,NO既具有潜在的有益作用,又有毒性作用。NO浓度升高主要发生在缺血早期,此时对神经细胞有毒性作用,而在再灌注后期,NO对脑血流等具有有益的调节作用。补阳还五汤可对抗再灌注后期NO含量和NOS活性的降低,提示该方可能通过提高NO的合成,而发挥抗缺血性损伤后细胞凋亡的作用。
, http://www.100md.com
3.3 对抗EAA的毒性 兴奋性氨基酸(excitatory aminoacid,EAA)主要指谷氨酸(Glu)和天冬氨酸(Asp)。EAA是中枢神经系统中兴奋性神经突触的主要神经递质,同时又是一种神经毒素。脑缺血缺氧时,大量EAA尤其是Glu的爆发性释放,EAA受体过度激活,使一些受体在正常生理刺激下引起的第二信使的效应得到扩大,突触后神经元过度兴奋、溃变、坏死,这就是所谓的“兴奋毒性”。脑缺血时,缺血神经元大量释放的EAA尤其是Glu对神经元的损伤起关键作用。由于EAA使神经元持续去极化,增强了神经元内的Glu等大量释放。又因脑缺血后ATP降解,依赖能量而重吸收Glu的机制衰竭,影响Glu摄取功能,甚至出现Glu向细胞外液转移,如此恶性循环,突触间隙持续高浓度的Glu就引起兴奋性神经毒性[14,15]。因此,拮抗EAA的兴奋毒性,包括抑制其过度释放,促进其再摄取,以及对抗其受体激活,对缺血性脑损伤具有良好的防治作用。本研究发现,补阳还五汤可使脑缺血再灌注后脑组织Glu含量降低,提示对抗EAA的兴奋毒性,可能也是补阳还五汤抗缺血性脑损伤细胞凋亡的作用机制之一。
, http://www.100md.com
脑内还存在抑制性氨基酸(inhibitoryaminoacid,IAA),主要指γ-氨基丁酸(GABA)和甘氨酸(Gly),为中枢神经系统内的抑制性递质,可抑制神经元兴奋,减少由于EAA造成的神经细胞损伤。本研究中补阳还五汤对IAA没有明显的作用。
基金项目:广东省中医药管理局资助项目(编号:98453)
作者简介:刘志龙(1963-),男,副主任医师;
参考文献:
[1] 吕晓红,许丽艳,李恩民,等.一氧化氮在迟发性神经元坏死中与程序性细胞死亡关系的研究[J].中风与神经疾病杂志,1997,2:68
[2] 严翠芬,李麟仙,王子灿,等.沙土鼠短暂性脑缺血后海马迟发性神经元死亡机理的研究[J].中国病理生理杂志,1991,7(6):605
, 百拇医药
[3] Chen B M, Xia L W ,Zhao R Q. Determination of NG, NG-dimethylarginine in human plasma by high-performance liquid chromatography[J]. Journal of Chromatography B,1997,692:467
[4] Nitatori T, Sato N, Waguri S, et al. Delayed neuronal death in the CA1 pyramidal cell layer of the gerbil hippocampus following transient ischemia is apoptosis[J]. J Neurochir, 1995,15:1001
[5] 吴俊芳,王洁,苏丹,等.神经生长因子对大鼠脑皮质神经细胞凋亡的影响[J].中国药理学通报,1999,15(1):80
, http://www.100md.com
[6] 邓常青,刘志龙,葛金文,等.补阳还五汤抗脑缺血再灌注损伤作用机理的研究[J].中国中医基础医学杂志,1998,4(8):32
[7] 刘志龙,邓常青,葛金文,等.补阳还五汤对兔脑缺血再灌注损伤 TXA2/PGI2、环核苷酸及钙的影响[J].中药药理与临床,1996,12(4):5
[8] Erecinska M, Silver I A.ATP and brain function[J].J Cereb Blood Flow Metab,1989,9:2
[9] Samdani A F, Dawson T M, Dawson V L. Nitric oxide synthase in models of focal ischemia[J].Stroke,1997,28(6):1283
, 百拇医药
[10] Malinski T, Bailey F,Zhang Z G,et al. Nitric oxide measured by a porphyrinic microsensor in rat brain after transient middle cerebral artery occlusion[J].J Cereb Blood Flow Metab, 1993, 13:355
[11] Sato S, Tominga T, Ohnishi T, et al. Role of nitric oxide in brain ischemia [J]. Ann NY Aca Sci,1994, 738:369
[12] Irikura K, Maynard K I, Moskowitz M A. Importance of nitric oxide synthase inhibition to the attenuated vascular responses induced by topical L-nitroarginine during vibrissal stimulation[J]. J Cereb Blood Flow Metab, 1994,14:45
, 百拇医药
[13] Nishikawa T, Kirsch J R, Koehler R C, et al. Effect of nitric oxide synthase inhibition on cerebral blood flow and injury volume during ischemia in cats[J].Stroke,1993,24:1717
[14] 胡国渊.脑血管意外和兴奋毒性[M].见:陈维洲,芮耀诚,主编.脑血管疾病基础与临床研究.济南:山东科技出版社,1993.12-25
[15] Hirose K, Chan P H. Blockade of glutamate excitoxicity and its clinical applications[J].Neurochem Res, 1993,18:479
收稿日期:2000-08-10, 百拇医药
单位:赖新生 余瑾(广州中医药大学针灸推拿学院,广州 510405);庄礼兴(广州中医药大学第一附属医院,广州 510405)
关键词:脑缺血/病理生理学;脑缺血/病理学;脑缺血/中药疗法;脑/超微结构;补阳还五汤/治疗应用
广州中医药大学学报000411摘要:目的:研究补阳还五汤对沙鼠脑缺血损伤后神经细胞凋亡的作用及可能的作用机理。方法:采用沙土鼠双侧颈总动脉夹闭脑缺血再灌注模型,于再灌后120h取大脑半球,在解剖显微镜下切取海马,电镜观察神经细胞凋亡的情况;同样模型,于缺血再灌注后48h取脑组织测定Na+、K+-ATP酶、Ca2+-ATP酶、Mg2+-ATP酶活性、乳酸含量、NO含量、一氧化氮合酶(NOS)活性、氨基酸含量等。结果:补阳还五汤可使发生海马CA1区神经细胞凋亡的例数明显减少;可防止缺血再灌注后脑组织Na+、K+-ATP酶和Ca2+-ATP酶活性的降低;增加NO含量,提高NOS活性;可使缺血再灌注48h后脑内谷氨酸(Glu)含量降低。结论:补阳还五汤可对抗沙鼠脑缺血再灌注损伤后的神经细胞凋亡,其作用机理与改善脑能量代谢、调节NO的合成、拮抗兴奋性氨基酸毒性等方面有关。
, 百拇医药
中图分类号:R285.5 文献标识码:A
文章编号:1007-3213(2000)04-0318-05
Effect of Buyang Huanwu Decoction on Neural Cell Apoptosis
After Cerebral Ischemia in Gerbils and Its Mechanism
LIU Zhilong, SONG Hanping,HAN Shaojuan
(Dept. of TCM, Zhuhai People's Hospital of Guangdong Province, Zhuhai 519000, China)
DENG Changqing
, 百拇医药
(The First Affiliated Hospital, Guangzhou University of TCM, Guangzhou 510405, China)
Abstract: To study the effect of Buyang Huanwu Decoction (BHD) on neural cell apoptosis after cerebral ischemia in gerbils and its mechanism, gerbil model with cerebral ischemia was established by clamping of bilateral carotid arteries and then reperfusion. Neural cell apoptosis of hippocampal gyrus slides was observed under electron microscope 120 hours after reperfusion. The activities of Na+-K+ ATPase, Ca2+ ATPase, Mg2+ ATPase and NOS, and the contents of lactic acid, NO and amino acid in cerebral tissues were detected 120 hours after reperfusion. The results showed that BHD can reduce the incidence of neural cell apoptosis of hippocampal gyrus, prevent the decrease of Na+-K+ ATPase and Ca2+ ATPase activities, increase NO content and NOS activity, and reduce cerebral glucose content. It is indicated that BHD can counteract neural cell apoptosis after cerebral ischemia in gerbils and its mechanism may be related to the improvement of cerebral energy metabolism, regulation of NO synthesis and antagonism of toxic effect of excitatory amino acid.
, 百拇医药
Key words: CEREBRAL ISCHEMIA/pathophysiology; CEREBRAL ISCHEMIA /pathology;CEREBRAL ISCHEMIA/TCD therapy; BRAIN/ultrastructure;BUYANG HUANWU DECOCTION/ther. use
近年来的研究表明,脑缺血引起的神经元死亡与“凋亡”密切相关,在缺血性脑损伤的发生过程中,既存在神经细胞坏死,但在再灌注数天后,海马CA1区神经元的迟发性死亡则表现为细胞凋亡[1]。提示脑缺血的神经细胞损伤不完全是坏死,而有的是凋亡。补阳还五汤是治疗缺血性脑血管疾病的有效方剂,其作用机理研究国内已有许多报道,但尚未见从细胞凋亡角度研究的报道。本研究观察了补阳还五汤对沙土鼠脑缺血再灌注损伤后海马CA1区细胞凋亡的影响。并对其可能的作用机理从能量代谢、一氧化氮、兴奋性氨基酸毒性等方面进行了探讨,现将结果报道如下。
, http://www.100md.com
1 材料与方法
1.1 试验药物 补阳还五汤由黄芪60g、当归9g、川芎6g、赤芍9g、桃仁9g、红花9g、地龙9g组成。各药按以上比例由湖南中医学院药学分院制成注射剂,生药含量为2g/mL,用时以生理盐水稀释成0.2g/mL。
1.2 动物 体重为60~80g的蒙古沙土鼠,雌雄各半,清洁级,由卫生部上海生物制品研究所实验动物中心提供。
1.3 实验方法
1.3.1 细胞凋亡实验 沙鼠随机分为假手术对照组(假手术组)、模型对照组(模型组)、补阳还五汤组,每组6只沙鼠,雌雄各半。参照文献[2]方法,在实验前12h,补阳还五汤组腹腔注射(ip)补阳还五汤注射剂稀释液2g/kg(10 mL/kg),假手术组和模型组ip生理盐水10 mL/kg。次日于缺血前15min再同前ip药物1次。第二次给药15min后,ip盐酸氯氨酮60mg/kg(1.2mL/kg)麻醉,分离两侧颈总动脉。除假手术组外,其余2组以无创性小动脉夹夹闭双侧颈总动脉造成脑缺血。缺血15min后松开动脉夹行再灌流。假手术组不结扎双侧颈总动脉,其他操作与以上各组相同。缝合皮肤,继续饲养。再分别于再灌流后12、24、36、48、60、72、84、96、108h同前注药,共计注药11次(每天2次)。在再灌注后120h(第5天),再以盐酸氯氨酮麻醉,打开胸腔,于右心房心耳部剪一小口,从左心室插入导管至主动脉,向主动脉方向缓慢灌注预热的生理盐水(37℃)。直至右心房流出液变清亮;然后再灌注内固定液(0.2 mol/L pH7.4 PBS50mL,10%多聚甲醛20mL,25%戊二醛溶液10mL,加蒸馏水混合至100mL)约50mL进行内固定。然后立即取出大脑,正中剖开,置2.5%戊二醛溶液(0.2 mol/L pH7.4 PBS50mL,25%戊二醛10mL,加水至100mL)中固定待测。
, 百拇医药
1.3.2 机理探讨 实验动物分组同上。实验前12h补阳还五汤组ip补阳还五汤4g/kg(生药量),假手术组和模型组ip等量生理盐水。实验前15min再同前ip药物1次。于给药后15min,ip盐酸氯氨酮60mg/kg(1.2mL/kg)麻醉,分离两侧颈总动脉。除假手术组外,其余各组均以小动脉夹夹闭双侧颈总动脉造成脑缺血,缺血20min后松开动脉夹行再灌流。假手术组不夹闭双侧颈总动脉,其他操作与以上方法相同。缝合手术切口,继续饲养。再分别于再灌注后12、24、36h同前ip药物1次。于再灌注后48h将沙鼠颈椎脱臼致死,迅速取脑置冰台上,在冰台上迅速分离双侧前脑皮质,以冰生理盐水冲洗除去残余后称重,加冰生理盐水在冰溶下制成10%脑匀浆液,3500r/min于4℃离心15min,分离上清液供测试用。
1.4 观察指标与方法
1.4.1 海马CA1区细胞凋亡 取大脑半球,在解剖显微镜下定位海马,切取海马,取海马CA1区以3%戊二醛磷酸缓冲液(0.1 mol/LpH7.4 )再固定2h,1%锇酸后固定1h;梯度丙酮脱水,Epon-812环氧树脂包埋,在定位海马CA1区后,用LKBⅢ型(瑞典)超薄切片机切片,切片厚度为60nm。经醋酸双氧铀—柠檬酸铅电子染色后,以日立H-600型透射电镜观察神经细胞凋亡情况。凡观察到CA1区有暗细胞(系凋亡前细胞)、凋亡细胞和凋亡小体者,均属CA1区神经元发生凋亡。
, 百拇医药
1.4.2 能量代谢指标 脑匀浆钠、钾—三磷酸腺苷酶(Na+、K+-ATP酶)、钙—三磷酸腺苷酶(Ca2+-ATP酶)、镁—三磷酸腺苷酶(Mg2+-ATP酶)活性以定磷法测定。
1.4.3 NO和NOS活性 脑匀浆液一氧化氮(NO)含量按重氮反应法测定;一氧化氮合酶(NOS)活性以分光光度计法测定。
1.4.4 氨基酸含量 取冷藏备用的脑组织匀浆液,测试前标本复溶,再10 000r/min(4℃)离心10min,取上清液,按文献[3]方法,以高效液相色谱仪按内标法进行测定,进样量为100μL。
1.5 统计分析 计数资料以χ2检验;计量资料以
 ±s表示,方差齐者以方差分析和q检验分析,方差不齐者以秩和检验分析。
±s表示,方差齐者以方差分析和q检验分析,方差不齐者以秩和检验分析。, 百拇医药
2 结果
2.1 对神经细胞凋亡的影响 假手术组未发现凋亡细胞(见图1-a);模型组6例中有5例可以见到凋亡细胞或凋亡小体(见图1-b);补阳还五汤组6例均未见到凋亡细胞,神经元超微结构基本正常,仅可见到胶质细胞及神经元周围轻度水肿(见图1-c)。经χ2检验分析表明,模型组CA1区出现神经元凋亡的例数明显升高(χ2=15.11,χ2 0.01,3=11.345,P<0.01)。而补阳还五汤组CA1区出现神经元凋亡的例数明显低于模型组(P<0.01)。
2.2 对脑组织NO含量和NOS活性的影响 见表1。模型组脑组织NO含量明显低于假手术组;补阳还五汤组NO含量也低于假手术组,但显著高于模型组(P<0.01)。模型组NOS活性显著低于假手术组;补阳还五汤组NOS活性明显升高,与假手术组之间差异无显著性(P>0.05)。
, 百拇医药
表1 各组NO和NOS的比较# (
 ±s) 组 别
±s) 组 别N/只
bNO/(μmol.g-1)
bNOS/(μmol.g-1)
假手术组
8
2.60±2.02
16.71±2.21
, 百拇医药 模型组
8
0.79±0.40△△
11.61±1.64△△
补阳还五汤组
8
1.33±0.77△△
15.47±1.95
#:计算每g蛋白中物质的量
2.3 对能量代谢的影响 见表2。沙鼠脑缺血再灌注48h后,模型组脑组织Na+、K+-ATP酶活性较假手术组明显降低,补阳还五汤组该酶活性也明显低于假手术组,但明显高于模型组(P<0.05);模型组Ca2+-ATP酶活性较假手术组明显降低,补阳还五汤组该酶活性虽高于模型组,但差异无显著性(P>0.05)。
, 百拇医药
2.4 对脑组织氨基酸含量的影响 见表3。
模型组脑组织谷氨酸(Glu)含量高于假手表2 各组能量代谢指标比较#(
 ±s) 组 别
±s) 组 别N/只
JNa+、K+-ATP酶/(nmol.s-1)
JCa2+-ATP酶/(nmol.s-1)
JMg2+-ATP酶/(nmol.s-1)
, http://www.100md.com
假手术组
8
0.97±0.13
0.81±0.10
0.82±0.06
模型组
8
0.20±0.16△△
0.26±0.25△△
0.24±0.24△△
补阳还五汤组
, http://www.100md.com 8
0.52±0.23△△*
0.35±0.11△△
0.31±0.08△△
*与模型组比P<0.05, P<0.01(下同);△与假手术组比P<0.05,△△P<0.01(下同);#均计算每s酶触反应将每mg蛋白转化有机磷的量表3 各组脑组织氨基酸含量比较# (
 ±s) 组 别
±s) 组 别N/只
bGlu/(μmol.g-1)
, 百拇医药
bAsp/(μmol.kg-1)
bGABA/(μmol.g-1)
bGly/(μmol.g-1)
假手术组
8
6.70±0.92
7.02±0.32
0.89±0.34
0.93±0.17
, 百拇医药
模型组
6
8.70±0.49△
1.41±0.31△
1.03±0.21
0.91±0.15
补阳还五汤组
6
7.62±1.55*
1.00±0.26
1.08±0.21
, 百拇医药
0.93±0.36
#:计算每g脑组织中物质的量
a.(×6000)假手术组:示海马CA1区神经元形态正常;b.模型组(×5000):示CA1区神经元和细胞核固缩变小,核染色质密集,核膜皱缩不平,胞质内细胞器密集,线粒体和粗面内质网均轻度肿胀,相邻可见暗细胞(凋亡细胞)、胶质细胞和毛细血管周围水肿空泡化;c.补阳还五汤组:示海马CA1区神经元形态基本正常,毛细血管周围胶质泡可见水肿术组(P<0.05),补阳还五汤组Glu含量低于模型组(P<0.05),但与假手术组相比差异无显著性(P>0.05)。模型组脑组织天冬氨酸(Asp)含量较假手术组明显降低(P<0.05),补阳还五汤组Asp含量较模型组降低,但差异无显著性(P>0.05)。脑组织γ-氨基丁酸(GABA)含量与甘氨酸(Gly)含量各组相比差异均无显著性(P>0.05)。

, 百拇医药
图1 各组沙鼠海马CA1区 电镜观察结果
3 讨论
细胞凋亡(apoptosis)又称细胞程序性死亡,是一种不同于细胞坏死的死亡方式,它是指细胞象秋天的树叶凋谢一样,在一定的生理或病理条件下,遵循自身的程序,自己结束其生命的过程,最后细胞脱落离体或裂解为若干凋亡小体(apoptotic bodies),而被其他细胞吞噬。在形态学上,细胞凋亡表现为神经细胞核染色质断裂、聚集;进而固缩,核膜崩解,细胞浆凝聚、固缩并空泡化,被细胞膜包裹形成凋亡小体而被巨噬细胞或小胶质细胞吞噬,没有炎症发生。细胞凋亡过程有其复杂的分子机制,受细胞自身基因调控。在脑卒中的病理过程中,存在细胞凋亡这一病理机制。沙鼠脑缺血再灌注后,海马CA1区出现迟发性神经细胞死亡,这种迟发性神经损伤与海马区神经元凋亡有关[4]。目前已有大量研究都证实缺血性脑损伤的神经元死亡与细胞凋亡关系密切,提示脑缺血的神经细胞损伤不只是坏死,而且与凋亡密切相关,特别是脑缺血后的迟发性神经元死亡,细胞凋亡为其主要的死亡方式[1]。本研究发现,模型组动物大多数海马CA1区神经元在电镜下可见到凋亡的发生,补阳还五汤可使海马CA1区神经元发生凋亡的例数减少,提示补阳还五汤可能具有对抗脑缺血再灌注后CA1区神经细胞凋亡的作用。由于本研究是采用电镜观察海马CA1区神经元,可能受观察范围和观察方法的局限,因此,本研究结果还有待于其他方法证实。至于凋亡发生的确切机制目前尚不清楚,有研究表明,体外小剂量的H2O2、NO及谷胱苷肽合成抑制剂均能诱导多种细胞发生凋亡,细胞内Ca2+浓度增加也可促进凋亡的发生[5],提示氧自由基和Ca2+在凋亡发生过程中起重要作用。补阳还五汤可对抗脑缺血后的氧自由基毒性,防止细胞内Ca2+超负荷,调节脑内花生烯代谢[6,7],由此推测补阳还五汤抗脑缺血后海马CA1区神经细胞凋亡与上述作用有关。为了深入阐明其具体作用机理,本文还进行了进一步的研究,推测其作用可能还与以下环节有关。
, 百拇医药
3.1 改善能量代谢 脑缺血后最早受影响的是能量代谢。脑内ATP的贮存是有限的,一旦血流供应中止,5~7min后ATP贮库耗竭,脑组织神经细胞不能进行主动过程(转运、合成等)[8]。补阳还五汤可防止缺血再灌注48h后脑组织Na+、K+-ATP酶的活性降低,对脑缺血损伤后脑组织的能量代谢有一定的改善作用。
3.2 提高NO的合成 脑组织存在丰富的NOS,可产生NO。研究表明,固有型NOS(cNOS)在基础条件下起作用,产生的NO对脑循环起重要的调节作用;而诱导型NOS(iNOS)在基础条件下不起作用,在缺血时表达并产生高浓度的NO,从而加速能量消耗,损伤DNA,导致神经细胞死亡。研究发现,iNOS的活化在原代神经细胞培养中引起的神经细胞死亡是以凋亡为特征的[9]。在大鼠局灶性脑缺血模型,脑缺血早期(阻断大脑中动脉后5~10min)NO持续增加,至30min达峰值,之后逐渐降至正常,再灌注数分钟到40min又轻度增加,之后又恢复至正常水平[10,11]。给予NOS抑制剂L-NANE或L-NNA等可明显减少大鼠局灶性脑缺血区血流量[12]。但也有研究表明,L-NANE等可使局部脑梗塞体积缩小,NOS抑制剂对脑缺血起保护作用[13]。可见,NO既具有潜在的有益作用,又有毒性作用。NO浓度升高主要发生在缺血早期,此时对神经细胞有毒性作用,而在再灌注后期,NO对脑血流等具有有益的调节作用。补阳还五汤可对抗再灌注后期NO含量和NOS活性的降低,提示该方可能通过提高NO的合成,而发挥抗缺血性损伤后细胞凋亡的作用。
, http://www.100md.com
3.3 对抗EAA的毒性 兴奋性氨基酸(excitatory aminoacid,EAA)主要指谷氨酸(Glu)和天冬氨酸(Asp)。EAA是中枢神经系统中兴奋性神经突触的主要神经递质,同时又是一种神经毒素。脑缺血缺氧时,大量EAA尤其是Glu的爆发性释放,EAA受体过度激活,使一些受体在正常生理刺激下引起的第二信使的效应得到扩大,突触后神经元过度兴奋、溃变、坏死,这就是所谓的“兴奋毒性”。脑缺血时,缺血神经元大量释放的EAA尤其是Glu对神经元的损伤起关键作用。由于EAA使神经元持续去极化,增强了神经元内的Glu等大量释放。又因脑缺血后ATP降解,依赖能量而重吸收Glu的机制衰竭,影响Glu摄取功能,甚至出现Glu向细胞外液转移,如此恶性循环,突触间隙持续高浓度的Glu就引起兴奋性神经毒性[14,15]。因此,拮抗EAA的兴奋毒性,包括抑制其过度释放,促进其再摄取,以及对抗其受体激活,对缺血性脑损伤具有良好的防治作用。本研究发现,补阳还五汤可使脑缺血再灌注后脑组织Glu含量降低,提示对抗EAA的兴奋毒性,可能也是补阳还五汤抗缺血性脑损伤细胞凋亡的作用机制之一。
, http://www.100md.com
脑内还存在抑制性氨基酸(inhibitoryaminoacid,IAA),主要指γ-氨基丁酸(GABA)和甘氨酸(Gly),为中枢神经系统内的抑制性递质,可抑制神经元兴奋,减少由于EAA造成的神经细胞损伤。本研究中补阳还五汤对IAA没有明显的作用。
基金项目:广东省中医药管理局资助项目(编号:98453)
作者简介:刘志龙(1963-),男,副主任医师;
参考文献:
[1] 吕晓红,许丽艳,李恩民,等.一氧化氮在迟发性神经元坏死中与程序性细胞死亡关系的研究[J].中风与神经疾病杂志,1997,2:68
[2] 严翠芬,李麟仙,王子灿,等.沙土鼠短暂性脑缺血后海马迟发性神经元死亡机理的研究[J].中国病理生理杂志,1991,7(6):605
, 百拇医药
[3] Chen B M, Xia L W ,Zhao R Q. Determination of NG, NG-dimethylarginine in human plasma by high-performance liquid chromatography[J]. Journal of Chromatography B,1997,692:467
[4] Nitatori T, Sato N, Waguri S, et al. Delayed neuronal death in the CA1 pyramidal cell layer of the gerbil hippocampus following transient ischemia is apoptosis[J]. J Neurochir, 1995,15:1001
[5] 吴俊芳,王洁,苏丹,等.神经生长因子对大鼠脑皮质神经细胞凋亡的影响[J].中国药理学通报,1999,15(1):80
, http://www.100md.com
[6] 邓常青,刘志龙,葛金文,等.补阳还五汤抗脑缺血再灌注损伤作用机理的研究[J].中国中医基础医学杂志,1998,4(8):32
[7] 刘志龙,邓常青,葛金文,等.补阳还五汤对兔脑缺血再灌注损伤 TXA2/PGI2、环核苷酸及钙的影响[J].中药药理与临床,1996,12(4):5
[8] Erecinska M, Silver I A.ATP and brain function[J].J Cereb Blood Flow Metab,1989,9:2
[9] Samdani A F, Dawson T M, Dawson V L. Nitric oxide synthase in models of focal ischemia[J].Stroke,1997,28(6):1283
, 百拇医药
[10] Malinski T, Bailey F,Zhang Z G,et al. Nitric oxide measured by a porphyrinic microsensor in rat brain after transient middle cerebral artery occlusion[J].J Cereb Blood Flow Metab, 1993, 13:355
[11] Sato S, Tominga T, Ohnishi T, et al. Role of nitric oxide in brain ischemia [J]. Ann NY Aca Sci,1994, 738:369
[12] Irikura K, Maynard K I, Moskowitz M A. Importance of nitric oxide synthase inhibition to the attenuated vascular responses induced by topical L-nitroarginine during vibrissal stimulation[J]. J Cereb Blood Flow Metab, 1994,14:45
, 百拇医药
[13] Nishikawa T, Kirsch J R, Koehler R C, et al. Effect of nitric oxide synthase inhibition on cerebral blood flow and injury volume during ischemia in cats[J].Stroke,1993,24:1717
[14] 胡国渊.脑血管意外和兴奋毒性[M].见:陈维洲,芮耀诚,主编.脑血管疾病基础与临床研究.济南:山东科技出版社,1993.12-25
[15] Hirose K, Chan P H. Blockade of glutamate excitoxicity and its clinical applications[J].Neurochem Res, 1993,18:479
收稿日期:2000-08-10, 百拇医药