分级定量PCR检测血清HBV DNA
作者:郭晏海1 任峰玲2 闫小君1 苏成芝1
单位:郭晏海 闫小君 苏成芝 第四军医大学全军基因诊断技术研究所 陕西省西安市 710033;任峰玲 西安医科大学环境卫生教研室 陕西省西安市 710061
关键词:乙型肝炎病毒;DNA,病毒/分析;聚合酶链反应
中国图书资料分类号 R512
中国图书资料分类号 R512.62
摘 要
目的 利用竞争PCR法建立分级测定HBV DNA含量的定量方法.
方法 设立3个标准竞争模板(102cop, 104 cop, 106cop),分别和恒量的待测模板混合,分别进行40,30,20次循环的PCR扩增,最后凝胶电泳分离待测模板和竞争模板的PCR产物,测定两者的荧光强度的比值,计算待测模板的初始量.
, 百拇医药
结果 对乙型肝炎血清HBV DNA定量表明,12份HBeAg阳性血清,HBV DNA的血清浓度在6×107~1×1011cop/L,而12份HBeAb阳性血清只有7份可检出HBV DNA,它们的血清浓度均在3×108cop/L以下,其余5份用该PCR方法,检测不到.
结论 该方法可用于HBV DNA以及其他病原体DNA的定量.
Grading quantitative PCR to measure serum HBV DNA levels
GUO Yan-Hai1, REN Feng-Ling2, YAN Xiao-Jun1 and SU Cheng Zhi1
, 百拇医药 1Chinese PLA Institute of Gene Diagnosis, Xi'an 710033, Shaanxi Province, China
2Environmental Health Department of Xi'an Medical University, Xi'an 710061, Shaanxi Province, China
Subject headings hepatitis B virus; DNA, viral/analysis; polymerase chain reaction
Abstract
AIM To set up a new method of measuring serum HBV DNA levels with grading quantitative PCR.
, http://www.100md.com
METHODS Three standard competition DNA templates (102 cop, 104 cop, 106 cop) were mixed separately with stable sample DNA templates, and then PCR with 40, 30 and 20 cycles was carried out. Then the PCR products of the sample DNA templates were separated from that of the competition DNA complates, and the fluorescence intensity ratio of them were measured. The initial contents of the sample DNA templates were calculated.
RESULTS The serum HBV DNA contents of the 12 samples of HBeAg positive serum ranged from 6×107 to 1×1011cop/L. Only 7 of the 12 HBeAb positive serum could be detected and their HBV DNA were all below 3×108cop/L and the other 5 samples HBV DNA could not be detected with PCR.
, http://www.100md.com
CONCLUSION This method can be used to measure the HBV DNA and other pathogenic DNA.
0引言
PCR技术对基因从定性到定量的测定是分子生物学方法研究一大飞跃,定量PCR已成为目前分子生物学技术研究的热点之一. 迄今研究和应用的定量PCR方法有4种,即PCR产物的直接定量;极限稀释法;靶基因与参照基因的同步扩增;竞争性PCR法. 以上方法各有利弊,选择某一方法取决于靶基因的特性,对准确度的要求,需要相对还是绝对的定量. 其中竞争性PCR方法的定量比较准确,被较多地采用[1]. 但该方法在实际应用时,需将恒量的样品DNA与一系列稀释的各种浓度的竞争性模板混合后进行PCR扩增,最后进行电泳,找出待测模板与竞争性模板终产物有相等摩尔数的一个反应,从而确定待测模板的初始量. 因此,对一个样品定量时需要进行多个反应,不适应多样品的同时定量测定. 我们建立了分级定量方法,只用3种浓度的竞争模板与恒定量样品DNA进行3个PCR反应,通过测定待测模板与竞争模板的终产物荧光强度比值,来确定待测样品DNA的初始模板量. 该方法适合多样品同时测定.
, http://www.100md.com
1 材料和方法
1.1 材料 GQS-960凝胶成像分析系统(第四军医大学基因诊断技术应用研究所),Thermolyne PCR扩增仪(美国),Taq DNA聚合酶,dNTP (Promega公司). 引物出自HBV DNA的X区,经oligo软件设计. 引物位置和序列为:B1(1402-1421),5,-ATC CTGCGCGGGACGTCCTT3;B2(1626-1607)5,-CGTTCACGGTGGTCTCCATG3扩增比较为225bp,由上海深工生物工程公司合成.
1.2 方法 含靶序列的PUC 19质粒和竞争序列的PUC19质粒,将B1,B2引物扩增HBV DNA的产物克隆入PUC19,该质粒作模拟靶序列用;竞争模板是在正常的B1,B2引物扩增产物中央部插入一段人工合成的40bp的DNA片段,并克隆于PUC19,该质粒作定量实验的竞争模板. 血清处理,主要按酚/氯仿抽提,乙醇沉淀的方法[2]提取血清中HBV DNA,血清用量为300μL,最后所得HBV DNA等分3份作定量PCR扩增. PCR扩增取上述纯化的HBV DNA(各5μL)分别加入三个定量反应管中,其中的竞争模板量分别为102cop,104cop,106cop. PCR反应成分为50mmol/L KCl,100mmol/LTris-HCl pH 8.3,1.5mmol/L MgCl2, 200μmol/L dNTP,B1,B2引物各30pmol. Taq DNA聚合酶1U,反应总体积30μL. 反应程序为:94℃预变性2min,然后94℃ 30s,55℃ 40s, 72℃ 50s分别循环40次,30次,20次后,72℃延伸5min,最后各准确取10μL PCR反应产物,进行40g/L琼脂糖凝胶电泳[3]. 荧光强度测定:将用溴化乙锭染色的凝胶板置于GQS-960型凝胶呈像分析系统上进行扫描,测定荧光强度比值[4,5],并用微机计算结果.
, 百拇医药
2 结果
2.1 竞争模板与待测模板扩增效率比较 对3个待测模板与竞争模板的PCR产物荧光强度比分别为10∶1;1∶1;1∶10的反应液进行106倍稀释,再各取3μL稀释后溶液进行PCR扩增,循环30次,结果两者荧光强度之比仍为10∶1;1∶1;1∶10. 说明所用引物对待测模板与竞争模板的扩增效率相等.
2.2 引物对两种模板的检测灵敏度 将提取并纯化的含有两种模板的两种质粒定量后,按2×105,2×104,2×103,2×102,20 cop分别进行PCR扩增反应,扩增40次循环,结果两种模板都被检测到20 cop的模板量.
2.3 标准曲线
2.3.1 标准曲线1 将102 cop的竞争模板分别与20,40,60,80,100,200,400,600,800,1000,2000,4000 cop的待测模板(含靶序列的PUC19质粒)混合后进行40次PCR扩增. 测定待测模板与竞争模板的PCR产物荧光强度之比(Ax/Ao),并以1g(Ax/Ao)作纵坐标,以待测模板初始量的对数lgX为横坐标作标准曲线1(以下作法相同).
, 百拇医药
2.3.2 标准曲线2 将104 cop的竞争模板分别1×103,2×103,4×103,6×103,8×103,1×104,2×104,4×104,6×104,8×104,1×105,2×105,4×105 cop待测模板混合后,分别进行30次PCR扩增,作标准曲线2.
2.3.3 标准曲线3 将106 cop的竞争模板分别1×105,2×105,4×105,6×105,8×105,1×106,2×106,4×106,6×106,8×106,1×107,2×107,4×107 cop的待测模板混合后,分别进行20次PCR扩增,作标准曲线3.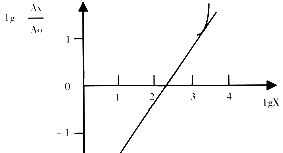
, http://www.100md.com
标准曲线1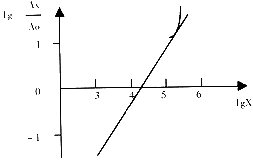
标准曲线2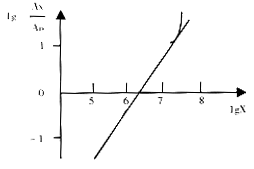
标准曲线3
2.4 临床样品的检测结果 用该定量法对24份HBV感染者的血清进行定量测定,其中12份HBeAg 阳性的血清PCR检测HBV DNA为阳性,HBV DNA在血清中的含量6×107~1×1011/L之间(8×109,6×107,5×1010,4×108,10×1010,5×108,1×1011,7×108,9×108,7×1010,4×109,5×109 cop/L),平均在2.1×1010/L. 而12份HBeAb阳性血清进行测定时,其中7例血清PCR可检出HBV DNA阳性,HBV DNA在血清中的浓度在2×105~3×108 cop/L(6×106,4×106,2×105,5×105,3×108,7×105,1×106 cop/L). 而其余7份血清PCR检测HBV DNA为阴性.
, 百拇医药
3 讨论
用竞争性PCR定量的基本条件是靶序列和竞争性序列用相同的引物,并以相同的效率扩增[1]. 在本实验中,我们采用一对引物对待测靶序列和竞争序列同时扩增,竞争序列是在靶序列中央插入40bp人工合成的DNA片段而来的,这样就保证了靶序列与竞争序列有相似性,使扩增效率相接近. 实验证明,我们设计的竞争模板与待测靶序列有相同的扩增效率,即两者开始的比值经扩增后没有改变,这就保证了本定量实验的可行性. 插入40bp序列也足以使扩增后的两种产物能在琼脂糖凝胶上被分离开. 但这段序列又不能太长,以免扩增效率和待测模板不一致. 在实验中为了使两条扩增带不相干扰,PCR扩增一定要保证特异性扩增. 为此该定量方法要求按严格的标本处理方法提模板DNA,同时对不同浓度范围内的模板按不同的循环次数扩增,即20~103 cop/每管的PCR用40次循环扩增;103~105cop/每管的PCR用30次循环扩增,105~107cop/每管的PCR用20次循环,这样不仅可以保证低浓度模板能被扩增出来,同时高浓度模板经扩增不易出现非特异扩增带,这样就有了定量的前提条件.
, 百拇医药
该方法的理论基础为Ax/Ao=(225Yx)/(265Y0)=[225X(1+e)N]/[265M0(1+e)N]. Ax/Ao为待测模板与竞争模板的扩增产物带荧光强度比;Yx/Yo为待测与竞争模板扩增产物拷贝数之比;225bp为待测模板的长度;265bp为竞争模板的长度;X为待测模板的初始量;Mo为竞争模板初始量;e为扩增效率;n为循环次数. 由于本实验中两种模板扩增效率相同,循环次数相同,上式就变为Ax/Ao=225X/265Mo,取对数后为1g(Ax/Ao)=lgX+1g(225/265Mo). 因此,1gX与1g(Ax/Ao)成线性关系[6]. 但在作分级定量的3个标准曲线时,当靶序列比竞争序列的拷贝数大于10倍以后,标准曲线就渐渐偏离理论值,斜率逐渐增大. 这是由于当待测序列的初始模板量大于竞争序列10倍以上时,经过一定的扩增循环后,待测序列的扩增产物量急剧增大,这些产物所产生的荧光强度已接近或超过了检测系统的饱和限. 因此Ax值增加幅度很微小,直至饱和,此后Ax的测量值不再变化[7]. 而另一方面由于PCR反应体系中各种成分迅速被大量的待测序列及其产物占有,竞争序列的扩增就受到强烈地限制,最终扩增产物下降到A0值接近0. 因此我们看到随着待测序列分子数量增加,标准曲线将迅速上升. 为此我们每一级的定量范围在标准竞争模板量的10±1之间.
, 百拇医药
在定量测定时,我们采用GQS-960凝胶成像及分析系统,对待测及竞争模板的扩增带进行荧光强度比较,经微机计算出相应的待测模板拷贝数. 该方法仍采用溴化乙锭染色,紫外灯下测定荧光. 因此过去有定性PCR设备的实验室,只需购买一套凝胶荧光强度检测仪就可以开展工作. 该定量法不需象以往竞争PCR定量方法那样,测定一个样品DNA要有一系列稀释的竞争模板来标定,而是只要作3个定量(与102,104,106cop竞争模板混合)反应就可最终定出待测DNA模板的拷贝数. 用该方法分别对12份HBeAg阳性和12份HBeAb阳性血清进行定量分析,结果前12份血清均可检测到HBV DNA,并且血清浓度为6×107~1×1011cop/L. 而后12份只检出7份HBV DNA阳性,其在血清中的含量在2×105~3×108 cop/L之间,还有5份血清用该PCR方法未检出HBV DNA. 以上定量结果与文献报道的相近[3]. 上述结果也说明了为什么用简便的处理血清方法进行PCR扩增时,HBeAb阳性血清大部分往往检测不到HBV DNA的原因. 因为一般抗HBeAb阳性血清中HBV DNA含量较低(在3×108 cop/L以下),而简便血清处理方法最多只取相当于2μL血清中的HBV DNA作PCR扩增,按上面结果计算只含有0.4~6×102 cop. 因此就有一大部分不能被检测出来.
, http://www.100md.com
总之,该方法操作简便,结果准确,可用于临床定量检测各种病原体的DNA.
作者简介:郭晏海,男,1964-12-30生,河南省封丘人,汉族. 1989年西安医科大学本科毕业,1995年西安医科大学硕士,讲师,主要从事肝炎病毒基因诊断研究,发表论文18篇.
通讯作者 郭晏海,710033,第四军医大学全军基因诊断技术研究所,陕西省西安市长乐西路17号.
Correspondence to:GUO Yan-Hai, Chinese PLA Institute of Gene Diagnosis, 17 Changle Xilu, Xi'an 710033, Shaanxi Province, China
Tel. +86.29.3216587
, http://www.100md.com
4 参考文献
[1] Kumar U, Thomas HC, Monjardino B. Serum HCV RNA levels in chronic HCV hepatitis measured by quantitative PCR assay; correlation with serum AST. J Virol Methods, 1994;47:95-102
[2] Chomczynski P, Sacch NA. Single-step method of RNA isolation by acid guanidine thiocyanate-phenol-chlorofrom extraction. Anal Biochem, 1987;162:156-159
[3] 林万明主编. PCR技术操作和临床应用指南. 第1版. 北京:人民军医出版社,1995:6-10
, http://www.100md.com
4 Krick LJ. Chemiluminescent and bioluminescent techniques. Clin Chem, 1991;37:1472-1481
[5] Martin CS, Butler L, Bron SI. Quantitation of PCR products with chemiluminescence. Biotechniques, 1995;18:908-913
[6] 陈波,成志恒,朱剑锋,杨蓓蕾,陈常庆. 一种检测聚合酶链反应产物的新方法. 中华医学检验杂志,1996;19:151-159
[7] Baccard-Longere M, Alpha-Bazin B, Chypre C. Fast solid support detection of human papillomavirus in in vitro amplified DNA using a DNA-anti DNP monoclonal antibody couple. J virol Methods, 1994;46:29-38
收稿日期 1998-07-15, http://www.100md.com(郭晏海1 任峰玲2 闫小君1 苏成芝1)
单位:郭晏海 闫小君 苏成芝 第四军医大学全军基因诊断技术研究所 陕西省西安市 710033;任峰玲 西安医科大学环境卫生教研室 陕西省西安市 710061
关键词:乙型肝炎病毒;DNA,病毒/分析;聚合酶链反应
中国图书资料分类号 R512
中国图书资料分类号 R512.62
摘 要
目的 利用竞争PCR法建立分级测定HBV DNA含量的定量方法.
方法 设立3个标准竞争模板(102cop, 104 cop, 106cop),分别和恒量的待测模板混合,分别进行40,30,20次循环的PCR扩增,最后凝胶电泳分离待测模板和竞争模板的PCR产物,测定两者的荧光强度的比值,计算待测模板的初始量.
, 百拇医药
结果 对乙型肝炎血清HBV DNA定量表明,12份HBeAg阳性血清,HBV DNA的血清浓度在6×107~1×1011cop/L,而12份HBeAb阳性血清只有7份可检出HBV DNA,它们的血清浓度均在3×108cop/L以下,其余5份用该PCR方法,检测不到.
结论 该方法可用于HBV DNA以及其他病原体DNA的定量.
Grading quantitative PCR to measure serum HBV DNA levels
GUO Yan-Hai1, REN Feng-Ling2, YAN Xiao-Jun1 and SU Cheng Zhi1
, 百拇医药 1Chinese PLA Institute of Gene Diagnosis, Xi'an 710033, Shaanxi Province, China
2Environmental Health Department of Xi'an Medical University, Xi'an 710061, Shaanxi Province, China
Subject headings hepatitis B virus; DNA, viral/analysis; polymerase chain reaction
Abstract
AIM To set up a new method of measuring serum HBV DNA levels with grading quantitative PCR.
, http://www.100md.com
METHODS Three standard competition DNA templates (102 cop, 104 cop, 106 cop) were mixed separately with stable sample DNA templates, and then PCR with 40, 30 and 20 cycles was carried out. Then the PCR products of the sample DNA templates were separated from that of the competition DNA complates, and the fluorescence intensity ratio of them were measured. The initial contents of the sample DNA templates were calculated.
RESULTS The serum HBV DNA contents of the 12 samples of HBeAg positive serum ranged from 6×107 to 1×1011cop/L. Only 7 of the 12 HBeAb positive serum could be detected and their HBV DNA were all below 3×108cop/L and the other 5 samples HBV DNA could not be detected with PCR.
, http://www.100md.com
CONCLUSION This method can be used to measure the HBV DNA and other pathogenic DNA.
0引言
PCR技术对基因从定性到定量的测定是分子生物学方法研究一大飞跃,定量PCR已成为目前分子生物学技术研究的热点之一. 迄今研究和应用的定量PCR方法有4种,即PCR产物的直接定量;极限稀释法;靶基因与参照基因的同步扩增;竞争性PCR法. 以上方法各有利弊,选择某一方法取决于靶基因的特性,对准确度的要求,需要相对还是绝对的定量. 其中竞争性PCR方法的定量比较准确,被较多地采用[1]. 但该方法在实际应用时,需将恒量的样品DNA与一系列稀释的各种浓度的竞争性模板混合后进行PCR扩增,最后进行电泳,找出待测模板与竞争性模板终产物有相等摩尔数的一个反应,从而确定待测模板的初始量. 因此,对一个样品定量时需要进行多个反应,不适应多样品的同时定量测定. 我们建立了分级定量方法,只用3种浓度的竞争模板与恒定量样品DNA进行3个PCR反应,通过测定待测模板与竞争模板的终产物荧光强度比值,来确定待测样品DNA的初始模板量. 该方法适合多样品同时测定.
, http://www.100md.com
1 材料和方法
1.1 材料 GQS-960凝胶成像分析系统(第四军医大学基因诊断技术应用研究所),Thermolyne PCR扩增仪(美国),Taq DNA聚合酶,dNTP (Promega公司). 引物出自HBV DNA的X区,经oligo软件设计. 引物位置和序列为:B1(1402-1421),5,-ATC CTGCGCGGGACGTCCTT3;B2(1626-1607)5,-CGTTCACGGTGGTCTCCATG3扩增比较为225bp,由上海深工生物工程公司合成.
1.2 方法 含靶序列的PUC 19质粒和竞争序列的PUC19质粒,将B1,B2引物扩增HBV DNA的产物克隆入PUC19,该质粒作模拟靶序列用;竞争模板是在正常的B1,B2引物扩增产物中央部插入一段人工合成的40bp的DNA片段,并克隆于PUC19,该质粒作定量实验的竞争模板. 血清处理,主要按酚/氯仿抽提,乙醇沉淀的方法[2]提取血清中HBV DNA,血清用量为300μL,最后所得HBV DNA等分3份作定量PCR扩增. PCR扩增取上述纯化的HBV DNA(各5μL)分别加入三个定量反应管中,其中的竞争模板量分别为102cop,104cop,106cop. PCR反应成分为50mmol/L KCl,100mmol/LTris-HCl pH 8.3,1.5mmol/L MgCl2, 200μmol/L dNTP,B1,B2引物各30pmol. Taq DNA聚合酶1U,反应总体积30μL. 反应程序为:94℃预变性2min,然后94℃ 30s,55℃ 40s, 72℃ 50s分别循环40次,30次,20次后,72℃延伸5min,最后各准确取10μL PCR反应产物,进行40g/L琼脂糖凝胶电泳[3]. 荧光强度测定:将用溴化乙锭染色的凝胶板置于GQS-960型凝胶呈像分析系统上进行扫描,测定荧光强度比值[4,5],并用微机计算结果.
, 百拇医药
2 结果
2.1 竞争模板与待测模板扩增效率比较 对3个待测模板与竞争模板的PCR产物荧光强度比分别为10∶1;1∶1;1∶10的反应液进行106倍稀释,再各取3μL稀释后溶液进行PCR扩增,循环30次,结果两者荧光强度之比仍为10∶1;1∶1;1∶10. 说明所用引物对待测模板与竞争模板的扩增效率相等.
2.2 引物对两种模板的检测灵敏度 将提取并纯化的含有两种模板的两种质粒定量后,按2×105,2×104,2×103,2×102,20 cop分别进行PCR扩增反应,扩增40次循环,结果两种模板都被检测到20 cop的模板量.
2.3 标准曲线
2.3.1 标准曲线1 将102 cop的竞争模板分别与20,40,60,80,100,200,400,600,800,1000,2000,4000 cop的待测模板(含靶序列的PUC19质粒)混合后进行40次PCR扩增. 测定待测模板与竞争模板的PCR产物荧光强度之比(Ax/Ao),并以1g(Ax/Ao)作纵坐标,以待测模板初始量的对数lgX为横坐标作标准曲线1(以下作法相同).
, 百拇医药
2.3.2 标准曲线2 将104 cop的竞争模板分别1×103,2×103,4×103,6×103,8×103,1×104,2×104,4×104,6×104,8×104,1×105,2×105,4×105 cop待测模板混合后,分别进行30次PCR扩增,作标准曲线2.
2.3.3 标准曲线3 将106 cop的竞争模板分别1×105,2×105,4×105,6×105,8×105,1×106,2×106,4×106,6×106,8×106,1×107,2×107,4×107 cop的待测模板混合后,分别进行20次PCR扩增,作标准曲线3.

, http://www.100md.com
标准曲线1

标准曲线2

标准曲线3
2.4 临床样品的检测结果 用该定量法对24份HBV感染者的血清进行定量测定,其中12份HBeAg 阳性的血清PCR检测HBV DNA为阳性,HBV DNA在血清中的含量6×107~1×1011/L之间(8×109,6×107,5×1010,4×108,10×1010,5×108,1×1011,7×108,9×108,7×1010,4×109,5×109 cop/L),平均在2.1×1010/L. 而12份HBeAb阳性血清进行测定时,其中7例血清PCR可检出HBV DNA阳性,HBV DNA在血清中的浓度在2×105~3×108 cop/L(6×106,4×106,2×105,5×105,3×108,7×105,1×106 cop/L). 而其余7份血清PCR检测HBV DNA为阴性.
, 百拇医药
3 讨论
用竞争性PCR定量的基本条件是靶序列和竞争性序列用相同的引物,并以相同的效率扩增[1]. 在本实验中,我们采用一对引物对待测靶序列和竞争序列同时扩增,竞争序列是在靶序列中央插入40bp人工合成的DNA片段而来的,这样就保证了靶序列与竞争序列有相似性,使扩增效率相接近. 实验证明,我们设计的竞争模板与待测靶序列有相同的扩增效率,即两者开始的比值经扩增后没有改变,这就保证了本定量实验的可行性. 插入40bp序列也足以使扩增后的两种产物能在琼脂糖凝胶上被分离开. 但这段序列又不能太长,以免扩增效率和待测模板不一致. 在实验中为了使两条扩增带不相干扰,PCR扩增一定要保证特异性扩增. 为此该定量方法要求按严格的标本处理方法提模板DNA,同时对不同浓度范围内的模板按不同的循环次数扩增,即20~103 cop/每管的PCR用40次循环扩增;103~105cop/每管的PCR用30次循环扩增,105~107cop/每管的PCR用20次循环,这样不仅可以保证低浓度模板能被扩增出来,同时高浓度模板经扩增不易出现非特异扩增带,这样就有了定量的前提条件.
, 百拇医药
该方法的理论基础为Ax/Ao=(225Yx)/(265Y0)=[225X(1+e)N]/[265M0(1+e)N]. Ax/Ao为待测模板与竞争模板的扩增产物带荧光强度比;Yx/Yo为待测与竞争模板扩增产物拷贝数之比;225bp为待测模板的长度;265bp为竞争模板的长度;X为待测模板的初始量;Mo为竞争模板初始量;e为扩增效率;n为循环次数. 由于本实验中两种模板扩增效率相同,循环次数相同,上式就变为Ax/Ao=225X/265Mo,取对数后为1g(Ax/Ao)=lgX+1g(225/265Mo). 因此,1gX与1g(Ax/Ao)成线性关系[6]. 但在作分级定量的3个标准曲线时,当靶序列比竞争序列的拷贝数大于10倍以后,标准曲线就渐渐偏离理论值,斜率逐渐增大. 这是由于当待测序列的初始模板量大于竞争序列10倍以上时,经过一定的扩增循环后,待测序列的扩增产物量急剧增大,这些产物所产生的荧光强度已接近或超过了检测系统的饱和限. 因此Ax值增加幅度很微小,直至饱和,此后Ax的测量值不再变化[7]. 而另一方面由于PCR反应体系中各种成分迅速被大量的待测序列及其产物占有,竞争序列的扩增就受到强烈地限制,最终扩增产物下降到A0值接近0. 因此我们看到随着待测序列分子数量增加,标准曲线将迅速上升. 为此我们每一级的定量范围在标准竞争模板量的10±1之间.
, 百拇医药
在定量测定时,我们采用GQS-960凝胶成像及分析系统,对待测及竞争模板的扩增带进行荧光强度比较,经微机计算出相应的待测模板拷贝数. 该方法仍采用溴化乙锭染色,紫外灯下测定荧光. 因此过去有定性PCR设备的实验室,只需购买一套凝胶荧光强度检测仪就可以开展工作. 该定量法不需象以往竞争PCR定量方法那样,测定一个样品DNA要有一系列稀释的竞争模板来标定,而是只要作3个定量(与102,104,106cop竞争模板混合)反应就可最终定出待测DNA模板的拷贝数. 用该方法分别对12份HBeAg阳性和12份HBeAb阳性血清进行定量分析,结果前12份血清均可检测到HBV DNA,并且血清浓度为6×107~1×1011cop/L. 而后12份只检出7份HBV DNA阳性,其在血清中的含量在2×105~3×108 cop/L之间,还有5份血清用该PCR方法未检出HBV DNA. 以上定量结果与文献报道的相近[3]. 上述结果也说明了为什么用简便的处理血清方法进行PCR扩增时,HBeAb阳性血清大部分往往检测不到HBV DNA的原因. 因为一般抗HBeAb阳性血清中HBV DNA含量较低(在3×108 cop/L以下),而简便血清处理方法最多只取相当于2μL血清中的HBV DNA作PCR扩增,按上面结果计算只含有0.4~6×102 cop. 因此就有一大部分不能被检测出来.
, http://www.100md.com
总之,该方法操作简便,结果准确,可用于临床定量检测各种病原体的DNA.
作者简介:郭晏海,男,1964-12-30生,河南省封丘人,汉族. 1989年西安医科大学本科毕业,1995年西安医科大学硕士,讲师,主要从事肝炎病毒基因诊断研究,发表论文18篇.
通讯作者 郭晏海,710033,第四军医大学全军基因诊断技术研究所,陕西省西安市长乐西路17号.
Correspondence to:GUO Yan-Hai, Chinese PLA Institute of Gene Diagnosis, 17 Changle Xilu, Xi'an 710033, Shaanxi Province, China
Tel. +86.29.3216587
, http://www.100md.com
4 参考文献
[1] Kumar U, Thomas HC, Monjardino B. Serum HCV RNA levels in chronic HCV hepatitis measured by quantitative PCR assay; correlation with serum AST. J Virol Methods, 1994;47:95-102
[2] Chomczynski P, Sacch NA. Single-step method of RNA isolation by acid guanidine thiocyanate-phenol-chlorofrom extraction. Anal Biochem, 1987;162:156-159
[3] 林万明主编. PCR技术操作和临床应用指南. 第1版. 北京:人民军医出版社,1995:6-10
, http://www.100md.com
4 Krick LJ. Chemiluminescent and bioluminescent techniques. Clin Chem, 1991;37:1472-1481
[5] Martin CS, Butler L, Bron SI. Quantitation of PCR products with chemiluminescence. Biotechniques, 1995;18:908-913
[6] 陈波,成志恒,朱剑锋,杨蓓蕾,陈常庆. 一种检测聚合酶链反应产物的新方法. 中华医学检验杂志,1996;19:151-159
[7] Baccard-Longere M, Alpha-Bazin B, Chypre C. Fast solid support detection of human papillomavirus in in vitro amplified DNA using a DNA-anti DNP monoclonal antibody couple. J virol Methods, 1994;46:29-38
收稿日期 1998-07-15, http://www.100md.com(郭晏海1 任峰玲2 闫小君1 苏成芝1)