FGF对关节软骨细胞基质及其TGFβ1表达的作用
作者:徐卫东 侯铁胜 张春才 胡惠民 毛积芳 颜永碧
单位:第二军医大学长海医院骨科,上海,200433;胡惠民 毛积芳:第二军医大学基础医学部生物化学与分子生物学教研室;颜永碧:第二军医大学基础医学部电镜中心
关键词:关节软骨细胞;转化生长因子β1;成纤维细胞生长因子;细胞基质
第二军医大学学报991021 摘要 目的:观察成纤维细胞生长因子(FGF)对培养兔关节软骨细胞基质及转化生长因子β1(TGFβ1)表达的影响。方法:培养1月龄新西兰兔关节软骨细胞,在每次换液时加入FGF 100 ng/ml,铺满后收集细胞,作关节软骨细胞TGFβ1检测及电镜免疫组织化学观察。采用氯胺T法和Antonopoulos法,作细胞基质的胶原和蛋白多糖含量测定。结果:FGF能明显促进胶原和蛋白多糖的合成,并且与剂量、时间呈正相关(P<0.01)。光镜下实验组细胞明显呈棕色,电镜下细胞膜表面有明显的胶金颗粒粘附。结论:FGF能促进关节软骨细胞TGFβ1的表达及基质合成,推迟了关节软骨细胞的成熟,维持细胞的软骨表现型,这些作用有利于关节软骨损伤后的修复,可能具有一定的临床意义。
, 百拇医药
中图分类号 R 684 文献标识码:A
Study of the fibroblast growth factor to the cultured rabbit cartilage chondrocytes
Xu Weidong, Hou Tiesheng, Zhang Chuncai, Hu Huimin, Mao Jifang, Yan Yongbi
(Department of Orthopedics, Changhai Hospital, Second Military Medical University, Shanghai, 200433)
ABSTRACT Objective:To observe the matrix and the expression of TGFβ1 of the cartilage cells with the FGF. Methods: The rabbit articular chondrocytes were cultured, while the FGF (100 ng/ml) were put in the cell culture liquid. After growing consistently, the chondrocytes and its liquids were harvested. Then the immunohistology of TGFβ1 on the cartilage cells and the concentration of the collagen and proteoglycan of it were detected. Results: The study showed the chondrocytes treated with the FGF (100 ng/ml) were showed obviously brown, the membrane of which were adhesion by much more grains of colloid-gold under electron microscope, and synthesized much more collagen and proteoglycan. Conclusion: It indicates that the FGF could prompt the expression of TGFβ1 of the cartilage cells and stimulate the synthesis of the matrix of the cartilage, inhibite mature of the chondrocytes and maintain the chondrotype, which is very crucial to the metabolic and function of the cartilage.
, 百拇医药
KEY WORDS articular chondrocytes;transforming growth factor beta;fibroblast growth factor;cell matrix
关节软骨的损伤与修复是目前骨科临床基础研究的一个重要课题。关节软骨损伤后的修复是极其有限的[1]。许多多肽生长因子在关节软骨损伤与修复中起着重要的调节作用,如成纤维细胞生长因子(fibroblast growth factor, FGF)对中胚层来源的细胞包括软骨细胞具有明显的促有丝分裂作用[2]。本研究培养1月龄新西兰兔关节软骨细胞,作关节软骨细胞转化生长因子β1(TGFβ1)免疫组织化学研究,以了解生长因子对软骨细胞的作用。
1 材料和方法
1.1 材料 专用微波炉、TGFβ1 抗体(美国 NIH Roche教授惠赠,3.5 μl抗体中和4 ng TGFβ),WAK-STP试剂盒,H-8000电镜、戊二醛、SPA-胶金、Epon 812包埋剂。1月龄新西兰兔由上海医科大学实验动物中心提供,共14只,均为雄性。FGF由第二军医大学基础医学部生化教研室姜关祥、胡惠民教授等按照Gospodarowicz方法[3],由牛脑中提取、纯化,为混合性。
, 百拇医药
1.2 方法
1.2.1 细胞培养 1月龄新西兰兔,无菌取关节软骨,用PBS漂洗后,剪碎成1~2 mm见方,用0.125%胰蛋白酶消化25 min(置培养箱),离心1 000 r/min,5 min,弃上清,DMEM洗3次,用无血清培养液加0.06%Ⅱ型胶原酶,置37℃,5% CO2孵箱,消化10 h。尼龙布网过滤,收集细胞,用DMEM洗3次,加10%胎牛血清及DMEM培养液,制成细胞悬液,细胞浓度为(1~3)×103个/ml,置于六孔培养板,每孔加细胞悬液3 ml,隔天换液。按以上方法,随机将15只兔分为2组(第1组10只,第2组5只),从第1组的每只兔关节软骨分离培养的细胞悬液制成4份,分别为胶原实验组及对照组和蛋白多糖实验组及对照组;同样,从第2组的每只兔关节软骨分离培养的细胞悬液制成4份,为免疫组化ABC染色实验组及对照组和免疫电镜实验组及对照组。
1.2.2 细胞基质胶原含量测定 氯胺T法:收集细胞悬液约2 ml,加入带盖试管中,加浓盐酸1.2 ml,110℃烘箱中水解7 h,加40% NaOH 1.2 ml,加水稀释至10 ml,以1 mol/L HCl,4% NaOH调pH值至6。3 000 r/min离心10 min,取上清液1 ml,加水1 ml,0.05 mol/L氯胺T 1.0 ml混匀。25℃水浴,充分振荡2次,加1 ml过氯酸,混匀,置5 min,加10%对二甲氨基苯甲醛1 ml,混匀,60℃水浴20 min。冷却后,用721型分光光度计,在560 nm处比色,读D值。以羟脯氨酸标准液作标准曲线,得出样品中羟脯氨酸的含量(×7.46即为胶原含量)。
, http://www.100md.com
1.2.3 细胞基质蛋白多糖含量测定 Antonopoulos法[4]:取细胞悬液1 ml,放于消化管中,加4 mol/L HCl 0.5 ml,生理盐水0.5 ml,置于烤箱,110℃水解8 h,调pH值至6,加水10 ml,过滤。取滤液0.2 ml,加水0.4 ml,2 mol/L碳酸钠0.4 ml,2%乙酰丙酮0.5 ml,充分混匀,沸水煮20 min,冷却,加无水乙醇1 ml,Ehr氏试剂0.5 ml,混匀充分。以721型分光光度计在530 nm处比色,读D值。用标准N-乙酰葡萄糖胺溶液作标准曲线,得出样品中蛋白多糖的含量。
1.2.4 免疫组化ABC法染色 关节软骨细胞经原代培养铺满后,吸除培养液,用0.25%胰蛋白酶与0.01%EDTA 1∶2消化1 min,离心1 000 r/min,5 min后收集细胞,以PBS洗涤2次,再以微量PBS重悬细胞后,作细胞涂片,用4%多聚甲醛固定20 min,PBS洗3×3 min,吹干后加血清,10 min。加一抗微波处理50 s,放置10 min,再用PBS洗3×3 min;二抗微波处理50 s,放置5 min,PBS洗3×3 min,HRP标记卵白素微波处理50 s,放置5 min。DAB 30 ml+0.3%双氧水50 μl显色10 min,蒸馏水稍洗后,用苏木素衬染1 min,脱水,透明,封片,镜检。
, 百拇医药
1.2.5 SPA-胶金标记免疫电镜研究[5] 同上收集关节软骨细胞,PBS漂洗后用1.25%戊二醛微波固定5~20 s。漂洗后用TGFβ1抗体振荡孵育60 min,35℃,PBS漂洗后用SPA-胶金振荡孵育60 min,35℃,PBS洗后再用2%戊二醛固定30~60 min,即可用血浆将标本凝成块状。上述标本在凝成块状之前均离心,凝成块后按常规电镜标本制备方法,Epon812包埋,超薄切片用醛酸铀、枸橼酸铅染色后即可在电镜下观察。
1.3 统计学处理 数据以 表示,组间以t检验进行差异显著性检测。
表示,组间以t检验进行差异显著性检测。
2 结 果
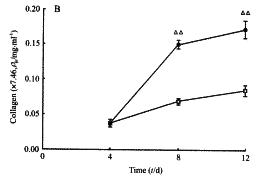
2.1 FGF明显促进胶原的合成 将FGF以倍比稀释成12.5,25,50,100和200 ng/ml,在每次隔天换液时分别加入5组细胞培养液,共加6次,于第12天收集细胞悬液。以FGF50 ng/ml于细胞换液时加入另5组细胞培养液, 于细胞培养第4,6,8,10和12天依次收集每组细胞悬液。对照组不加FGF。 作羟脯氨酸含量检测, 结果显示FGF能明显促进胶原的合成, 并且与剂量、时间呈正相关(图1A,1B)。
, http://www.100md.com
图1 FGF促进胶原合成的剂量效应关系(A)和时间效应关系(B)
Fig 1 The relation of dose-effect (A) and time-effect (B) on FGF promoting synthesis of collegen
**P<0.01 vs 0 ng/ml; (B)□:Control; ●: FGF 100 ng/ml; △△P<0.01 vs control group
2.2 FGF明显促进蛋白多糖的合成 同2.1方法,结果显示FGF能明显促进蛋白多糖的合成,并且与剂量、时间呈正相关(图2A,2B)。

, http://www.100md.com
图2 FGF促进蛋白多糖合成的剂量效应关系(A)和时间效应关系(B)
Fig 2 The relation of dose-effect (A) and time-effect (B) on FGF promoting synthesis of proteoglycan
*P<0.05,**P<0.01 vs 0 ng/ml; (B)□:Control; ●: FGF 100 ng/ml; △P<0.05, △△P<0.01 vs control group
2.3 免疫组化检测结果 实验中将FGF 100 ng/ml换液时加入细胞培养液,隔天换液,共加FGF6次,结果显示实验组细胞明显呈棕色,而对照组则棕色不明显或呈阴性(图3),说明FGF明显促进TGFβ1的合成。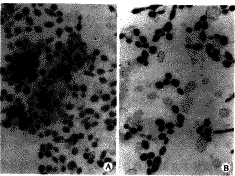
, http://www.100md.com
图3 免疫组化ABC法检测结果
(×3.3×100×2.5)
Fig 3 Immunohistochamical stainine of ABC show
(×3.3×100×2.5)
A: Contrast cells no brown;
B: Studied cells brown obviously
2.4 免疫组化电镜观察结果 显示实验组细胞膜表面有明显的胶金颗粒粘附,而对照组则较少(图4)。结果表明FGF能促进TGFβ1的合成,而且显示TGFβ1定位于关节软骨细胞膜表面。
, 百拇医药
图4 免疫组化电镜观察结果(醛酸铀、枸橼酸铅染色,A×60 000×2.5)
Fig 4 Immunohistochmical of electron
microscope show (A×60 000×2.5)
A: Contrast cells adhesion less grains of
colloid-gold; B: Studied cells adhesion more
colloid-gold grains
3 讨 论
FGF对软骨细胞具有明显的促有丝分裂作用,在软骨的生长、发育、分化、骨化过程中有重要的调节作用。
, http://www.100md.com
软骨组织通过软骨细胞肥大、透明、成熟以及钙质沉积而骨化。这对骨骼的发育、生长、损伤后的修复是极其重要的。但在关节软骨损伤修复中,过早地钙化以致形成骨赘,不利于软骨损伤的修复。FGF能通过促进软骨细胞合成蛋白多糖来抑制软骨的钙化。当蛋白多糖含量丰富时,能抑制软骨组织的矿物质沉积和钙化。若把分解蛋白多糖的酶加入软骨细胞培养液中,则促进培养细胞的钙化。当关节软骨发生退变、钙化时,蛋白多糖的合成及含量明显下降,这进一步加重了退变性关节炎的发生。在一些富含FGF的组织,如软骨肉瘤中,始终没有骨化,这也支持了FGF能抑制软骨钙化这一结论。本实验显示100 ng/ml FGF能明显促进培养软骨细胞蛋白多糖的合成,且与剂量、时间呈正相关(P<0.01,t检验)。
胶原是软骨基质的重要组成成分,结构呈网状,包纳了软骨细胞及其他基质成分,从而抑制或阻止软骨细胞的成熟与钙化。胶原的破坏、合成降低,必然影响软骨组织的结构及功能。本实验提示FGF能促进胶原合成,在FGF大于100 ng/ml时,作用最明显,也与剂量、时间呈正相关(P<0.01,t检验)。
, http://www.100md.com
本研究将FGF作用于培养兔关节软骨细胞,作链酶素-亲和素放大系统ABC免疫组化研究,结果显示实验组细胞呈明显棕色,而对照组棕色不明显或为阴性。同时,本文还采用免疫胶体金标记组化方法,进一步明确软骨细胞TGFβ1的定位。本研究结果显示,FGF作用于培养兔关节软骨细胞后,细胞膜表面的绒毛上有明显的胶金标记,而对照组则很少。从上述免疫组化研究可见,FGF能促进兔关节软骨细胞TGFβ1的合成。 一般认为,TGFβ1对于未分化的细胞,它是一种促分化生长因子,诱导间质细胞转化为软骨细胞,能促进软骨细胞的复制,但对于比较成熟的软骨细胞,则抑制其分化和增殖。TGFβ1抑制培养中兔关节软骨细胞的终末分化及钙化[6]。
本研究结果表明FGF能促进基质合成及其TGFβ1的表达,抑制关节软骨细胞成熟,具有较为重要的临床意义。
文章编号:0258-879X(1999)10-0773-04
, 百拇医药
参考文献
1 Hunter W. The structure and disease of articulating cartilage[J]. Clin Orthop,1995,11(317):3
2 Guerne PA,Sublet A,Lotz M. Growth factor responsiveness of human articular chondrocytes: distinct profiles in primary chondrocytes, subculture chondrocytes, and fibroblasts[J]. J Cell Physiol,1994,158(3):476
3 姜关祥,胡惠民,陈克明,等. 牛脑两种不同生长因子的纯化和特性[J]. 第二军医大学学报,1992,13(5):488
, http://www.100md.com
4 张惟杰 主编. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社,1994. 23~25
5 颜永碧,夏原耀,陆月良. 游离细胞表面抗原的免疫金标记技术(结合微波固定)[J]. 解剖学杂志, 1992,15(6):471
6 Kato Y, Iwamoto M. Fibroblast growth factor is an inhibitor of chondrocyte terminal differentiation[J]. J Biol Chem,1990,265(10):5903
(1999-02-21收稿,1999-08-05修回), 百拇医药
单位:第二军医大学长海医院骨科,上海,200433;胡惠民 毛积芳:第二军医大学基础医学部生物化学与分子生物学教研室;颜永碧:第二军医大学基础医学部电镜中心
关键词:关节软骨细胞;转化生长因子β1;成纤维细胞生长因子;细胞基质
第二军医大学学报991021 摘要 目的:观察成纤维细胞生长因子(FGF)对培养兔关节软骨细胞基质及转化生长因子β1(TGFβ1)表达的影响。方法:培养1月龄新西兰兔关节软骨细胞,在每次换液时加入FGF 100 ng/ml,铺满后收集细胞,作关节软骨细胞TGFβ1检测及电镜免疫组织化学观察。采用氯胺T法和Antonopoulos法,作细胞基质的胶原和蛋白多糖含量测定。结果:FGF能明显促进胶原和蛋白多糖的合成,并且与剂量、时间呈正相关(P<0.01)。光镜下实验组细胞明显呈棕色,电镜下细胞膜表面有明显的胶金颗粒粘附。结论:FGF能促进关节软骨细胞TGFβ1的表达及基质合成,推迟了关节软骨细胞的成熟,维持细胞的软骨表现型,这些作用有利于关节软骨损伤后的修复,可能具有一定的临床意义。
, 百拇医药
中图分类号 R 684 文献标识码:A
Study of the fibroblast growth factor to the cultured rabbit cartilage chondrocytes
Xu Weidong, Hou Tiesheng, Zhang Chuncai, Hu Huimin, Mao Jifang, Yan Yongbi
(Department of Orthopedics, Changhai Hospital, Second Military Medical University, Shanghai, 200433)
ABSTRACT Objective:To observe the matrix and the expression of TGFβ1 of the cartilage cells with the FGF. Methods: The rabbit articular chondrocytes were cultured, while the FGF (100 ng/ml) were put in the cell culture liquid. After growing consistently, the chondrocytes and its liquids were harvested. Then the immunohistology of TGFβ1 on the cartilage cells and the concentration of the collagen and proteoglycan of it were detected. Results: The study showed the chondrocytes treated with the FGF (100 ng/ml) were showed obviously brown, the membrane of which were adhesion by much more grains of colloid-gold under electron microscope, and synthesized much more collagen and proteoglycan. Conclusion: It indicates that the FGF could prompt the expression of TGFβ1 of the cartilage cells and stimulate the synthesis of the matrix of the cartilage, inhibite mature of the chondrocytes and maintain the chondrotype, which is very crucial to the metabolic and function of the cartilage.
, 百拇医药
KEY WORDS articular chondrocytes;transforming growth factor beta;fibroblast growth factor;cell matrix
关节软骨的损伤与修复是目前骨科临床基础研究的一个重要课题。关节软骨损伤后的修复是极其有限的[1]。许多多肽生长因子在关节软骨损伤与修复中起着重要的调节作用,如成纤维细胞生长因子(fibroblast growth factor, FGF)对中胚层来源的细胞包括软骨细胞具有明显的促有丝分裂作用[2]。本研究培养1月龄新西兰兔关节软骨细胞,作关节软骨细胞转化生长因子β1(TGFβ1)免疫组织化学研究,以了解生长因子对软骨细胞的作用。
1 材料和方法
1.1 材料 专用微波炉、TGFβ1 抗体(美国 NIH Roche教授惠赠,3.5 μl抗体中和4 ng TGFβ),WAK-STP试剂盒,H-8000电镜、戊二醛、SPA-胶金、Epon 812包埋剂。1月龄新西兰兔由上海医科大学实验动物中心提供,共14只,均为雄性。FGF由第二军医大学基础医学部生化教研室姜关祥、胡惠民教授等按照Gospodarowicz方法[3],由牛脑中提取、纯化,为混合性。
, 百拇医药
1.2 方法
1.2.1 细胞培养 1月龄新西兰兔,无菌取关节软骨,用PBS漂洗后,剪碎成1~2 mm见方,用0.125%胰蛋白酶消化25 min(置培养箱),离心1 000 r/min,5 min,弃上清,DMEM洗3次,用无血清培养液加0.06%Ⅱ型胶原酶,置37℃,5% CO2孵箱,消化10 h。尼龙布网过滤,收集细胞,用DMEM洗3次,加10%胎牛血清及DMEM培养液,制成细胞悬液,细胞浓度为(1~3)×103个/ml,置于六孔培养板,每孔加细胞悬液3 ml,隔天换液。按以上方法,随机将15只兔分为2组(第1组10只,第2组5只),从第1组的每只兔关节软骨分离培养的细胞悬液制成4份,分别为胶原实验组及对照组和蛋白多糖实验组及对照组;同样,从第2组的每只兔关节软骨分离培养的细胞悬液制成4份,为免疫组化ABC染色实验组及对照组和免疫电镜实验组及对照组。
1.2.2 细胞基质胶原含量测定 氯胺T法:收集细胞悬液约2 ml,加入带盖试管中,加浓盐酸1.2 ml,110℃烘箱中水解7 h,加40% NaOH 1.2 ml,加水稀释至10 ml,以1 mol/L HCl,4% NaOH调pH值至6。3 000 r/min离心10 min,取上清液1 ml,加水1 ml,0.05 mol/L氯胺T 1.0 ml混匀。25℃水浴,充分振荡2次,加1 ml过氯酸,混匀,置5 min,加10%对二甲氨基苯甲醛1 ml,混匀,60℃水浴20 min。冷却后,用721型分光光度计,在560 nm处比色,读D值。以羟脯氨酸标准液作标准曲线,得出样品中羟脯氨酸的含量(×7.46即为胶原含量)。
, http://www.100md.com
1.2.3 细胞基质蛋白多糖含量测定 Antonopoulos法[4]:取细胞悬液1 ml,放于消化管中,加4 mol/L HCl 0.5 ml,生理盐水0.5 ml,置于烤箱,110℃水解8 h,调pH值至6,加水10 ml,过滤。取滤液0.2 ml,加水0.4 ml,2 mol/L碳酸钠0.4 ml,2%乙酰丙酮0.5 ml,充分混匀,沸水煮20 min,冷却,加无水乙醇1 ml,Ehr氏试剂0.5 ml,混匀充分。以721型分光光度计在530 nm处比色,读D值。用标准N-乙酰葡萄糖胺溶液作标准曲线,得出样品中蛋白多糖的含量。
1.2.4 免疫组化ABC法染色 关节软骨细胞经原代培养铺满后,吸除培养液,用0.25%胰蛋白酶与0.01%EDTA 1∶2消化1 min,离心1 000 r/min,5 min后收集细胞,以PBS洗涤2次,再以微量PBS重悬细胞后,作细胞涂片,用4%多聚甲醛固定20 min,PBS洗3×3 min,吹干后加血清,10 min。加一抗微波处理50 s,放置10 min,再用PBS洗3×3 min;二抗微波处理50 s,放置5 min,PBS洗3×3 min,HRP标记卵白素微波处理50 s,放置5 min。DAB 30 ml+0.3%双氧水50 μl显色10 min,蒸馏水稍洗后,用苏木素衬染1 min,脱水,透明,封片,镜检。
, 百拇医药
1.2.5 SPA-胶金标记免疫电镜研究[5] 同上收集关节软骨细胞,PBS漂洗后用1.25%戊二醛微波固定5~20 s。漂洗后用TGFβ1抗体振荡孵育60 min,35℃,PBS漂洗后用SPA-胶金振荡孵育60 min,35℃,PBS洗后再用2%戊二醛固定30~60 min,即可用血浆将标本凝成块状。上述标本在凝成块状之前均离心,凝成块后按常规电镜标本制备方法,Epon812包埋,超薄切片用醛酸铀、枸橼酸铅染色后即可在电镜下观察。
1.3 统计学处理 数据以
 表示,组间以t检验进行差异显著性检测。
表示,组间以t检验进行差异显著性检测。2 结 果
2.1 FGF明显促进胶原的合成 将FGF以倍比稀释成12.5,25,50,100和200 ng/ml,在每次隔天换液时分别加入5组细胞培养液,共加6次,于第12天收集细胞悬液。以FGF50 ng/ml于细胞换液时加入另5组细胞培养液, 于细胞培养第4,6,8,10和12天依次收集每组细胞悬液。对照组不加FGF。 作羟脯氨酸含量检测, 结果显示FGF能明显促进胶原的合成, 并且与剂量、时间呈正相关(图1A,1B)。


, http://www.100md.com
图1 FGF促进胶原合成的剂量效应关系(A)和时间效应关系(B)
Fig 1 The relation of dose-effect (A) and time-effect (B) on FGF promoting synthesis of collegen
**P<0.01 vs 0 ng/ml; (B)□:Control; ●: FGF 100 ng/ml; △△P<0.01 vs control group
2.2 FGF明显促进蛋白多糖的合成 同2.1方法,结果显示FGF能明显促进蛋白多糖的合成,并且与剂量、时间呈正相关(图2A,2B)。


, http://www.100md.com
图2 FGF促进蛋白多糖合成的剂量效应关系(A)和时间效应关系(B)
Fig 2 The relation of dose-effect (A) and time-effect (B) on FGF promoting synthesis of proteoglycan
*P<0.05,**P<0.01 vs 0 ng/ml; (B)□:Control; ●: FGF 100 ng/ml; △P<0.05, △△P<0.01 vs control group
2.3 免疫组化检测结果 实验中将FGF 100 ng/ml换液时加入细胞培养液,隔天换液,共加FGF6次,结果显示实验组细胞明显呈棕色,而对照组则棕色不明显或呈阴性(图3),说明FGF明显促进TGFβ1的合成。

, http://www.100md.com
图3 免疫组化ABC法检测结果
(×3.3×100×2.5)
Fig 3 Immunohistochamical stainine of ABC show
(×3.3×100×2.5)
A: Contrast cells no brown;
B: Studied cells brown obviously
2.4 免疫组化电镜观察结果 显示实验组细胞膜表面有明显的胶金颗粒粘附,而对照组则较少(图4)。结果表明FGF能促进TGFβ1的合成,而且显示TGFβ1定位于关节软骨细胞膜表面。

, 百拇医药
图4 免疫组化电镜观察结果(醛酸铀、枸橼酸铅染色,A×60 000×2.5)
Fig 4 Immunohistochmical of electron
microscope show (A×60 000×2.5)
A: Contrast cells adhesion less grains of
colloid-gold; B: Studied cells adhesion more
colloid-gold grains
3 讨 论
FGF对软骨细胞具有明显的促有丝分裂作用,在软骨的生长、发育、分化、骨化过程中有重要的调节作用。
, http://www.100md.com
软骨组织通过软骨细胞肥大、透明、成熟以及钙质沉积而骨化。这对骨骼的发育、生长、损伤后的修复是极其重要的。但在关节软骨损伤修复中,过早地钙化以致形成骨赘,不利于软骨损伤的修复。FGF能通过促进软骨细胞合成蛋白多糖来抑制软骨的钙化。当蛋白多糖含量丰富时,能抑制软骨组织的矿物质沉积和钙化。若把分解蛋白多糖的酶加入软骨细胞培养液中,则促进培养细胞的钙化。当关节软骨发生退变、钙化时,蛋白多糖的合成及含量明显下降,这进一步加重了退变性关节炎的发生。在一些富含FGF的组织,如软骨肉瘤中,始终没有骨化,这也支持了FGF能抑制软骨钙化这一结论。本实验显示100 ng/ml FGF能明显促进培养软骨细胞蛋白多糖的合成,且与剂量、时间呈正相关(P<0.01,t检验)。
胶原是软骨基质的重要组成成分,结构呈网状,包纳了软骨细胞及其他基质成分,从而抑制或阻止软骨细胞的成熟与钙化。胶原的破坏、合成降低,必然影响软骨组织的结构及功能。本实验提示FGF能促进胶原合成,在FGF大于100 ng/ml时,作用最明显,也与剂量、时间呈正相关(P<0.01,t检验)。
, http://www.100md.com
本研究将FGF作用于培养兔关节软骨细胞,作链酶素-亲和素放大系统ABC免疫组化研究,结果显示实验组细胞呈明显棕色,而对照组棕色不明显或为阴性。同时,本文还采用免疫胶体金标记组化方法,进一步明确软骨细胞TGFβ1的定位。本研究结果显示,FGF作用于培养兔关节软骨细胞后,细胞膜表面的绒毛上有明显的胶金标记,而对照组则很少。从上述免疫组化研究可见,FGF能促进兔关节软骨细胞TGFβ1的合成。 一般认为,TGFβ1对于未分化的细胞,它是一种促分化生长因子,诱导间质细胞转化为软骨细胞,能促进软骨细胞的复制,但对于比较成熟的软骨细胞,则抑制其分化和增殖。TGFβ1抑制培养中兔关节软骨细胞的终末分化及钙化[6]。
本研究结果表明FGF能促进基质合成及其TGFβ1的表达,抑制关节软骨细胞成熟,具有较为重要的临床意义。
文章编号:0258-879X(1999)10-0773-04
, 百拇医药
参考文献
1 Hunter W. The structure and disease of articulating cartilage[J]. Clin Orthop,1995,11(317):3
2 Guerne PA,Sublet A,Lotz M. Growth factor responsiveness of human articular chondrocytes: distinct profiles in primary chondrocytes, subculture chondrocytes, and fibroblasts[J]. J Cell Physiol,1994,158(3):476
3 姜关祥,胡惠民,陈克明,等. 牛脑两种不同生长因子的纯化和特性[J]. 第二军医大学学报,1992,13(5):488
, http://www.100md.com
4 张惟杰 主编. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社,1994. 23~25
5 颜永碧,夏原耀,陆月良. 游离细胞表面抗原的免疫金标记技术(结合微波固定)[J]. 解剖学杂志, 1992,15(6):471
6 Kato Y, Iwamoto M. Fibroblast growth factor is an inhibitor of chondrocyte terminal differentiation[J]. J Biol Chem,1990,265(10):5903
(1999-02-21收稿,1999-08-05修回), 百拇医药