大蒜素和更昔洛韦抑制巨细胞病毒所致细胞凋亡的实验研究
作者:李红 董永绥 方峰 李革
单位:430030 武汉,同济医科大学附属同济医院儿科
关键词:巨细胞病毒属;脱噬作用;基因;bcl-2;二硫化物类;更西罗韦
中华儿科杂志/990408 【摘要】 目的 探讨抗巨细胞病毒(CMV)药物对CMV感染所致细胞凋亡的影响。方法 将大蒜素作用于CMV感染的人胚肺成纤维细胞(HEL),经凋亡原位末端标记检测和DNA含量流式细胞仪检测。结果 发现大蒜素用药组细胞凋亡发生率低于未用药的病毒感染对照组,但二者差异无显著意义(P>0.05);进一步经原位分子杂交检测和图像分析发现,虽然与病毒感染组相比,大蒜素用药组HEL细胞内bcl-2基因的表达有所增加,fas基因表达减少;但与正常HEL细胞组比较,bcl-2基因的表达仍是明显减低,fas基因表达亦是明显增高的(P<0.01)。结论 大蒜素能影响CMV感染所致的细胞凋亡,但作用较弱。用同样的方法,又对比了更昔洛韦用药组,结果提示更昔洛韦能有效地抑制CMV所诱导的HEL细胞凋亡的发生。
, http://www.100md.com
The inhibitory effect of garlicin and ganciclovir on CMV-induced apoptosis in vitro LI Hong, DONG Yongsui, FANG Feng, et al. Department of Pediatrics, Tongji Hospital, Tongji Medical University. Wuhan, 430030
【Abstract】 Objective To evaluate the effect of garlicin and ganciclovir on CMV-induced apoptosis. Methods The authors detected the CMV-infected human embryonic lung (HEL) fibroblast cells after adding garlicin and ganciclovir with in situ end-labeling (TUNEL) apoptotic cell detection method and flow cytometric cell cycle analysis; they also investigated the expressions of bcl-2 and fas mRNA by means of in situ hybridization techniques and image analysis system. Results There was little change in CMV-induced apoptosis in the group of garlicin. Meanwhile, bcl-2 was upregulated and fas was downregulated compared with the CMV-infected control, but both of them were different from the normal control significantly. Conclusion The effect of garlicin on CMV-induced apoptosis was weak. Nevertheless, ganciclovir could inhibit CMV-induced apoptosis effectively.
, 百拇医药
【Key words】 Cytomegalovirus Apoptosis Genes, bcl-2 Disulfides Ganciclovir
巨细胞病毒(CMV)感染在世界范围内广为传播,至今仍缺乏安全高效的抗CMV药物。通过抗CMV药物的体外实验研究,我们筛选出大蒜素及更昔洛韦(GCV)对CMV AD169和临床分离株均有明显抑制作用。更昔洛韦作为一种化学制剂,其抗CMV作用机理已十分明确,即它被CMV感染的细胞产生的GCV-三磷酸盐(GCV-TP)诱导活化,而发挥对CMV DNA多聚酶的抑制作用。而大蒜素这一中药制剂,由于其组成成分的复杂性,使其抗病毒作用机理难以阐明。我们通过检测药物对CMV感染所致细胞凋亡的影响,以期从细胞凋亡这一角度对大蒜素的抗CMV机理加以阐述。
材料和方法
一、材料
, http://www.100md.com
1.细胞:自制人胚肺成纤维细胞(HEL),取自妊娠4个月水囊引产的胚胎,经常规原代细胞培养方法,制成单层细胞,第10~20代用于本实验。
2.标准病毒株:CMV AD169病毒株,由中国预防医学科学院病毒研究所提供。
3.临床分离株:从CMV性肝炎患儿及无症状感染者尿中分离的CMV 7株(来自不同患婴),传代次数少于10代,分别编号H1,H2,H3,H4,H5,H6,H7。
4.药物:大蒜素,由湖北医科大学药房生产,批号951044。更昔洛韦,由湖北省医药工业研究所提供。
5.探针来源:含bcl-2 cDNA及fas-cDNA片段的质粒由同济医科大学免疫教研室惠赠。bcl-2 cDNA片段长度为2.0 kb,于EcoR Ⅰ单酶切位点插入载体Bluescript质粒中,经氯化钙渗透法转化入JM101菌株;fas-cDNA片段长度为2.3 kb,于BamHI及XBal酶切位点插入载体pUC18,经氯化钙渗透法转化TG1菌株,再按常规方法提取质粒DNA,经酶切,回收,纯化后,获得bcl-2及fas cDNA探针。
, 百拇医药
6.试剂:抗巨细胞病毒即刻早期抗原(CMV-IEA)单抗由美国UAB儿童医院Britt教授提供(1∶100);细胞凋亡原位检测试剂盒及地高辛标记检测试剂盒购自德国Boehringer Mannheim公司。
二、方法
1.细胞毒性实验:根据Mosmann建立的四甲基偶氮唑盐(MTT)法检测药物细胞毒性[1]。具体方法是:用胰酶将HEL细胞分散成单个细胞悬液,按1×105/ml浓度分种于96孔板,24小时后换含不同浓度药物培养液,隔天换新鲜含药培养液,共3次。同时设不加药物的对照孔。12天后去掉培养液,加入含5 mg/ml MTT的无血清培养液,每孔100 μl,37℃,5%CO2箱内置4小时后,弃上清,加入二甲亚砜(DMSO),每孔100 μl,混匀,5~10分钟后,置96孔酶标测定仪上,测570 nm波长下的吸光度A值(曾称光密度OD)。找出细胞对药物的最大耐受浓度(MTC)。
, http://www.100md.com
2.流式细胞仪检测细胞CMV-IEA:将HEL细胞按1×105/ml分种于内含飞片的24孔板,感染病毒2小时后,换含药培养液,同时设不加药物的病毒对照,24小时后,弃上清,用0.01 mol pH 7.4的磷酸盐缓冲液(PBS)洗2次,0.25%胰酶消化3~5分钟后,弃消化液,加Hanks液,用吸管将细胞轻轻吹打下来,并移入离心管中,800~1 000 r/min,离心5分钟,弃上清,用PBS洗2次后,加入CMV-IEA单抗(1∶100),37℃,30分钟,再用PBS洗2次后,加入荧光素标记的第二抗体(兔抗鼠IgG-FITC 1∶50),37℃,孵育30分钟,PBS洗3次,置测定管,应用流式细胞仪(美国BD公司)测定荧光强度。
3.细胞培养及病毒感染:将HEL细胞按1×105/ml分种于内含飞片的24孔板,待细胞成片后,按100倍半数组织培养感染量(TCID50)/0.1 ml浓度接种CMV AD169病毒,37℃,5%CO2箱内吸附2小时,弃上清,用含2%小牛血清的培养液洗涤1次,再分别加入含MTC浓度不同药物的新鲜培养液,继续在上述条件下培养,隔天换液一次,同时设正常细胞对照组及病毒感染对照组。待病毒对照组细胞出现典型病变时,取出小飞片,PBS洗1次,风干,置4%多聚甲醛内,室温下固定30分钟后,常规乙醇逐级脱水,4℃保存;同时用0.25%胰酶将培养孔内细胞消化下来,制成单细胞悬液,800 r/min,离心5分钟,弃上清,细胞沉淀用PBS洗2次,用70%冷乙醇固定,4℃保存。
, http://www.100md.com
4.凋亡细胞原位检测:用PBS(pH 7.4)将经4%多聚甲醛固定的细胞飞片洗5分钟,3次;再用含0.3%H2O2的甲醇浸泡,高温下30分钟,PBS洗3次后,浸入4℃预冷的含0.1% Triton X-100的0.1%枸橼酸钠液中2分钟;PBS洗2次,擦干标本周边。加入50 μl反应液即5 μl 10×末端脱氧核苷酸转移酶溶液及45 μl dNTP反应混合液(TUNEL反应液,用前现配),盖上盖玻片,37℃湿盒内孵育1小时,PBS洗5分钟,3次,擦干标本周边,每片滴加50 μl抗体-过氧化物酶联结物,37℃湿盒内30分钟,PBS洗5分钟,3次;加入50 μl二胺基联苯胺(DAB)底物显色液,室温下显色10分钟,PBS洗5分钟,3次,常规脱水,透明后,封片镜检。显微镜下,胞核黄色着染者为阳性凋亡细胞。阳性对照:用DNaseⅠ(20 μg/ml)在室温下处理细胞片,以诱导DNA链的断裂。阴性对照:加入的TUNEL反应液中不含末端脱氧核苷酸转移酶。每张飞片至少观察500个细胞,计算凋亡发生率。
, 百拇医药
5.DNA含量的流式细胞仪测定:经70%冷乙醇固定的HEL单细胞悬液用pH 7.4的PBS洗,离心后去除固定液,加碘化丙锭(PI)染色液(含50 μg/ml PI,0.1% Triton X-100,100 μg/ml RNase A)混匀,4℃,避光30分钟后,应用流式细胞仪检测,低于G1期DNA含量主峰(亚G1期峰)的细胞为凋亡细胞。
6.bcl-2和fas基因mRNA表达:采用原位杂交技术参考文献[2,3]加以改进,将细胞飞片经4%多聚甲醛固定5分钟后,乙醇梯度脱水,37℃湿盒内预杂交2小时后,滴加杂交液(其中的探针预先经98℃变性后,立即置冰中5分钟,再加入到预杂交液中,探针终浓度为2 ng/μl),42℃湿盒内杂交36小时,再加入地高辛-辣根过氧化物酶(1∶500),37℃湿盒内1小时,然后按试剂盒说明进行显色,结果满意后,经PBS-焦磷酸二乙酯(DEPC)水洗终止,乙醇梯度脱水,二甲苯透明树胶封片镜检。设不加探针的阴性对照和RNase处理后的阴性对照。杂交结果进行计算机图像分析处理。
, 百拇医药
三、统计学处理
数据以均数±标准差( ±s)表示,采用t或χ2检验进行比较分析,P<0.05时,差别有显著意义。
±s)表示,采用t或χ2检验进行比较分析,P<0.05时,差别有显著意义。
结果
一、药物对细胞的毒性作用
将每种药物用维持液进行一系列稀释后,分别加入单层HEL细胞培养。结果当大蒜素浓度为7.5 μg/ml和更昔洛韦10 μg/ml时,细胞形态与对照正常细胞组相同,经MTT法检测,其A570nm值与正常细胞对照组A值一致。当超过该浓度时,则出现细胞变圆,大小不一,皱缩等典型细胞毒性反应。由此确定上述各药物浓度为实验的最高允许浓度。
二、大蒜素及更昔洛韦对CMV AD169毒株IEA的影响
, 百拇医药
将药物自最大耐受浓度开始,除大蒜素第一次半倍稀释外,其它各药用维持液进行倍比稀释,每种药物选择5种浓度。结果显示,各药物均在其MTC浓度时,对CMV-IEA抑制作用最强,即大蒜素为57.2%,更昔洛韦为94.5%(表1);且经统计学处理,药物的浓度与CMV-IEA抑制率均呈明显正相关性,相关系数分别为大蒜素0.994,更昔洛韦0.958。
表1 大蒜素与更昔洛韦对CMV AD169的IEA抑制率 药名
不同剂量药物对AD169的IEA抑制率
剂量
(μg/ml)
抑制率
(%)
, 百拇医药
剂量
(μg/ml)
抑制率
(%)
剂量
(μg/ml)
抑制率
(%)
剂量
(μg/ml)
抑制率
(%)
剂量
, 百拇医药
(μg/ml)
抑制率
(%)
大蒜素
7.5
57.2
5
40.7
2.5
23.6
1.25
10.3
0.625
, 百拇医药
2.5
更昔洛韦
10
94.5
5
81.2
2.5
64.4
1.25
55.7
0.625
45.2
三、大蒜素及更昔洛韦对分离毒株IEA的影响
, http://www.100md.com
将MTC浓度的大蒜素及更昔洛韦分别作用于7株临床分离毒株,同时设AD169毒株对照。结果显示,大蒜素对临床分离株有抑制作用,其平均抗原抑制率为58.4%,与对AD169抗原抑制率60.47%比较,P>0.05,差别无显著性意义;更昔洛韦对分离毒株的平均抗原抑制率为89.40%,与对AD169抗原抑制率87.07%相比,P>0.05,差别亦无显著性意义(表2)。
表2 大蒜素及更昔洛韦对不同CMV分离毒株IEA的抑制率 药名
不同病毒株CMV-IEA的抑制率(%)
AD169
分离株
H1
, 百拇医药
H2
H3
H4
H5
H6
H7
大蒜素
60.47
58.4
61.7
43.3
57.1
, http://www.100md.com
64.4
66.7
52.9
62.7
更昔洛韦
87.07
89.4
90.3
87.9
88.2
91.3
90.1
89.5
, http://www.100md.com
88.5
四、凋亡原位末端标记检测结果
阳性凋亡细胞表现为细胞核浓缩,多聚集于核膜,呈境界分明的颗粒状或新月状小体,为棕褐色着染;部分细胞胞浆可能因核DNA碎片的逸出呈阳性着染。结果显示:(1)正常细胞对照组:光镜下正常细胞呈梭形排列,阳性凋亡细胞呈单个散在分布,阳性率为3.7%(图1a);(2)病毒感染对照组:光镜下受CMV感染的成纤维细胞变大、变圆,阳性细胞多为病毒感染细胞,阳性率为34.4%(图1b);(3)大蒜素用药组:由于药物有抗CMV作用,光镜下受CMV感染而出现细胞病变的HEL细胞较病毒对照组减少,阳性凋亡细胞数亦减少,阳性率为26.4%(图1c)。但大蒜素用药组与病毒感染对照组比较,经χ2检验,P>0.05,差异无显著性意义。
图1 HEL细胞凋亡原位检测
, http://www.100md.com
1a.正常HEL细胞,呈梭形排列,阳性凋亡细胞单个散在分布;
1b.CMV感染的HEL细胞,细胞变大,变圆,阳性细胞多为发生病变的病毒感染细胞;
1c.大蒜素用药组 光镜下受CMV感染而出现细胞病变的HEL细胞较病毒对照组
减少,阳性凋亡细胞数亦减少(×120)
五、DNA含量流式细胞仪检测结果
正常细胞组在DNA直方图上显示出G0/G1,S,G2,M期(图2a);病毒感染组则在G1峰左侧有一亚二倍体细胞群的峰型(亚G1峰),提示细胞凋亡(图2b);而两用药组,虽有亚G1峰,但较低平(图2c,2d)。经χ2检验,大蒜素用药组凋亡发生率28.7%与病毒感染对照组33.2%比较,差异无显著性意义(P>0.05);更昔洛韦用药组凋亡发生率19.4%明显低于病毒感染对照组(P<0.05)。正常细胞对照组凋亡发生率为3.1%。

, 百拇医药
2a:正常HEL细胞周期;
2b:CMV感染的HEL细胞在G1峰左侧可见一个典型的凋亡峰型(亚G1峰);
2c:大蒜素用药组;2d:更昔洛韦用药组
图2 DNA含量流式细胞仪检测结果
六、bcl-2和fas基因mRNA的表达
经计算机图像分析,CMV感染组与正常细胞对照组bcl-2和fas基因mRNA的表达水平比较见表3。结果显示,正常人胚肺成纤维细胞高表达bcl-2,低表达fas(图3a,4a);受CMV感染后,HEL细胞的bcl-2表达水平下调,而fas表达则明显增强(图3b,4b)。大蒜素用药组bcl-2的表达水平明显高于病毒感染组(P<0.01);同时fas的表达水平明显低于病毒感染组(P<0.1)(图3c,4c)。将大蒜素用药组与正常HEL细胞对照组比较,bcl-2的表达水平明显降低,fas的表达水平也明显增高(P均小于0.01)。
, 百拇医药
表3 各组HEL细胞内bcl-2和fas基因
mRNA表达比较( ±s) 组别
±s) 组别
平均积分光度
bcl-2表达
fas表达
正常HEL细胞组
9.52±0.20*
2.45±0.12*
CMV感染组
1.72±0.19*
, 百拇医药
8.42±0.15*
大蒜素用药组
6.60±0.13**
3.20±0.11**
* CMV感染组,大蒜素用药组与正常HEL细胞组比较P<0.01;**CMV感染组与大蒜素用药组比较P<0.01
图3 原位杂交bcl-2基因mRNA表达情况
3a.正常HEL细胞;3b.CMV感染的HEL细胞;3c.大蒜素用药组(×120)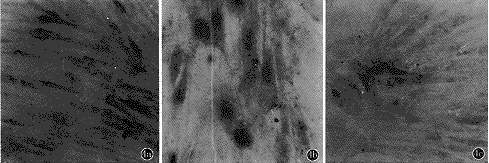
, 百拇医药
图4 原位杂交fas基因mRNA表达情况
4a.正常HEL细胞;4b.CMV感染的HEL细胞;4c.大蒜素用药组(×120)
讨论
一、大蒜素具有良好的抗病毒活性
大蒜作为传统的有效食物已有悠久的历史,近代研究已证明其有多方面的医疗作用[4]。大蒜的抗细菌及抗真菌等作用国内外已有众多研究[4],此外,其抗病毒作用亦日益受到重视。Yen[5]的研究说明大蒜对流感B型病毒及单纯疱疹Ⅰ型病毒有明显的体外抑制作用,而对柯萨奇病毒作用不显著;郭乃榄等[6]发现大蒜素在体外能有效地抑制CMV;在我们的实验中亦进一步证实了大蒜素对CMV临床分离株的抑制作用。从而提示,大蒜素这一中药制剂具有良好的抗病毒活性。但其作用机理尚未阐明。
, 百拇医药
二、大蒜素对CMV感染所致细胞凋亡的影响
细胞凋亡是单个细胞受其内在基因编程调节,通过主动的生化过程,而自杀死亡的现象[7]。凋亡规律失常已被认为是许多疾病的重要发病机制。近年研究发现,许多病毒性疾病(如病毒性肝炎,艾滋病等)的发生与细胞凋亡有关[8]。我们在体内外均证实CMV感染可诱导细胞凋亡异常增加[9],而这种凋亡规律的紊乱可能参与了CMV性疾病的发生和发展。大蒜素对由CMV感染所致的细胞凋亡有无影响,我们做了一些相关探讨。经凋亡原位末端标记检测和DNA含量流式细胞仪检测,大蒜素用药组细胞凋亡发生率为28.7%,较未用药的病毒感染对照组33.2%为低,但经χ2检验,二者差异无显著性意义(P>0.05)。我们选择目前研究较为深入的两个凋亡调控基因bcl-2和fas[10,11]作为进一步检测对象,经原位分子杂交检测和图像分析发现,虽然与病毒感染组相比,大蒜素用药组HEL细胞内bcl-2基因的表达有所增加,fas基因表达减少;但与正常HEL细胞组比较,bcl-2基因的表达仍是明显减低,fas基因表达亦是明显增高的(P<0.01)。从而证实,大蒜素能影响CMV感染所致的细胞凋亡,但作用较弱。用同样的方法,我们又检测了更昔洛韦用药组凋亡发生情况为19.4%,与未用药的病毒对照组比较,P<0.05,提示更昔洛韦能有效地抑制CMV所诱导的人胚肺细胞凋亡的发生。
, 百拇医药
三、有待深入研究的问题
大蒜素与更昔洛韦均有抗CMV活性,更昔洛韦能明显减少CMV所诱导的细胞凋亡的发生,而大蒜素对这种凋亡现象却影响不大,由此推测,大蒜素的抗CMV机制可能与更昔洛韦不同。在MTC浓度时,更昔洛韦的CMV-IEA抑制率达90%左右,而大蒜素的最大CMV-IEA抑制率为60%左右,是这种抗CMV活性的差异造成了二种药物对凋亡影响的不同,抑或还存在其他更复杂的机制,还值得深入研究。
参考文献
1 Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Meth, 1983, 65:55-61.
, 百拇医药 2 Brigati DJ, Myerson D, Leary JJ, et al. Detection of viral genomes in cultured cells and paraffin-embedded tissue sections using biotin-labeled hybridization probes. Virology, 1983, 126:32-50.
3 Polak JM, McGee JO. In situ hybridization: principles and practice. New York: Oxford, 1990. 59-73.
4 Abuliah TH1. Garlic revisited: therapeutic for the major disease of our time? J Natl Med Asso, 1988, 80:439-445.
, http://www.100md.com
5 Yen Tsai. Antiviral properties of garlic: in vitro effects on influenza B, herpes simplex and coxsackie viruses. Planta Medical, 1985, 5:460-468.
6 郭乃榄,陆道培,周桂珍,等.大蒜提取物体外抑制巨细胞病毒的研究.中华实验和临床病毒学杂志,1991,5:58-60.
7 Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide ranging implications in tissues kinetics. Br J Cancer, 1972, 26:239-257.
8 Peter T, Gores G. Apoptosis and hepatobiliary disease. Hepatology, 1995, 21:1725-1741.
, 百拇医药
9 李红,董永绥,方峰,等.巨细胞病毒感染对细胞凋亡及bcl-2和fas基因表达的影响初探.中华儿科杂志,1998,36:645-648.
10 Korsmeyer SJ. Bcl-2 initates a new category of oncogenes: regulators of cell death. Blood, 1992, 80:879-886.
11 Martin SJ, Green DR. Protease activation during apoptosis: death by a thousand cuts? Cell, 1995, 82:349-353.
(收稿:1998-05-14 修回:1998-08-20), 百拇医药
单位:430030 武汉,同济医科大学附属同济医院儿科
关键词:巨细胞病毒属;脱噬作用;基因;bcl-2;二硫化物类;更西罗韦
中华儿科杂志/990408 【摘要】 目的 探讨抗巨细胞病毒(CMV)药物对CMV感染所致细胞凋亡的影响。方法 将大蒜素作用于CMV感染的人胚肺成纤维细胞(HEL),经凋亡原位末端标记检测和DNA含量流式细胞仪检测。结果 发现大蒜素用药组细胞凋亡发生率低于未用药的病毒感染对照组,但二者差异无显著意义(P>0.05);进一步经原位分子杂交检测和图像分析发现,虽然与病毒感染组相比,大蒜素用药组HEL细胞内bcl-2基因的表达有所增加,fas基因表达减少;但与正常HEL细胞组比较,bcl-2基因的表达仍是明显减低,fas基因表达亦是明显增高的(P<0.01)。结论 大蒜素能影响CMV感染所致的细胞凋亡,但作用较弱。用同样的方法,又对比了更昔洛韦用药组,结果提示更昔洛韦能有效地抑制CMV所诱导的HEL细胞凋亡的发生。
, http://www.100md.com
The inhibitory effect of garlicin and ganciclovir on CMV-induced apoptosis in vitro LI Hong, DONG Yongsui, FANG Feng, et al. Department of Pediatrics, Tongji Hospital, Tongji Medical University. Wuhan, 430030
【Abstract】 Objective To evaluate the effect of garlicin and ganciclovir on CMV-induced apoptosis. Methods The authors detected the CMV-infected human embryonic lung (HEL) fibroblast cells after adding garlicin and ganciclovir with in situ end-labeling (TUNEL) apoptotic cell detection method and flow cytometric cell cycle analysis; they also investigated the expressions of bcl-2 and fas mRNA by means of in situ hybridization techniques and image analysis system. Results There was little change in CMV-induced apoptosis in the group of garlicin. Meanwhile, bcl-2 was upregulated and fas was downregulated compared with the CMV-infected control, but both of them were different from the normal control significantly. Conclusion The effect of garlicin on CMV-induced apoptosis was weak. Nevertheless, ganciclovir could inhibit CMV-induced apoptosis effectively.
, 百拇医药
【Key words】 Cytomegalovirus Apoptosis Genes, bcl-2 Disulfides Ganciclovir
巨细胞病毒(CMV)感染在世界范围内广为传播,至今仍缺乏安全高效的抗CMV药物。通过抗CMV药物的体外实验研究,我们筛选出大蒜素及更昔洛韦(GCV)对CMV AD169和临床分离株均有明显抑制作用。更昔洛韦作为一种化学制剂,其抗CMV作用机理已十分明确,即它被CMV感染的细胞产生的GCV-三磷酸盐(GCV-TP)诱导活化,而发挥对CMV DNA多聚酶的抑制作用。而大蒜素这一中药制剂,由于其组成成分的复杂性,使其抗病毒作用机理难以阐明。我们通过检测药物对CMV感染所致细胞凋亡的影响,以期从细胞凋亡这一角度对大蒜素的抗CMV机理加以阐述。
材料和方法
一、材料
, http://www.100md.com
1.细胞:自制人胚肺成纤维细胞(HEL),取自妊娠4个月水囊引产的胚胎,经常规原代细胞培养方法,制成单层细胞,第10~20代用于本实验。
2.标准病毒株:CMV AD169病毒株,由中国预防医学科学院病毒研究所提供。
3.临床分离株:从CMV性肝炎患儿及无症状感染者尿中分离的CMV 7株(来自不同患婴),传代次数少于10代,分别编号H1,H2,H3,H4,H5,H6,H7。
4.药物:大蒜素,由湖北医科大学药房生产,批号951044。更昔洛韦,由湖北省医药工业研究所提供。
5.探针来源:含bcl-2 cDNA及fas-cDNA片段的质粒由同济医科大学免疫教研室惠赠。bcl-2 cDNA片段长度为2.0 kb,于EcoR Ⅰ单酶切位点插入载体Bluescript质粒中,经氯化钙渗透法转化入JM101菌株;fas-cDNA片段长度为2.3 kb,于BamHI及XBal酶切位点插入载体pUC18,经氯化钙渗透法转化TG1菌株,再按常规方法提取质粒DNA,经酶切,回收,纯化后,获得bcl-2及fas cDNA探针。
, 百拇医药
6.试剂:抗巨细胞病毒即刻早期抗原(CMV-IEA)单抗由美国UAB儿童医院Britt教授提供(1∶100);细胞凋亡原位检测试剂盒及地高辛标记检测试剂盒购自德国Boehringer Mannheim公司。
二、方法
1.细胞毒性实验:根据Mosmann建立的四甲基偶氮唑盐(MTT)法检测药物细胞毒性[1]。具体方法是:用胰酶将HEL细胞分散成单个细胞悬液,按1×105/ml浓度分种于96孔板,24小时后换含不同浓度药物培养液,隔天换新鲜含药培养液,共3次。同时设不加药物的对照孔。12天后去掉培养液,加入含5 mg/ml MTT的无血清培养液,每孔100 μl,37℃,5%CO2箱内置4小时后,弃上清,加入二甲亚砜(DMSO),每孔100 μl,混匀,5~10分钟后,置96孔酶标测定仪上,测570 nm波长下的吸光度A值(曾称光密度OD)。找出细胞对药物的最大耐受浓度(MTC)。

, http://www.100md.com
2.流式细胞仪检测细胞CMV-IEA:将HEL细胞按1×105/ml分种于内含飞片的24孔板,感染病毒2小时后,换含药培养液,同时设不加药物的病毒对照,24小时后,弃上清,用0.01 mol pH 7.4的磷酸盐缓冲液(PBS)洗2次,0.25%胰酶消化3~5分钟后,弃消化液,加Hanks液,用吸管将细胞轻轻吹打下来,并移入离心管中,800~1 000 r/min,离心5分钟,弃上清,用PBS洗2次后,加入CMV-IEA单抗(1∶100),37℃,30分钟,再用PBS洗2次后,加入荧光素标记的第二抗体(兔抗鼠IgG-FITC 1∶50),37℃,孵育30分钟,PBS洗3次,置测定管,应用流式细胞仪(美国BD公司)测定荧光强度。
3.细胞培养及病毒感染:将HEL细胞按1×105/ml分种于内含飞片的24孔板,待细胞成片后,按100倍半数组织培养感染量(TCID50)/0.1 ml浓度接种CMV AD169病毒,37℃,5%CO2箱内吸附2小时,弃上清,用含2%小牛血清的培养液洗涤1次,再分别加入含MTC浓度不同药物的新鲜培养液,继续在上述条件下培养,隔天换液一次,同时设正常细胞对照组及病毒感染对照组。待病毒对照组细胞出现典型病变时,取出小飞片,PBS洗1次,风干,置4%多聚甲醛内,室温下固定30分钟后,常规乙醇逐级脱水,4℃保存;同时用0.25%胰酶将培养孔内细胞消化下来,制成单细胞悬液,800 r/min,离心5分钟,弃上清,细胞沉淀用PBS洗2次,用70%冷乙醇固定,4℃保存。
, http://www.100md.com
4.凋亡细胞原位检测:用PBS(pH 7.4)将经4%多聚甲醛固定的细胞飞片洗5分钟,3次;再用含0.3%H2O2的甲醇浸泡,高温下30分钟,PBS洗3次后,浸入4℃预冷的含0.1% Triton X-100的0.1%枸橼酸钠液中2分钟;PBS洗2次,擦干标本周边。加入50 μl反应液即5 μl 10×末端脱氧核苷酸转移酶溶液及45 μl dNTP反应混合液(TUNEL反应液,用前现配),盖上盖玻片,37℃湿盒内孵育1小时,PBS洗5分钟,3次,擦干标本周边,每片滴加50 μl抗体-过氧化物酶联结物,37℃湿盒内30分钟,PBS洗5分钟,3次;加入50 μl二胺基联苯胺(DAB)底物显色液,室温下显色10分钟,PBS洗5分钟,3次,常规脱水,透明后,封片镜检。显微镜下,胞核黄色着染者为阳性凋亡细胞。阳性对照:用DNaseⅠ(20 μg/ml)在室温下处理细胞片,以诱导DNA链的断裂。阴性对照:加入的TUNEL反应液中不含末端脱氧核苷酸转移酶。每张飞片至少观察500个细胞,计算凋亡发生率。
, 百拇医药
5.DNA含量的流式细胞仪测定:经70%冷乙醇固定的HEL单细胞悬液用pH 7.4的PBS洗,离心后去除固定液,加碘化丙锭(PI)染色液(含50 μg/ml PI,0.1% Triton X-100,100 μg/ml RNase A)混匀,4℃,避光30分钟后,应用流式细胞仪检测,低于G1期DNA含量主峰(亚G1期峰)的细胞为凋亡细胞。
6.bcl-2和fas基因mRNA表达:采用原位杂交技术参考文献[2,3]加以改进,将细胞飞片经4%多聚甲醛固定5分钟后,乙醇梯度脱水,37℃湿盒内预杂交2小时后,滴加杂交液(其中的探针预先经98℃变性后,立即置冰中5分钟,再加入到预杂交液中,探针终浓度为2 ng/μl),42℃湿盒内杂交36小时,再加入地高辛-辣根过氧化物酶(1∶500),37℃湿盒内1小时,然后按试剂盒说明进行显色,结果满意后,经PBS-焦磷酸二乙酯(DEPC)水洗终止,乙醇梯度脱水,二甲苯透明树胶封片镜检。设不加探针的阴性对照和RNase处理后的阴性对照。杂交结果进行计算机图像分析处理。
, 百拇医药
三、统计学处理
数据以均数±标准差(
 ±s)表示,采用t或χ2检验进行比较分析,P<0.05时,差别有显著意义。
±s)表示,采用t或χ2检验进行比较分析,P<0.05时,差别有显著意义。结果
一、药物对细胞的毒性作用
将每种药物用维持液进行一系列稀释后,分别加入单层HEL细胞培养。结果当大蒜素浓度为7.5 μg/ml和更昔洛韦10 μg/ml时,细胞形态与对照正常细胞组相同,经MTT法检测,其A570nm值与正常细胞对照组A值一致。当超过该浓度时,则出现细胞变圆,大小不一,皱缩等典型细胞毒性反应。由此确定上述各药物浓度为实验的最高允许浓度。
二、大蒜素及更昔洛韦对CMV AD169毒株IEA的影响
, 百拇医药
将药物自最大耐受浓度开始,除大蒜素第一次半倍稀释外,其它各药用维持液进行倍比稀释,每种药物选择5种浓度。结果显示,各药物均在其MTC浓度时,对CMV-IEA抑制作用最强,即大蒜素为57.2%,更昔洛韦为94.5%(表1);且经统计学处理,药物的浓度与CMV-IEA抑制率均呈明显正相关性,相关系数分别为大蒜素0.994,更昔洛韦0.958。
表1 大蒜素与更昔洛韦对CMV AD169的IEA抑制率 药名
不同剂量药物对AD169的IEA抑制率
剂量
(μg/ml)
抑制率
(%)
, 百拇医药
剂量
(μg/ml)
抑制率
(%)
剂量
(μg/ml)
抑制率
(%)
剂量
(μg/ml)
抑制率
(%)
剂量
, 百拇医药
(μg/ml)
抑制率
(%)
大蒜素
7.5
57.2
5
40.7
2.5
23.6
1.25
10.3
0.625
, 百拇医药
2.5
更昔洛韦
10
94.5
5
81.2
2.5
64.4
1.25
55.7
0.625
45.2
三、大蒜素及更昔洛韦对分离毒株IEA的影响
, http://www.100md.com
将MTC浓度的大蒜素及更昔洛韦分别作用于7株临床分离毒株,同时设AD169毒株对照。结果显示,大蒜素对临床分离株有抑制作用,其平均抗原抑制率为58.4%,与对AD169抗原抑制率60.47%比较,P>0.05,差别无显著性意义;更昔洛韦对分离毒株的平均抗原抑制率为89.40%,与对AD169抗原抑制率87.07%相比,P>0.05,差别亦无显著性意义(表2)。
表2 大蒜素及更昔洛韦对不同CMV分离毒株IEA的抑制率 药名
不同病毒株CMV-IEA的抑制率(%)
AD169
分离株
H1
, 百拇医药
H2
H3
H4
H5
H6
H7
大蒜素
60.47
58.4
61.7
43.3
57.1
, http://www.100md.com
64.4
66.7
52.9
62.7
更昔洛韦
87.07
89.4
90.3
87.9
88.2
91.3
90.1
89.5
, http://www.100md.com
88.5
四、凋亡原位末端标记检测结果
阳性凋亡细胞表现为细胞核浓缩,多聚集于核膜,呈境界分明的颗粒状或新月状小体,为棕褐色着染;部分细胞胞浆可能因核DNA碎片的逸出呈阳性着染。结果显示:(1)正常细胞对照组:光镜下正常细胞呈梭形排列,阳性凋亡细胞呈单个散在分布,阳性率为3.7%(图1a);(2)病毒感染对照组:光镜下受CMV感染的成纤维细胞变大、变圆,阳性细胞多为病毒感染细胞,阳性率为34.4%(图1b);(3)大蒜素用药组:由于药物有抗CMV作用,光镜下受CMV感染而出现细胞病变的HEL细胞较病毒对照组减少,阳性凋亡细胞数亦减少,阳性率为26.4%(图1c)。但大蒜素用药组与病毒感染对照组比较,经χ2检验,P>0.05,差异无显著性意义。

图1 HEL细胞凋亡原位检测
, http://www.100md.com
1a.正常HEL细胞,呈梭形排列,阳性凋亡细胞单个散在分布;
1b.CMV感染的HEL细胞,细胞变大,变圆,阳性细胞多为发生病变的病毒感染细胞;
1c.大蒜素用药组 光镜下受CMV感染而出现细胞病变的HEL细胞较病毒对照组
减少,阳性凋亡细胞数亦减少(×120)
五、DNA含量流式细胞仪检测结果
正常细胞组在DNA直方图上显示出G0/G1,S,G2,M期(图2a);病毒感染组则在G1峰左侧有一亚二倍体细胞群的峰型(亚G1峰),提示细胞凋亡(图2b);而两用药组,虽有亚G1峰,但较低平(图2c,2d)。经χ2检验,大蒜素用药组凋亡发生率28.7%与病毒感染对照组33.2%比较,差异无显著性意义(P>0.05);更昔洛韦用药组凋亡发生率19.4%明显低于病毒感染对照组(P<0.05)。正常细胞对照组凋亡发生率为3.1%。


, 百拇医药
2a:正常HEL细胞周期;
2b:CMV感染的HEL细胞在G1峰左侧可见一个典型的凋亡峰型(亚G1峰);
2c:大蒜素用药组;2d:更昔洛韦用药组
图2 DNA含量流式细胞仪检测结果
六、bcl-2和fas基因mRNA的表达
经计算机图像分析,CMV感染组与正常细胞对照组bcl-2和fas基因mRNA的表达水平比较见表3。结果显示,正常人胚肺成纤维细胞高表达bcl-2,低表达fas(图3a,4a);受CMV感染后,HEL细胞的bcl-2表达水平下调,而fas表达则明显增强(图3b,4b)。大蒜素用药组bcl-2的表达水平明显高于病毒感染组(P<0.01);同时fas的表达水平明显低于病毒感染组(P<0.1)(图3c,4c)。将大蒜素用药组与正常HEL细胞对照组比较,bcl-2的表达水平明显降低,fas的表达水平也明显增高(P均小于0.01)。
, 百拇医药
表3 各组HEL细胞内bcl-2和fas基因
mRNA表达比较(
 ±s) 组别
±s) 组别平均积分光度
bcl-2表达
fas表达
正常HEL细胞组
9.52±0.20*
2.45±0.12*
CMV感染组
1.72±0.19*
, 百拇医药
8.42±0.15*
大蒜素用药组
6.60±0.13**
3.20±0.11**
* CMV感染组,大蒜素用药组与正常HEL细胞组比较P<0.01;**CMV感染组与大蒜素用药组比较P<0.01

图3 原位杂交bcl-2基因mRNA表达情况
3a.正常HEL细胞;3b.CMV感染的HEL细胞;3c.大蒜素用药组(×120)

, 百拇医药
图4 原位杂交fas基因mRNA表达情况
4a.正常HEL细胞;4b.CMV感染的HEL细胞;4c.大蒜素用药组(×120)
讨论
一、大蒜素具有良好的抗病毒活性
大蒜作为传统的有效食物已有悠久的历史,近代研究已证明其有多方面的医疗作用[4]。大蒜的抗细菌及抗真菌等作用国内外已有众多研究[4],此外,其抗病毒作用亦日益受到重视。Yen[5]的研究说明大蒜对流感B型病毒及单纯疱疹Ⅰ型病毒有明显的体外抑制作用,而对柯萨奇病毒作用不显著;郭乃榄等[6]发现大蒜素在体外能有效地抑制CMV;在我们的实验中亦进一步证实了大蒜素对CMV临床分离株的抑制作用。从而提示,大蒜素这一中药制剂具有良好的抗病毒活性。但其作用机理尚未阐明。
, 百拇医药
二、大蒜素对CMV感染所致细胞凋亡的影响
细胞凋亡是单个细胞受其内在基因编程调节,通过主动的生化过程,而自杀死亡的现象[7]。凋亡规律失常已被认为是许多疾病的重要发病机制。近年研究发现,许多病毒性疾病(如病毒性肝炎,艾滋病等)的发生与细胞凋亡有关[8]。我们在体内外均证实CMV感染可诱导细胞凋亡异常增加[9],而这种凋亡规律的紊乱可能参与了CMV性疾病的发生和发展。大蒜素对由CMV感染所致的细胞凋亡有无影响,我们做了一些相关探讨。经凋亡原位末端标记检测和DNA含量流式细胞仪检测,大蒜素用药组细胞凋亡发生率为28.7%,较未用药的病毒感染对照组33.2%为低,但经χ2检验,二者差异无显著性意义(P>0.05)。我们选择目前研究较为深入的两个凋亡调控基因bcl-2和fas[10,11]作为进一步检测对象,经原位分子杂交检测和图像分析发现,虽然与病毒感染组相比,大蒜素用药组HEL细胞内bcl-2基因的表达有所增加,fas基因表达减少;但与正常HEL细胞组比较,bcl-2基因的表达仍是明显减低,fas基因表达亦是明显增高的(P<0.01)。从而证实,大蒜素能影响CMV感染所致的细胞凋亡,但作用较弱。用同样的方法,我们又检测了更昔洛韦用药组凋亡发生情况为19.4%,与未用药的病毒对照组比较,P<0.05,提示更昔洛韦能有效地抑制CMV所诱导的人胚肺细胞凋亡的发生。
, 百拇医药
三、有待深入研究的问题
大蒜素与更昔洛韦均有抗CMV活性,更昔洛韦能明显减少CMV所诱导的细胞凋亡的发生,而大蒜素对这种凋亡现象却影响不大,由此推测,大蒜素的抗CMV机制可能与更昔洛韦不同。在MTC浓度时,更昔洛韦的CMV-IEA抑制率达90%左右,而大蒜素的最大CMV-IEA抑制率为60%左右,是这种抗CMV活性的差异造成了二种药物对凋亡影响的不同,抑或还存在其他更复杂的机制,还值得深入研究。
参考文献
1 Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Meth, 1983, 65:55-61.
, 百拇医药 2 Brigati DJ, Myerson D, Leary JJ, et al. Detection of viral genomes in cultured cells and paraffin-embedded tissue sections using biotin-labeled hybridization probes. Virology, 1983, 126:32-50.
3 Polak JM, McGee JO. In situ hybridization: principles and practice. New York: Oxford, 1990. 59-73.
4 Abuliah TH1. Garlic revisited: therapeutic for the major disease of our time? J Natl Med Asso, 1988, 80:439-445.
, http://www.100md.com
5 Yen Tsai. Antiviral properties of garlic: in vitro effects on influenza B, herpes simplex and coxsackie viruses. Planta Medical, 1985, 5:460-468.
6 郭乃榄,陆道培,周桂珍,等.大蒜提取物体外抑制巨细胞病毒的研究.中华实验和临床病毒学杂志,1991,5:58-60.
7 Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide ranging implications in tissues kinetics. Br J Cancer, 1972, 26:239-257.
8 Peter T, Gores G. Apoptosis and hepatobiliary disease. Hepatology, 1995, 21:1725-1741.
, 百拇医药
9 李红,董永绥,方峰,等.巨细胞病毒感染对细胞凋亡及bcl-2和fas基因表达的影响初探.中华儿科杂志,1998,36:645-648.
10 Korsmeyer SJ. Bcl-2 initates a new category of oncogenes: regulators of cell death. Blood, 1992, 80:879-886.
11 Martin SJ, Green DR. Protease activation during apoptosis: death by a thousand cuts? Cell, 1995, 82:349-353.
(收稿:1998-05-14 修回:1998-08-20), 百拇医药