Leptin对大鼠肝细胞葡萄糖氧化影响的剂量效应与时间效应
作者:曹筱佩 程桦 钟女奇 黄冰 傅祖植
单位:曹筱佩 中山医科大学 附属第一医院内分泌科;程 桦 傅祖植 中山医科大学 孙逸仙纪念医院内分泌科;钟女奇 黄 冰 中山医科大学 动物实验中心; 广州,510080)
关键词:Leptin②;肥胖症;糖代谢
中山医科大学学报990406
摘 要 目的:观察Leptin对大鼠肝细胞葡萄糖氧化的影响,及其剂量与时间效应。方法:培养肝细胞以不同剂量Leptin处理,以及以同一剂量Leptin处理不同时间,以液体闪烁计数法检测肝细胞氧化D-[U-14C]葡萄糖的量。结果:细胞培养1 h,当Leptin为10 μg.L-1时,肝细胞葡萄糖氧化与未予Leptin处理的对照组之间无明显差异,当Leptin为50 μg.L-1,葡萄糖氧化较对照组下降(P<0.05),在50~200 μg.L-1范围随剂量的上升而逐渐下降。以Leptin 100 μg.L-1延长作用时间至3 h、12 h、24 h、48 h,葡萄糖氧化反而较1 h时显著上升(P<0.01),恢复至对照组水平。结论:低剂量Leptin对肝细胞葡萄糖氧化无显著影响,高剂量Leptin对肝细胞葡萄糖氧化具剂量依赖性急性抑制作用,慢性作用时,其抑制作用消失。
, 百拇医药
中图号 R 364.2; 587.1
The Dose and Time Effects of Leptin on Glucose Oxidation in Hepatic Cells
Cao Xiaopei1 Cheng Hua2 Zhong Nuqi3 Huang Bin3 Fu Zuzhi2
( 1 Department of Endocrinology, First Affiliated Hospital 2 Department of Endocinolog,Memorial Hospital 3 Animal Experimental Center, Sun Yat-sen University of Medical Sciences, Guangzhou, 510080)
, 百拇医药
Abstract Objective: To observe the dose and time effects of leptin on glucose oxidation in cultured rat hepatic cells. Methods: Hepatic cells were incubated with leptin of different doses and different time courses with a same dose. D-[U-14C]glucose oxidation were determined by liquid scintillation counting. Results: Leptin treatment of 10 μg.L-1 for 1h had no significant effects on glucose oxidation in hepatic cells. However, at the dose of 50 μg.L-1, leptin significantly inhibited glucose oxidation vs control oxidation (P<0.05). At the doses range from 50 μg.L-1 to 200 μg.L-1, the inhibitory effect of leptin was dose dependent. This effects were reversed or glucose oxidation was slightly higher than the control group when hepatic cells were exposed to leptin(100 μg.L-1) for 3 h、12 h、24 h and 48 h. And comparing to the 1 h group the glucose oxidation were significantly elevated (P<0.01). Conclusion: Low dose of leptin has no significant effect on glucose oxidation in hepatic cells. A relatively high dose of leptin has an acute, dose dependent inhibitory effect on the glucose oxidation in hepatic cells. This effect is reversed by prolonging the exposure time.
, http://www.100md.com
Subject headings leptin②; obesity; glucose metabolism
Leptin(瘦素)是近年发现的肥胖基因(OB)的表达产物,由脂肪细胞分泌,具有促进产热及抑制食欲的功能,被认为是机体维持正常体重不可缺少的激素。新近的研究认为,Leptin除对机体能量代谢有重要作用外,对糖、脂肪等物质代谢亦存在影响。肥胖者易发生糖代谢异常,并表现高Leptin血症。它们之间是否存在联系,是目前肥胖症研究的重要课题之一。本实验探讨Leptin对肝细胞葡萄糖氧化的影响,并观察其剂量效应与时间效应,以供作进一步的实验和临床研究参考。
1 材料与方法
1.1 主要材料与试剂
正常大鼠肝细胞株BRL(上海细胞生物研究所),RPMI1640培养基(Gibcol BRL公司),Leptin(R&D公司),D-[U-14 C]葡萄糖(中国科学院核医学技术中心),闪烁液PPO、POPOP(Sigma公司)。
, 百拇医药
1.2 肝细胞的培养与处理
正常大鼠肝细胞株BRL,于含φ=10%小牛血清、φ=10%双抗(青霉素、链霉素)的RPMI 1640培养液中,在37 ℃ φ=5%CO2,培养箱中进行培养。每2 d换液1次,培养3~4 d进行传代。选择生长良好的细胞进行实验。
1.3 Leptin作用的剂量效应
细胞分为不加Leptin(对照组)、加Leptin 10 μg.L-1、50 μg.L-1、100 μg.L-1、200 μg.L-15种条件,预培养1 h后进行葡萄糖氧化检测,每种条件重复检测6次。
1.4 Leptin作用的时间效应
, 百拇医药
细胞不加Leptin(对照组),和以Leptin 100 μg.L-1分别预培养1 、3 、12、24 、48 h等6种条件,然后进行葡萄糖氧化检测,每种条件重复检测6次。
1.5 肝细胞葡萄糖氧化检测
参照文献[1]方法,以液体闪烁计数法检测葡萄糖氧化:细胞于含5 g/L BSA RPMI1640培养液中预培养3 d。胰酶消化,离心收集细胞,细胞再以含5.6 mmol/L葡萄糖、Hepes 10 mmol/L 的RPMI 1640培养液,于硅化瓶内培养1 h。加D-[U-14 C]葡萄糖(放射性比活性为9.18×109 Bq/mmol)3.7×105Bq/mL,于培养瓶内悬挂一小管,胶塞密封瓶口,继续培养1 h。加100 ml/L三氯醋酸0.2 mL终止反应,并于悬挂的小管内注入氢氧化海胺0.3 mL,以捕获CO2。室温放置3 h,小管内加入闪烁液,液体闪烁计数器(LS3801, Bechman公司)检测放射活性。检测的批内变异系数为3.1%。
, http://www.100md.com
1.6 数据处理
数值以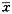 ±s表示,两组间数值比较采用t检验。葡萄糖氧化以每小时每106细胞氧化葡萄糖的物质的量n/nmol表示。
±s表示,两组间数值比较采用t检验。葡萄糖氧化以每小时每106细胞氧化葡萄糖的物质的量n/nmol表示。
2 结 果
2.1 Leptin对肝细胞葡萄糖氧化影响的剂量效应
Leptin 10 μg.L-1时,葡萄糖氧化较对照组无差异,Leptin质量浓度上升至50 μg.L-1时,葡萄糖氧化较对照组显著下降,并随剂量上升而逐渐下降,至200 μg.L-1时,葡萄糖氧化降至最低,与对照组比较P<0.01,见表1。
, http://www.100md.com
表1 不同浓度Leptin对肝细胞葡萄糖氧化的影响
Table 1 Effects of Leptin of different concentrations on glucose oxidation in cultured hepatic cells Group
(ρ/μg.L-1)
Glucose oxidized per hour per 106 cells
(n/nmol)
Control
3.69±1.08
Leptin 10
, http://www.100md.com
3.08±1.88
Leptin 50
1.78±0.591)
Leptin 100
1.64±0.542)
Leptin 200
1.60±0.182)
vs control group 1)P<0.05, 2) P<0.012.2 Leptin对肝细胞葡萄糖氧化影响的时间效应
细胞以Leptin 100 μg.L-1 预培养1 h,肝细胞葡萄糖氧化均较对照组明显下降,但延长Leptin 100 μg.L-1预培养时间至3 h后,肝细胞葡萄糖氧化并未继续下降,反而较1 h显著上升,达到或轻度高于对照组水平,见表2。
, http://www.100md.com
表2 Leptin 100 μg.L-1对肝细胞葡萄糖氧化影响的时间效应
Table 2 Time dependent effects of Leptin 100 μg.L-1 on glucose oxidation in cultured hepatic cells
(n/nmol) Group t/h
Glucose Oxidized per Hour per 106 cells
01)
3.69±1.08
1
, 百拇医药
1.64±0.542)
3
3.12±1.95
12
3.50±0.84
24
4.08±0.45
48
4.04±0.33
1) Control group, 2) each group vs 1 h group P<0.013 讨 论
Leptin为近年发现的肥胖基因(OB)的表达产物,由脂肪细胞分泌。它通过与下丘脑特异的受体结合,抑制食欲中枢,使食欲下降,进食量减少;并通过兴奋交感神经系统,促进脂肪组织的脂肪分解,产热增加,因而发挥降体重的功能。在OB突变的ob/ob小鼠,体内缺乏内源性Leptin,表现出极度肥胖、多食,同时还表现高胰岛素血症、高血糖,给予外源性Leptin后,不但体重下降,高血糖与高胰岛素血症亦得以纠正[2]。并且发现,Leptin的功能性受体除主要分布在下丘脑外,外周组织如肝脏、胰腺、骨胳肌、脂肪亦有少量分布[3]。这些结果提示Leptin可能直接或间接作用于胰岛素的分泌器官及靶器官,参与机体糖代谢的调节。但其具体机制目前尚不明了。
, 百拇医药
肝脏是物质代谢最活跃的场所,它可使过多的血糖迅速转化为糖原及进行氧化利用,并通过糖异生与糖原分解补充血糖的不足,在维持血糖浓度的稳定中起关键作用。许多激素均通过影响肝脏的糖代谢过程发挥对血糖的调节。已发现在肝脏的表面存在Leptin的功能受体,并在培养的肝细胞观察到,Leptin对胰岛素受体后的信号传导途径存在影响[4]。这些研究说明Leptin可能直接参与影响肝内物质代谢。
本实验以肝细胞葡萄糖氧化为观察指标,初步探讨不同剂量、不同作用时间的Leptin对肝糖代谢可能存在的影响。实验结果显示,近似于正常人生理范围的低剂量Leptin(10 μg.L-1),对肝细胞葡萄糖氧化无明显影响,但当剂量上升至50 μg.L-1以上时,则抑制肝细胞葡萄糖氧化,并在50~200 μg.L-1范围内,随剂量增加抑制作用越明显,剂量达200 μg.L-1时最低。应用达到抑制剂量的100 μg.L-1 Leptin继续作用时,其抑制作用并未持续存在,反而在作用3 h后葡萄糖氧化又显著上升,恢复甚至稍超过对照组水平。Leptin对肝细胞葡萄糖氧化的影响主要表现在高浓度时的急性抑制作用,在高剂量慢性作用时抑制作用消失。Rossetti等在大鼠一次性注射leptin观察其短期效应,发现Leptin可显著抑制糖酵解关键酶葡萄糖激酶的表达,且使游离脂肪酸减少[5]。研究已证实Leptin的主要生理功能是促进脂肪的氧化分解与产热,因而我们推测在急性作用期,Leptin以促进脂肪的β氧化为主,此时大量的ATP生成可反馈抑制葡萄糖酵解的关键酶如葡萄糖激酶,使葡萄糖氧化减少,当后期脂肪氧化减速后,这种抑制作用解除,则葡萄糖氧化恢复;此外亦存在以下可能性:①为保证脂肪的充分氧化,Leptin在急性期直接抑制葡萄糖酵解的关键酶,脂肪氧化完成后,抑制解除,为机体内物质代谢的一种协调行为;②Leptin对肝细胞葡萄糖氧化过程中不同的关键酶作用不同,以及显效时间不一致。这些假设均有待进一步研究。结果还说明,Leptin可不通过中枢而直接作用于肝细胞,发挥对糖代谢的影响。
, 百拇医药
本结果说明,低浓度Leptin对肝细胞葡萄糖氧化无明显影响,高浓度时具急性抑制作用,这可能是机体物质代谢之间协调作用的结果,为可逆的过程。长期高浓度作用时,肝细胞葡萄糖氧化仍能维持在稳定的范围内甚至轻度增加。
参考文献
1 Assimacopoulos-Jeannet F, Thumelin S, Roche E, et al. Fatty acid rapidly induce the carnitine palmitoyltransferase 1 gene in the pancreatic Beta-cell line INS-1. J Biol Chem, 1997,272(3):1659
2 Weigle D S, Bukowski T R, Foster D C, et al. Recombinant ob protein reduces feeding and body weight in the ob/ob mouse.J Clin Invest 1995,96(10):2065
, 百拇医药
3 Emilsson V, Liu Y, Cawthorne M A, et al. Expression of the functional leptin receptor mRNA in pancreatic islets and direct inhibitory action of leptin on insulin secretion. Diabetes, 1997,46(1):313
4 Cohen B, Novick D, Rubinstein M. Modulation of insulin activities by leptin. Science, 1996, 274(11.15):1185
5 Rossetti L, Massillon D, Barzilai N, et al. Short term effects of leptin on hepatic gluconeogenesis and in vivo insulin action. J Biol Chem, 1997,272(44):27758
(1999 - 05 - 31收稿 1999 - 09 - 13修回), 百拇医药
单位:曹筱佩 中山医科大学 附属第一医院内分泌科;程 桦 傅祖植 中山医科大学 孙逸仙纪念医院内分泌科;钟女奇 黄 冰 中山医科大学 动物实验中心; 广州,510080)
关键词:Leptin②;肥胖症;糖代谢
中山医科大学学报990406
摘 要 目的:观察Leptin对大鼠肝细胞葡萄糖氧化的影响,及其剂量与时间效应。方法:培养肝细胞以不同剂量Leptin处理,以及以同一剂量Leptin处理不同时间,以液体闪烁计数法检测肝细胞氧化D-[U-14C]葡萄糖的量。结果:细胞培养1 h,当Leptin为10 μg.L-1时,肝细胞葡萄糖氧化与未予Leptin处理的对照组之间无明显差异,当Leptin为50 μg.L-1,葡萄糖氧化较对照组下降(P<0.05),在50~200 μg.L-1范围随剂量的上升而逐渐下降。以Leptin 100 μg.L-1延长作用时间至3 h、12 h、24 h、48 h,葡萄糖氧化反而较1 h时显著上升(P<0.01),恢复至对照组水平。结论:低剂量Leptin对肝细胞葡萄糖氧化无显著影响,高剂量Leptin对肝细胞葡萄糖氧化具剂量依赖性急性抑制作用,慢性作用时,其抑制作用消失。
, 百拇医药
中图号 R 364.2; 587.1
The Dose and Time Effects of Leptin on Glucose Oxidation in Hepatic Cells
Cao Xiaopei1 Cheng Hua2 Zhong Nuqi3 Huang Bin3 Fu Zuzhi2
( 1 Department of Endocrinology, First Affiliated Hospital 2 Department of Endocinolog,Memorial Hospital 3 Animal Experimental Center, Sun Yat-sen University of Medical Sciences, Guangzhou, 510080)
, 百拇医药
Abstract Objective: To observe the dose and time effects of leptin on glucose oxidation in cultured rat hepatic cells. Methods: Hepatic cells were incubated with leptin of different doses and different time courses with a same dose. D-[U-14C]glucose oxidation were determined by liquid scintillation counting. Results: Leptin treatment of 10 μg.L-1 for 1h had no significant effects on glucose oxidation in hepatic cells. However, at the dose of 50 μg.L-1, leptin significantly inhibited glucose oxidation vs control oxidation (P<0.05). At the doses range from 50 μg.L-1 to 200 μg.L-1, the inhibitory effect of leptin was dose dependent. This effects were reversed or glucose oxidation was slightly higher than the control group when hepatic cells were exposed to leptin(100 μg.L-1) for 3 h、12 h、24 h and 48 h. And comparing to the 1 h group the glucose oxidation were significantly elevated (P<0.01). Conclusion: Low dose of leptin has no significant effect on glucose oxidation in hepatic cells. A relatively high dose of leptin has an acute, dose dependent inhibitory effect on the glucose oxidation in hepatic cells. This effect is reversed by prolonging the exposure time.
, http://www.100md.com
Subject headings leptin②; obesity; glucose metabolism
Leptin(瘦素)是近年发现的肥胖基因(OB)的表达产物,由脂肪细胞分泌,具有促进产热及抑制食欲的功能,被认为是机体维持正常体重不可缺少的激素。新近的研究认为,Leptin除对机体能量代谢有重要作用外,对糖、脂肪等物质代谢亦存在影响。肥胖者易发生糖代谢异常,并表现高Leptin血症。它们之间是否存在联系,是目前肥胖症研究的重要课题之一。本实验探讨Leptin对肝细胞葡萄糖氧化的影响,并观察其剂量效应与时间效应,以供作进一步的实验和临床研究参考。
1 材料与方法
1.1 主要材料与试剂
正常大鼠肝细胞株BRL(上海细胞生物研究所),RPMI1640培养基(Gibcol BRL公司),Leptin(R&D公司),D-[U-14 C]葡萄糖(中国科学院核医学技术中心),闪烁液PPO、POPOP(Sigma公司)。
, 百拇医药
1.2 肝细胞的培养与处理
正常大鼠肝细胞株BRL,于含φ=10%小牛血清、φ=10%双抗(青霉素、链霉素)的RPMI 1640培养液中,在37 ℃ φ=5%CO2,培养箱中进行培养。每2 d换液1次,培养3~4 d进行传代。选择生长良好的细胞进行实验。
1.3 Leptin作用的剂量效应
细胞分为不加Leptin(对照组)、加Leptin 10 μg.L-1、50 μg.L-1、100 μg.L-1、200 μg.L-15种条件,预培养1 h后进行葡萄糖氧化检测,每种条件重复检测6次。
1.4 Leptin作用的时间效应
, 百拇医药
细胞不加Leptin(对照组),和以Leptin 100 μg.L-1分别预培养1 、3 、12、24 、48 h等6种条件,然后进行葡萄糖氧化检测,每种条件重复检测6次。
1.5 肝细胞葡萄糖氧化检测
参照文献[1]方法,以液体闪烁计数法检测葡萄糖氧化:细胞于含5 g/L BSA RPMI1640培养液中预培养3 d。胰酶消化,离心收集细胞,细胞再以含5.6 mmol/L葡萄糖、Hepes 10 mmol/L 的RPMI 1640培养液,于硅化瓶内培养1 h。加D-[U-14 C]葡萄糖(放射性比活性为9.18×109 Bq/mmol)3.7×105Bq/mL,于培养瓶内悬挂一小管,胶塞密封瓶口,继续培养1 h。加100 ml/L三氯醋酸0.2 mL终止反应,并于悬挂的小管内注入氢氧化海胺0.3 mL,以捕获CO2。室温放置3 h,小管内加入闪烁液,液体闪烁计数器(LS3801, Bechman公司)检测放射活性。检测的批内变异系数为3.1%。
, http://www.100md.com
1.6 数据处理
数值以
2 结 果
2.1 Leptin对肝细胞葡萄糖氧化影响的剂量效应
Leptin 10 μg.L-1时,葡萄糖氧化较对照组无差异,Leptin质量浓度上升至50 μg.L-1时,葡萄糖氧化较对照组显著下降,并随剂量上升而逐渐下降,至200 μg.L-1时,葡萄糖氧化降至最低,与对照组比较P<0.01,见表1。
, http://www.100md.com
表1 不同浓度Leptin对肝细胞葡萄糖氧化的影响
Table 1 Effects of Leptin of different concentrations on glucose oxidation in cultured hepatic cells Group
(ρ/μg.L-1)
Glucose oxidized per hour per 106 cells
(n/nmol)
Control
3.69±1.08
Leptin 10
, http://www.100md.com
3.08±1.88
Leptin 50
1.78±0.591)
Leptin 100
1.64±0.542)
Leptin 200
1.60±0.182)
vs control group 1)P<0.05, 2) P<0.012.2 Leptin对肝细胞葡萄糖氧化影响的时间效应
细胞以Leptin 100 μg.L-1 预培养1 h,肝细胞葡萄糖氧化均较对照组明显下降,但延长Leptin 100 μg.L-1预培养时间至3 h后,肝细胞葡萄糖氧化并未继续下降,反而较1 h显著上升,达到或轻度高于对照组水平,见表2。
, http://www.100md.com
表2 Leptin 100 μg.L-1对肝细胞葡萄糖氧化影响的时间效应
Table 2 Time dependent effects of Leptin 100 μg.L-1 on glucose oxidation in cultured hepatic cells
(n/nmol) Group t/h
Glucose Oxidized per Hour per 106 cells
01)
3.69±1.08
1
, 百拇医药
1.64±0.542)
3
3.12±1.95
12
3.50±0.84
24
4.08±0.45
48
4.04±0.33
1) Control group, 2) each group vs 1 h group P<0.013 讨 论
Leptin为近年发现的肥胖基因(OB)的表达产物,由脂肪细胞分泌。它通过与下丘脑特异的受体结合,抑制食欲中枢,使食欲下降,进食量减少;并通过兴奋交感神经系统,促进脂肪组织的脂肪分解,产热增加,因而发挥降体重的功能。在OB突变的ob/ob小鼠,体内缺乏内源性Leptin,表现出极度肥胖、多食,同时还表现高胰岛素血症、高血糖,给予外源性Leptin后,不但体重下降,高血糖与高胰岛素血症亦得以纠正[2]。并且发现,Leptin的功能性受体除主要分布在下丘脑外,外周组织如肝脏、胰腺、骨胳肌、脂肪亦有少量分布[3]。这些结果提示Leptin可能直接或间接作用于胰岛素的分泌器官及靶器官,参与机体糖代谢的调节。但其具体机制目前尚不明了。
, 百拇医药
肝脏是物质代谢最活跃的场所,它可使过多的血糖迅速转化为糖原及进行氧化利用,并通过糖异生与糖原分解补充血糖的不足,在维持血糖浓度的稳定中起关键作用。许多激素均通过影响肝脏的糖代谢过程发挥对血糖的调节。已发现在肝脏的表面存在Leptin的功能受体,并在培养的肝细胞观察到,Leptin对胰岛素受体后的信号传导途径存在影响[4]。这些研究说明Leptin可能直接参与影响肝内物质代谢。
本实验以肝细胞葡萄糖氧化为观察指标,初步探讨不同剂量、不同作用时间的Leptin对肝糖代谢可能存在的影响。实验结果显示,近似于正常人生理范围的低剂量Leptin(10 μg.L-1),对肝细胞葡萄糖氧化无明显影响,但当剂量上升至50 μg.L-1以上时,则抑制肝细胞葡萄糖氧化,并在50~200 μg.L-1范围内,随剂量增加抑制作用越明显,剂量达200 μg.L-1时最低。应用达到抑制剂量的100 μg.L-1 Leptin继续作用时,其抑制作用并未持续存在,反而在作用3 h后葡萄糖氧化又显著上升,恢复甚至稍超过对照组水平。Leptin对肝细胞葡萄糖氧化的影响主要表现在高浓度时的急性抑制作用,在高剂量慢性作用时抑制作用消失。Rossetti等在大鼠一次性注射leptin观察其短期效应,发现Leptin可显著抑制糖酵解关键酶葡萄糖激酶的表达,且使游离脂肪酸减少[5]。研究已证实Leptin的主要生理功能是促进脂肪的氧化分解与产热,因而我们推测在急性作用期,Leptin以促进脂肪的β氧化为主,此时大量的ATP生成可反馈抑制葡萄糖酵解的关键酶如葡萄糖激酶,使葡萄糖氧化减少,当后期脂肪氧化减速后,这种抑制作用解除,则葡萄糖氧化恢复;此外亦存在以下可能性:①为保证脂肪的充分氧化,Leptin在急性期直接抑制葡萄糖酵解的关键酶,脂肪氧化完成后,抑制解除,为机体内物质代谢的一种协调行为;②Leptin对肝细胞葡萄糖氧化过程中不同的关键酶作用不同,以及显效时间不一致。这些假设均有待进一步研究。结果还说明,Leptin可不通过中枢而直接作用于肝细胞,发挥对糖代谢的影响。
, 百拇医药
本结果说明,低浓度Leptin对肝细胞葡萄糖氧化无明显影响,高浓度时具急性抑制作用,这可能是机体物质代谢之间协调作用的结果,为可逆的过程。长期高浓度作用时,肝细胞葡萄糖氧化仍能维持在稳定的范围内甚至轻度增加。
参考文献
1 Assimacopoulos-Jeannet F, Thumelin S, Roche E, et al. Fatty acid rapidly induce the carnitine palmitoyltransferase 1 gene in the pancreatic Beta-cell line INS-1. J Biol Chem, 1997,272(3):1659
2 Weigle D S, Bukowski T R, Foster D C, et al. Recombinant ob protein reduces feeding and body weight in the ob/ob mouse.J Clin Invest 1995,96(10):2065
, 百拇医药
3 Emilsson V, Liu Y, Cawthorne M A, et al. Expression of the functional leptin receptor mRNA in pancreatic islets and direct inhibitory action of leptin on insulin secretion. Diabetes, 1997,46(1):313
4 Cohen B, Novick D, Rubinstein M. Modulation of insulin activities by leptin. Science, 1996, 274(11.15):1185
5 Rossetti L, Massillon D, Barzilai N, et al. Short term effects of leptin on hepatic gluconeogenesis and in vivo insulin action. J Biol Chem, 1997,272(44):27758
(1999 - 05 - 31收稿 1999 - 09 - 13修回), 百拇医药