鼠脑线粒体一氧化氮的生成
作者:王蕾 唐朝枢 赵保路 陈清棠
单位:王蕾(100083 北京医科大学第一医院神经科学研究中心);陈清棠(100083 北京医科大学第一医院神经科学研究中心);唐朝枢(北京医科大学心血管基础研究所);赵保路(中国科学院生物物理研究所)
关键词:
中华医学杂志000721 目前已知细胞产生一氧化氮(NO)主要由存在于胞浆的一氧化氮合酶(NOS)催化L-精氨酸(L-Arg)生成。最近,Giulivi等[1]发现,分离的大鼠肝线粒体能独立合成NO,并提取和纯化出线粒体NOS。Bates等[2]用免疫组织化学技术发现大鼠脑的线粒体内膜存在NOS或其抗原相关蛋白,而NOS激活所必需的底物及辅助因子亦存在于脑神经元的线粒体内。由此我们推测脑线粒体存在有独立于胞浆的L-Arg/NOS/NO系统,该系统对线粒体的生理及病理生理活动可能具有重要意义。我们在分离和纯化的大鼠脑线粒体上用光谱技术直接检测脑线粒体NO的生成,以论证脑线粒体内存在独立的NO合成系统。
, http://www.100md.com
一、材料与方法
1.材料:聚乙二醇8000(PEG-8000)、L-精氨酸(L-Arg)、L-甲基精氨酸(L-NMMA)购于美国Sigma公司;Lubrol PX、Percoll购于Pharmacia公司;MGD(N-methyl-D-glucamine) 由中国科学院生物物理研究所赵保路教授合成并赠送。
2.大鼠纯化脑线粒体的制备[1,3]:体重280~320 g,雄性Wistar大鼠(中国科学院遗传学研究所动物中心提供),取4只,断头速取两侧大脑半球。按文献方法得到的沉淀即为线粒体匀浆。沉淀重新悬浮于5 ml分离介质(IMB)中,铺于15 ml含40% Percoll的IMB上,超速离心,取线粒体层,用IMB洗2次,去除Percoll,即为纯化的线粒体。Lowry法行蛋白定量。线粒体的纯化鉴定采用线粒体及其污染物的特征酶含量分析,其测定方法及线粒体呼吸控制率(RCR)及Latency的测定方法参考文献[4]。
, 百拇医药
3.脑线粒体NO测定:(1)Griess试剂法测定脑线粒体NO-2生成;(2)(MGD)2-Fe2+自旋捕集EPR(electron paramagnetic resonance)技术测定NO[1]。纯化线粒体悬浮在含8.5% PEG8000的IMB中,加入甲苯(体积分数为0.2%),去上清。用IMB洗2次后悬浮于含8.5% PEG8000的IMB中,即为通透线粒体。分别取该线粒体及线粒体匀浆各5.2 mg加入反应体系[1],再加入30 mmol/L(MGD)2/Fe2+,室温下孵育1 h和8 h(线粒体匀浆孵育1 h)。其中既不加L-arg也不加L-NMMA的为A组,B组为加入1 mmol/L L-arg,C组为加入10 mmol/L L-NMMA。用VarianE-109自旋共振仪测NO波谱信号。
4.统计学处理:所有数据均以均数±标准差表示,采用单因素方差分析(Qne way ANOVA)及组间差异显著性检验采用q检验。
, 百拇医药
二、结果
1.脑纯化线粒体功能及纯度的鉴定:本实验制备的鼠脑线粒体,有效地去除污染的亚细胞器及破碎线粒体。纯化线粒体的非线粒体污染程度很低(表1),仅为1%~5%,且具有较高的呼吸控制率,Latency细胞外膜完整性的指标也较高。
2.光谱技术检测脑线粒体生成的NO:(1)Griess试剂法测定脑线粒体NO-2生成:随孵育时间增加,线粒体生成的NO·在30 min内呈线性增加,60 min近峰值。随线粒体蛋白浓度增加,孵育30 min线粒体匀浆和纯化线粒体内NO·的生成呈线性增加,其速率分别为0.063和0.213 nmol/L NO×(min*mg protein)-1,后者是前者的3.5倍。(2)电子自旋/EPR技术检测NO: 与NO·供体-谷胱苷肽产生的标准三相波相比,孵育1 h,通透线粒体的A组有微弱的(MGD)2/Fe2+-NO三相波信号,B组与A组比较信号大小无明显差别,而C组比A组及B组在标准三相波的位置波谱信号稍小;通透线粒体孵育8 h,随着时间的延长,增加了底物和抑制剂的浓度,3组均出现明显的三相波信号,B组信号强度虽大于A组,但差异无显著意义(表2),而C组信号分别减小了A、 B 2组信号的36%和48%。孵育8 h的A组和B组信号强度分别是孵育1 h的2.5和2.7倍。线粒体匀浆的A、 B 、C 3组孵育1 h,在标准(MGD)2/Fe2+-NO·三相波位置无明显EPR信号,只是C组波形较前2组稍小(表2)。
, 百拇医药
表1 大鼠脑线粒体酶的特性和功能及结构完整性的比较(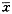 ±s) 测定参数
±s) 测定参数
鼠数
意义
比活性
相对于匀浆的比活性之比
线粒体匀浆
Percoll纯化线粒体
细胞色素氧化酶
5
线粒体marker酶
2.55±0.31
, http://www.100md.com
13.620±2.720
5.49±1.03
葡萄糖-6-磷酸酶
5
微粒体marker酶
0.47±0.13
0.060±0.020
0.21±0.06
酸性磷酸酶
5
脂质体marker酶
9.47±2.59
, http://www.100md.com
6.460±2.730
0.66±0.15
RCR
5
线粒体功能
3.05±0.48
6.060±0.470
-
Latency
5
线粒体外膜完整性
90.0%±2.3%
, 百拇医药
91.9%±3.7%
-
注:细胞色素氧化酶的活性用每分钟每毫克蛋白吸光度差的对数值[(Δlog absorbance)/min*mg protein]表示,葡萄糖-6-磷酸酶和酸性磷酸酶的活性用每分钟每毫克蛋白所消耗磷离子的纳摩尔数(nmol/min*mg protein)表示表2 不同脑线粒体制品产生(MGD)2Fe2+NO·的
EPR信号(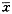 ±s) 组别
±s) 组别
鼠数
甲苯处理的通透线粒体
线粒体匀浆
, http://www.100md.com
1 h
8 h
1 h
A组
4
2.02±0.37
4.65±0.86
1.33±0.25
B组
4
2.15±0.42
5.78±0.95
1.52±0.31
, http://www.100md.com
C组
4
1.24±0.11△
2.98±0.25*△△
0.99±0.18△
注:与A组比较,*q=4.222,P<0.05;与B组比较,△q=4.933,P<0.05,△△q=7.378,P<0.01 甲苯处理的脑通透线粒体和脑线粒体匀浆与1 mmol/L L-Arg 或10 mmol/L L-NMMA按给定的时间孵育。信号强度的比较采用三线波三个波的高度之和进行比较。
三、讨论
, 百拇医药
本实验提取脑线粒体同以往的方法不同,利用Percoll的可以忽略的渗透性和化学惰性,去除非线粒体污染,得到纯度较高的制品。下列证据支持脑线粒体产生NO·。首先,纯化的脑线粒体被其他亚细胞器的污染很少,可以被忽略(表1),说明线粒体是NO·的来源而不是其它亚细胞器。第二是脑线粒体产生的NO·被Griess试剂法和自旋捕集/EPR技术2种不同光谱技术检测到。前者非常灵敏,但不特异;后者特异性好,自旋捕获剂MGD可以识别亚硝酰基复合物EPR的信号,该信号因而成为鉴别NO·的“指纹”。第三是在底物及蛋白浓度不变条件下,随着时间增加NO·生成增加;而且NO·的产生可以由NOS的底物(L-ARG)及抑制剂(L-NMMA)调节,这提示线粒体内NO·是经NOS途径产生的。另外,经Percoll纯化的线粒体产生NO·的信号强度明显大于线粒体匀浆,从生化角度证实了免疫组织化学发现的NOS位于脑线粒体内的现象。
, 百拇医药
大量研究证实,NO对线粒体的功能存在重要影响,表现为NO作用于线粒体呼吸链上与能量代谢有关的酶如细胞色素C氧化酶,可逆或不可逆地抑制其活性,干扰氧化磷酸化过程,能量耗竭,引起细胞坏死[5];NO加速了Ca2+内流,直接抑制氧化磷酸化[6],ATP生成障碍,细胞死亡;大量NO造成线粒体内膜脂质过氧化,再加上线粒体内大量增加的Ca2+促使MPT(Mitichondria Permeability Transition)开放增多,使促凋亡蛋白如细胞色素C大量释放,诱导细胞凋亡[8]。本研究表明,脑线粒体本身即产生NO,线粒体产生的NO对线粒体的直接作用,尤其在脑缺血中风等与NO代谢改变有关的疾病过程中,脑线粒体产生的NO的影响需要进一步重视。
基金项目:国家“九五”攻关课题基金资助项目(02-3-16)
参考文献
, 百拇医药
1,Giulivi C, Poderoso JJ,Boveris A. Production of Nitric oxide by Mitochondria. J Biol Chemistry,1998,273:11038-11043.
2,Bates TE,Loesch A,Clark JB. Immunocytochemical evidence for amitochondrially located nitric oxide synthase in brain and liver. Bio Biophysic Res Communicati, 1995,213:896-898.
3,Sims RN. Rapid isolation of metabolically active mitochondria from rat brain and subregions using percoll density gradient centrifugation. J Neurochemistry, 1990,55:698-707.
, http://www.100md.com
4,Lambrechts H, Hovius R, Nicolay K. Improved methods to isolate and subfractionate rat liver mitochondria.lipid composition of the inner and outer membrane. Bio Biophysica Acta, 1990,1021:217-226.
5,Zhang H, Brorson RJ, Schumacker TP. Nitric oxide acutely inhibits neuronal energy production. J Neuroscience, 1999,19:147-158.
6,Richer C, Chafourifar P,Schweizert M. Nitric oxide and mitochondrial Ca2+. Bio Soci Transactions, 1997,25:914-918.
7,Leist M, Single B,Naumann H. Inhibition of mitochondrial ATP generation by nitric oxide switches apoptosis to necrosis. Exp Cell Res, 1999,249:396-403.
收稿日期:1999-11-25, 百拇医药
单位:王蕾(100083 北京医科大学第一医院神经科学研究中心);陈清棠(100083 北京医科大学第一医院神经科学研究中心);唐朝枢(北京医科大学心血管基础研究所);赵保路(中国科学院生物物理研究所)
关键词:
中华医学杂志000721 目前已知细胞产生一氧化氮(NO)主要由存在于胞浆的一氧化氮合酶(NOS)催化L-精氨酸(L-Arg)生成。最近,Giulivi等[1]发现,分离的大鼠肝线粒体能独立合成NO,并提取和纯化出线粒体NOS。Bates等[2]用免疫组织化学技术发现大鼠脑的线粒体内膜存在NOS或其抗原相关蛋白,而NOS激活所必需的底物及辅助因子亦存在于脑神经元的线粒体内。由此我们推测脑线粒体存在有独立于胞浆的L-Arg/NOS/NO系统,该系统对线粒体的生理及病理生理活动可能具有重要意义。我们在分离和纯化的大鼠脑线粒体上用光谱技术直接检测脑线粒体NO的生成,以论证脑线粒体内存在独立的NO合成系统。
, http://www.100md.com
一、材料与方法
1.材料:聚乙二醇8000(PEG-8000)、L-精氨酸(L-Arg)、L-甲基精氨酸(L-NMMA)购于美国Sigma公司;Lubrol PX、Percoll购于Pharmacia公司;MGD(N-methyl-D-glucamine) 由中国科学院生物物理研究所赵保路教授合成并赠送。
2.大鼠纯化脑线粒体的制备[1,3]:体重280~320 g,雄性Wistar大鼠(中国科学院遗传学研究所动物中心提供),取4只,断头速取两侧大脑半球。按文献方法得到的沉淀即为线粒体匀浆。沉淀重新悬浮于5 ml分离介质(IMB)中,铺于15 ml含40% Percoll的IMB上,超速离心,取线粒体层,用IMB洗2次,去除Percoll,即为纯化的线粒体。Lowry法行蛋白定量。线粒体的纯化鉴定采用线粒体及其污染物的特征酶含量分析,其测定方法及线粒体呼吸控制率(RCR)及Latency的测定方法参考文献[4]。
, 百拇医药
3.脑线粒体NO测定:(1)Griess试剂法测定脑线粒体NO-2生成;(2)(MGD)2-Fe2+自旋捕集EPR(electron paramagnetic resonance)技术测定NO[1]。纯化线粒体悬浮在含8.5% PEG8000的IMB中,加入甲苯(体积分数为0.2%),去上清。用IMB洗2次后悬浮于含8.5% PEG8000的IMB中,即为通透线粒体。分别取该线粒体及线粒体匀浆各5.2 mg加入反应体系[1],再加入30 mmol/L(MGD)2/Fe2+,室温下孵育1 h和8 h(线粒体匀浆孵育1 h)。其中既不加L-arg也不加L-NMMA的为A组,B组为加入1 mmol/L L-arg,C组为加入10 mmol/L L-NMMA。用VarianE-109自旋共振仪测NO波谱信号。
4.统计学处理:所有数据均以均数±标准差表示,采用单因素方差分析(Qne way ANOVA)及组间差异显著性检验采用q检验。
, 百拇医药
二、结果
1.脑纯化线粒体功能及纯度的鉴定:本实验制备的鼠脑线粒体,有效地去除污染的亚细胞器及破碎线粒体。纯化线粒体的非线粒体污染程度很低(表1),仅为1%~5%,且具有较高的呼吸控制率,Latency细胞外膜完整性的指标也较高。
2.光谱技术检测脑线粒体生成的NO:(1)Griess试剂法测定脑线粒体NO-2生成:随孵育时间增加,线粒体生成的NO·在30 min内呈线性增加,60 min近峰值。随线粒体蛋白浓度增加,孵育30 min线粒体匀浆和纯化线粒体内NO·的生成呈线性增加,其速率分别为0.063和0.213 nmol/L NO×(min*mg protein)-1,后者是前者的3.5倍。(2)电子自旋/EPR技术检测NO: 与NO·供体-谷胱苷肽产生的标准三相波相比,孵育1 h,通透线粒体的A组有微弱的(MGD)2/Fe2+-NO三相波信号,B组与A组比较信号大小无明显差别,而C组比A组及B组在标准三相波的位置波谱信号稍小;通透线粒体孵育8 h,随着时间的延长,增加了底物和抑制剂的浓度,3组均出现明显的三相波信号,B组信号强度虽大于A组,但差异无显著意义(表2),而C组信号分别减小了A、 B 2组信号的36%和48%。孵育8 h的A组和B组信号强度分别是孵育1 h的2.5和2.7倍。线粒体匀浆的A、 B 、C 3组孵育1 h,在标准(MGD)2/Fe2+-NO·三相波位置无明显EPR信号,只是C组波形较前2组稍小(表2)。
, 百拇医药
表1 大鼠脑线粒体酶的特性和功能及结构完整性的比较(
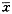 ±s) 测定参数
±s) 测定参数鼠数
意义
比活性
相对于匀浆的比活性之比
线粒体匀浆
Percoll纯化线粒体
细胞色素氧化酶
5
线粒体marker酶
2.55±0.31
, http://www.100md.com
13.620±2.720
5.49±1.03
葡萄糖-6-磷酸酶
5
微粒体marker酶
0.47±0.13
0.060±0.020
0.21±0.06
酸性磷酸酶
5
脂质体marker酶
9.47±2.59
, http://www.100md.com
6.460±2.730
0.66±0.15
RCR
5
线粒体功能
3.05±0.48
6.060±0.470
-
Latency
5
线粒体外膜完整性
90.0%±2.3%
, 百拇医药
91.9%±3.7%
-
注:细胞色素氧化酶的活性用每分钟每毫克蛋白吸光度差的对数值[(Δlog absorbance)/min*mg protein]表示,葡萄糖-6-磷酸酶和酸性磷酸酶的活性用每分钟每毫克蛋白所消耗磷离子的纳摩尔数(nmol/min*mg protein)表示表2 不同脑线粒体制品产生(MGD)2Fe2+NO·的
EPR信号(
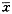 ±s) 组别
±s) 组别鼠数
甲苯处理的通透线粒体
线粒体匀浆
, http://www.100md.com
1 h
8 h
1 h
A组
4
2.02±0.37
4.65±0.86
1.33±0.25
B组
4
2.15±0.42
5.78±0.95
1.52±0.31
, http://www.100md.com
C组
4
1.24±0.11△
2.98±0.25*△△
0.99±0.18△
注:与A组比较,*q=4.222,P<0.05;与B组比较,△q=4.933,P<0.05,△△q=7.378,P<0.01 甲苯处理的脑通透线粒体和脑线粒体匀浆与1 mmol/L L-Arg 或10 mmol/L L-NMMA按给定的时间孵育。信号强度的比较采用三线波三个波的高度之和进行比较。
三、讨论
, 百拇医药
本实验提取脑线粒体同以往的方法不同,利用Percoll的可以忽略的渗透性和化学惰性,去除非线粒体污染,得到纯度较高的制品。下列证据支持脑线粒体产生NO·。首先,纯化的脑线粒体被其他亚细胞器的污染很少,可以被忽略(表1),说明线粒体是NO·的来源而不是其它亚细胞器。第二是脑线粒体产生的NO·被Griess试剂法和自旋捕集/EPR技术2种不同光谱技术检测到。前者非常灵敏,但不特异;后者特异性好,自旋捕获剂MGD可以识别亚硝酰基复合物EPR的信号,该信号因而成为鉴别NO·的“指纹”。第三是在底物及蛋白浓度不变条件下,随着时间增加NO·生成增加;而且NO·的产生可以由NOS的底物(L-ARG)及抑制剂(L-NMMA)调节,这提示线粒体内NO·是经NOS途径产生的。另外,经Percoll纯化的线粒体产生NO·的信号强度明显大于线粒体匀浆,从生化角度证实了免疫组织化学发现的NOS位于脑线粒体内的现象。
, 百拇医药
大量研究证实,NO对线粒体的功能存在重要影响,表现为NO作用于线粒体呼吸链上与能量代谢有关的酶如细胞色素C氧化酶,可逆或不可逆地抑制其活性,干扰氧化磷酸化过程,能量耗竭,引起细胞坏死[5];NO加速了Ca2+内流,直接抑制氧化磷酸化[6],ATP生成障碍,细胞死亡;大量NO造成线粒体内膜脂质过氧化,再加上线粒体内大量增加的Ca2+促使MPT(Mitichondria Permeability Transition)开放增多,使促凋亡蛋白如细胞色素C大量释放,诱导细胞凋亡[8]。本研究表明,脑线粒体本身即产生NO,线粒体产生的NO对线粒体的直接作用,尤其在脑缺血中风等与NO代谢改变有关的疾病过程中,脑线粒体产生的NO的影响需要进一步重视。
基金项目:国家“九五”攻关课题基金资助项目(02-3-16)
参考文献
, 百拇医药
1,Giulivi C, Poderoso JJ,Boveris A. Production of Nitric oxide by Mitochondria. J Biol Chemistry,1998,273:11038-11043.
2,Bates TE,Loesch A,Clark JB. Immunocytochemical evidence for amitochondrially located nitric oxide synthase in brain and liver. Bio Biophysic Res Communicati, 1995,213:896-898.
3,Sims RN. Rapid isolation of metabolically active mitochondria from rat brain and subregions using percoll density gradient centrifugation. J Neurochemistry, 1990,55:698-707.
, http://www.100md.com
4,Lambrechts H, Hovius R, Nicolay K. Improved methods to isolate and subfractionate rat liver mitochondria.lipid composition of the inner and outer membrane. Bio Biophysica Acta, 1990,1021:217-226.
5,Zhang H, Brorson RJ, Schumacker TP. Nitric oxide acutely inhibits neuronal energy production. J Neuroscience, 1999,19:147-158.
6,Richer C, Chafourifar P,Schweizert M. Nitric oxide and mitochondrial Ca2+. Bio Soci Transactions, 1997,25:914-918.
7,Leist M, Single B,Naumann H. Inhibition of mitochondrial ATP generation by nitric oxide switches apoptosis to necrosis. Exp Cell Res, 1999,249:396-403.
收稿日期:1999-11-25, 百拇医药