α粒子诱发人支气管永生化上皮细胞转化前后蛋白质组变化的初步研究
作者:王大东 葛世丽 王嘉玺 吴卫星 楼铁柱 彭善云 王金惠 邹民吉 吴德昌
单位:王大东(100850 北京基础医学研究所);葛世丽(北京放射医学研究所);王嘉玺(100850 北京基础医学研究所);吴卫星(100850 北京基础医学研究所);楼铁柱(北京放射医学研究所);彭善云(100850 北京基础医学研究所);王金惠(100850 北京基础医学研究所);邹民吉(100850 北京基础医学研究所);吴德昌(北京放射医学研究所)
关键词:
中华放射医学与防护杂志000510 研究辐射诱导细胞转化过程中新的相关蛋白和基因,对于阐明癌变机理和预防有重要意义。随着蛋白质组(Proteome),尤其是功能蛋白质组(Functional Proteome)概念的提出和双向电泳技术的成熟,为本研究提供一种崭新的研究策略。
一、材料和方法
, http://www.100md.com
1.细胞:HPV18转染的人支气管永生化上皮细胞BEP2D(对照组),238Pu α粒子照射(1.5 Gy)后连续培养31代,可复层重叠生长,能在软琼脂上形成克隆的细胞(α BEP2D)为实验组(吴德昌院士提供),均以无血清培养基LHC-8培养。
2.试剂:18 cm IPG胶条pH3~10,IPG Buffer\,IPG Cover Fluid\,尿素购自Pharmacia公司,DTT、CHAPS、碘乙酰胺、核酸酶购自Sigma公司,29:1预混丙烯酰胺、甲叉双丙溶液、Tris碱、甘氨酸、二维电泳标准购自Bio-Rad公司,银染试剂购自北京化学试剂公司。
3.样品制备:细胞培养于LHC-8培养基中,生长至对数生长期,胰酶消化,收集并按1×106细胞溶于60 μl裂解液(9 mol/L尿素,4% CHAPS,65 mmol/L DTT,2% v/v 3-10 Pharmalyte)后,快速冻融3~4个循环,离心,收集上清液,Bradford法测定蛋白浓度为1~1.5 mg/ml。-20℃贮存[1]。
, 百拇医药
4.双向电泳:一维固相pH梯度等电聚焦使用IPGphor等电聚焦仪(Pharmacia公司)。两种细胞各160 μl加入到重泡涨液(8 mol/L尿素,2% w/v CHAPS,0.5% v/v IPG Buffer,痕量溴酚蓝)中,使总体积为350 μl。组装好的容器作为等电聚焦的泳道,按如下程序自动进行:①至少12 h重泡涨,其间加上低电压(<50V);②200 V,1 h;③500 V,1 h;④1000 V 30 min;⑤1000~8000 V线性上升30 min;⑥8000 V,4h[2]。聚焦完毕的IPG胶条在10 ml平衡液中(50 mmol/L 1.5 mol/L Tris-Cl pH 8.8,6 mol/L尿素,30%甘油,2% SDS,痕量的溴酚蓝,0.5% DTT)平衡15 min,再进行另15 min平衡(0.5% DTT换成4.8%碘乙酰胺,其余组成同上)。IPG胶条转移到SDS-PAGE均匀胶(14% T,3.3% C,20 cm×20 cm×0.1 cm)上,用封胶液封闭[3]。凝固后按30 mA/每块胶,PROTEN II xi Cell电泳仪(BIO-RAD公司)进行第二维PAGE电泳,至溴酚蓝前沿到达玻璃板底部停止。银染。
, 百拇医药
5.计算机图像分析:银染胶用GS-710光密度仪(BIORAD公司)在63.5 μm的分辨率下数字化成凝胶扫描图像(Gel Scan File)。蛋白表达谱分析采用PDQUEST。6.0软件包(BIO-RAD公司)。凝胶图像经过背景消除,图像平滑,斑点定位,最后经过Gaussian Fitting,较暗斑点的修正获得凝胶对应的蛋白斑点图。
二、结果
同样培养条件下的两种样品重复电泳10次后,达到结果稳定后分析结果。图1为经α粒子诱导转化的BEP2D细胞蛋白质组2-D电泳图,图像分析有1 041个蛋白点;图2为BEP2D细胞的电泳图,共有959个蛋白点。两者总蛋白点数相差82个。肉眼目测两张凝胶,可发现在酸性区(pH<7.0)蛋白点染色较深,蛋白质分布谱型差异不大,而在碱性蛋白区(pH>7.0),蛋白点染色较浅,分布差异较大。在分子量之间,蛋白图谱的变化更明显。两张凝胶计算机共配比858个点。差异蛋白点共有284个,转化细胞有183个;BEP2D永生化细胞有101个,其中94个蛋白点仅有丰度的差异,89个蛋白点是转化细胞独有的;7个是BEP2D细胞独有的。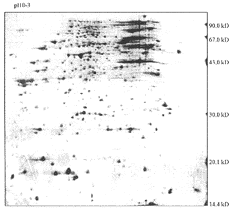
, 百拇医药
图1 辐射诱导转化BEP2D细胞蛋白质组双向电泳图
图2 BEP2D细胞蛋白质组双向电泳图
三、讨论
目前,常采用差异显示技术研究转化细胞与正常细胞基因表达的差异。但用差异显示进行类似研究存在两个限制因素,第一,差异显示操作过程中不可避免地形成大量假阳性信号[4];第二,差异显示针对的是基因转录水平的变化,并不能真实的反映蛋白质或量的改变。而细胞表型改变的真正物质基础是蛋白质。1994年,澳大利亚的Wilkins 和Williams首先提出了蛋白质组和蛋白质组学(Proteomics)的概念。其主要基于3条理由[5]:①从mRNA表达水平并不能完全预测蛋白表达水平;②蛋白质的动态修饰和加工并非必须来自基因序列;③蛋白质组是动态反映生物系统所处的状态。故用寻找恶性转化相关蛋白来逆向寻找相关基因是一条探求细胞恶性转化的捷径。
, http://www.100md.com
正常细胞转化为癌细胞包括“启动-促进-发展”3个阶段。电离辐射是有效的诱变剂,目前多认为是一种启动因子。常引起染色体断裂、缺失和重组,包括原癌基因的重组与表达异常,有证据表明高LET电离辐射所致的DNA损伤以DNA双链断裂为主。根据辐射诱变特点,推测抑癌基因是辐射致癌的主要靶基因。所谓的靶学说,即认为,靶越大被击中的概率越大,靶的大小不但决定于该基因的实际大小,而且决定于该基因激活或失活的特点及条件[6]。
永生化BEP2D细胞和恶性转化的BEP2D细胞表达蛋白的差异结果表明,经α粒子辐射诱导后,BEP2D细胞的基因组表达序列发生了变化,出现了一系列新表达的蛋白质,其中可能既有已知的癌基因的蛋白产物,又有新的未知基因的产物。部分原有蛋白的丰度发生了变化。这点符合肿瘤细胞生物学的特点,诸如肿瘤细胞处于高代谢状态时,各种代谢酶和传递蛋白的丰度提高。同时一些抑制性调控蛋白和由此引起的级联反应蛋白表达减低或消失。
欲鉴定新的差异蛋白,须进行N端测序、氨基酸组成分析、质谱分析、肽质谱及数据库搜寻鉴定蛋白质[7]。目前,用银染的蛋白质进行鉴定尚有一系列的困难,且凝胶中的差异蛋白量极低,鉴定仍有困难。这也是蛋白质组研究需突破的瓶颈。必须进一步提高各蛋白点的含量,应用新的分析方法,提高质谱分析仪的灵敏度,使其达到可鉴定低拷贝蛋白的水平。从中可能会发现辐射诱导后新的表达蛋白。
, 百拇医药
目前双向电泳技术的分辨率尚不能分辨人基因组编码的全部蛋白质(约5万个),但应用该技术初步分析转化细胞的功能蛋白质组,说明在辐射诱导转化条件下,细胞蛋白质组谱有明显的表达不同。
感谢北京放射医学研究所罗凌、万晶红博士的帮助
参考文献
1,Sanchez JC,Appel RD,Hochstrasser DF,et al. Inside SWISS-2DPAGE database. Electrophoresis,1995,16:1131-1151.
2,2-D Electrophoresis using immobilized PH gradients principles and methods. Amersham pharmacia Biotech AB SE-75184 Uppsala Sweden,1998.
, http://www.100md.com
3,Gorg A,Obermaier C,Boguth G,et al. Very alkaline immobilized pH gradients for two-dimensional electrophoresis of ribosomal and nuclear protein. Electrophoresis,1997,18:328-337.
4,Regina VL,Niels B,Thomas B,et al. Rapid selection and classification of positive clones generated by mRNA differential display. Nucl Aci Res,1996,24:1385-1386.
5,Haynes PA,Gygi SP,Figeys D,et al. Proteome analysis:biological assay or data archive. Electrophoresis,1998,19:1862-1871.
, 百拇医药
6,Cox R. Molecular mechanisms of radiation oncogenesis. Int J Radiat Biol,1994,65:57-64.
7,Jensen ON,Larsen MR,Roepsrorff P,et al. Mass spectrometric identification and microcharacterization of proteins from electrophoretic gels:strategies and applications. Proteins,1998,(Suppl 2):74-89.
(收稿日期:1999-12-12), http://www.100md.com
单位:王大东(100850 北京基础医学研究所);葛世丽(北京放射医学研究所);王嘉玺(100850 北京基础医学研究所);吴卫星(100850 北京基础医学研究所);楼铁柱(北京放射医学研究所);彭善云(100850 北京基础医学研究所);王金惠(100850 北京基础医学研究所);邹民吉(100850 北京基础医学研究所);吴德昌(北京放射医学研究所)
关键词:
中华放射医学与防护杂志000510 研究辐射诱导细胞转化过程中新的相关蛋白和基因,对于阐明癌变机理和预防有重要意义。随着蛋白质组(Proteome),尤其是功能蛋白质组(Functional Proteome)概念的提出和双向电泳技术的成熟,为本研究提供一种崭新的研究策略。
一、材料和方法
, http://www.100md.com
1.细胞:HPV18转染的人支气管永生化上皮细胞BEP2D(对照组),238Pu α粒子照射(1.5 Gy)后连续培养31代,可复层重叠生长,能在软琼脂上形成克隆的细胞(α BEP2D)为实验组(吴德昌院士提供),均以无血清培养基LHC-8培养。
2.试剂:18 cm IPG胶条pH3~10,IPG Buffer\,IPG Cover Fluid\,尿素购自Pharmacia公司,DTT、CHAPS、碘乙酰胺、核酸酶购自Sigma公司,29:1预混丙烯酰胺、甲叉双丙溶液、Tris碱、甘氨酸、二维电泳标准购自Bio-Rad公司,银染试剂购自北京化学试剂公司。
3.样品制备:细胞培养于LHC-8培养基中,生长至对数生长期,胰酶消化,收集并按1×106细胞溶于60 μl裂解液(9 mol/L尿素,4% CHAPS,65 mmol/L DTT,2% v/v 3-10 Pharmalyte)后,快速冻融3~4个循环,离心,收集上清液,Bradford法测定蛋白浓度为1~1.5 mg/ml。-20℃贮存[1]。
, 百拇医药
4.双向电泳:一维固相pH梯度等电聚焦使用IPGphor等电聚焦仪(Pharmacia公司)。两种细胞各160 μl加入到重泡涨液(8 mol/L尿素,2% w/v CHAPS,0.5% v/v IPG Buffer,痕量溴酚蓝)中,使总体积为350 μl。组装好的容器作为等电聚焦的泳道,按如下程序自动进行:①至少12 h重泡涨,其间加上低电压(<50V);②200 V,1 h;③500 V,1 h;④1000 V 30 min;⑤1000~8000 V线性上升30 min;⑥8000 V,4h[2]。聚焦完毕的IPG胶条在10 ml平衡液中(50 mmol/L 1.5 mol/L Tris-Cl pH 8.8,6 mol/L尿素,30%甘油,2% SDS,痕量的溴酚蓝,0.5% DTT)平衡15 min,再进行另15 min平衡(0.5% DTT换成4.8%碘乙酰胺,其余组成同上)。IPG胶条转移到SDS-PAGE均匀胶(14% T,3.3% C,20 cm×20 cm×0.1 cm)上,用封胶液封闭[3]。凝固后按30 mA/每块胶,PROTEN II xi Cell电泳仪(BIO-RAD公司)进行第二维PAGE电泳,至溴酚蓝前沿到达玻璃板底部停止。银染。
, 百拇医药
5.计算机图像分析:银染胶用GS-710光密度仪(BIORAD公司)在63.5 μm的分辨率下数字化成凝胶扫描图像(Gel Scan File)。蛋白表达谱分析采用PDQUEST。6.0软件包(BIO-RAD公司)。凝胶图像经过背景消除,图像平滑,斑点定位,最后经过Gaussian Fitting,较暗斑点的修正获得凝胶对应的蛋白斑点图。
二、结果
同样培养条件下的两种样品重复电泳10次后,达到结果稳定后分析结果。图1为经α粒子诱导转化的BEP2D细胞蛋白质组2-D电泳图,图像分析有1 041个蛋白点;图2为BEP2D细胞的电泳图,共有959个蛋白点。两者总蛋白点数相差82个。肉眼目测两张凝胶,可发现在酸性区(pH<7.0)蛋白点染色较深,蛋白质分布谱型差异不大,而在碱性蛋白区(pH>7.0),蛋白点染色较浅,分布差异较大。在分子量之间,蛋白图谱的变化更明显。两张凝胶计算机共配比858个点。差异蛋白点共有284个,转化细胞有183个;BEP2D永生化细胞有101个,其中94个蛋白点仅有丰度的差异,89个蛋白点是转化细胞独有的;7个是BEP2D细胞独有的。

, 百拇医药
图1 辐射诱导转化BEP2D细胞蛋白质组双向电泳图

图2 BEP2D细胞蛋白质组双向电泳图
三、讨论
目前,常采用差异显示技术研究转化细胞与正常细胞基因表达的差异。但用差异显示进行类似研究存在两个限制因素,第一,差异显示操作过程中不可避免地形成大量假阳性信号[4];第二,差异显示针对的是基因转录水平的变化,并不能真实的反映蛋白质或量的改变。而细胞表型改变的真正物质基础是蛋白质。1994年,澳大利亚的Wilkins 和Williams首先提出了蛋白质组和蛋白质组学(Proteomics)的概念。其主要基于3条理由[5]:①从mRNA表达水平并不能完全预测蛋白表达水平;②蛋白质的动态修饰和加工并非必须来自基因序列;③蛋白质组是动态反映生物系统所处的状态。故用寻找恶性转化相关蛋白来逆向寻找相关基因是一条探求细胞恶性转化的捷径。
, http://www.100md.com
正常细胞转化为癌细胞包括“启动-促进-发展”3个阶段。电离辐射是有效的诱变剂,目前多认为是一种启动因子。常引起染色体断裂、缺失和重组,包括原癌基因的重组与表达异常,有证据表明高LET电离辐射所致的DNA损伤以DNA双链断裂为主。根据辐射诱变特点,推测抑癌基因是辐射致癌的主要靶基因。所谓的靶学说,即认为,靶越大被击中的概率越大,靶的大小不但决定于该基因的实际大小,而且决定于该基因激活或失活的特点及条件[6]。
永生化BEP2D细胞和恶性转化的BEP2D细胞表达蛋白的差异结果表明,经α粒子辐射诱导后,BEP2D细胞的基因组表达序列发生了变化,出现了一系列新表达的蛋白质,其中可能既有已知的癌基因的蛋白产物,又有新的未知基因的产物。部分原有蛋白的丰度发生了变化。这点符合肿瘤细胞生物学的特点,诸如肿瘤细胞处于高代谢状态时,各种代谢酶和传递蛋白的丰度提高。同时一些抑制性调控蛋白和由此引起的级联反应蛋白表达减低或消失。
欲鉴定新的差异蛋白,须进行N端测序、氨基酸组成分析、质谱分析、肽质谱及数据库搜寻鉴定蛋白质[7]。目前,用银染的蛋白质进行鉴定尚有一系列的困难,且凝胶中的差异蛋白量极低,鉴定仍有困难。这也是蛋白质组研究需突破的瓶颈。必须进一步提高各蛋白点的含量,应用新的分析方法,提高质谱分析仪的灵敏度,使其达到可鉴定低拷贝蛋白的水平。从中可能会发现辐射诱导后新的表达蛋白。
, 百拇医药
目前双向电泳技术的分辨率尚不能分辨人基因组编码的全部蛋白质(约5万个),但应用该技术初步分析转化细胞的功能蛋白质组,说明在辐射诱导转化条件下,细胞蛋白质组谱有明显的表达不同。
感谢北京放射医学研究所罗凌、万晶红博士的帮助
参考文献
1,Sanchez JC,Appel RD,Hochstrasser DF,et al. Inside SWISS-2DPAGE database. Electrophoresis,1995,16:1131-1151.
2,2-D Electrophoresis using immobilized PH gradients principles and methods. Amersham pharmacia Biotech AB SE-75184 Uppsala Sweden,1998.
, http://www.100md.com
3,Gorg A,Obermaier C,Boguth G,et al. Very alkaline immobilized pH gradients for two-dimensional electrophoresis of ribosomal and nuclear protein. Electrophoresis,1997,18:328-337.
4,Regina VL,Niels B,Thomas B,et al. Rapid selection and classification of positive clones generated by mRNA differential display. Nucl Aci Res,1996,24:1385-1386.
5,Haynes PA,Gygi SP,Figeys D,et al. Proteome analysis:biological assay or data archive. Electrophoresis,1998,19:1862-1871.
, 百拇医药
6,Cox R. Molecular mechanisms of radiation oncogenesis. Int J Radiat Biol,1994,65:57-64.
7,Jensen ON,Larsen MR,Roepsrorff P,et al. Mass spectrometric identification and microcharacterization of proteins from electrophoretic gels:strategies and applications. Proteins,1998,(Suppl 2):74-89.
(收稿日期:1999-12-12), http://www.100md.com