腺苷的结构改造与细胞毒活性研究
作者:何军林* 张礼和
单位:(北京医科大学天然药物及仿生药物国家重点实验室, 北京 100085)
关键词:腺苷类似物;8-氯腺苷;维甲酸;细胞毒活性
药学学报990107.htm摘要 目的: 为寻找新型抗肿瘤化合物和探讨糖环羟基对8-Cl-腺苷的抗肿瘤活性的影响,合成了腺苷的维甲类似物和8-Cl-腺苷衍生物。方法: 对腺苷的8位和8-Cl-腺苷的糖环羟基进行了结构改造,以酰胺键和酯键在腺苷的8位连接了具共轭基团的肉桂酰基和苯甲酰基,得到腺苷的维甲类似物;对8-Cl-腺苷的5′-羟基进行了甲磺酰化,硝基化以及氯代反应,得到了它的衍生物。结果: 合成了(6~12),(16),(18~20)等11个新化合物。结论: 这些新化合物以HL-60,BIU,KB细胞株的细胞毒为指标进行生物活性筛选,结果表明,8-位取代基和5′-羟基是影响腺苷类化合物细胞毒活性的重要药效基团。
, http://www.100md.com
STRUCTURAL MODIFICATION AND
CYTOTOXIC ACTIVITY OF ADENOSINE
He Junlin(He JL) and Zhang Lihe(Zhang LH)
(National research laboratories of natural and biomimetic drugs,Beijing Medical University, Beijing 100083)
ABSTRACT AIM: In order to find new type of antitumor compounds and study the contribution of hydroxyl groups on the sugar part to the antitumor activity of 8-Cl-adenosine, the retinoid analogs of adenosine and the derivatives of 8-Cl-adenosine were synthesized. METHODS: Based on the antitumor activity and structural feature of 8-chloroadenosine and retinoic acid, modifications were made at positions 5′ and 8, (un)substituted cinnamoyl and benzoyl groups were bound at 8 position through amido and ester bonds, sulfonation and nitrosation at 5′-OH and its direct chlorination were conducted. RESULTS: Eleven new compounds were synthesized, they were (6~12), (16), (18~20). CONCLUSION: The cytotoxic activity to HL-60, BIU, and KB of the new compounds were not great. Modifications on the 5′-OH and other hydroxyl groups influenced the cytotoxic activities of 8-Cl-adenosine significantly. It is sugested that the substitutions at position 8 and the hydroxyl groups on the sugar ring play an important role for the antitumor activity of adenosine analogs.
, 百拇医药
KEY WORDS adenosine analogues; 8-chloroadenosine; retinoic acid; cytotoxic activity
8-氯腺苷和维甲酸在细胞的生长和调节中起着非常重要的作用,维甲酸可治疗白血病,8-氯腺苷对人和多种哺乳动物的恶性肿瘤有抑制生长作用[1,2]。8-氯腺苷的8位和维甲酸的共轭体系及极性部分对生物活性影响极大[3],为寻找新型抗肿瘤化合物,我们在腺苷的8位引入芳香酰胺基,酰氧基或含有共轭双键的芳香酰基和酰胺基,模拟维甲酸的共轭部分,利用各自的结构特点将两类化合物结合在一个化合物中,获得了一类新型化合物。
为改善8-氯腺苷的首过效应,增强抗肿瘤作用。我们采用三氯化硼或三溴化硼脱芳甲醚的甲基的方法,将8-甲氧基腺苷的8位甲氧基转化为羟基。由于反应物在二氯甲烷和氯仿中的溶解度小,加入DMF助溶, 方法简单,产率也高得多, 达96.2%。以8-氨基(羟基)-2′,3′,5′-三乙酰基腺苷为起始物合成腺苷的维甲类似物,用酰氯法,先将酸制备成酰氯, 在三乙胺或吡啶的存在下,在室温下即发生反应。对8-氯腺苷的改造集中在它的5′位羟基上,它的直接氯代是通过8-氯腺苷与氯化亚砜和六甲基磷酰胺完成的[4]。由于2′和3′位羟基没有保护,故生成2′和3′位羟基被亚磺酰化的中间体(19),使之不能发生氯代反应,但这一中间体在碱性条件下不稳定,当反应混合物用碳酸氢钠溶液中和时,便得到产物(20)。以2′,3′-原甲酸乙酯基-8-Cl-腺苷(13)作为直接氯代反应的反应物,由于保护基在反应条件下易脱去,所得的反应产物是(20)。在进行5′位羟基的酯化反应前,先用丙叉基保护8-氯腺苷的2′和3′羟基,然后用甲酸去保护得到产物。合成路线见图1。
, 百拇医药
将所合成的化合物以对HL-60,膀胱癌(BIU)和鼻咽癌(KB)细胞株的细胞毒性进行生物活性的初步筛选。结果表明,5′-氯-5′-去羟基-8-氯腺苷(20)对细胞毒活性最强,将这个化合物的2′和3′位羟基用亚砜基保护后,则没有了细胞毒活性。说明8位和糖环的3个羟基都对化合物的药理活性有贡献。
实验部分
仪器 VG-ZAB-MS质谱仪,300 MHz, Varian UXR-300,500 MHz, Bruker AM-500核磁共振仪,PE-240C元素分析仪。无水吡啶是吡啶(AR)经氢化钙回流24 h后蒸出,无水甲醇经甲醇镁回流8 h后蒸出后得到。二氯甲烷经用五氧化二磷回流8 h后蒸出。展开剂有以下系列:A,氯仿—甲醇(4∶1);B,乙酸乙酯—石油醚(3∶1);C,乙酸乙酯—环己烷(2∶1);D,氯仿—甲醇(8∶1);E,乙酸乙酯—乙醇(9∶1);F,乙酸乙酯—乙醇(80∶1)。
, 百拇医药 1 8-羟基腺苷(1)
将8-甲氧基腺苷[5]悬浮于干燥的CH2Cl2中,由于溶解度小,加入干燥的DMF助溶,在冰盐浴冷却下,滴加三溴化硼(0.4 ml)的CH2Cl2溶液(5 ml),滴加完毕后,其间出现短暂的澄清,然后变浑浊,直至大量固体析出。室温下继续搅拌24 h,以使反应完全,将混合物倾入冰水中,搅拌。有机层无紫外吸收,将水层浓缩,然后进行减压柱色谱得到产物95 mg,产率96.2%,Rf(C) 0.38。元素分析C10H13N5O5(M283),计算值%:C 42.40,H 4.59,N 24.73;测定值%:C 42.46,H 4.46,N 24.54。MS(FAB,M+1,284)。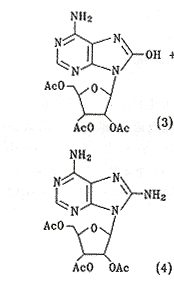







, 百拇医药
Fig 1 The synthesis of adenosine analogs.
2 8-羟基腺苷的乙酰化反应
将8-羟基腺苷60 mg(0.212 mmol)溶于干燥的吡啶中,向其中滴加乙酸酐(0.23 ml)后,在室温下搅拌10 h。TLC监测反应物至完全被乙酰化。减压(10 ml)蒸去大部分溶剂,加入冰水搅拌1 h后,用CHCl3萃取。此CHCl3溶液经干燥,蒸去溶剂后,FAB显示出有2个产物。因此扩大反应量。
(1) 3.14 g(11.1 mmol)溶于吡啶150 ml中,在室温下搅拌,滴加乙酸酐12 ml。处理方法同前,产物经TCL显示反应情况相同。因此用减压柱色谱分离。用EtOAc和石油醚梯度洗脱,得到2′,3′,5′-三乙酰化产物(3),重3.24 g,产率71.4%,Rf(E) 0.22,全乙酰化产物(5) (即8-OH也乙酰化) 0.5 g,产率10%,Rf(E) 0.70。元素分析L59-1,C18H29N5O9(M451),计算值%:C 47.89,H 4.66,N 15.52;测定值%:C 47.83,H 4.45,N 15.24。MS(FAB,M+1,452)。L59-2,C16H19N5O8(M409),计算值%:C 46.94,H 4.65,N 17.11;测定值%:C 46.59,H 4.35,N 16.89。MS(FAB,M+1,410)。
, 百拇医药
3 8-肉桂酰氧基-2′,3′,5′-三乙酰基腺苷(6)
肉桂酸0.45 g(3 mmol)溶于氯化亚砜5 ml中,加热至90℃回流4 h后,减压蒸去多余的氯化亚砜,得到浅黄色的油状物,冷至室温后,加入干燥的CH2Cl2 15 ml使其溶解,加入(3) 0.41 g,并滴加几滴干燥的吡啶,在室温下搅拌,溶液呈棕红色。6 h后,TLC监测反应物完全消失。减压蒸去溶剂,用常压柱色谱方法分离产物,CHCl3,石油醚和MeOH作梯度洗脱。得到产物0.26 g,产率为42.1%,Rf(D) 0.63,元素分析C25H25N5O9(M618),计算值%: C 58.04, H 4.91, N 13.22; 测定值%: C 58.25, H 4.85, N 13.59。MS(FAB,M+1,540)。1HNMR: δ 8.18(s,1H,2-H), 7.94(dd,2H,J=16 Hz,-CH=CH-), 7.49(m,5H,Harom), 6.12(1H,1′H), 6.12(1H,2′H), 5.77(m,1H,J=6.6 Hz,3′H), 4.39(m,1H,J4′3′=6.6 Hz,4′H), 4.49(dd,1H,Jab=12,Ja4′=3.5 Hz,5′a), 4.28(dd,1H,Jb4′=6.5 Hz,5′b), 2.12, 2.10, 2.06(s,9H,CH3CO)。
, http://www.100md.com
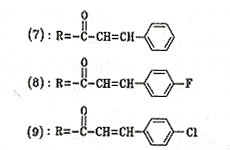
4 6-肉桂酰基-8-二肉桂酰胺基-2′,3′,5′-三乙酰基腺苷(7)
(4) 0.31 g(0.76 mmol) 8-氨基-2′,3′,5′-三乙酰基腺苷[6]溶于干燥的CH2Cl2溶液(10 ml)中,滴加入肉桂酰氯0.51 g(3.04 mmol)的CH2Cl2溶液5 ml,再加入几滴三乙胺,在室温下继续搅拌5 h,此混合物用常压柱色谱方法分离(两次),CHCl3,石油醚和MeOH梯度洗脱。得到8,6位三酰化产物0.21 g,产率为34.7%,Rf(D) 0.63,元素分析C43H38N6O10,计算值%:C 64.66,H 4.76,N 10.53;测定值%:C 65.09,H 4.90,N 10.26。MS(FAB,M+1,799), NMR: δ 8.71(s,1H,2-H), 7.98, 7.82, 7.75(dd,3H,Jαβ=15.5 Hz,烯基的Hβ), 6.77, 6.43(dd,3H,烯基Hα), 6.56[s(br),1H,1′H], 6.36[s(br),1H,2′H], 6.13[s(br),1H,1′H], 4.44(m,1H,J=3.36 Hz,5.92 Hz,4′H), 4.47, 4.34(m,2H,5′H), 2.18, 2.17, 2.06(s,9H,CH3CO)。
, http://www.100md.com
5 6-(4-F-肉桂酰基)-8-(4-F-肉桂酰胺基)-2′,3′,5′-三乙酰基腺苷(8)
4-F-肉桂酸0.83 g(5 mmol)溶于氯化亚砜10 ml中,回流4 h,减压蒸去多余的氯化亚砜,残余物用干燥的吡啶10 ml溶解,加入8-氨基-2′,3′,5′-三乙酰基腺苷0.61 g(1.5 mmol),溶液为棕红色,室温下搅拌5 h后,TLC监测反应物已经消失,减压蒸去溶剂,剩余物用EtOAc溶解,滤去不溶物,滤液用常压柱色谱分离,CHCl3,石油醚和MeOH作梯度洗脱。得到8,6位二酰化产物0.495 g,产率为46.3%,Rf(D) 0.55。元素分析C34H30F2N6O9.1/2H2O,计算值%: C 57.22, H 4.35, N 11.78; 测定值%: C 57.20, H 4.57, N 11.52。MS(FAB,M+1,705), NMR:δ 8.89(s,1H,6-NH), 8.45(s,1H,2-H), 8.48,7.16(dd,2H,Jβα=15.4 Hz,β-H), 6.62,6.52(dd,2H,α-H), 7.53(8H,Harom), 7.04(8H,Harom), 7.04(1H,1′H), 6.41(m,1H,2′H′), 6.14(brs,1H,3′H′), 4.44(1H,4′H′), 4.53(1H,5′aH), 4.32(1H,5′bH), 2.20(9H,CH3CO), 2.02(CH3CO)。
, 百拇医药
6 6-(4-Cl-肉桂酰基)-8-(4-Cl-肉桂酰胺基)-2,′3′,5′-三乙酰基腺苷(9)
4-Cl-肉桂酸0.91 g(5 mmol)溶于二氯亚砜10 ml中,于90℃回流5 h后,减压蒸去剩余的二氯亚砜,冷却至室温,用干燥的CH2Cl2 10 ml溶解残余物,然后加入(4) 0.61 g(1.5 mmol)和三乙胺2 ml,在室温下搅拌5 h。溶液为深棕红色。减压蒸去溶剂,加入EtOAc溶解。过滤除去不溶物后,用常压柱色谱分离(两次)。石油醚,CHCl3梯度洗脱。用乙酸乙酯和石油醚重结晶,得淡黄色固体0.17 g,产率15%。 Rf(D) 0.63。元素分析C34H30Cl2N6O9.0.5H2O(M746), 计算值%: C 54.69, H 4.16, N 11.26; 测定值%: C 54.70, H 4.23, N 11.48。
, http://www.100md.com
7 6-苯甲酰基-8-苯甲酰胺基-2′,3′,5′-三乙酰基腺苷(10)
将干燥的8-氨基-2′,3′,5′-三乙酰基腺苷溶于干燥的吡啶中,滴加苯甲酰氯0.21 ml,在室温下搅拌, 5 h后TLC监测反应已完全。 将混合物蒸干,用减压柱色谱法分离各组分,EtOAc和环己烷作梯度洗脱,Rf(C) 0.72,得产物0.27 g,产率60%。元素分析 C30H27N6O9(M615),计算值%: C 58.54, H 4.39, N 13.66; 测定值%: C 58.73, H 4.57, N 13.94。
8 6-对甲苯甲酰基-8-对甲苯甲酰胺基-2′,3′,5′-三乙酰基-腺苷(11)
对甲苯甲酸0.4 g(2.94 mmol)与氯化亚砜4 ml在90℃回流4 h后,减压除去过量的氯化亚砜。加入吡啶5 ml溶解残留物。冷却后,加入到8-氨基-2′,3′,5′-三乙酰基腺苷(4)0.408 g(1 mmol)的无水吡啶溶液(10 ml)中。室温下反应4 h。产物用常压柱色谱分离,乙酸乙酯和石油醚梯度洗脱。得产物0.22 g,产率30.4%,Rf(D) 0.57。元素分析C32H32N6O9.C5H5N,计算值%:C 61.41,H 5.12,N 13.55;测定值%:C 61.86,H 5.22,N 12.98。1HNMR: δ 13.14(s,1H,8-NHCO), 9.04(s,1H,6-NHCO), 8.54(s,1H,2-H),7.97,7.35,7.26,8.26(m,10H,Harom), 6.62(1H,J1′2′=4.0 Hz,1′H), 6.45(1H,J2′1′=4.0 Hz,J2′3′=6.5 Hz,2′H), 5.96(1H,J3′2′=6.5 Hz,J3′4′=6.5 Hz,3′H), 4.41(1H,J4′3′=6.5 Hz,3.5 Hz,5.5 Hz,4′H), 4.51(m,1H,Jab=12.0 Hz,Ja4′=3.5 Hz,5′bH,5′aH), 4.30(m,1H,Jba=12.0 Hz, Jb4′=5.5 Hz)。
, 百拇医药
9 6-苯甲酰基-8-苯甲酰胺基腺苷(12)
(10) 0.225 g(0.366 mmol)溶于CH3ONa/MeOH 4 ml(0.1 mol.L-1)溶液和干燥MeOH 10 ml中, 在室温下反应10 h。用稀醋酸中和此混合物,然后用减压柱色谱法分离,得到(12) 60 mg,产率为33.5%。Rf(D) 0.41。元素分析C24H21N6O6(M489), 计算值%: C 58.90, H 4.29, N 17.18; 测定值%: C 58.59, H 4.17, N 16.93。1HNMR: 12.75(s,1H,8-NH), 11.75(s,1H,6-NH), 8.71(s,1H,2-H), 8.23,7.56(m,10H,Harom), 6.40(d,1H,J1′2′=5.5 Hz,1′H), 5.20(T,1H,J2′1′=5.5 Hz,2′H), 4.38(t,1H,J2′3′=5.5 Hz,J3′4′=9 Hz,3′H), 3.98(m,1H,J4′5′=5.5 Hz,4′H), 3.73(m,1H,Jab=12 Hz,Ja4′=4.5 Hz,5′aH), 3.56(m,1H,Jb′4′=5.5 Hz,5′bH)。
, 百拇医药
10 2′,3′-原甲酸乙酯基-8-Cl-腺苷(13)
8-Cl-腺苷2 g(6.62 mmol)和原甲酸乙酯5.3 ml;三氯乙酸4.66 g和二氧六环53 ml的混合物在60℃加热反应4 h,TLC监测反应完全[7]。用CH2Cl2 100 ml稀释此溶液,然后用NaCO3溶液和H2O各洗3次。干燥,除去溶剂后,用无水EtOH重结晶,得到产物2.11 g,产率89.2%。NMR证实为非对映异构体混合物, Rf(D) 0.87。1HNMR: 异构体I,δ 8.19(s,1H,2-H), 7.57(s,2H,6-NH2), 6.23(s,1H,原甲酸乙酯的H), 6.20(d,1H,J1′2′=2.7 Hz,1′H), 5.78(dd,1H,J1′2′=2.7 Hz,J2′3′=6.6 Hz,2′H), 5.14(m,1H,J3′4′=3.6 Hz,3′H), 4.28(m,1H,J4′5′=6.6 Hz,4′H), 3.50~3.37(m,2H,5′H), 4.21(m,2H,J=6.6 Hz,-CH2-), 1.22(t,3H,-CH3), 5.16~5.01(br,1H,5′-OH)。异构体II, δ 8.17(s,1H,2-H), 7.57(s,2H,6-NH2), 6.17(s,1H,原甲酸酯的H), 6.07(s,1H,1′H), 5.73(dd,1H,J1′2′=3 Hz,2′H), 5.02(m,1H,J3′4′=3.6 Hz,3′H), 4.19(m,1H,J4′5′=3.8 Hz,4′H), 3.50~3.37(m,1H,5′H), 4.21(m,2H,J=6.6,-CH2-), 1.13(t,3H,CH3), 5.16~5.01(m,1H,5′-OH)。
, 百拇医药
11 2′,3′-丙叉基-8-Cl-腺苷(14)
8-Cl-腺苷0.3 g(1 mmol)于普通丙酮中剧烈搅拌,在冰浴冷却下,分批滴加硫酸0.15 ml。维持反应温度在(0.5~10)℃。滴加完毕后,再继续搅拌5 h。在此期间,温度逐渐升至室温。反应完成后,在冰浴冷却下,用NaOH溶液中和至中性,过夜,过滤除去盐,滤液浓缩后用氯仿溶解,水洗此氯仿溶液,并用常压柱色谱法分离出产物0.32 g, Rf(C) 0.89,元素分析C13H16ClN5O4(M342),计算值%: C 45.61, H 4.68, N 20.47; 测定值%: C 45.24, H 4.47, N 20.24。
12 2′,3′-丙叉基-5′-O-甲磺酰基-8-Cl-腺苷(15)[8]
, 百拇医药
将(14) 1 g(2.93 mmol)溶于干燥吡啶30 ml中,在冰浴冷却下,滴加甲磺酰氯0.5 ml。溶液即变黄色。在此温度下搅拌4 h。减压蒸去溶剂,用减压柱色谱法分离。EtOAc和EtOH梯度洗脱,得产物0.39 g,产率31.7%,Rf(B) 0.78。
13 5′-O-甲磺酰基-8-Cl-腺苷(16)
将(15) 0.21 g(0.5 mmol)溶于HCOOH(80%) 2.5 ml中,室温下搅拌10 h。然后减压蒸去HCOOH,并用无水EtOH重蒸3次。残余物用常压柱色谱法分离。石油醚和乙酸乙酯作梯度洗脱,得到白色固体0.13 g,产率68%,元素分析C11H14ClN5O6S(M380),计算值%:C 34.74,H 3.68,N 18.42;测定值%:C 34.97,H 3.72,N 18.19。
, 百拇医药
14 2′,3′-丙叉基-5′-O-硝基-8-Cl-腺苷(17)
将浓HNO3 1.4 ml滴加入冰盐浴冷却的等体积的乙酸酐中,得到混合酸酐。(14) 0.26 g(0.7 mmol) 溶于EtOAc中,用冰盐浴冷却至-30℃。取混合酸酐1 ml滴加入(14)的溶液中,反应混合物在此温度下继续反应,4.5 h后,用NaHCO3溶液中和。有机层和H2O层分开,H2O层用EtOAc萃取3次。合并EtOAc溶液,干燥,用减压柱色谱法得到0.2 g产物(白色固体),产率74.1%,Rf(C) 0.44。元素分析C13H15ClN6O6.H2O(M387),计算值%: C 40.31, H 3.88, N 21.71; 测定值%: C 39.84, H 3.96, N 21.46。
, 百拇医药
15 (17)的去保护反应5′-O-硝基-8-Cl-腺苷(18)
将(17)溶于88%的HCOOH中,在室温下搅拌10 h,减压蒸去HCOOH,再用无水EtOH重蒸3次。反应混合物用常压柱色谱法分离。EtOAc和石油醚梯度洗脱。得到产物60 mg,产率61.8%。Rf(B) 0.74,元素分析C10H11ClN6O6(M347), 计算值%: C 34.58, H 3.17, N 24.21; 测定值%: C 34.83, H 3.32, N 23.86。
16 5′-氯-5′-去氧-2′,3′-亚砜基-8-Cl-腺苷(19)
将(13)代替8-Cl-腺苷与HMPA和SOCl2的混合物反应。反应混合物用减压柱色谱分离,乙酸乙酯、环己烷和EtOH梯度洗脱,得到产物0.2 g,产率32.8%。Rf(F) 0.78。元素分析C10H9Cl2N5O4S.H2O(M370.5), 计算值%: C 32.38, H 2.56, N 18.89; 测定值%: C 32.78, H 2.53, N 18.57。1HNMR: δ 6.43(d,1H,J1′2′=2.4 Hz,1′H), 6.39(m,1H,J1′2′=2.4 Hz,J2′,3′=7.5 Hz,2′H), 5.87(m,1H,J2′,3′=7.5 Hz,J3′,4′=3.9 Hz,3′H), 4.73(m,1H,J=3.9,6.0,7.2 Hz,4′H), 3.86(m,2H,Jab=11.1, Ja4′=7.2 Hz,Jb4′=6.3 Hz,5′H), 7.64(s,2H,6-NH2), 8.19(s,1H,2-H)。
, 百拇医药
17 5′-氯-5′-去氧-8-Cl-腺苷(20)[9]
六甲基磷酰胺(HMPA)1.6 ml用冰浴冷却,向其中滴加SOCl2 0.24 ml。在0℃搅拌下15 min后,投入8-Cl-腺苷0.3 g(1 mmol)。反应2 h。室温下搅拌过夜。溶液呈鲜红色。将混合物倾入冰H2O 25 ml中,NaHCO3溶液中和至中性,用减压柱色谱分离,EtOAc和EtOH梯度洗脱。得到白色固体0.1 g,产率31.3%,Rf(B) 0.90。元素分析C10H11Cl2N5O3,计算值%: C 37.50, H 3.44, N 21.88; 测定值%: C 37.87, H 3.78, N 21.48。
致谢 王书玉教授提供取代肉桂酸;重点实验室的元素分析实验室和核磁室,中心实验室质谱室,北京大学和防化院核磁室,中国科学院化学所协作完成了核磁共振,质谱和元素分析;重点实验室王瑞卿等老师完成初步生物活性筛选实验。
, 百拇医药
*联系人现址:军事医学科学院毒物药物研究所,北京 100850
Tel:(010)66887429-66611
参考文献
1 方家椿,石永进,彭敏,等. 8-氯腺苷的抗肿瘤作用研究. 中华肿瘤杂志, 1995,17∶5
2 王宪焘,郑德先,刘睿,等. 8-氯腺苷诱导MOLT-4细胞凋亡. 科学通报, 1997,42∶189
3 Lin Z, Nadzan AM, Heyman RA, et al. Discovery of novel retinoicacid receptor agonists having potent antiproliferative activity in cervical cancer cells. J Med Chem, 1996,39∶2659
, 百拇医药
4 Holy A, Rosenberg I. An improved synthesis of S-adenosyl-L-nomocystein and related compounds. Collect Czech Chem Commun, 1985,50∶1514
5 Long RA, Robins RK, Townsend LB. Purine nucleosides, XV. The synthesis of 8-amino- and 8-substituted aminopurine nucleosides. Biochemistry, 1967,32∶2751
6 Ikehara M, Yamada S. Studies of nucleosides and nucleotides. XLIX. Synthesis of 8-fluoroadenosine. Chem Pharm Bull, 1971,19∶104
, http://www.100md.com
7 Eckstein F, Cramer F. Notize uber 2′,3′-O-athoxy-methylen-derivate von Ribonucleosiden. Chem Ber, 1965∶995
8 Sharma M, Wikiel H, Hromchak R, et al. Synthesis of 5′-substituted derivatives of the pyrrolo[2,3-d]-pyrimidine nucleoside sangivamycin and their effect on protein kinase A and C. Nucleosides and Nudeotides, 1993,12(3 & 4)∶295
9 Prisbe EJ, Smejkal J, Verheyden JPH, et al. Halo sugar nucleosides. 5. Synthesis of angustmycin A and some base analogues. J Org Chem, 1976,41∶1836
收稿日期: 1997-11-28, 百拇医药(何军林* 张礼和)
单位:(北京医科大学天然药物及仿生药物国家重点实验室, 北京 100085)
关键词:腺苷类似物;8-氯腺苷;维甲酸;细胞毒活性
药学学报990107.htm摘要 目的: 为寻找新型抗肿瘤化合物和探讨糖环羟基对8-Cl-腺苷的抗肿瘤活性的影响,合成了腺苷的维甲类似物和8-Cl-腺苷衍生物。方法: 对腺苷的8位和8-Cl-腺苷的糖环羟基进行了结构改造,以酰胺键和酯键在腺苷的8位连接了具共轭基团的肉桂酰基和苯甲酰基,得到腺苷的维甲类似物;对8-Cl-腺苷的5′-羟基进行了甲磺酰化,硝基化以及氯代反应,得到了它的衍生物。结果: 合成了(6~12),(16),(18~20)等11个新化合物。结论: 这些新化合物以HL-60,BIU,KB细胞株的细胞毒为指标进行生物活性筛选,结果表明,8-位取代基和5′-羟基是影响腺苷类化合物细胞毒活性的重要药效基团。
, http://www.100md.com
STRUCTURAL MODIFICATION AND
CYTOTOXIC ACTIVITY OF ADENOSINE
He Junlin(He JL) and Zhang Lihe(Zhang LH)
(National research laboratories of natural and biomimetic drugs,Beijing Medical University, Beijing 100083)
ABSTRACT AIM: In order to find new type of antitumor compounds and study the contribution of hydroxyl groups on the sugar part to the antitumor activity of 8-Cl-adenosine, the retinoid analogs of adenosine and the derivatives of 8-Cl-adenosine were synthesized. METHODS: Based on the antitumor activity and structural feature of 8-chloroadenosine and retinoic acid, modifications were made at positions 5′ and 8, (un)substituted cinnamoyl and benzoyl groups were bound at 8 position through amido and ester bonds, sulfonation and nitrosation at 5′-OH and its direct chlorination were conducted. RESULTS: Eleven new compounds were synthesized, they were (6~12), (16), (18~20). CONCLUSION: The cytotoxic activity to HL-60, BIU, and KB of the new compounds were not great. Modifications on the 5′-OH and other hydroxyl groups influenced the cytotoxic activities of 8-Cl-adenosine significantly. It is sugested that the substitutions at position 8 and the hydroxyl groups on the sugar ring play an important role for the antitumor activity of adenosine analogs.
, 百拇医药
KEY WORDS adenosine analogues; 8-chloroadenosine; retinoic acid; cytotoxic activity
8-氯腺苷和维甲酸在细胞的生长和调节中起着非常重要的作用,维甲酸可治疗白血病,8-氯腺苷对人和多种哺乳动物的恶性肿瘤有抑制生长作用[1,2]。8-氯腺苷的8位和维甲酸的共轭体系及极性部分对生物活性影响极大[3],为寻找新型抗肿瘤化合物,我们在腺苷的8位引入芳香酰胺基,酰氧基或含有共轭双键的芳香酰基和酰胺基,模拟维甲酸的共轭部分,利用各自的结构特点将两类化合物结合在一个化合物中,获得了一类新型化合物。
为改善8-氯腺苷的首过效应,增强抗肿瘤作用。我们采用三氯化硼或三溴化硼脱芳甲醚的甲基的方法,将8-甲氧基腺苷的8位甲氧基转化为羟基。由于反应物在二氯甲烷和氯仿中的溶解度小,加入DMF助溶, 方法简单,产率也高得多, 达96.2%。以8-氨基(羟基)-2′,3′,5′-三乙酰基腺苷为起始物合成腺苷的维甲类似物,用酰氯法,先将酸制备成酰氯, 在三乙胺或吡啶的存在下,在室温下即发生反应。对8-氯腺苷的改造集中在它的5′位羟基上,它的直接氯代是通过8-氯腺苷与氯化亚砜和六甲基磷酰胺完成的[4]。由于2′和3′位羟基没有保护,故生成2′和3′位羟基被亚磺酰化的中间体(19),使之不能发生氯代反应,但这一中间体在碱性条件下不稳定,当反应混合物用碳酸氢钠溶液中和时,便得到产物(20)。以2′,3′-原甲酸乙酯基-8-Cl-腺苷(13)作为直接氯代反应的反应物,由于保护基在反应条件下易脱去,所得的反应产物是(20)。在进行5′位羟基的酯化反应前,先用丙叉基保护8-氯腺苷的2′和3′羟基,然后用甲酸去保护得到产物。合成路线见图1。
, 百拇医药
将所合成的化合物以对HL-60,膀胱癌(BIU)和鼻咽癌(KB)细胞株的细胞毒性进行生物活性的初步筛选。结果表明,5′-氯-5′-去羟基-8-氯腺苷(20)对细胞毒活性最强,将这个化合物的2′和3′位羟基用亚砜基保护后,则没有了细胞毒活性。说明8位和糖环的3个羟基都对化合物的药理活性有贡献。
实验部分
仪器 VG-ZAB-MS质谱仪,300 MHz, Varian UXR-300,500 MHz, Bruker AM-500核磁共振仪,PE-240C元素分析仪。无水吡啶是吡啶(AR)经氢化钙回流24 h后蒸出,无水甲醇经甲醇镁回流8 h后蒸出后得到。二氯甲烷经用五氧化二磷回流8 h后蒸出。展开剂有以下系列:A,氯仿—甲醇(4∶1);B,乙酸乙酯—石油醚(3∶1);C,乙酸乙酯—环己烷(2∶1);D,氯仿—甲醇(8∶1);E,乙酸乙酯—乙醇(9∶1);F,乙酸乙酯—乙醇(80∶1)。
, 百拇医药 1 8-羟基腺苷(1)
将8-甲氧基腺苷[5]悬浮于干燥的CH2Cl2中,由于溶解度小,加入干燥的DMF助溶,在冰盐浴冷却下,滴加三溴化硼(0.4 ml)的CH2Cl2溶液(5 ml),滴加完毕后,其间出现短暂的澄清,然后变浑浊,直至大量固体析出。室温下继续搅拌24 h,以使反应完全,将混合物倾入冰水中,搅拌。有机层无紫外吸收,将水层浓缩,然后进行减压柱色谱得到产物95 mg,产率96.2%,Rf(C) 0.38。元素分析C10H13N5O5(M283),计算值%:C 42.40,H 4.59,N 24.73;测定值%:C 42.46,H 4.46,N 24.54。MS(FAB,M+1,284)。









, 百拇医药
Fig 1 The synthesis of adenosine analogs.
2 8-羟基腺苷的乙酰化反应
将8-羟基腺苷60 mg(0.212 mmol)溶于干燥的吡啶中,向其中滴加乙酸酐(0.23 ml)后,在室温下搅拌10 h。TLC监测反应物至完全被乙酰化。减压(10 ml)蒸去大部分溶剂,加入冰水搅拌1 h后,用CHCl3萃取。此CHCl3溶液经干燥,蒸去溶剂后,FAB显示出有2个产物。因此扩大反应量。
(1) 3.14 g(11.1 mmol)溶于吡啶150 ml中,在室温下搅拌,滴加乙酸酐12 ml。处理方法同前,产物经TCL显示反应情况相同。因此用减压柱色谱分离。用EtOAc和石油醚梯度洗脱,得到2′,3′,5′-三乙酰化产物(3),重3.24 g,产率71.4%,Rf(E) 0.22,全乙酰化产物(5) (即8-OH也乙酰化) 0.5 g,产率10%,Rf(E) 0.70。元素分析L59-1,C18H29N5O9(M451),计算值%:C 47.89,H 4.66,N 15.52;测定值%:C 47.83,H 4.45,N 15.24。MS(FAB,M+1,452)。L59-2,C16H19N5O8(M409),计算值%:C 46.94,H 4.65,N 17.11;测定值%:C 46.59,H 4.35,N 16.89。MS(FAB,M+1,410)。
, 百拇医药
3 8-肉桂酰氧基-2′,3′,5′-三乙酰基腺苷(6)
肉桂酸0.45 g(3 mmol)溶于氯化亚砜5 ml中,加热至90℃回流4 h后,减压蒸去多余的氯化亚砜,得到浅黄色的油状物,冷至室温后,加入干燥的CH2Cl2 15 ml使其溶解,加入(3) 0.41 g,并滴加几滴干燥的吡啶,在室温下搅拌,溶液呈棕红色。6 h后,TLC监测反应物完全消失。减压蒸去溶剂,用常压柱色谱方法分离产物,CHCl3,石油醚和MeOH作梯度洗脱。得到产物0.26 g,产率为42.1%,Rf(D) 0.63,元素分析C25H25N5O9(M618),计算值%: C 58.04, H 4.91, N 13.22; 测定值%: C 58.25, H 4.85, N 13.59。MS(FAB,M+1,540)。1HNMR: δ 8.18(s,1H,2-H), 7.94(dd,2H,J=16 Hz,-CH=CH-), 7.49(m,5H,Harom), 6.12(1H,1′H), 6.12(1H,2′H), 5.77(m,1H,J=6.6 Hz,3′H), 4.39(m,1H,J4′3′=6.6 Hz,4′H), 4.49(dd,1H,Jab=12,Ja4′=3.5 Hz,5′a), 4.28(dd,1H,Jb4′=6.5 Hz,5′b), 2.12, 2.10, 2.06(s,9H,CH3CO)。
, http://www.100md.com
4 6-肉桂酰基-8-二肉桂酰胺基-2′,3′,5′-三乙酰基腺苷(7)
(4) 0.31 g(0.76 mmol) 8-氨基-2′,3′,5′-三乙酰基腺苷[6]溶于干燥的CH2Cl2溶液(10 ml)中,滴加入肉桂酰氯0.51 g(3.04 mmol)的CH2Cl2溶液5 ml,再加入几滴三乙胺,在室温下继续搅拌5 h,此混合物用常压柱色谱方法分离(两次),CHCl3,石油醚和MeOH梯度洗脱。得到8,6位三酰化产物0.21 g,产率为34.7%,Rf(D) 0.63,元素分析C43H38N6O10,计算值%:C 64.66,H 4.76,N 10.53;测定值%:C 65.09,H 4.90,N 10.26。MS(FAB,M+1,799), NMR: δ 8.71(s,1H,2-H), 7.98, 7.82, 7.75(dd,3H,Jαβ=15.5 Hz,烯基的Hβ), 6.77, 6.43(dd,3H,烯基Hα), 6.56[s(br),1H,1′H], 6.36[s(br),1H,2′H], 6.13[s(br),1H,1′H], 4.44(m,1H,J=3.36 Hz,5.92 Hz,4′H), 4.47, 4.34(m,2H,5′H), 2.18, 2.17, 2.06(s,9H,CH3CO)。
, http://www.100md.com
5 6-(4-F-肉桂酰基)-8-(4-F-肉桂酰胺基)-2′,3′,5′-三乙酰基腺苷(8)
4-F-肉桂酸0.83 g(5 mmol)溶于氯化亚砜10 ml中,回流4 h,减压蒸去多余的氯化亚砜,残余物用干燥的吡啶10 ml溶解,加入8-氨基-2′,3′,5′-三乙酰基腺苷0.61 g(1.5 mmol),溶液为棕红色,室温下搅拌5 h后,TLC监测反应物已经消失,减压蒸去溶剂,剩余物用EtOAc溶解,滤去不溶物,滤液用常压柱色谱分离,CHCl3,石油醚和MeOH作梯度洗脱。得到8,6位二酰化产物0.495 g,产率为46.3%,Rf(D) 0.55。元素分析C34H30F2N6O9.1/2H2O,计算值%: C 57.22, H 4.35, N 11.78; 测定值%: C 57.20, H 4.57, N 11.52。MS(FAB,M+1,705), NMR:δ 8.89(s,1H,6-NH), 8.45(s,1H,2-H), 8.48,7.16(dd,2H,Jβα=15.4 Hz,β-H), 6.62,6.52(dd,2H,α-H), 7.53(8H,Harom), 7.04(8H,Harom), 7.04(1H,1′H), 6.41(m,1H,2′H′), 6.14(brs,1H,3′H′), 4.44(1H,4′H′), 4.53(1H,5′aH), 4.32(1H,5′bH), 2.20(9H,CH3CO), 2.02(CH3CO)。
, 百拇医药
6 6-(4-Cl-肉桂酰基)-8-(4-Cl-肉桂酰胺基)-2,′3′,5′-三乙酰基腺苷(9)
4-Cl-肉桂酸0.91 g(5 mmol)溶于二氯亚砜10 ml中,于90℃回流5 h后,减压蒸去剩余的二氯亚砜,冷却至室温,用干燥的CH2Cl2 10 ml溶解残余物,然后加入(4) 0.61 g(1.5 mmol)和三乙胺2 ml,在室温下搅拌5 h。溶液为深棕红色。减压蒸去溶剂,加入EtOAc溶解。过滤除去不溶物后,用常压柱色谱分离(两次)。石油醚,CHCl3梯度洗脱。用乙酸乙酯和石油醚重结晶,得淡黄色固体0.17 g,产率15%。 Rf(D) 0.63。元素分析C34H30Cl2N6O9.0.5H2O(M746), 计算值%: C 54.69, H 4.16, N 11.26; 测定值%: C 54.70, H 4.23, N 11.48。
, http://www.100md.com
7 6-苯甲酰基-8-苯甲酰胺基-2′,3′,5′-三乙酰基腺苷(10)
将干燥的8-氨基-2′,3′,5′-三乙酰基腺苷溶于干燥的吡啶中,滴加苯甲酰氯0.21 ml,在室温下搅拌, 5 h后TLC监测反应已完全。 将混合物蒸干,用减压柱色谱法分离各组分,EtOAc和环己烷作梯度洗脱,Rf(C) 0.72,得产物0.27 g,产率60%。元素分析 C30H27N6O9(M615),计算值%: C 58.54, H 4.39, N 13.66; 测定值%: C 58.73, H 4.57, N 13.94。
8 6-对甲苯甲酰基-8-对甲苯甲酰胺基-2′,3′,5′-三乙酰基-腺苷(11)
对甲苯甲酸0.4 g(2.94 mmol)与氯化亚砜4 ml在90℃回流4 h后,减压除去过量的氯化亚砜。加入吡啶5 ml溶解残留物。冷却后,加入到8-氨基-2′,3′,5′-三乙酰基腺苷(4)0.408 g(1 mmol)的无水吡啶溶液(10 ml)中。室温下反应4 h。产物用常压柱色谱分离,乙酸乙酯和石油醚梯度洗脱。得产物0.22 g,产率30.4%,Rf(D) 0.57。元素分析C32H32N6O9.C5H5N,计算值%:C 61.41,H 5.12,N 13.55;测定值%:C 61.86,H 5.22,N 12.98。1HNMR: δ 13.14(s,1H,8-NHCO), 9.04(s,1H,6-NHCO), 8.54(s,1H,2-H),7.97,7.35,7.26,8.26(m,10H,Harom), 6.62(1H,J1′2′=4.0 Hz,1′H), 6.45(1H,J2′1′=4.0 Hz,J2′3′=6.5 Hz,2′H), 5.96(1H,J3′2′=6.5 Hz,J3′4′=6.5 Hz,3′H), 4.41(1H,J4′3′=6.5 Hz,3.5 Hz,5.5 Hz,4′H), 4.51(m,1H,Jab=12.0 Hz,Ja4′=3.5 Hz,5′bH,5′aH), 4.30(m,1H,Jba=12.0 Hz, Jb4′=5.5 Hz)。
, 百拇医药
9 6-苯甲酰基-8-苯甲酰胺基腺苷(12)
(10) 0.225 g(0.366 mmol)溶于CH3ONa/MeOH 4 ml(0.1 mol.L-1)溶液和干燥MeOH 10 ml中, 在室温下反应10 h。用稀醋酸中和此混合物,然后用减压柱色谱法分离,得到(12) 60 mg,产率为33.5%。Rf(D) 0.41。元素分析C24H21N6O6(M489), 计算值%: C 58.90, H 4.29, N 17.18; 测定值%: C 58.59, H 4.17, N 16.93。1HNMR: 12.75(s,1H,8-NH), 11.75(s,1H,6-NH), 8.71(s,1H,2-H), 8.23,7.56(m,10H,Harom), 6.40(d,1H,J1′2′=5.5 Hz,1′H), 5.20(T,1H,J2′1′=5.5 Hz,2′H), 4.38(t,1H,J2′3′=5.5 Hz,J3′4′=9 Hz,3′H), 3.98(m,1H,J4′5′=5.5 Hz,4′H), 3.73(m,1H,Jab=12 Hz,Ja4′=4.5 Hz,5′aH), 3.56(m,1H,Jb′4′=5.5 Hz,5′bH)。
, 百拇医药
10 2′,3′-原甲酸乙酯基-8-Cl-腺苷(13)
8-Cl-腺苷2 g(6.62 mmol)和原甲酸乙酯5.3 ml;三氯乙酸4.66 g和二氧六环53 ml的混合物在60℃加热反应4 h,TLC监测反应完全[7]。用CH2Cl2 100 ml稀释此溶液,然后用NaCO3溶液和H2O各洗3次。干燥,除去溶剂后,用无水EtOH重结晶,得到产物2.11 g,产率89.2%。NMR证实为非对映异构体混合物, Rf(D) 0.87。1HNMR: 异构体I,δ 8.19(s,1H,2-H), 7.57(s,2H,6-NH2), 6.23(s,1H,原甲酸乙酯的H), 6.20(d,1H,J1′2′=2.7 Hz,1′H), 5.78(dd,1H,J1′2′=2.7 Hz,J2′3′=6.6 Hz,2′H), 5.14(m,1H,J3′4′=3.6 Hz,3′H), 4.28(m,1H,J4′5′=6.6 Hz,4′H), 3.50~3.37(m,2H,5′H), 4.21(m,2H,J=6.6 Hz,-CH2-), 1.22(t,3H,-CH3), 5.16~5.01(br,1H,5′-OH)。异构体II, δ 8.17(s,1H,2-H), 7.57(s,2H,6-NH2), 6.17(s,1H,原甲酸酯的H), 6.07(s,1H,1′H), 5.73(dd,1H,J1′2′=3 Hz,2′H), 5.02(m,1H,J3′4′=3.6 Hz,3′H), 4.19(m,1H,J4′5′=3.8 Hz,4′H), 3.50~3.37(m,1H,5′H), 4.21(m,2H,J=6.6,-CH2-), 1.13(t,3H,CH3), 5.16~5.01(m,1H,5′-OH)。
, 百拇医药
11 2′,3′-丙叉基-8-Cl-腺苷(14)
8-Cl-腺苷0.3 g(1 mmol)于普通丙酮中剧烈搅拌,在冰浴冷却下,分批滴加硫酸0.15 ml。维持反应温度在(0.5~10)℃。滴加完毕后,再继续搅拌5 h。在此期间,温度逐渐升至室温。反应完成后,在冰浴冷却下,用NaOH溶液中和至中性,过夜,过滤除去盐,滤液浓缩后用氯仿溶解,水洗此氯仿溶液,并用常压柱色谱法分离出产物0.32 g, Rf(C) 0.89,元素分析C13H16ClN5O4(M342),计算值%: C 45.61, H 4.68, N 20.47; 测定值%: C 45.24, H 4.47, N 20.24。
12 2′,3′-丙叉基-5′-O-甲磺酰基-8-Cl-腺苷(15)[8]
, 百拇医药
将(14) 1 g(2.93 mmol)溶于干燥吡啶30 ml中,在冰浴冷却下,滴加甲磺酰氯0.5 ml。溶液即变黄色。在此温度下搅拌4 h。减压蒸去溶剂,用减压柱色谱法分离。EtOAc和EtOH梯度洗脱,得产物0.39 g,产率31.7%,Rf(B) 0.78。
13 5′-O-甲磺酰基-8-Cl-腺苷(16)
将(15) 0.21 g(0.5 mmol)溶于HCOOH(80%) 2.5 ml中,室温下搅拌10 h。然后减压蒸去HCOOH,并用无水EtOH重蒸3次。残余物用常压柱色谱法分离。石油醚和乙酸乙酯作梯度洗脱,得到白色固体0.13 g,产率68%,元素分析C11H14ClN5O6S(M380),计算值%:C 34.74,H 3.68,N 18.42;测定值%:C 34.97,H 3.72,N 18.19。
, 百拇医药
14 2′,3′-丙叉基-5′-O-硝基-8-Cl-腺苷(17)
将浓HNO3 1.4 ml滴加入冰盐浴冷却的等体积的乙酸酐中,得到混合酸酐。(14) 0.26 g(0.7 mmol) 溶于EtOAc中,用冰盐浴冷却至-30℃。取混合酸酐1 ml滴加入(14)的溶液中,反应混合物在此温度下继续反应,4.5 h后,用NaHCO3溶液中和。有机层和H2O层分开,H2O层用EtOAc萃取3次。合并EtOAc溶液,干燥,用减压柱色谱法得到0.2 g产物(白色固体),产率74.1%,Rf(C) 0.44。元素分析C13H15ClN6O6.H2O(M387),计算值%: C 40.31, H 3.88, N 21.71; 测定值%: C 39.84, H 3.96, N 21.46。
, 百拇医药
15 (17)的去保护反应5′-O-硝基-8-Cl-腺苷(18)
将(17)溶于88%的HCOOH中,在室温下搅拌10 h,减压蒸去HCOOH,再用无水EtOH重蒸3次。反应混合物用常压柱色谱法分离。EtOAc和石油醚梯度洗脱。得到产物60 mg,产率61.8%。Rf(B) 0.74,元素分析C10H11ClN6O6(M347), 计算值%: C 34.58, H 3.17, N 24.21; 测定值%: C 34.83, H 3.32, N 23.86。
16 5′-氯-5′-去氧-2′,3′-亚砜基-8-Cl-腺苷(19)
将(13)代替8-Cl-腺苷与HMPA和SOCl2的混合物反应。反应混合物用减压柱色谱分离,乙酸乙酯、环己烷和EtOH梯度洗脱,得到产物0.2 g,产率32.8%。Rf(F) 0.78。元素分析C10H9Cl2N5O4S.H2O(M370.5), 计算值%: C 32.38, H 2.56, N 18.89; 测定值%: C 32.78, H 2.53, N 18.57。1HNMR: δ 6.43(d,1H,J1′2′=2.4 Hz,1′H), 6.39(m,1H,J1′2′=2.4 Hz,J2′,3′=7.5 Hz,2′H), 5.87(m,1H,J2′,3′=7.5 Hz,J3′,4′=3.9 Hz,3′H), 4.73(m,1H,J=3.9,6.0,7.2 Hz,4′H), 3.86(m,2H,Jab=11.1, Ja4′=7.2 Hz,Jb4′=6.3 Hz,5′H), 7.64(s,2H,6-NH2), 8.19(s,1H,2-H)。
, 百拇医药
17 5′-氯-5′-去氧-8-Cl-腺苷(20)[9]
六甲基磷酰胺(HMPA)1.6 ml用冰浴冷却,向其中滴加SOCl2 0.24 ml。在0℃搅拌下15 min后,投入8-Cl-腺苷0.3 g(1 mmol)。反应2 h。室温下搅拌过夜。溶液呈鲜红色。将混合物倾入冰H2O 25 ml中,NaHCO3溶液中和至中性,用减压柱色谱分离,EtOAc和EtOH梯度洗脱。得到白色固体0.1 g,产率31.3%,Rf(B) 0.90。元素分析C10H11Cl2N5O3,计算值%: C 37.50, H 3.44, N 21.88; 测定值%: C 37.87, H 3.78, N 21.48。
致谢 王书玉教授提供取代肉桂酸;重点实验室的元素分析实验室和核磁室,中心实验室质谱室,北京大学和防化院核磁室,中国科学院化学所协作完成了核磁共振,质谱和元素分析;重点实验室王瑞卿等老师完成初步生物活性筛选实验。
, 百拇医药
*联系人现址:军事医学科学院毒物药物研究所,北京 100850
Tel:(010)66887429-66611
参考文献
1 方家椿,石永进,彭敏,等. 8-氯腺苷的抗肿瘤作用研究. 中华肿瘤杂志, 1995,17∶5
2 王宪焘,郑德先,刘睿,等. 8-氯腺苷诱导MOLT-4细胞凋亡. 科学通报, 1997,42∶189
3 Lin Z, Nadzan AM, Heyman RA, et al. Discovery of novel retinoicacid receptor agonists having potent antiproliferative activity in cervical cancer cells. J Med Chem, 1996,39∶2659
, 百拇医药
4 Holy A, Rosenberg I. An improved synthesis of S-adenosyl-L-nomocystein and related compounds. Collect Czech Chem Commun, 1985,50∶1514
5 Long RA, Robins RK, Townsend LB. Purine nucleosides, XV. The synthesis of 8-amino- and 8-substituted aminopurine nucleosides. Biochemistry, 1967,32∶2751
6 Ikehara M, Yamada S. Studies of nucleosides and nucleotides. XLIX. Synthesis of 8-fluoroadenosine. Chem Pharm Bull, 1971,19∶104
, http://www.100md.com
7 Eckstein F, Cramer F. Notize uber 2′,3′-O-athoxy-methylen-derivate von Ribonucleosiden. Chem Ber, 1965∶995
8 Sharma M, Wikiel H, Hromchak R, et al. Synthesis of 5′-substituted derivatives of the pyrrolo[2,3-d]-pyrimidine nucleoside sangivamycin and their effect on protein kinase A and C. Nucleosides and Nudeotides, 1993,12(3 & 4)∶295
9 Prisbe EJ, Smejkal J, Verheyden JPH, et al. Halo sugar nucleosides. 5. Synthesis of angustmycin A and some base analogues. J Org Chem, 1976,41∶1836
收稿日期: 1997-11-28, 百拇医药(何军林* 张礼和)