病理性瘢痕成纤维细胞Fas受体及Bcl-2蛋白的表达
作者:黎小间 高建华 鲁峰
单位:黎小间(第一军医大学南方医院整形外科,广东 广州 510515);高建华(第一军医大学南方医院整形外科,广东 广州 510515);鲁峰(第一军医大学南方医院整形外科,广东 广州 510515)
关键词:瘢痕疙瘩;增生性瘢痕;Fas;Bcl-2
第一军医大学学报000312 摘要:目的 研究病理性瘢痕成纤维细胞Fas受体及凋亡相关蛋白bcl-2的表达,探讨增生性瘢痕成纤维细胞对Fas介导凋亡的抑制作用。方法 取手术切除的增生性瘢痕和瘢痕疙瘩组织各6例,通过细胞培养6~10代后,应用流式细胞仪、粘附式细胞仪分别检测增生性瘢痕及瘢痕疙瘩成纤维细胞Fas及Bcl-2蛋白的表达。结果 增生性瘢痕成纤维细胞Fas受体呈低表达,而瘢痕疙瘩成纤维细胞Fas受体强表达。凋亡抑制蛋白Bcl-2的表达在增生性瘢痕和瘢痕疙瘩成纤维细胞内均呈低表达,两者无显著差异。结论 正常情况下,Fas Mcab能诱导Fas受体表达阳性的细胞凋亡,瘢痕疙瘩成纤维细胞却表现为Fas受体高表达而不凋亡,Bcl-2低表达。实验结果表明,瘢痕疙瘩成纤维细胞不凋亡现象并非Fas受体缺陷或外源性抑制所致,提示瘢痕疙瘩成纤维细胞膜表面高表达的Fas受体可能处于无功能状态。
, http://www.100md.com
中图分类号:R868-8 文献标识码:A 文章编号:1000-2588 (2000)-03-0231-02
Expression of apoptosis-related Fas antigen and Bcl-2 protein in fibroblasts derived from hypertrophic scar and keloid
LI Xiao-jian, GAO Jian-hua, LU Feng
Department of Plastic Surgery, Nanfang Hospital, First Military Medical University, Guangzhou 510515,China
Abstract: Objective To investigate the expression of apoptosis-related protein Fas and Bcl-2 and to explore the corresponding mechanism. Methods Six samples of hypertrophic scars and 6 of keloids were collected cultured, and only 6~10 passages fibroblasts were selected for experiment. With the help of the flow cytometer and adherent cell analysis and sorting interactive laser coytometer (ACAS 570), the expression of apoptosis-related protein -Fas and Bcl-2 were detected. Results The expression of Fas antigen in the fibroblasts derived from the keloids were significant elevated in comparison with that in the fibroblasts from hypertrophic scars. The levels of the Bcl-2 protein, loe in both groups, did not differ significantly between the 2 groups, respectively. Conclusions In contrast to that hypertrophic scars from fibroblasts derived from keloids showed high expressed Fas antigen and resistance to apoptosis induced by FasMcab. Considering the low expression of Bcl-2 protein, we assume that Fas receptor on firoblasts derived from keloids may be insert for functioning.
, 百拇医药
Key words: keloid; hypertrophic scar; Fas; Bcl-2
瘢痕疙瘩临床表现为超过原伤口界限呈“蟹足样”过度生长,侵犯临近组织,自始自终难以退化且单纯手术切除后易复发[2]。有研究[3]认为:成纤维细胞是瘢痕形成、增生、挛缩的功能性细胞,其增殖-凋亡的调控异常直接导致瘢痕疙瘩的形成。Fas是一种新发现的介导凋亡的膜表面抗原,Fas Mcab、FasL能与其受体结合,诱导受体表达阳性的细胞凋亡。因此,Fas在调控增殖-凋亡领域内作用已得到广泛重视。但在前阶段实验中[1],我们发现:瘢痕疙瘩有别于增生性瘢痕,其成纤维细胞对Fas介导的凋亡产生抗性,即瘢痕疙瘩成纤维细胞在Fas Mcab(IgM 、IgG)作用下不凋亡。为探讨这种现象与受体表达强度及外源性抑制因素间的关系,我们应用流式细胞仪、粘附式细胞仪分别检测了增生性瘢痕及瘢痕疙瘩成纤维细胞Fas及Bcl-2蛋白的表达。
, 百拇医药
1 材料和方法
1.1 临床资料
瘢痕疙瘩和增生性瘢痕均取自
瘢痕疙瘩和增生性瘢痕均取自1997~1999年我科收治经临床和病理诊断证实年龄20~35岁的手术患者。瘢痕疙瘩患者6例(男女各3例),病变部位分别为耳垂、耳后及前胸;增生性瘢痕患者6例(男4例、女2例),病变部位分别为足背、面部及肘部;取增生性瘢痕患者供皮区正常皮肤为对照。
1.2 材料来源
DMEM 培养基(购自美国Gibco公司),Fas Mcab(IgM,购自美国Coulter公司),Bcl-2 单克隆抗体(购自美国sigma 公司),胎牛血清(购自美国Hyclone公司)。
1.3 方法
, 百拇医药
1.3.1 成纤维细胞的培养 将手术切下的瘢痕疙瘩和增生性瘢痕组织在无菌条件下切除表皮,在少量胎牛血清中将标本切成1 mm3 左右的组织块置于培养瓶中,95%空气、5%二氧化碳、37° C、饱和湿度条件下培养6~8 h。组织块附壁后加入含15%胎牛血清的DMEM培养基培养,3~4 d换液1次,2~3周后,原代细胞生长成单层,用0.25%胰蛋白酶消化后,按1: 3的比例传代培养,此后每2~3 d换液1次,每4~5 d传代1次,实验用第6~10代细胞。
1.3.2流式细胞仪检测病理性瘢痕及正常皮肤成纤维细胞Fas受体、Bcl-2蛋白的表达 取处于指数生长期的细胞,用0.25%的胰蛋白酶消化后加入离心管内,1 000 r/min 离心5 min。PBS清洗后4%多聚甲醛固定30 min以上。40C 、2 500 r/min离心5 min,PBS洗2遍,1%兔血清封闭非特异性抗原5 min。PBS洗后,加入Fas Mcab或 Bcl-2单抗50 μl,40C下过夜。PBS清洗后加入FITC标记的羊抗鼠的二抗,370C水浴1 h,PBS清洗2遍,200目筛孔过筛,应用Coulter EPICS Elite ESP流式细胞仪检测。
, http://www.100md.com
1.3.3粘附式细胞仪检测病理性瘢痕及正常皮肤成纤维细胞内Fas受体、Bcl-2蛋白的表达 取处于指数生长期的细胞,用0.25%的胰蛋白酶消化后,加入适量含15%胎牛血清的DMEM培养基,吹打后按每皿含细胞1×105的密度接种到Petri培养皿中,95%空气、5%二氧化碳、37° C、饱和湿度条件下孵育8~10 h,使细胞完全贴壁并伸展呈梭形。将培养皿取出,室温下PBS液漂洗3次,4%多聚甲醛固定5~7 min,PBS液漂洗3次后加入FasMcab或 Bcl-2单抗20 μl,37° C 孵育30 min,PBS液漂洗3次后加入FITC标记的羊抗鼠的二抗,室温孵育30 min,PBS液漂洗3次,加入少许 PBS液后待检。
将含已染色细胞的培养皿置于ACAS570交互式激光细胞仪载物台上,扫描测定细胞内染料初始荧光强度,得到细胞图象。选择待检测细胞,测定各细胞内荧光强度。
1.3.4 统计学分析 所得资料应用χ2检验进行比较分析。
, http://www.100md.com
2 结果
2.1 流式细胞仪检测结果
增生性瘢痕成纤维细胞
增生性瘢痕成纤维细胞Fas受体阳性表达率较低,瘢痕疙瘩成纤维细胞较高,两者有显著性差异(P<0.01)。正常皮肤成纤维细胞Fas受体阳性表达率与瘢痕疙瘩成纤维细胞相近(两者无显著性差异,P>0.05),明显高于增生性瘢痕成纤维细胞(P<0.01);正常皮肤、增生性瘢痕、瘢痕疙瘩成纤维细胞内Bcl-2蛋白表达阳性率均较低,各组间无显著差异(P>0.05)。
表1 3种不同来源的成纤维细胞膜表面Fas、Bcl-2受体表达阳性率(%,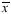 ±s)
±s)
Tab.1 Expression ratio of Fas and bcl-2 on fibroblasts derived
, 百拇医药
from pathological scars and normal skin(%, Mean ± SD)
control
Fas
Bcl-2
Normal skin
1.9±0.2
46.2±2.5
3.9±0.2
Keloid
2.3±0.1
48.6±2.1
, http://www.100md.com
3.6±0.4
Hypertrophic scar
2.5±0.2
15.3±1.6
4.3±0.3
2.2 粘附式细胞仪检测结果
粘附式细胞仪实验结果与流式细胞仪检测结果一致,即正常皮肤与瘢痕疙瘩成纤维细胞
粘附式细胞仪实验结果与流式细胞仪检测结果一致,即正常皮肤与瘢痕疙瘩成纤维细胞Fas受体阳性表达明显强于增生性瘢痕成纤维细胞。正常皮肤、增生性瘢痕、瘢痕疙瘩成纤维细胞内Bcl-2蛋白阳性表达均较弱。
表2不同来源成纤维细胞Fas受体、Bcl-2蛋白的表达
, 百拇医药
Tab.2 expression of Fas and Bcl-2 on fibroblasts derived
from pathological scars and normal skin
Normal skin
Hypertrophic scar
Keloid
Fas
Bcl-2
1 971±773
938±134
1 023±310
, http://www.100md.com
913±124
2 181±531
992±137
3 讨论
Fas受体属于Ⅰ型跨膜蛋白,主要分布在人活化的T、B淋巴细胞膜表面,在正常皮肤及病理性瘢痕成纤维细胞膜上亦有分布。其相应的配体及单克隆抗体与之结合后可诱导细胞凋亡。随着细胞生物学和免疫学的进展,已证实FasR-FasL系统在调控细胞增殖和凋亡中起着重要的作用[4~7]。
前阶段实验[1]发现,瘢痕疙瘩成纤维细胞有别于增生性瘢痕成纤维细胞,在Fas Mcab作用下不能正常凋亡。瘢痕疙瘩成纤维细胞对Fas Mcab诱导的凋亡产生抗性的原因可能主要与以下几个方面有关:(1)Fas受体的缺陷,即受体低表达或不表达。(2)外源性抑制蛋白(如Bcl-2蛋白)的过度表达。(3)Fas受体表达无缺陷,但这种受体功能低下甚至无功能。
, 百拇医药
本实验结果表明:(1)瘢痕疙瘩成纤维细胞不但存在Fas受体,且阳性表达率较高,与之对应的增生性瘢痕成纤维细胞Fas受体阳性表达率却较低。(2)外源性抑制蛋白Bcl-2在增生性瘢痕、瘢痕疙瘩成纤维细胞内表达阳性率均较低,且各组间无显著差异。提示瘢痕疙瘩成纤维细胞膜表面高表达的Fas受体可能处于无功能状态。因此,即使在高浓度梯度Fas Mcab作用下,瘢痕疙瘩成纤维细胞仍不凋亡。至于产生这种无功能Fas分子的确切机制,目前尚不清楚,我们考虑可有以下几种可能:(1)瘢痕疙瘩成纤维细胞内编码Fas分子的结构基因发生改变(包括突变和大片段缺失),导致Fas分子的死亡域改变,死亡信号传导随之发生障碍,瘢痕疙瘩成纤维细胞不凋亡。(2)瘢痕疙瘩成纤维细胞内虽未发生结构基因改变,但由于瘢痕疙瘩成纤维细胞内特殊的“内环境”导致Fas分子空间构像改变而产生的无功能的Fas分子。
综上所述,本研究提示:瘢痕疙瘩的形成与Fas的基因结构改变可能存在密切关系。
国家自然科学基金(39870807)
, 百拇医药
黎小间(1973-),男,福建长汀人,1999年毕业于第一军医大学,硕士,医师
参考文献
1.鲁 峰,高建华,黎小间等. Fas介导下瘢痕成纤维细胞中死亡信号传导的研究[J].中华医学美容外科杂志, 2000,6(1) : 31~3.
2.汪良能, 高学书. 整形外科学[M]. 北京: 人民卫生出版社,1989.324~7.
3.Leithauser F, Dhein J, Mechtersheimer G et al. Constitutive and induced expression of APO-1, a new member of the nerve growth factor /tumor necrosis factor receptor superfamily, in normal and neoplastic cells[J].Lab Invest, 1993, 69(4): 415~29.
, 百拇医药
4.Nagata S; Suda T. Fas and Fas ligand: lpr and gld mutations[J]. Immu-nol Today, 1995, 16(1): 39~43.
5.Strasser A, Apoptosis S. Death of a T cell[J]. Nature, 1995, 373(6513): 385~6.
6.Cleveland JL, Ihle JN. Contenders in FasL/TNF death signaling[J]. Cell, 1995, 81(4): 479~82.
7.Freiberg RA, Spencer DM, Choate KA et al. Fas signal transduction triggers either proliferation or apoptosis in human fibroblasts[J]. J Invest Dermatol, 1997, 108(9): 215~9.
1999-10-13, 百拇医药
单位:黎小间(第一军医大学南方医院整形外科,广东 广州 510515);高建华(第一军医大学南方医院整形外科,广东 广州 510515);鲁峰(第一军医大学南方医院整形外科,广东 广州 510515)
关键词:瘢痕疙瘩;增生性瘢痕;Fas;Bcl-2
第一军医大学学报000312 摘要:目的 研究病理性瘢痕成纤维细胞Fas受体及凋亡相关蛋白bcl-2的表达,探讨增生性瘢痕成纤维细胞对Fas介导凋亡的抑制作用。方法 取手术切除的增生性瘢痕和瘢痕疙瘩组织各6例,通过细胞培养6~10代后,应用流式细胞仪、粘附式细胞仪分别检测增生性瘢痕及瘢痕疙瘩成纤维细胞Fas及Bcl-2蛋白的表达。结果 增生性瘢痕成纤维细胞Fas受体呈低表达,而瘢痕疙瘩成纤维细胞Fas受体强表达。凋亡抑制蛋白Bcl-2的表达在增生性瘢痕和瘢痕疙瘩成纤维细胞内均呈低表达,两者无显著差异。结论 正常情况下,Fas Mcab能诱导Fas受体表达阳性的细胞凋亡,瘢痕疙瘩成纤维细胞却表现为Fas受体高表达而不凋亡,Bcl-2低表达。实验结果表明,瘢痕疙瘩成纤维细胞不凋亡现象并非Fas受体缺陷或外源性抑制所致,提示瘢痕疙瘩成纤维细胞膜表面高表达的Fas受体可能处于无功能状态。
, http://www.100md.com
中图分类号:R868-8 文献标识码:A 文章编号:1000-2588 (2000)-03-0231-02
Expression of apoptosis-related Fas antigen and Bcl-2 protein in fibroblasts derived from hypertrophic scar and keloid
LI Xiao-jian, GAO Jian-hua, LU Feng
Department of Plastic Surgery, Nanfang Hospital, First Military Medical University, Guangzhou 510515,China
Abstract: Objective To investigate the expression of apoptosis-related protein Fas and Bcl-2 and to explore the corresponding mechanism. Methods Six samples of hypertrophic scars and 6 of keloids were collected cultured, and only 6~10 passages fibroblasts were selected for experiment. With the help of the flow cytometer and adherent cell analysis and sorting interactive laser coytometer (ACAS 570), the expression of apoptosis-related protein -Fas and Bcl-2 were detected. Results The expression of Fas antigen in the fibroblasts derived from the keloids were significant elevated in comparison with that in the fibroblasts from hypertrophic scars. The levels of the Bcl-2 protein, loe in both groups, did not differ significantly between the 2 groups, respectively. Conclusions In contrast to that hypertrophic scars from fibroblasts derived from keloids showed high expressed Fas antigen and resistance to apoptosis induced by FasMcab. Considering the low expression of Bcl-2 protein, we assume that Fas receptor on firoblasts derived from keloids may be insert for functioning.
, 百拇医药
Key words: keloid; hypertrophic scar; Fas; Bcl-2
瘢痕疙瘩临床表现为超过原伤口界限呈“蟹足样”过度生长,侵犯临近组织,自始自终难以退化且单纯手术切除后易复发[2]。有研究[3]认为:成纤维细胞是瘢痕形成、增生、挛缩的功能性细胞,其增殖-凋亡的调控异常直接导致瘢痕疙瘩的形成。Fas是一种新发现的介导凋亡的膜表面抗原,Fas Mcab、FasL能与其受体结合,诱导受体表达阳性的细胞凋亡。因此,Fas在调控增殖-凋亡领域内作用已得到广泛重视。但在前阶段实验中[1],我们发现:瘢痕疙瘩有别于增生性瘢痕,其成纤维细胞对Fas介导的凋亡产生抗性,即瘢痕疙瘩成纤维细胞在Fas Mcab(IgM 、IgG)作用下不凋亡。为探讨这种现象与受体表达强度及外源性抑制因素间的关系,我们应用流式细胞仪、粘附式细胞仪分别检测了增生性瘢痕及瘢痕疙瘩成纤维细胞Fas及Bcl-2蛋白的表达。
, 百拇医药
1 材料和方法
1.1 临床资料
瘢痕疙瘩和增生性瘢痕均取自
瘢痕疙瘩和增生性瘢痕均取自1997~1999年我科收治经临床和病理诊断证实年龄20~35岁的手术患者。瘢痕疙瘩患者6例(男女各3例),病变部位分别为耳垂、耳后及前胸;增生性瘢痕患者6例(男4例、女2例),病变部位分别为足背、面部及肘部;取增生性瘢痕患者供皮区正常皮肤为对照。
1.2 材料来源
DMEM 培养基(购自美国Gibco公司),Fas Mcab(IgM,购自美国Coulter公司),Bcl-2 单克隆抗体(购自美国sigma 公司),胎牛血清(购自美国Hyclone公司)。
1.3 方法
, 百拇医药
1.3.1 成纤维细胞的培养 将手术切下的瘢痕疙瘩和增生性瘢痕组织在无菌条件下切除表皮,在少量胎牛血清中将标本切成1 mm3 左右的组织块置于培养瓶中,95%空气、5%二氧化碳、37° C、饱和湿度条件下培养6~8 h。组织块附壁后加入含15%胎牛血清的DMEM培养基培养,3~4 d换液1次,2~3周后,原代细胞生长成单层,用0.25%胰蛋白酶消化后,按1: 3的比例传代培养,此后每2~3 d换液1次,每4~5 d传代1次,实验用第6~10代细胞。
1.3.2流式细胞仪检测病理性瘢痕及正常皮肤成纤维细胞Fas受体、Bcl-2蛋白的表达 取处于指数生长期的细胞,用0.25%的胰蛋白酶消化后加入离心管内,1 000 r/min 离心5 min。PBS清洗后4%多聚甲醛固定30 min以上。40C 、2 500 r/min离心5 min,PBS洗2遍,1%兔血清封闭非特异性抗原5 min。PBS洗后,加入Fas Mcab或 Bcl-2单抗50 μl,40C下过夜。PBS清洗后加入FITC标记的羊抗鼠的二抗,370C水浴1 h,PBS清洗2遍,200目筛孔过筛,应用Coulter EPICS Elite ESP流式细胞仪检测。
, http://www.100md.com
1.3.3粘附式细胞仪检测病理性瘢痕及正常皮肤成纤维细胞内Fas受体、Bcl-2蛋白的表达 取处于指数生长期的细胞,用0.25%的胰蛋白酶消化后,加入适量含15%胎牛血清的DMEM培养基,吹打后按每皿含细胞1×105的密度接种到Petri培养皿中,95%空气、5%二氧化碳、37° C、饱和湿度条件下孵育8~10 h,使细胞完全贴壁并伸展呈梭形。将培养皿取出,室温下PBS液漂洗3次,4%多聚甲醛固定5~7 min,PBS液漂洗3次后加入FasMcab或 Bcl-2单抗20 μl,37° C 孵育30 min,PBS液漂洗3次后加入FITC标记的羊抗鼠的二抗,室温孵育30 min,PBS液漂洗3次,加入少许 PBS液后待检。
将含已染色细胞的培养皿置于ACAS570交互式激光细胞仪载物台上,扫描测定细胞内染料初始荧光强度,得到细胞图象。选择待检测细胞,测定各细胞内荧光强度。
1.3.4 统计学分析 所得资料应用χ2检验进行比较分析。
, http://www.100md.com
2 结果
2.1 流式细胞仪检测结果
增生性瘢痕成纤维细胞
增生性瘢痕成纤维细胞Fas受体阳性表达率较低,瘢痕疙瘩成纤维细胞较高,两者有显著性差异(P<0.01)。正常皮肤成纤维细胞Fas受体阳性表达率与瘢痕疙瘩成纤维细胞相近(两者无显著性差异,P>0.05),明显高于增生性瘢痕成纤维细胞(P<0.01);正常皮肤、增生性瘢痕、瘢痕疙瘩成纤维细胞内Bcl-2蛋白表达阳性率均较低,各组间无显著差异(P>0.05)。
表1 3种不同来源的成纤维细胞膜表面Fas、Bcl-2受体表达阳性率(%,
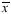 ±s)
±s)Tab.1 Expression ratio of Fas and bcl-2 on fibroblasts derived
, 百拇医药
from pathological scars and normal skin(%, Mean ± SD)
control
Fas
Bcl-2
Normal skin
1.9±0.2
46.2±2.5
3.9±0.2
Keloid
2.3±0.1
48.6±2.1
, http://www.100md.com
3.6±0.4
Hypertrophic scar
2.5±0.2
15.3±1.6
4.3±0.3
2.2 粘附式细胞仪检测结果
粘附式细胞仪实验结果与流式细胞仪检测结果一致,即正常皮肤与瘢痕疙瘩成纤维细胞
粘附式细胞仪实验结果与流式细胞仪检测结果一致,即正常皮肤与瘢痕疙瘩成纤维细胞Fas受体阳性表达明显强于增生性瘢痕成纤维细胞。正常皮肤、增生性瘢痕、瘢痕疙瘩成纤维细胞内Bcl-2蛋白阳性表达均较弱。
表2不同来源成纤维细胞Fas受体、Bcl-2蛋白的表达
, 百拇医药
Tab.2 expression of Fas and Bcl-2 on fibroblasts derived
from pathological scars and normal skin
Normal skin
Hypertrophic scar
Keloid
Fas
Bcl-2
1 971±773
938±134
1 023±310
, http://www.100md.com
913±124
2 181±531
992±137
3 讨论
Fas受体属于Ⅰ型跨膜蛋白,主要分布在人活化的T、B淋巴细胞膜表面,在正常皮肤及病理性瘢痕成纤维细胞膜上亦有分布。其相应的配体及单克隆抗体与之结合后可诱导细胞凋亡。随着细胞生物学和免疫学的进展,已证实FasR-FasL系统在调控细胞增殖和凋亡中起着重要的作用[4~7]。
前阶段实验[1]发现,瘢痕疙瘩成纤维细胞有别于增生性瘢痕成纤维细胞,在Fas Mcab作用下不能正常凋亡。瘢痕疙瘩成纤维细胞对Fas Mcab诱导的凋亡产生抗性的原因可能主要与以下几个方面有关:(1)Fas受体的缺陷,即受体低表达或不表达。(2)外源性抑制蛋白(如Bcl-2蛋白)的过度表达。(3)Fas受体表达无缺陷,但这种受体功能低下甚至无功能。
, 百拇医药
本实验结果表明:(1)瘢痕疙瘩成纤维细胞不但存在Fas受体,且阳性表达率较高,与之对应的增生性瘢痕成纤维细胞Fas受体阳性表达率却较低。(2)外源性抑制蛋白Bcl-2在增生性瘢痕、瘢痕疙瘩成纤维细胞内表达阳性率均较低,且各组间无显著差异。提示瘢痕疙瘩成纤维细胞膜表面高表达的Fas受体可能处于无功能状态。因此,即使在高浓度梯度Fas Mcab作用下,瘢痕疙瘩成纤维细胞仍不凋亡。至于产生这种无功能Fas分子的确切机制,目前尚不清楚,我们考虑可有以下几种可能:(1)瘢痕疙瘩成纤维细胞内编码Fas分子的结构基因发生改变(包括突变和大片段缺失),导致Fas分子的死亡域改变,死亡信号传导随之发生障碍,瘢痕疙瘩成纤维细胞不凋亡。(2)瘢痕疙瘩成纤维细胞内虽未发生结构基因改变,但由于瘢痕疙瘩成纤维细胞内特殊的“内环境”导致Fas分子空间构像改变而产生的无功能的Fas分子。
综上所述,本研究提示:瘢痕疙瘩的形成与Fas的基因结构改变可能存在密切关系。
国家自然科学基金(39870807)
, 百拇医药
黎小间(1973-),男,福建长汀人,1999年毕业于第一军医大学,硕士,医师
参考文献
1.鲁 峰,高建华,黎小间等. Fas介导下瘢痕成纤维细胞中死亡信号传导的研究[J].中华医学美容外科杂志, 2000,6(1) : 31~3.
2.汪良能, 高学书. 整形外科学[M]. 北京: 人民卫生出版社,1989.324~7.
3.Leithauser F, Dhein J, Mechtersheimer G et al. Constitutive and induced expression of APO-1, a new member of the nerve growth factor /tumor necrosis factor receptor superfamily, in normal and neoplastic cells[J].Lab Invest, 1993, 69(4): 415~29.
, 百拇医药
4.Nagata S; Suda T. Fas and Fas ligand: lpr and gld mutations[J]. Immu-nol Today, 1995, 16(1): 39~43.
5.Strasser A, Apoptosis S. Death of a T cell[J]. Nature, 1995, 373(6513): 385~6.
6.Cleveland JL, Ihle JN. Contenders in FasL/TNF death signaling[J]. Cell, 1995, 81(4): 479~82.
7.Freiberg RA, Spencer DM, Choate KA et al. Fas signal transduction triggers either proliferation or apoptosis in human fibroblasts[J]. J Invest Dermatol, 1997, 108(9): 215~9.
1999-10-13, 百拇医药